Académique Documents
Professionnel Documents
Culture Documents
Info 3 Equivalencia Entre La Caloria y El Joule
Transféré par
Natalia RestrepoDescription originale:
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Info 3 Equivalencia Entre La Caloria y El Joule
Transféré par
Natalia RestrepoDroits d'auteur :
Formats disponibles
UNIVERSIDAD DEL QUINDO FACULTAD DE CIENCIAS BSICAS Y TECNOLOGAS PROGRAMA DE QUMICA FISICOQUMICA II
NATALIA RESTREPO MESA, LEYDI BIBIANA GRAJALES SANABRIA EQUIVALENCIA ENTRE LA CALORIA Y EL JOULE
TABLA DE DATOS Y RESULTADOS
1. Determinacin de la capacidad calrica C del calormetro: C calormetro:
CORRIDA 1 2 3
T1 (C) ambiente 22 22 22
T2 (C) caliente 40 39 43
T3 (C) mezcla 30 29 32
Tm (C) 30,67 30 32,33
C (cal/C) 31,25 53,57 12,5
2. Equivalencia calora Joule: Equivalencia:
Ti (C) 23
Tf (C) 42
Volt. Volt. inicial final 115,5 116,3
Volt. promedio 115,9
t (min) 3.5
Joule/Cal
% error
CLCULOS 1. Calcular el C calormetro para cada corrida y establecer una relacin con la temperatura media Tm del calormetro. mCpTH2O fra + CT calormetro = mCPTH2O caliente Corrida # 1: C = 125mL*1 cal/C *(40-30) C - 125mL*1 cal/C * (30-22) C (30-22) C C = 31,25 cal/C
Corrida # 2: C = 125mL*1 cal/C *(39-29) C - 125mL*1 cal/C * (29-22) C (29-22) C C = 53,57 cal/C Corrida # 3: C = 125mL*1 cal/C *(43-32) C - 125mL*1 cal/C * (32-22) C (32-22) C C = 12,5 cal/C
2. Calcular el U del calormetro y el agua (250mL) en caloras. Q = mCT
( )
C = 0.02259 J/g * C U = mCT
U = 250g * 0.02259 J/g * C * (43 22) C U = 118.5975J * 1 cal / 4.184000J U = 28,3454 cal 3. Calcular el trabajo elctrico suministrado en Joule. U = q + w w = U - q W = 118.5975J 118.6J W = -2.5X10-3J
PROBLEMAS: 1. Un calentador aislado que contiene 30L de agua a 20C, tiene una resistencia elctrica de 1500W. Cunto tiempo tardara en elevar la temperatura del agua a 70C?
Dnde: W- Trabajo R- Resistencia elctrica t- Tiempo ( )
2. Un dispositivo de cilindro-embolo contiene inicialmente 30L de vapor saturado de agua a 30MPa. En una primera etapa se enfra a volumen constante hasta 200C; luego se expande isotrmicamente hasta que el volumen se duplica. Calcular la presin final del sistema, el calo Q y el trabajo W involucrados y representar el proceso en un diagrama P-V Proceso Isocrico
Proceso Isotrmico
( )
Para todo el proceso tenemos que: ( )
CONCLUSIN Todas las variaciones de los procesos se dan en su gran mayora por los cambios de temperatura y voltaje que son suministrados al calormetro
ca UNIVERSIDAD DEL QUINDO FACULTAD DE CIENCIAS BSICAS Y TECNOLOGAS PROGRAMA DE QUMICA FISICOQUMICA II
NATALIA RESTREPO, LEYDI BIBIANA GRAJALES SANABRIA INTERCAMBIO CALRICO Y CAMBIOS DE ENTROPA
Procedimiento 1. Calormetro Se determino C del calormetro como en la prctica de termoqumica utilizando agua a temperatura ambiente y agua fra 2. Fusin parcial En esta parte adicionamos 100 mL de agua de la llave al calormetro y medimos la temperatura de estabilizacin, posteriormente se adiciono 26.35 g de hielo y esperamos hasta que la temperatura se estabilizar a 0C, se retiro el liquido y medimos su volumen. 3. Fusin Total Se cambiaron las cantidades por 150 mL de agua y por 20 g de hielo y se toma la temperatura estabilizada.
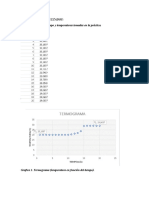
TABLAS DE DATOS Y RESULTADOS Fusin parcial M hielo (g) 51.16 Fusin total M hielo (g) 28.25 T estab. (C) 0 Agua Agregada mL 150 T C 21 T mezcla Exp. 7.5 Calculado 2.4753 S (J/K) T estab. (C) 0 Agua Agregada mL 100 T C 21 Mezcla T C 4 M hielo fundido (g) Exp. 26.02 Calculado 48.31 S (J/K)
Clculos 1. C del Calormetro Nota: Se calcula haciendo un promedio de los datos tomados en el anterior laboratorio. C = (16 -12.90 + 50) cal/C C = 17,7 cal/C 2. Fusin Parcial T H2O inicial= 21C Masa del agua=100 g Masa Hielo=51.16
Masa Hielo Terico Calcular la masa del hielo fundido y compararlo con el dato experimental m Hielo *m Hf = M H2O x Cp (23-0) + C(23-0)
M hielo =
= 48.31 g
Masa Hielo experimental Vol (g) H2O fundido=148.31 g
3. Fusin total Calcular la T final y compararla con el dato experimental (m.Hf)hielo + (m.Cp.T)hielo + (m.Cp.T)Liquido +CTcalorim=0
Problema
Conclusiones En esta prctica de laboratorio hallamos el calor de una solucin a diferentes temperaturas y cantidades diferentes encontrando as una diferencia de entropa en su anlisis. En la fusin total no hicimos una medicin de volumen ya que se encontraba en mayor proporcin el agua lquida que el hielo y esto provoco una disolucin completa del hielo y es por esto que no se determino una masa final.
Vous aimerez peut-être aussi
- Problemas resueltos de Hidráulica de CanalesD'EverandProblemas resueltos de Hidráulica de CanalesÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Mini SplitDocument11 pagesMini SplitAlan SanchezPas encore d'évaluation
- Balance de EnergíaDocument13 pagesBalance de EnergíaAlexCajas67% (6)
- Termodinamica ExamenesDocument21 pagesTermodinamica ExamenesRicardo Anibal Arroyo Flores100% (1)
- Ingeniería química. Soluciones a los problemas del tomo ID'EverandIngeniería química. Soluciones a los problemas del tomo IPas encore d'évaluation
- Plan de Trabajo Control de Vibraciones de Orica - ChaquicochaDocument10 pagesPlan de Trabajo Control de Vibraciones de Orica - ChaquicochaJhol Dueñas GutierrezPas encore d'évaluation
- HidraulicaDocument17 pagesHidraulicaRamiro Jesus Aguilar HuallpaPas encore d'évaluation
- HumidificaciónDocument28 pagesHumidificaciónManuela MendozaPas encore d'évaluation
- Examen Resuelto BalseiroDocument22 pagesExamen Resuelto BalseirogerPas encore d'évaluation
- Pretensado 2019 - I, (23 - 56)Document34 pagesPretensado 2019 - I, (23 - 56)jplacios100% (1)
- 3 Informe de Lab.Document14 pages3 Informe de Lab.Jheremy Gomez ConovilcaPas encore d'évaluation
- 1 CalorimetroDocument4 pages1 CalorimetroAndrea ParedesPas encore d'évaluation
- Entalpia de Descomposicion PDFDocument18 pagesEntalpia de Descomposicion PDFale fgPas encore d'évaluation
- Determinacion Del Calor Especifico de Los LiquidosDocument4 pagesDeterminacion Del Calor Especifico de Los Liquidosfernanda oviedoPas encore d'évaluation
- Informe Efecto JouleDocument6 pagesInforme Efecto JouleKevin David AlvarezPas encore d'évaluation
- Calorimetria 2Document11 pagesCalorimetria 2Cristian González TatésPas encore d'évaluation
- Annotated-Calor Especifico Del Agua LDocument10 pagesAnnotated-Calor Especifico Del Agua LEstefani ZSPas encore d'évaluation
- Calor Específico de SólidosDocument5 pagesCalor Específico de SólidosDavid QuinteroPas encore d'évaluation
- Termoquimica2 Laboratorio de Fisicoquimica UNMSMDocument19 pagesTermoquimica2 Laboratorio de Fisicoquimica UNMSMwaldir marcelinoPas encore d'évaluation
- Patricio Castro Fisico Quimica Segunda Ley de La TermodinamicaDocument18 pagesPatricio Castro Fisico Quimica Segunda Ley de La TermodinamicaJackson TapiaPas encore d'évaluation
- CalorimetriaDocument7 pagesCalorimetriaArnaldo simonPas encore d'évaluation
- Practica 5Document17 pagesPractica 5Paulii Alexandra QuijiaPas encore d'évaluation
- Informe Lab 12 QuimicaDocument8 pagesInforme Lab 12 QuimicaRODRIGO MAURO CATACORA ZARABIAPas encore d'évaluation
- Fisicoquimica Primer Principio de La TermodinamicaDocument6 pagesFisicoquimica Primer Principio de La TermodinamicaJosefa FernandaPas encore d'évaluation
- Calor Latente Fusion de AguaDocument9 pagesCalor Latente Fusion de AguaMagda Isabel Javier Villanueva100% (1)
- Informe 3 Laboratorio FisicaDocument15 pagesInforme 3 Laboratorio FisicaJoel Stewart Anton SalazarPas encore d'évaluation
- Trabajo PracticoDocument11 pagesTrabajo PracticoCaro JuradoPas encore d'évaluation
- Trabajo Academico Andrea Hilda Guillen Alvarado 2009227149 MoqueguaDocument11 pagesTrabajo Academico Andrea Hilda Guillen Alvarado 2009227149 MoqueguaAndrea Guillen AlvaradoPas encore d'évaluation
- Fisica Semana 10 Cpu UnsmDocument6 pagesFisica Semana 10 Cpu UnsmSilverTelloFernadezPas encore d'évaluation
- Analisis y Resultados FisicoquimicaDocument3 pagesAnalisis y Resultados FisicoquimicaAngelo VarelaPas encore d'évaluation
- PRQ 2201 - Laboratorio 4 CalorimetríaDocument5 pagesPRQ 2201 - Laboratorio 4 Calorimetríamaguayo.9118Pas encore d'évaluation
- Reporte TermoDocument6 pagesReporte TermopersanimePas encore d'évaluation
- Practica 5 Calor de NeutralizacionDocument5 pagesPractica 5 Calor de NeutralizacionDiego JavierPas encore d'évaluation
- Informe de Termoquimica - Laboratorio de Fisicoquimica UNMSMDocument16 pagesInforme de Termoquimica - Laboratorio de Fisicoquimica UNMSMAbel Art Bejarano Higa50% (2)
- Practica 3 TermoquimicaDocument9 pagesPractica 3 TermoquimicaLiPas encore d'évaluation
- Informe Laboratorio de Intercambiador de CalorDocument18 pagesInforme Laboratorio de Intercambiador de CalorAlejandro ValenzuelaPas encore d'évaluation
- Informe Calor EspecíficoDocument4 pagesInforme Calor EspecíficoJulianAndresVarelaPas encore d'évaluation
- s02s1 Acv s02 Laboratorio n0 1 Equilibrio Termico Calorimetria Fisicoquimica 18102Document11 pagess02s1 Acv s02 Laboratorio n0 1 Equilibrio Termico Calorimetria Fisicoquimica 18102ELIZABETH COAGUILA AÑARIPas encore d'évaluation
- CALORIMETRÍADocument5 pagesCALORIMETRÍAVANESSA ARELIS HUARITA ADRIANPas encore d'évaluation
- Informe de Laboratorio Nro3Document14 pagesInforme de Laboratorio Nro3NELLY YOHANA TARAZONA GONZALESPas encore d'évaluation
- Practica 2 - Calorimetria-MemoriaDocument9 pagesPractica 2 - Calorimetria-MemoriaalexjandroherreroPas encore d'évaluation
- Lab 1Document26 pagesLab 1juan contrerasPas encore d'évaluation
- Problemas Resueltos FisicoquímicaDocument26 pagesProblemas Resueltos FisicoquímicatmuzzioPas encore d'évaluation
- Practica Fis 4Document11 pagesPractica Fis 4ALBINO ISIDRO JULCA MORALESPas encore d'évaluation
- Practica 4 Termodinamica Dos 2222Document9 pagesPractica 4 Termodinamica Dos 2222Atax Mejia MedinaPas encore d'évaluation
- Informe 6 FisicoquímicaDocument16 pagesInforme 6 FisicoquímicaAngela Abanto BelloPas encore d'évaluation
- Guia2 1 Ley TDDocument5 pagesGuia2 1 Ley TDCis FranPas encore d'évaluation
- Práctica 8 J LTSP EQ4Document11 pagesPráctica 8 J LTSP EQ4Иван МартинесPas encore d'évaluation
- Cuestionario Lab 1Document11 pagesCuestionario Lab 1Osler Meza TorresPas encore d'évaluation
- Guias Mea 421Document11 pagesGuias Mea 421gonzalo burgosPas encore d'évaluation
- Resultados y DiscusionesDocument25 pagesResultados y DiscusionesPriscila MejiaPas encore d'évaluation
- Laboratorio 8 - CALOR ABSORBIDO/DISIPADO Y CONVECCIÓNDocument17 pagesLaboratorio 8 - CALOR ABSORBIDO/DISIPADO Y CONVECCIÓNJuan RoncerosPas encore d'évaluation
- Equivalente ElectricoDocument6 pagesEquivalente ElectricoALEXIS CAMILO ARCOS CATUCHEPas encore d'évaluation
- Problem A Rio para Quimica2Document18 pagesProblem A Rio para Quimica2Minerva Mine0% (1)
- Cambios Entalpicos de Una Reacción QuímicaDocument5 pagesCambios Entalpicos de Una Reacción QuímicaStalin OmarPas encore d'évaluation
- Práctica N8 - TERMODINÁMICADocument2 pagesPráctica N8 - TERMODINÁMICAJose Chavez VargasPas encore d'évaluation
- TermodinamicaDocument36 pagesTermodinamicaBiblioteca Amauta SurPas encore d'évaluation
- Deber de Termodinamica 2Document13 pagesDeber de Termodinamica 2Christian QuispilemaPas encore d'évaluation
- Informe Práctica Calorimetría11Document6 pagesInforme Práctica Calorimetría11Jhonny SanchezPas encore d'évaluation
- 3 Medida Del Calor Latente de Fusión Del HieloDocument10 pages3 Medida Del Calor Latente de Fusión Del HieloNicole Machado TubiñezPas encore d'évaluation
- 06 Virtual Reporte Experimento de JouleDocument5 pages06 Virtual Reporte Experimento de Jouleedgard gomezPas encore d'évaluation
- Objetivos:: Trabajo de Laboratorio #2: TERMOQUÍMICA Calorimetría A Presión ConstanteDocument3 pagesObjetivos:: Trabajo de Laboratorio #2: TERMOQUÍMICA Calorimetría A Presión ConstanteDolores RiveraPas encore d'évaluation
- Reporte de Laboratorio N°3-2022-1Document17 pagesReporte de Laboratorio N°3-2022-1Angel MarellaPas encore d'évaluation
- 25 Problemas de FisicoquimicaDocument14 pages25 Problemas de FisicoquimicaLisset Cori CórdovaPas encore d'évaluation
- Paper Fatiga Por Cargas VariablesDocument7 pagesPaper Fatiga Por Cargas VariablesElieser MirandaPas encore d'évaluation
- Filtros AcústicosDocument5 pagesFiltros AcústicosAntonio G. JimenezPas encore d'évaluation
- SEGUNDO PARCIAL DE AA Virtualb Marzo.2021Document4 pagesSEGUNDO PARCIAL DE AA Virtualb Marzo.2021Darlyn guerraPas encore d'évaluation
- Unidad 3 Química 3Document6 pagesUnidad 3 Química 3Efren Ruilova MerchanPas encore d'évaluation
- Análisis Vigas Estáticamente IndeterminadasDocument4 pagesAnálisis Vigas Estáticamente IndeterminadasCarlos Cepeda LópezPas encore d'évaluation
- Taller 11 Mecanica de FluidosDocument1 pageTaller 11 Mecanica de FluidosAndres Felipe PossosPas encore d'évaluation
- Fisica IIIDocument2 pagesFisica IIItareasaramisPas encore d'évaluation
- Fisica EnanoideDocument6 pagesFisica EnanoideClaudia Betancourtt MejiasPas encore d'évaluation
- Determinación de La Banda Prohibida en Un SemiconductorDocument17 pagesDeterminación de La Banda Prohibida en Un SemiconductorIsrael GarcíaPas encore d'évaluation
- Tablas Propiedades MaterialesDocument103 pagesTablas Propiedades MaterialesJUAN RODRIGO FERNANDEZPas encore d'évaluation
- La DensidadDocument6 pagesLa DensidadDazy Gonzales RPas encore d'évaluation
- SolucschaumDocument92 pagesSolucschaumWILMER100% (1)
- HAZOPDocument14 pagesHAZOPAfanador LizPas encore d'évaluation
- Destilación Fraccionada Guía FinalDocument7 pagesDestilación Fraccionada Guía FinalRoberto ConstanzaPas encore d'évaluation
- Tipos de QuemadoresDocument6 pagesTipos de QuemadoresRoman Gabriel Merino GarciaPas encore d'évaluation
- 3er Trabajo Escalonado Villanueva BazanDocument75 pages3er Trabajo Escalonado Villanueva BazanJhoselyn VillanuevaPas encore d'évaluation
- Guía 6 Química Primero Medio Reacciones Químicas IiDocument5 pagesGuía 6 Química Primero Medio Reacciones Químicas IiTsuuki- Ray0% (1)
- Semana 8Document22 pagesSemana 8Natha GoPas encore d'évaluation
- Ley de Coulomb para Un Sistema Continuo de Cargas y Campo ElectricoDocument24 pagesLey de Coulomb para Un Sistema Continuo de Cargas y Campo ElectricoLizet Mayli Mejia PenadilloPas encore d'évaluation
- Tabla Periódica de Los ElementosDocument12 pagesTabla Periódica de Los ElementosGustavo PolancoPas encore d'évaluation
- Factor de Lluvia RDocument10 pagesFactor de Lluvia RFernando Robles AguilarPas encore d'évaluation
- Motoreductores Transtecno AC America Latina 2011Document94 pagesMotoreductores Transtecno AC America Latina 2011elkin manriquePas encore d'évaluation
- Silabo Física 1 Wa - 222513fisi1207 - Iciv - IindDocument4 pagesSilabo Física 1 Wa - 222513fisi1207 - Iciv - Iindtony21jacPas encore d'évaluation
- Propiedades ColigativasDocument2 pagesPropiedades Coligativasgisella oshea0% (1)