Académique Documents
Professionnel Documents
Culture Documents
Valoraciones Redox
Transféré par
MaryMondayGrrrl0 évaluation0% ont trouvé ce document utile (0 vote)
104 vues10 pagesCopyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
104 vues10 pagesValoraciones Redox
Transféré par
MaryMondayGrrrlDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 10
1
TEMA 9: REACCIONES DE TRANSFERENCIA DE ELECTRONES. VOLUMETRAS REDOX
CONCEPTO DE OXIDACINREDUCCIN
En un principio se consider que, la oxidacin era la combinacin de una sustancia con oxgeno y
reduccin era el proceso inverso, esto es, la disminucin del contenido en oxgeno de una sustancia. Por
ejemplo:
oxidacin: 2 Mg + O
2
2 MgO
reduccin: ZnO + C Zn + CO
se dice que el magnesio se ha oxidado, mientras que el xido de Zn se ha reducido.
Se encontr que en muchas ocasiones, la oxidacin no era ocasionada por el oxgeno del aire, el
oxgeno libre, sino que el oxgeno necesario para la oxidacin lo proporcionaban otras sustancias que eran
capaces de liberar ese elemento, tales como CuO, HNO
3
, K
2
Cr
2
O
7
, KClO
3
, etc, oxidantes). Ejemplos:
Mg + CuO MgO + Cu
S + 2 HNO
3
H
2
SO
4
+ 2 NO
Lo mismo que ocurre con los conceptos cido-base, tambin los conceptos de oxidacin y reduccin se
fueron ampliando progresivamente. En un primer momento se vio que, muchas veces, cuando el oxgeno
reacciona con un compuesto que tiene hidrgeno, en lugar de combinarse con el compuesto lo que hace es
quitarle el hidrgeno para formar agua. Por ejemplo:
2 H
2
S + O
2
2 S + 2 H
2
O
Por ello, se ampli el concepto de oxidacin para incluir tambin la prdida de hidrgeno y, a la
inversa, reduccin como la adicin de hidrgeno, manteniendo constante la cantidad de oxgeno. Por ejemplo:
oxidacin: CH
3
CH
2
OH CH
3
CHO + H
2
reduccin: CO + 2 H
2
CH
3
OH
Con el desarrollo posterior de la qumica, se puso de manifiesto que casi todos los elementos no
metlicos producan reacciones similares a las del oxgeno. As:
Mg + Cl
2
MgCl
2
Conocida la estructura electrnica de los tomos y la naturaleza del enlace qumico, se pudo ver que
esta reaccin es anloga a la primera. En efecto, utilizando los diagramas de Lewis:
Mg + O Mg
2+
+ O
2-
Mg + 2 Cl Mg
2+
+ 2 Cl
-
En los dos casos, el magnesio pierde sus dos electrones de valencia y se transforma en su ion. Puesto
que el magnesio experimenta el mismo cambio, en ambos procesos, deber ampliarse el concepto de oxidacin.
Se define entonces oxidacin como la prdida de electrones, y el proceso inverso, la reduccin como la
ganancia de electrones.
Aunque el concepto electrnico engloba al restringido, este, nos puede ser til para establecer
fcilmente si una especie se oxida o se reduce, simplemente observando la variacin en la proporcin de
oxgeno, por lo cual se sigue utilizando. Si tenemos en cuenta los dos conceptos anteriormente establecidos,
podemos dar una definicin conjunta y simplificada de oxidacin y de reduccin, as:
OXIDACIN.- Todo proceso en el que una especie qumica gane oxgeno o pierda electrones.
REDUCCIN.- Todo proceso en el que una especie qumica pierda oxgeno o gane electrones.
De esta nueva definicin se deduce que no puede haber procesos de oxidacin o reduccin aislados,
porque si una especie qumica pierde electrones, estos electrones no pueden quedar perdidos en el medio de
2
reaccin, otra especie debe ganarlos. Esto es lo que ocurre en los ejemplos anteriores, tanto el oxgeno como
el cloro ganan electrones (los cedidos por el magnesio) y se transforman en sus respectivos aniones.
Por tanto, todo proceso de oxidacin va unido necesariamente a otro de reduccin. Son procesos
simultneos e inseparables. Se ha de hablar, pues de reacciones de oxidacin-reduccin, que abreviadamente
reciben el nombre de reacciones redox. En ellas hay una transferencia de electrones desde la especie que se
oxida a la especie que se reduce.
De todas formas, manejaremos con bastante frecuencia oxidaciones y reducciones por separado,
independientes, a las que llamaremos semirreacciones de oxidacin y de reduccin, por constituir cada una de
ellas la mitad del proceso total, pero tiene que quedar claro que esa separacin se hace nica y
exclusivamente para su estudio terico, y que eso no sucede en la realidad.
La siguiente reaccin es un ejemplo de reaccin redox
Fe + I
2
Fe
3+
+ 2 I
-
en ella el yodo que no tena carga, le quita electrones al hierro y adquiere carga negativa, se
transforma en yoduro y experimenta una reduccin; en cambio el hierro, que ha perdido los electrones
transformndose en ion frrico, experimenta una reduccin.
Semirreaccin de oxidacin: Fe Fe
3+
Semirreaccin de reduccin: I
2
2 I
-
NMERO DE OXIDACIN
Cada tomo de un compuesto se caracteriza por un estado de oxidacin, debido a los electrones
ganados o cedidos o perdidos (totalmente en los compuestos inicos o parcialmente en los covalentes) con
respecto al tomo aislado y neutro. El nmero que indica este estado se llama nmero de oxidacin del
elemento en dicho compuesto.
El nmero de oxidacin se define como la carga elctrica formal (es decir, que no es real) que se
asigna a un tomo en un compuesto.
El nmero de oxidacin es un concepto asociado a los tomos; se habla de nmero de oxidacin de tal o
cual tomo y a ste asociado a un determinado compuesto, ya que el nmero de oxidacin de un tomo puede
cambiar al cambiar el compuesto del que dicho elemento forme parte.
Puede ser positivo o negativo, entero o fraccionario.
Cuando el nmero de oxidacin es fraccionario, eso indica que el compuesto no es puro, con una
estructura definida, sino que estar formado por mezcla de dos o ms compuestos puros en una proporcin
determinada, y la frmula dada para el mismo corresponde a la suma de las frmulas moleculares de los
compuestos que los forman. Ejemplo: el xido de hierro Fe
3
O
4
est formado por el xido de hierro (II), FeO,
y por el de hierro (III), Fe
2
O
3
(si sumamos estas dos frmulas nos dar la de aquel, y de ah viene su nombre,
xido ferroso-frrico. El nmero de oxidacin del Fe en el Fe
3
O
4
es de +8/3, mientras que en el FeO es de +2
y en el Fe
2
O
3
. Estos compuestos con nmero de oxidacin fraccionario se llaman compuestos no
estequiomtricos.
Con frecuencia se confunden los conceptos de valencia y de grado o nmero de oxidacin, porque sus
valores, en nmeros enteros, suelen coincidir. Sin embargo, tienen significados distintos. La valencia es la
capacidad de combinacin de un elemento, expresada en nmero de tomos de hidrgeno con los que pueden
combinarse, o bien el nmero de enlaces sencillos posibles del citado elemento. La valencia es siempre un
nmero entero, sin signo, puesto que no se conciben valencias negativas. Mientras que el nmero o grado de
oxidacin hace referencia al nmero de electrones perifricos del tomo que toman parte en los enlaces.
Reglas para asignar nmeros de oxidacin
1. El estado de oxidacin de un elemento en su forma libre (an formando molcula poliatmica) es
cero. As, los tomos en He, F
2
, S
8
, P
4
, Ca metlico, tienen el nmero de oxidacin cero.
2 El nmero de oxidacin de los iones monoatmicos es la misma carga del ion. Por ejemplo, los iones
Na
+
, Al
3+
, S
2-
tienen respectivamente los nmeros de oxidacin 1+, 3+, 2-.
3
3 La suma de todos los nmeros de oxidacin de los elementos en la frmula de un compuesto neutro
es cero. Para los iones poliatmicos dicha suma es igual a la carga del ion.
4 El nmero de oxidacin del flor en sus compuestos es siempre 1-.
5 El nmero de oxidacin del hidrgeno es normalmente 1+. En los hidruros metlicos utiliza 1- (por
ejemplo, en NaH, CaH
2
, etc.).
6 El nmero de oxidacin
del oxgeno es normalmente 2- (por ejemplo, en H
2
O, H
2
SO
4
, etc.) pero en
los perxidos es 1- (por ejemplo, en K
2
O
2
, CaO
2
, etc.) y en los superxidos, - (como en NaO
2
, CaO
4
). En los
compuestos binarios con el flor, el nmero de oxidacin del oxgeno es positivo (as en OF
2
y O
2
F
2
).
7 El nmero de oxidacin de los elementos de algunos grupos es constante en sus compuestos: as, los
metales alcalinos del grupo 1A tienen el nmero de oxidacin 1+; los elementos del grupo 2A tienen 2+ y los
elementos del grupo 7B utilizan el nmero de oxidacin 1- en los compuestos binarios con elementos menos
electronegativos que ellos. (El oxgeno es ms electronegativo que el cloro, el bromo y el yodo!) Los elementos
del grupo 6B utilizan el nmero de oxidacin 2- en los compuestos binarios con elementos menos
electronegativos que ellos.
Ejemplos: En el H
2
O, la valencia del oxgeno es igual a 2, pero su nmero de oxidacin es 2-. En el
H
2
O
2
, la valencia del oxgeno sigue con el valor de 2, pero su nmero de oxidacin es 1-. En el metano, CH
4
, el
nmero de oxidacin del carbono es 4-; en el cloruro de metileno, CH
2
Cl
2
, es cero y en el tetracloruro de
carbono, CCl
4
es 4+; sin embargo, la valencia del carbono en todos estos compuestos es siempre 4. En el
S
4
O
6
Na
2
el grado de oxidacin del azufre es 2.5 nmero originado por el cociente (6x2-2)/4 = 2.5.
A pesar de su carcter un tanto artificial, los nmeros de oxidacin tienen gran utilidad a la hora de
hacer balance de los electrones que se transfieren formalmente de unos tomos a otros en las reacciones
redox, y decidir as si una reaccin es de oxidacin-reduccin,
Los nmeros de oxidacin permiten adems establecer la definicin ms general de oxidacin-
reduccin: un elemento se oxida cuando aumenta su nmero de oxidacin y, a la inversa, se reduce cuando
disminuye (esto es, se reduce) su nmero de oxidacin.
OXIDANTES Y REDUCTORES. PARES REDOX.
Se puede establecer un paralelismo entre las reacciones cido-base y las reacciones redox:
cido-base Redox
Transferencia de: protones electrones
Donador cido reductor
aceptor base oxidante
Un agente oxidante, o simplemente, un oxidante es una especie que produce la oxidacin de otra
especie llamada agente reductor, o simplemente, reductor.
Ahora bien, el oxidante para oxidar a otro compuesto tiene que robarle electrones (parcial o
totalmente) pero entonces aumentar su carga negativa, esto es, disminuir su nmero de oxidacin y por lo
tanto, se reduce a s mismo.
El reductor, a la inversa, tiene que ceder electrones y por tanto, se oxida.
Ej: Mg + Cl
2
Mg
2+
+ 2 Cl
-
El magnesio es el reductor que al perder electrones se oxida, y el cloro es el oxidante que al ganar
electrones se reduce.
OXIDANTE.- Especie qumica (elemento o compuesto) que:
- Produce oxidacin (de otra); hace que otra se oxide.
- Gana electrones.
- Se reduce y queda reducido al final de la reaccin.
4
REDUCTOR.- Especie qumica (elemento o compuesto) que:
- Produce la reduccin (de otra); hace que se reduzca.
- Pierde electrones.
- Se oxida y queda oxidada al final de la reaccin.
TABLA RESUMEN
Trmino Transferencia electrnica Variacin del n de oxidacin
Oxidacin
Reduccin
Reductor
Oxidante
Especie oxidada
Especie reducida
Prdida de electrones
Ganancia de electrones
Dador de electrones
Aceptor de electrones
La que perdi electrones
La que gan electrones
Aumento
Disminucin
Aumenta su n de oxidacin
Disminuye su n de oxidacin
La que aument su n de oxidacin
La que disminuy su n de oxidacin
Lo mismo que en las reacciones cido-base, en las reacciones redox siempre hay implicado un oxidante
y un reductor; y tambin como en las reacciones cido-base, el concepto de oxidante y reductor es relativo,
una sustancia puede ser oxidante o reductor dependiendo de con quin se enfrente. Ej: el perxido de
hidrgeno, H
2
O
2
, acta habitualmente como oxidante pero, sin embargo, frente al permanganato de potasio,
que es un oxidante ms potente, lo hace como reductor.
PESO EQUIVALENTE DE OXIDANTES Y REDUCTORES
El peso equivalente de una sustancia, referido a una reaccin determinada, se define como la cantidad
de sustancia que produce o consume, directa o indirectamente, un mol de electrones.
Para calcular el peso equivalente y el eq-g de un oxidante o reductor, se necesita conocer la
transformacin que sufre la especie de la cual queremos calcular esas magnitudes, ya que dependen del
nmero de electrones intercambiados y estos varan con la transformacin que se produzca. Una vez conocida
la transformacin, se determina el nmero de electrones intercambiados, bien por ajuste de la semirreaccin
correspondiente a la oxidacin o a la reduccin, o por la variacin del nmero de oxidacin.
El valor numrico del peso equivalente se obtiene dividiendo la masa molar de la sustancia entre el
cambio de nmero de oxidacin asociado con esa reaccin o por el nmero de electrones intercambiados.
AJUSTE DE ECUACIONES DE OXIDACIN-REDUCCIN
Para poder hacer clculos en una reaccin, es necesario que la ecuacin correspondiente est
ajustada. En general se dice que una ecuacin est ajustada, cuando el n y la naturaleza de los tomos que
intervienen como reactivos en la ecuacin, coincide exactamente con el n y la naturaleza de los tomos que
aparecen como productos en dicha reaccin. En el caso de las ecuaciones de oxidacin-reduccin, adems de
eso debe cumplirse que los dos miembros de la ecuacin tengan la misma carga elctrica.
Para conseguir ese ajuste, y que la ecuacin sea estequiomtrica, se puede aplicar alguno de los
mtodos generales, tanteo o coeficientes indeterminados, siempre y cuando conozcamos todas las especies
qumicas que deben aparecer en la ecuacin. Sin embargo, para estas reacciones redox, existen dos mtodos
especficos para realizar su ajuste, el mtodo del ion-electrn, y el mtodo de la variacin del nmero de
oxidacin.
De los dos mtodos indicados, se considera ms apropiado el mtodo del ion-electrn, ya que se
aproxima ms a la marcha verdadera de la reaccin; se manejan especies qumicas con existencia real, iones y
molculas. No obstante, algunos autores dicen que el mtodo del in-electrn es ms recomendable entre
sustancias inicas, y el de la variacin del nmero de oxidacin entre sustancias no inicas: xidos, anhdridos,
etc.
5
MTODO DEL ION ELECTRN:
Los pasos a seguir segn este mtodo de ajuste son:
1. Si tenemos una ecuacin molecular (en forma de molculas), plantear la ecuacin inica correspondiente.
Se omite este paso si partimos de una ecuacin en forma inica. Las especies que se pueden transformar
en iones son los electrolitos (los cidos, las bases y las sales), las dems (xidos, anhdridos, agua,
hidruros, hidrocarburos, etc.) se dejan tal cual estn.
2. Se establece el nmero de oxidacin de cada tomo, para saber qu tomo o tomos se oxidan y cules se
reducen.
3. Se plantean las semirreacciones de oxidacin y de reduccin por separado, tomando slo las especies que
contienen a los tomos que cambian de nmero de oxidacin.
4. Ajustar las semirreacciones anteriores atmicamente. Primero se ajusta siempre el tomo que cambia de
nmero de oxidacin. El ajuste del hidrgeno y del oxgeno debe realizarse de la siguiente forma:
a) En soluciones cidas:
Para igualar el oxgeno, por cada tomo de oxgeno en un lado de la ecuacin, se aade en el
otro lado una molcula de agua.
Para igualar el hidrgeno, se aaden tantos iones H
+
, como tomos de hidrgeno falten en el
miembro correspondiente de la ecuacin.
b) En soluciones bsicas:
Para igualar el oxgeno, por cada tomo de ste en exceso en un lado de la ecuacin, se aade
en ese mismo lado una molcula de agua y se aaden dos iones OH
-
en el otro.
Para igualar el hidrgeno, se aade por cada tomo de hidrgeno en exceso un ion OH
-
en el
mismo lado y una molcula de agua en el otro.
5. Ajustar las semirreacciones electrnicamente, es decir, ajustar las cargas, sumando siempre electrones
en el miembro que haga falta para igualar las cargas en los dos miembros (en la oxidacin se suman en el
segundo miembro y en la reduccin en el primero).
6. Igualar el nmero de electrones intercambiados; para ello lo ms fcil es multiplicar los dos miembros de
cada semirreaccin por el nmero de electrones que haya en la otra. Para simplificar se dividen si es
posible ambos nmeros de electrones entre su m.c.d. (m.c.d.: se descomponen los nmeros de electrones
en factores primos y se toman los comunes con el menor exponente).
7. Sumando miembro a miembro las dos semirreacciones con el nmero de electrones intercambiados
igualado, tendremos la ecuacin inica ajustada.
8. Transformar, si es necesario, la ecuacin ajustada en su forma inica a molecular.
EJEMPLO: Ajustar por el mtodo del ion electrn la siguiente ecuacin redox
H
2
SO
4
+ K
2
Cr
2
O
7
+ FeSO
4
Fe
2
(SO
4
)
3
+ Cr
2
(SO
4
)
3
+ K
2
SO
4
+ H
2
O
El medio es cido por la presencia del cido sulfrico.
2 H
+
+ SO
4
2-
+ 2 K
+
+ Cr
2
O
7
2-
+ Fe
2+
+ SO
4
2-
2 Fe
3+
+ 2 Cr
3+
+ 2 K
+
+ 7 SO
4
2-
+ H
2
O
Semirreaccin de oxidacin: Fe
2+
Fe
3+
+ 1 e
-
Semirreaccin de reduccin: Cr
2
O
7
2-
+ 14 H
+
+ 6 e
-
2 Cr
3+
+ 7 H
2
O
Se multiplica la de oxidacin por 6 para igualar los electrones intercambiados: 6 Fe
2+
6 Fe
3+
+ 6 e
-
Sumamos las dos semirreacciones obtenidas, dndonos la siguiente ecuacin inica:
Cr
2
O
7
2-
+ 14 H
+
+ 6 Fe
2+
2 Cr
3+
+ 7 H
2
O + 6 Fe
3+
Escribimos la ecuacin molecular, aadiendo a cada lado de la ecuacin los iones potasio y sulfato necesarios:
7 H
2
SO
4
+ K
2
Cr
2
O
7
+ 6 FeSO
4
3 Fe
2
(SO
4
)
3
+ Cr
2
(SO
4
)
3
+ K
2
SO
4
+ 7 H
2
O
6
EJEMPLO: Ajustar por el mtodo del ion electrn la siguiente ecuacin redox
CrI
3
+ Cl
2
+ KOH K
2
CrO
4
+ KIO
4
+ KCl
El medio es bsico por la presencia del hidrxido.
La ecuacin inica ser:
Cr
3+
+ 3 I
-
+ Cl
2
+ K
+
+ OH
-
2 K
+
+ CrO
4
2-
+ K
+
+ IO
4
-
+ K
+
+ Cl
-
En este caso se oxidan los iones Cr
3+
e I
-
:
Cr
3+
+ 8 OH
-
CrO
4
2-
+ 4 H
2
O + 3 e
-
I
-
+ 8 OH
-
IO
4
-
+ 4 H
2
O + 8 e
-
Para obtener la semirreaccin de oxidacin, se multiplica la segunda ecuacin por 3 (debido a la
estequiometra del triyoduro de cromo, en el que existen tres iones I
-
por cada uno de Cr
3+
):
Cr
3+
+ 3 I
-
+ 32 OH
-
CrO
4
2-
+3 IO
4
-
+ 16 H
2
O + 27 e
-
Semirreaccin de reduccin:
Cl
2
+ 2 e
-
2 Cl
-
Como el nmero de electrones ha de ser el mismo en ambas semirreacciones, se multiplica la de oxidacin por
2 y la de reduccin por 27 y, tras sumar ambas, se obtiene la ecuacin inica global ajustada:
2 Cr
3+
+ 6 I
-
+ 27 Cl
2
+ 64 OH
-
2 CrO
4
2-
+ 6 IO
4
-
+ 32 H
2
O + 54 Cl
-
Escribimos la ecuacin molecular:
2 CrI
3
+ 27 Cl
2
+ 64 KOH 2 K
2
CrO
4
+ 6 KIO
4
+ 54 KCl+ 32 H
2
O
EJERCICIO: Ajusta por el mtodo del ion-electrn las siguientes ecuaciones de oxidacin-reduccin,
teniendo en cuenta que tienen lugar en medio cido:
a) Cu + NO
3
-
Cu
2+
+ NO
b) Cr
2
O
7
2-
+ H
3
AsO
3
Cr
3+
+ H
3
AsO
4
c) Ag
+
+ AsH
3
H
3
AsO
4
+ Ag
d) IO
3
-
+ SO
3
2-
I
-
+ SO
4
2-
e) NO
2
-
+ I
-
I
2
+ NO
f) KMnO
4
+ H
2
O
2
+ H
2
SO
4
MnSO
4
+ K
2
SO
4
+ O
2
+ H
2
O
g) MnO
2
+ FeSO
4
+ H
2
SO
4
MnSO
4
+ Fe
2
(SO
4
)
3
h) HCl + K
2
Cr
2
O
7
Cl
2
+ CrCl
3
+ KCl
i) SnCl
2
+ K
2
Cr
2
O
7
+ HCl SnCl
4
+ CrCl
3
+ KCl + H
2
O
j) KMnO
4
+ H
2
SO
4
+ HCl MnSO
4
+ K
2
SO
4
+ Cl
2
EJERCICIO: Ajusta por el mtodo del ion-electrn las siguientes ecuaciones de oxidacin-reduccin,
teniendo en cuenta que tienen lugar en medio alcalino:
a) Zn Zn(OH)
4
2-
+ H
2
b) Br
2
Br
-
+ BrO
3
-
c) ClO
2
ClO
2
-
+ ClO
3
-
d) Zn + NO
3
-
Zn(OH)
4
2-
+ NH
3
e) MnO
4
-
+ C
2
O
4
2-
MnO
2
+ CO
2
7
POTENCIALES NORMALES DE ELECTRODO
Las reacciones redox pueden aprovecharse para producir electricidad si hacemos que los electrones
implicados en el proceso de oxidacin-reduccin circulen por un circuito externo. Tendremos entonces una
celda electroqumica, tambin llamada pila galvnica o voltaica (en honor de los cientficos Galvani y Volta, que
fueron los primeros en desarrollar las primeras celdas de este tipo). Es un dispositivo experimental para
generar electricidad mediante una reaccin redox espontnea. En la siguiente figura se muestran los
componentes de una pila galvnica.
Una barra de cinc metlico se sumerge en una
disolucin de ZnSO
4
y una barra de cobre se sumerge en una
disolucin de CuSO
4
. El funcionamiento de la pila se basa en el
principio de que la oxidacin de Zn a Zn
2+
y la reduccin de Cu
2+
a Cu se pueden llevar a cabo simultneamente, pero en
recipientes separados, con la transferencia de electrones a
travs de un alambre conductor externo. Las barras de cinc y
cobre se llaman electrodos. Por definicin el nodo es el
electrodo en el que tiene lugar la oxidacin, y el ctodo es el
electrodo en el que ocurre la reduccin.
En esta celda, las reacciones de oxidacin y de reduccin en los electrodos, es decir las reacciones de
semicelda, son:
Electrodo de Zn (nodo): Zn
(s)
Zn
2+
(ac)
+ 2 e
-
Electrodo de Cu (ctodo): Cu
2+
(ac)
+ 2 e
-
Cu
(s)
Si las disoluciones no estuviesen separadas, los iones Cu
2+
reaccionaran directamente con la barra de
cinc, pero no se obtendra trabajo elctrico til:
Cu
2+
(ac)
+ Zn
(s)
Cu
(s)
+
Zn
2+
(ac)
Para completar el circuito elctrico, las disoluciones deben estar conectadas a travs de un medio
conductor por el cual se pueden mover los cationes y aniones desde un compartimiento al otro. Este requisito
se cumple con un puente salino, que en su forma ms simple es un tubo en forma de U invertida que contiene
una disolucin de un electrolito inerte como KCl, cuyos iones no reaccionarn con los iones de la disolucin o
con los electrodos. Durante el curso de la reaccin redox global, los electrodos fluyen externamente desde el
nodo (electrodo de Zn) a travs del alambre conductor y del voltmetro hacia el ctodo (electrodo de Cu).
Los cationes (Zn
2+
, Cu
2+
y K
+
) disueltos se mueven hacia el ctodo, mientras que los aniones (SO
4
2-
y Cl
-
) se
mueven hacia el nodo. Sin el puente salino que conecta las dos disoluciones, en forma rpida se acumularan
cargas positivas en el compartimiento del nodo (por la formacin de iones Zn
2+
) y cargas negativas en el del
ctodo (que se generan cuando parte de los iones Cu
2+
se reducen a Cu) impidiendo que la celda funcione.
La corriente elctrica fluye del nodo al ctodo porque hay una diferencia de energa potencial
elctrica entre los electrodos.
El que un semisistema acte como nodo o como ctodo depende de la mayor tendencia del mismo a
ceder electrones en comparacin del semisistema frente al cual se encuentre; y para establecer la mayor o
menor tendencia de un semisistema a ceder electrones se construy una tabla comparndolos a todos con un
mismo electrodo tomado como referencia en unas determinadas condiciones estndar. El electrodo elegido
fue el electrodo de hidrgeno al cual se le asign un valor de potencial cero si est a 25 C, la concentracin
de protones es 1 M y la presin del hidrgeno 1 atm.
2 H
+
+ 2 e
-
H
2
(g)
e = 0,00 Voltios
La tabla se construye constituyendo con cada electrodo y con el electrodo estndar de hidrgeno una
pila galvnica, midiendo a continuacin el potencial de dicha pila con un voltmetro. Frente al electrodo de
hidrgeno unos electrodos se comportarn como nodos y otros como ctodos. Para simplificar todos los
potenciales se escriben en la tabla como potenciales de reduccin, si frente al electrodo de hidrgeno actan
como ctodos su potencial es positivo y si lo hacen como nodos ser negativo.
El significado de la tabla de potenciales redox puede resumirse en:
1. El potencial normal de reduccin mide la fuerza reductora de un semisistema. Cuanto ms negativo
sea su potencial ms reductor ser, y cuanto ms positivo ms oxidante.
2. Cada semisistema reduce a todos los que tiene por debajo en la tabla.
8
3. Si se forma una pila galvnica con dos semisistemas de la tabla, el nodo (el que se oxide) ser el
que est situado ms arriba.
En la realidad el potencial de una pila (que depende entre otros factores de la concentracin de las
disoluciones y de la temperatura) solo ser el que indique la tabla, si estamos en unas condiciones llamadas
estndar. Si estas condiciones varan el potencial de la pila habr que calcularlo aplicando una ecuacin
llamada ecuacin de Nernst.
VOLUMETRAS DE OXIDACIN-REDUCCIN
Se trata de valoraciones en las que tiene lugar una transferencia de electrones, esto es, una reaccin
de oxidacin-reduccin entre la sustancia a valorar y la disolucin valorada. La determinacin de sustancias
oxidantes o reductoras se lleva a cabo por valoracin con disoluciones patrn de reductores u oxidantes,
respectivamente.
Para ver en una valoracin cual es la sustancia que acta como oxidante y cual como reductor y as
escribir correctamente la reaccin que se produce durante la misma; podemos recurrir a la tabla de
potenciales de reduccin recordando que una sustancia ser ms oxidante cuanto ms positivo sea su
potencial y viceversa.
Los clculos pueden hacerse basados en la molaridad, con moles, o en normalidad, con equivalentes-
gramo, pero habitualmente se emplea est ltima, la normalidad; ya que siempre se cumple que el nmero de
los eq-g de las sustancias que reaccionan, cuando la reaccin es completa, es el mismo, lo que no se puede
decir de sus moles. Si se emplea la normalidad al preparar las disoluciones valoradas al hacer los clculos se
debe recordar que ahora el peso equivalente de un oxidante o de un reductor ser igual a su masa molar
dividida por el nmero de electrones que ste acepta o cede en la reaccin. En el punto de equivalencia deber
cumplirse que el nmero de eq-g de oxidante y de reductor sean iguales.
En la prctica los oxidantes ms utilizados son: KMnO
4
, K
2
Cr
2
0
7
, Ce
2
(SO
4
)
3
, H
2
O
2
, KIO
3
, KBrO
3
, etc.; y
los reductores ms empleados, entre otros son: FeSO
4
, SnCl
2
, Na
2
S
2
0
3
, As
2
0
3
, etc.
lndicadores para valoraciones redox
1. Autoindicadores: El reactivo puede servir como su propio indicador.- El ejemplo ms representativo
y clsico de este tipo de indicadores lo constituye la disolucin de permanganato de potasio. Su utilizacin se
basa en el hecho de que una sola gota (0,05 mL) de disolucin de permanganato de potasio 0,02 M es
suficiente para comunicar color rosa bien perceptible a varios centenares de mL de agua destilada o de una
disolucin no reductora y esta coloracin es incluso perceptible en presencia de iones ligeramente coloreados
como los de Fe
2+
. Tambin pueden utilizarse como autoindicadores las disoluciones de sulfato de cerio (IV) y
de yodo, pero los cambios de tonalidad producidos no son tan marcados y rara vez se utilizan.
2. lndicadores redox.- El potencial de un sistema redox va variando a medida que vamos aadiendo
disolucin valorada, de la misma forma que en una disolucin cido-base lo iba haciendo el pH. En el punto de
equivalencia y; tambin de forma similar; se produce un cambio brusco en el potencial.
Un indicador de oxidacin-reduccin es una sustancia cuyas formas oxidada y reducida tienen colores
diferentes, siendo la reaccin de oxidacin del mismo reversible. Esquemticamente se puede representar
as: In
ox
(color 1) + n e
-
In
red
(color 2)
Se llama potencial normal del indicador al que corresponde a iguales concentraciones de In
ox
e In
red
,
en ese momento el color ser intermedio al que tienen cada una de las dos formas. Una variacin de potencial
de : 0,05 V en un sentido o en otro de este potencial debe ser suficiente para que tenga lugar un cambio de
color hacia 1 o hacia 2.
Para que el indicador funcione debe de tener un potencial normal tal que est en un valor intermedio
entre los potenciales de las dos reacciones empleadas en la valoracin, y cambiar de color para un potencial
prximo al punto de equivalencia.
9
Tipos de volumetras redox
Se suelen estudiar principalmente tres tipos de valoraciones redox:
1. Valoraciones con KMnO
4
: Permanganimetras.- El permanganato de potasio es uno de los oxidantes
de ms amplia aplicacin en el anlisis qumico.
No requiere indicador debido a que esta sustancia tiene diferente color en su forma oxidada que en
su forma reducida, as una vez pasado el punto de equivalencia una sola gota en exceso hace cambiar el color
de incoloro a violeta.
Las valoraciones con permanganato suelen llevarse a cabo en medio cido, generalmente H
2
SO
4
,
reducindose el ion permanganato a Mn
2+
segn la reaccin:
MnO
4
-
+ 8 H
+
+ 5 e
-
Mn
2+
+ 4 H
2
O = +1,507 V
Cuando acta de esta forma el peso equivalente del permanganato es la quinta parte de su masa molar.
Las disoluciones de permanganato se conservan sino estn expuestas a gases reductores, al polvo o a
la luz intensa por lo que deben de guardarse en frascos de color topacio. No es una sustancia que sirva como
patrn primario, pues aunque puede obtenerse pura, pronto se descompone transformndose en dixido de
manganeso, por ello sus disoluciones valoradas se preparan de manera aproximada y se valoran despus contra
un agente reductor que sea patrn primario.
Se utiliza en gran cantidad de determinaciones qumicas oxidando a iones o molculas tales como:
Mn
2+
Mn
3+
; Fe
2+
Fe
3+
; As
3+
As
5+
; Cu
+
Cu
2+
; Sn
2+
Sn
4+
; H
2
O
2
O
2
; NO
2-
NO
3
-
;
Mn
2+
MnO
2
2. Valoraciones con K
2
Cr
2
0
7
: Dicromatometras.- El dicromato de potasio no es un oxidante tan fuerte
como el permanganato de potasio, pero posee algunas ventajas sobre ste.
Es una sustancia que se emplea como patrn primario, por lo que sus disoluciones patrn se preparan
directamente y no necesitan valoracin posterior. Adems, sus disoluciones son perfectamente estables.
Las valoraciones con dicromato se realizan siempre en medio cido, y el dicromato se reduce a Cr
3+
,
segn la reaccin:
Cr
2
0
7
2-
+ 14 H
+
+ 6 e
-
2 Cr
3+
+ 7 H
2
O
Su principal aplicacin es la determinacin de hierro en minerales o en sales, el hierro se disuelve y se
pasa a Fe2+ valorndolo a continuacin con el dicromato. Tambin se pueden valorar con dicromato otros
metales como el cromo en sales crmicas o el manganeso en aceros o minerales de manganeso.
3. Valoraciones con iodo: yodimetras y yodometras.- El yodo no es un oxidante tan fuerte como los
anteriores, pero tiene algunas caractersticas que lo hacen muy interesante: su potencial no depende del pH
del medio, y con base a su semirreaccin se pueden valorar tanto reductores como oxidantes.
Todas las valoraciones que se hacen con yodo se basan en la siguiente reaccin:
I
2
+ 2 e
-
2 I
-
yodimetra
yodometra
La yodimetra comprende las determinaciones efectuadas con disoluciones valoradas de yodo y las
yodometras consisten en la valoracin del yodo que se forma por oxidacin del ioduro.
Las sustancias que tiene un potencial inferior al del sistema I
2
/ I
-
se oxidan con el yodo y se pueden
determinar por valoracin patrn de yodo. Algunas de las principales reacciones yodimtricas son:
Sn
2+
+ I
2
Sn
4+
+ 2 I
-
S
2-
+ I
2
S + 2 H
+
+ 2 I
-
2 S
2
0
3
2-
+ I
2
S
4
0
6
2-
+ 2 I
-
En cambio en los sistemas fuertemente oxidantes el yoduro ejerce una accin reductora, con
formacin de una cantidad equivalente de yodo. El yodo liberado se valora con el tiosulfato de sodio. Algunas
de las principales reacciones yodomtricas son:
Cl
2
+ 2 I
-
2 Cl
-
+ I
2
2 Cu
2+
+ 4 I
-
2 CuI + I
2
BrO
3
-
+ 6 H
+
+ 6 I
-
Br
-
+ 3 I
2
+ 3 H
2
O
10
Vous aimerez peut-être aussi
- Química. Guia. Celdas Electroquímicas PDFDocument20 pagesQuímica. Guia. Celdas Electroquímicas PDFcarlosPas encore d'évaluation
- ReaccionesDocument24 pagesReaccionesFelipeBangiroPas encore d'évaluation
- Práctica III Quimica Basica EsimeZDocument11 pagesPráctica III Quimica Basica EsimeZLuis AngelPas encore d'évaluation
- Reacciones Redox y Electroquimica LECTURA Y TEMASDocument18 pagesReacciones Redox y Electroquimica LECTURA Y TEMASVanessa Sanchez CastroPas encore d'évaluation
- Reacciones Redox y Electroquímica LECTURA Y TEMASDocument18 pagesReacciones Redox y Electroquímica LECTURA Y TEMASManuel Orlando Márquez MartínezPas encore d'évaluation
- ReducciónDocument15 pagesReduccióncarolinaPas encore d'évaluation
- Reacciones RedoxDocument4 pagesReacciones RedoxKatherine LevPas encore d'évaluation
- Consideraciones Teoricas (Redox)Document6 pagesConsideraciones Teoricas (Redox)Mondragón AbelPas encore d'évaluation
- Introducciona A Redox Teoria y Ejemplos PDFDocument15 pagesIntroducciona A Redox Teoria y Ejemplos PDFMaria PardoPas encore d'évaluation
- Tema+7 RedoxDocument23 pagesTema+7 RedoxJose De Posada VelaPas encore d'évaluation
- Primera Parte TeoriaDocument6 pagesPrimera Parte TeoriaMario Monreal ToledanoPas encore d'évaluation
- Practica 3 Quimica Basica Esime ZacatencoDocument7 pagesPractica 3 Quimica Basica Esime Zacatencomago866100% (2)
- RedoxDocument18 pagesRedoxIstarted JokePas encore d'évaluation
- Oxido ReducciónDocument7 pagesOxido Reducciónjorge fernando TorresPas encore d'évaluation
- 5 - Reacciones de Óxido ReducciónDocument11 pages5 - Reacciones de Óxido ReducciónManuela LopezPas encore d'évaluation
- Reacciones de Oxidación Reduccion .Celdas y F.E.MDocument23 pagesReacciones de Oxidación Reduccion .Celdas y F.E.MJesus CardenasPas encore d'évaluation
- Oxdidacion-Reduccion RedoxDocument12 pagesOxdidacion-Reduccion RedoxAshly De Jesus RodriguezPas encore d'évaluation
- CuestionarioDocument11 pagesCuestionarioana moralesPas encore d'évaluation
- 2.2 Balanceo de Reacciones Oxidación-ReducciónDocument10 pages2.2 Balanceo de Reacciones Oxidación-ReducciónOctavio DaNoobPas encore d'évaluation
- Apuntes ElectroquímicaDocument22 pagesApuntes ElectroquímicaRaúl CortésPas encore d'évaluation
- RedoxDocument6 pagesRedoxJaime LopezPas encore d'évaluation
- Electroquimica CompletoDocument106 pagesElectroquimica CompletoMyrtha Fernandez FonsecaPas encore d'évaluation
- IntroducciónDocument25 pagesIntroducciónMariana Olivos MuñozPas encore d'évaluation
- Deber Intro RedoxDocument3 pagesDeber Intro RedoxEdGab PiedraMazaPas encore d'évaluation
- Resumen Unidad 8 ElectroquimicaDocument30 pagesResumen Unidad 8 ElectroquimicaJavier HerreraPas encore d'évaluation
- Reacciones RedoxDocument9 pagesReacciones RedoxDavid Reinaldo Ascue SalgadoPas encore d'évaluation
- Estados de Oxidación (Whitten)Document8 pagesEstados de Oxidación (Whitten)ElyReyesPas encore d'évaluation
- Fisicoquimica LaboDocument6 pagesFisicoquimica LaboHernando VillavicencioPas encore d'évaluation
- INTRODUCCIÓ1Document20 pagesINTRODUCCIÓ1LEOPas encore d'évaluation
- GuiaQuímica Inorganica Ing Qca y Mat 2019Document64 pagesGuiaQuímica Inorganica Ing Qca y Mat 2019Aproba Quimica MdqPas encore d'évaluation
- Practica 5 Oxido-Reduccion Equipo 6Document8 pagesPractica 5 Oxido-Reduccion Equipo 6RODRIGUEZ RAMIREZ SAMUEL100% (1)
- Reaccion RedoxDocument7 pagesReaccion Redoxdarir400Pas encore d'évaluation
- Reducción-Oxidación: ÍndiceDocument8 pagesReducción-Oxidación: Índiceup dawn underPas encore d'évaluation
- Reacciones de Oxido ReduccionDocument7 pagesReacciones de Oxido ReduccionJuan Sebastian Segura LugoPas encore d'évaluation
- Reacciones RedoxDocument12 pagesReacciones RedoxKarla BairesPas encore d'évaluation
- Resumen Quimica Organica 2Document5 pagesResumen Quimica Organica 2Melissa RodríguezPas encore d'évaluation
- Experimento 4 - Reacciones RedoxDocument8 pagesExperimento 4 - Reacciones RedoxAlfredo IvanPas encore d'évaluation
- Unidad 4 Quimica CuestionarioDocument7 pagesUnidad 4 Quimica CuestionarioAnn RMendezPas encore d'évaluation
- Apuntes Sobre Reacciones de Óxido-ReducciónDocument15 pagesApuntes Sobre Reacciones de Óxido-ReducciónLaboratoriodeciencias AltazorPas encore d'évaluation
- REDOXDocument16 pagesREDOXMaria Alejandra Perez100% (1)
- Balanceo de EcuacionesDocument8 pagesBalanceo de EcuacionesROMINA PADILLA MAMANIPas encore d'évaluation
- Practica Numero 3 OxidacionDocument11 pagesPractica Numero 3 OxidacionOmar LabastidaPas encore d'évaluation
- 5.2 Equipo 4Document5 pages5.2 Equipo 4John TitorPas encore d'évaluation
- Apuntes de ElectroquimicaDocument33 pagesApuntes de ElectroquimicaJuana Juana JuanaPas encore d'évaluation
- ReducciónDocument23 pagesReducciónemanueltorress144Pas encore d'évaluation
- TP 3Document14 pagesTP 3Romii MaldonadoPas encore d'évaluation
- Reacciones de Oxido ReducciónDocument36 pagesReacciones de Oxido ReducciónguidoPas encore d'évaluation
- Practica N3Document7 pagesPractica N3Carmen Reyes RamirezPas encore d'évaluation
- Reacciones Redox PasosDocument41 pagesReacciones Redox PasosAndrés100% (1)
- Principio de ElectroneutralidadDocument4 pagesPrincipio de ElectroneutralidadRichard Alejandro Leal GutiérrezPas encore d'évaluation
- Informe 6 de Quimica IIDocument33 pagesInforme 6 de Quimica IIJosseline Patricia Custodio SosaPas encore d'évaluation
- Trabajo Oxido ReducciónDocument13 pagesTrabajo Oxido ReducciónFrancis MorenoPas encore d'évaluation
- Laboratorio VirtualDocument15 pagesLaboratorio VirtualValeria NCoronadoPas encore d'évaluation
- AngeliniDocument12 pagesAngeliniBrianVelazquePas encore d'évaluation
- Oxidacion - ReduccionDocument13 pagesOxidacion - Reduccionjose luis moncayoPas encore d'évaluation
- Tema 5 RedoxDocument13 pagesTema 5 RedoxHanna SerarPas encore d'évaluation
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaD'EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaÉvaluation : 5 sur 5 étoiles5/5 (1)
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAD'EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAPas encore d'évaluation
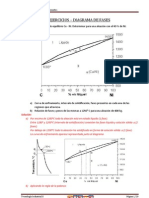
- Unidad 1 - 3Document5 pagesUnidad 1 - 3MaryMondayGrrrlPas encore d'évaluation
- Dialnet ICongresoVirtualInternacionalSobreInnovacionPedago 535470Document1 771 pagesDialnet ICongresoVirtualInternacionalSobreInnovacionPedago 535470Lettizia Manuel Díaz100% (1)
- Expresión e Interacción EscritaDocument3 pagesExpresión e Interacción EscritaMaryMondayGrrrlPas encore d'évaluation
- 5 - Fiji ProDocument2 pages5 - Fiji ProMaryMondayGrrrlPas encore d'évaluation
- ComunicadoNovedadesDocument75 pagesComunicadoNovedadeshel_bladePas encore d'évaluation
- HTML Apuntes TeoriaDocument24 pagesHTML Apuntes TeoriaRuben811986Pas encore d'évaluation
- 1 - Roxy Pro Gold CoastDocument1 page1 - Roxy Pro Gold CoastMaryMondayGrrrlPas encore d'évaluation
- 8.0 Higiene IndustrialDocument8 pages8.0 Higiene IndustrialMaryMondayGrrrlPas encore d'évaluation
- Ext in ContratoDocument26 pagesExt in ContratoMaryMondayGrrrlPas encore d'évaluation
- Ejercicios Analisis Series Datos AlumnosDocument3 pagesEjercicios Analisis Series Datos AlumnosMaryMondayGrrrlPas encore d'évaluation
- 2.0 Ejercicios de Repaso Temas 1 y 2 CSLDocument2 pages2.0 Ejercicios de Repaso Temas 1 y 2 CSLMaryMondayGrrrlPas encore d'évaluation
- Molienda y TamizadoDocument15 pagesMolienda y TamizadoMaryMondayGrrrlPas encore d'évaluation
- 4.3 UltravioletaDocument14 pages4.3 UltravioletaMaryMondayGrrrlPas encore d'évaluation
- Equilibrio QuímicoDocument6 pagesEquilibrio QuímicoMaryMondayGrrrlPas encore d'évaluation
- 4.0 Introduccion A Los Ensayos No DestructivosDocument9 pages4.0 Introduccion A Los Ensayos No DestructivosMaryMondayGrrrlPas encore d'évaluation
- PNT ExtracciónDocument2 pagesPNT ExtracciónMaryMondayGrrrlPas encore d'évaluation
- CC Estatal QuimicaDocument50 pagesCC Estatal QuimicaesajuaniPas encore d'évaluation
- Los Factores de Riesgo LaboralDocument17 pagesLos Factores de Riesgo LaboralMaryMondayGrrrlPas encore d'évaluation
- Jeff BeckDocument9 pagesJeff BeckMaryMondayGrrrlPas encore d'évaluation
- Equilibrio QuímicoDocument6 pagesEquilibrio QuímicoMaryMondayGrrrlPas encore d'évaluation
- M-CAL-1!02!01 Control y Aseguramiento de Calidad SubrayadoDocument10 pagesM-CAL-1!02!01 Control y Aseguramiento de Calidad SubrayadoMiguelngelPas encore d'évaluation
- U.D.3 Principios de La Termodinámica IIDocument21 pagesU.D.3 Principios de La Termodinámica IIMaryMondayGrrrlPas encore d'évaluation
- Ejercicios Resueltos Diagrama de Fases - Daniel Gomariz - Ingeniería IndustrialDocument20 pagesEjercicios Resueltos Diagrama de Fases - Daniel Gomariz - Ingeniería IndustrialDaniel Gomariz63% (8)
- EF - Corrosión en Los MetalesDocument7 pagesEF - Corrosión en Los MetalesMaryMondayGrrrl100% (1)
- DisolucionesDocument9 pagesDisolucionesMaryMondayGrrrlPas encore d'évaluation
- Reacciones QuimicasDocument6 pagesReacciones QuimicasMaryMondayGrrrlPas encore d'évaluation
- M-CAL-1!02!01 Control y Aseguramiento de Calidad SubrayadoDocument10 pagesM-CAL-1!02!01 Control y Aseguramiento de Calidad SubrayadoMiguelngelPas encore d'évaluation
- Tema 06 PDFDocument12 pagesTema 06 PDFJuan Gonzalo RosePas encore d'évaluation
- Formulación Inorgánica IDocument10 pagesFormulación Inorgánica IMaryMondayGrrrlPas encore d'évaluation
- Formulación Inorgánica 4ESODocument34 pagesFormulación Inorgánica 4ESOjulieth minPas encore d'évaluation
- Taller Sobre NomenclaturaDocument2 pagesTaller Sobre NomenclaturaNicolay VillaPas encore d'évaluation
- Determinacion de La Formula Del Yoduro de CobreDocument11 pagesDeterminacion de La Formula Del Yoduro de Cobre.:("*"BLacK BuLLeT"*"):.81% (16)
- ELEMENTOSDELGRUPOIIIADocument36 pagesELEMENTOSDELGRUPOIIIAJOSE ARMANDO CHUPA VILCAPas encore d'évaluation
- wuolah-free-NOMENCLATURA Y FORMULACIÓN DE COMPUESTOS IÓNICOS PDFDocument33 pageswuolah-free-NOMENCLATURA Y FORMULACIÓN DE COMPUESTOS IÓNICOS PDFVictoria Camarasa BonoPas encore d'évaluation
- Formulacion Inorganica WordDocument17 pagesFormulacion Inorganica WordLeslie ParraPas encore d'évaluation
- Tema No. 1 Estado de OxidaciónDocument3 pagesTema No. 1 Estado de OxidaciónBenjamin Antolinez GomezPas encore d'évaluation
- Tarea Semana 6 - Química en Procesos ProductivosDocument7 pagesTarea Semana 6 - Química en Procesos ProductivosAntonio Soto Avendaño100% (3)
- Quimica Recurso Didactico B4 090913Document58 pagesQuimica Recurso Didactico B4 090913Marichuy Ap67% (3)
- Guía 2022-1 QuímicaDocument54 pagesGuía 2022-1 QuímicaJesus MontiPas encore d'évaluation
- Cuestionario de Quimica Sanitaria UceDocument19 pagesCuestionario de Quimica Sanitaria UceCristian Pol SuquilloPas encore d'évaluation
- Tarea1Química (Andrés Borgonio)Document19 pagesTarea1Química (Andrés Borgonio)Andres LopezPas encore d'évaluation
- Balanceo de Ecuaciones RedoxDocument12 pagesBalanceo de Ecuaciones RedoxAngélica Tommaso AcevedoPas encore d'évaluation
- Modelo de InformeDocument14 pagesModelo de InformeMax Palomino AltezPas encore d'évaluation
- Guia Quimica NovenoDocument12 pagesGuia Quimica NovenoPATRICA ARIZA100% (1)
- Oxidacion y ReduccionDocument13 pagesOxidacion y ReduccionJulio Anthony Aragón HernándezPas encore d'évaluation
- Elementos: Carga Del Protón + 1,6.10 Carga Del ElectrónDocument21 pagesElementos: Carga Del Protón + 1,6.10 Carga Del ElectrónMatias PosstaPas encore d'évaluation
- UNIVERSIDAD MILITAR NUEVA GRANADA Practi PDFDocument20 pagesUNIVERSIDAD MILITAR NUEVA GRANADA Practi PDFesteban ramirez rodriguezPas encore d'évaluation
- ElectroquímicaDocument24 pagesElectroquímicaTatiana ArturiPas encore d'évaluation
- 3.2 - Nomenclatura QuímicaDocument7 pages3.2 - Nomenclatura QuímicaAlejandro MartínPas encore d'évaluation
- Equilibrio RedoxDocument12 pagesEquilibrio RedoxAlkaedaFlowDanysDanyelitoPas encore d'évaluation
- Formulación Q InorgDocument101 pagesFormulación Q Inorgcabasen73Pas encore d'évaluation
- L Nomenclatura SalesDocument4 pagesL Nomenclatura SalesNicolas GiraldoPas encore d'évaluation
- Qmc. 5to. (2015)Document78 pagesQmc. 5to. (2015)Nelson Nel100% (2)
- Balanceo Ecuaciones Oxido-ReducciónDocument38 pagesBalanceo Ecuaciones Oxido-ReducciónSan KanPas encore d'évaluation
- Tarea 3 Cambios QuimicosDocument12 pagesTarea 3 Cambios QuimicosNerlis morenoPas encore d'évaluation
- Funcion OxidoDocument2 pagesFuncion OxidoferrerPas encore d'évaluation
- Modulo Electroquimica - 401538 Actualizacion 2014Document222 pagesModulo Electroquimica - 401538 Actualizacion 2014Anonymous BWVdO6j3Pas encore d'évaluation
- s10 - Ppt-Balance Ión ElectrónDocument25 pagess10 - Ppt-Balance Ión ElectrónkattyPas encore d'évaluation
- Tabla PeriodicaDocument6 pagesTabla PeriodicaCondor Anaya EzequiasPas encore d'évaluation