Académique Documents
Professionnel Documents
Culture Documents
Exercices Diriges Enzymologie 2011 2012
Transféré par
alphonse1988Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices Diriges Enzymologie 2011 2012
Transféré par
alphonse1988Droits d'auteur :
Formats disponibles
Exercices Dirigs : Enzymologie
2011-2012
QCM
I) Les affirmations suivantes, concernant la spcificit des enzymes sont-elles
vraies?
(1) les enzymes ont une grande spcificit vis--vis de leur substrat.
(2) Lenzyme nest pas modifie par la raction de transformation du substrat
en produit.
(3) Une enzyme augmente la vitesse dune raction dun facteur 10
6
par
rapport la mme raction non-enzymatique.
(4) La prsence de lenzyme change ltat initial et ltat final dune raction
enzymatique.
(5) Le site actif (ou centre actif) dune enzyme est la zone de la protine o se
fixe le substrat
(6) Une enzyme peut avoir plusieurs sites de fixation pour son substrat.
(7) Une enzyme peut tre utilise plusieurs fois pour effectuer la mme
raction.
II) Soit la raction enzymatique simple :
E est lenzyme, S le substrat et P le produit.
Si lon part du principe que la raction catalytique seffectue partir dun seul complexe
ES (complexe de Michaelis), et que dans les premiers instants de la raction : k-2 est
ngligeable, lquilibre k+1/k-1 trs rapide et k+2 ltape limitante.
Dans ces conditions, les affirmations suivantes concernant ltat stationnaire sont-
elles vraies ?
(1) Tant que la concentration en substrat est beaucoup plus importante que celle
de lenzyme (S saturant), tout lenzyme est sous forme ES.
(2) Quand tout lenzyme est complex par le substrat, la vitesse de formation du
produit est constante.
(3) La vitesse de formation du produit est constante jusqu disparition complte
du substrat.
(4) La vitesse de formation du produit est directement proportionnelle la
concentration de lenzyme.
(5) La vitesse de disparition du substrat est indpendante de la concentration en
enzyme.
III) Lorsque [S] = Km, la vitesse de raction enzymatique est peut prt de :
(1) 0,1 Vmax
(2) 0,2 Vmax
(3) 0,3 Vmax
(4) 0,5 Vmax
(5) 0,9 Vmax
IV) Lorsque [S] = 0,1 * Km, la vitesse dune raction chimique catalyse par une
enzyme ayant un comportement Michaelien est peu prt de :
(1) 0,1 * Vmax
(2) 0,3 * Vmax
(3) 0,5 * Vmax
(4) 0,7 * Vmax
(5) 0,9 * Vmax
V) Lorsque [S] = 10 * Km, la vitesse dune raction chimique catalyse par une
enzyme ayant un comportement Michaelien est peu prt de :
(1) 0,1 * Vmax
(2) 0,3 * Vmax
(3) 0,5 * Vmax
(4) 0,7 * Vmax
(5) 0,9 * Vmax
VI) Les affirmations suivantes sont-elles vraies ?
La vitesse dune raction enzymatique :
(1) prsente une relation linaire en fonction de quantits croissantes
denzyme.
(2) prsente une relation hyperbolique en fonction de quantits croissante
denzyme
(3) est maximale la concentration de NaCl 9
(4) est maximale pH = 7
(5) est sensible aux variations de temprature.
(6) est sensible la prsence dautres ligands que le substrat.
VII) Il existe trois modles simple dinhibition enzymatique : linhibition
comptitive, linhibition non-comptitive et linhibition anti-comptitive (ou
incomptitive).
Les affirmations suivantes sont-elles vraies ?
Dans le cas dune inhibition :
(1) comptitive, le substrat et linhibiteur se fixent sparment sur lenzyme
(2) comptitive, cest Km qui varie et v
max
qui reste fixe
(3) non-comptitive, linhibiteur peut se fixer avant le substrat
(4) non-comptitive, cest le Km et la v
max
qui varient
(5) anti-comptitive, linhibiteur peut se fixer avant le substrat.
(6) anti-comptitive, cest Km et v
max
qui varient
VIII) Lequel de ces composs pharmaceutiques, nest pas un inhibiteur
enzymatique ?
(1) Mthotrexate
(2) Pnicilline
(3) Sulfonilamide
(4) Iode
(5) Viagra
EXERCICES
Exercice 1 :
On tudie la constante de Michaelis dune enzyme avec plusieurs substrats de structures
voisines. Les rsultats sont les suivants :
A : 5 x 10
-4
M B : 3 x 10
-3
M C : 3,5 x 10
-4
M D : 6 x 10
-2
M E : 5,5 x 10
-2
M
Pour lequel de ces composes, A, B, C, D et E lenzyme a telle le moins daffinit.
Exercice 2 :
Si une enzyme transforme 25
o
C 100 mol de substrat par minute, on peut admettre
priori, qu 85
o
C, elle en transformera par minutes :
A = 600 B = 300 C = 100 D = 10 E = 0
Exercice 3 :
Une cintique enzymatique peut tre reprsente graphiquement en portant
respectivement Vi en ordonne et Vi/S en abscisse. En utilisant lquation suivante :
Vi = Vmax Vi / S . Km
(dduite de celle de Michaelis et Menten et dont elle emprunte les mmes symboles), on
obtient un graphique du type reprsent ci-dessous pour un substrat en labsence
dinhibiteur.
(1) quel est le paramtre, dsign par son symbole, qui est mesur lintersection de
la droite et de laxe des ordonnes ?
(2) quel est celui mesur lintersection de la droite et de laxe des abscisses ?
(3) La pente de la droite tant le troisime paramtre, citer uniquement celui ou ceux
qui varie (nt) en prsence dun inhibiteur comptitif.
(4) La pente de la droite tant le troisime paramtre, citer uniquement celui ou ceux
qui varie (nt) en prsence dun inhibiteur non-comptitif.
Exercice 4:
Dans la figure reprsente ci-dessous, la droite I reprsente une tude cintique obtenue
avec une certaine concentration denzyme. Laquelle des droites reprsentes sur cette
figure pourrait correspondre la cintique obtenue dans les mmes conditions
exprimentales mais une concentration denzyme deux fois moindre.
Exercice 5:
Le foie du rat contient deux enzymes, lhexokinase (HK) et la glucokinase (GK),
capables de phosphoryler le glucose suivant la raction :
Mg
2+
Glucose + ATP Glucose-6-phosphate + ADP
On mesure la vitesse initiale (V1 pour HK, V2 pour la GK et V reprsente lactivit
phosphorylante totale) en fonction de la concentration en glucose, la concentration en
ATP tant maintenue constante. Les rsultats, exprims en UI par g de foie, sont reports
dans le tableau ci-dessous.
(1) Dduire de ce tableau les constantes cintiques Km et Vmax des deux enzymes
(2) Sachant que la concentration intracellulaire hpatique de glucose est de 5 mM,
calculer en pourcentage de Vmax, les vitesses initiales des ractions catalyses
par les deux enzymes.
(3) Indiquer laquelle de ces deux enzymes est susceptible dintervenir efficacement
en cas dlvation de la concentration en glucose au del de 5 mM. Justifier votre
rponse.
(4) On mesure lactivit phosphorylante totale V en prsence de glucose-6-phosphate
(G-6-P) la concentration de 5 mM. On obtient les rsultats suivants :
- pour [glucose] = 0,5 mM, V = 0,03 UI/g
- pour [glucose] = 150 mM, V = 1,00 UI/g
Quen dduisez vous ?
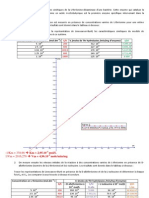
(5) La cintique de lHK en absence ou en prsence de G-6-P donne les rsultats
suivants en reprsentation de Lineweaver-Burk :
Quen dduisez vous ?
Glucose (mM) 0,05 0,1 0,5 1 5 10 15 150 500 1500
V1 (HK) 0,10 0,15 0,23 0,29 0,30 0,30 0,30 0,30 0,30 0,30
V2 (GK) 0,01 0,01 0,03 0,06 0,25 0,50 0,60 1,00 1,00 1,00
V = V1 + V2 0,11 0,16 0,26 0,35 0,55 0,80 0,90 1,30 1,30 1,30
Exercice 6:
On tudie lactivit de la -galactosidase sur orthonitrophnyl--D-galactopyranoside
(ONPG). Le protocole opratoire est le suivant :
Dans un tube on introduit :
1 ml de solution dONPG 2 mmol/l
1 ml de solution tampon pH = 7
mettre au bain marie 37oC pendant 5 minutes
ajouter 1 ml de prparation enzymatique 1 mg/ml
mettre au bain marie 37oC pendant 10 minutes
ajouter 1 ml de NaOH 1 M (afin de stopper la raction)
On mesure alors la vitesse de la raction enzymatique, et le rsultat est de 0,091 mol
dONPG transform par minute et par ml denzyme.
A- Parmi les propositions de rponse concernant les affirmations suivantes, indiquer
laquelle est vraie.
1- Le temps t pendant lequel sest droul la raction enzymatique est de 10
minutes.
2- La mme raction enzymatique, ralise dans des conditions identiques mais
temprature de 80oC, prsente une vitesse proche du double.
3- La mme raction enzymatique, ralise dans des conditions identiques mais
avec une concentration double denzyme (soit 2 mg/ml) prsente une vitesse
moiti moindre.
4- La vitesse mesure au terme de la raction correspond la vitesse initiale.
5- Au terme de la raction, la quantit dONPG transforme est 0,91 mol/ml
denzyme.
Propositions de rponse :
a) 1 + 2 + 3
b) 2 + 3 + 5
c) 1 + 4 + 5
d) 1 + 3 + 5
e) aucune de ces propositions nest exacte.
B- On recommence lexprience mais en utilisant des solutions dONPG de
concentrations variables. Les vitesses de ractions pour chaque concentration
figurent dans le tableau ci-dessous :
[ONPG]
mmol/l
0,25 0,5 0,75 1 2 5 10 15 20
Vi
mol/min/ml
0,027 0,045 0,070 0,083 0,091 0,11 0,14 0,14 0,14
Dterminer daprs ce tableau et sans construire de courbe, la vitesse initiale
maximale (Vmax) de la raction enzymatique exprime en UI/l, ainsi que la constante
de Michaelis (Km) en mol/l.
C- On ralise la mme exprience quen B mais en prsence dun compos inhibiteur
I. les vitesses de raction obtenues en prsence de I figurent dans le tableau ci-
dessous :
[ONPG]
mmol/l
0,25 0,5 0,75 1 2 5 10 15 20
Vi
mol/min/ml
0,012 0,033 0,060 0,071 0,080 0,095 0,12 0,12 0,12
(1) Dterminer daprs ce tableau et sans construire de courbe, la vitesse initiale
maximale (Vmax) de la raction enzymatique exprime en UI/l, ainsi que la
constatnte de Michaelis (Km) en mol/l, en prsence de I.
(2) En dduire la nature de linhibiteur I.
(3) Calculer le pourcentage dinhibition lorsque la concentration en ONPG est 2
mmol/l.
Exercice 7:
La phosphatase alcaline (PAL) hydrolyse les monoesters de lacide phosphorique. Le
substrat utilis pour cette tude cintique est le paranitrophnyl phosphate de sodium
(PNPP). Le produit de la raction, le paranitrophnol (PNP), est jaune en milieu alcalin et
prsente un maximum dabsorption 410 nm, ce qui permet un dosage
spectrophotomtrique. La raction est effectue pH 10 selon le schma suivant :
La vitesse initiale de la raction a t mesure pour des concentrations variables en
substrat en prsence et en labsence de -glycrophosphate. Les rsultats exprimentaux
sont donns dans le tableau ci-dessous (les vitesses initiales sont donnes en units
arbitraires)
Concentration du substrat
(mol/l)
Vitesse initiale sans
-glycrophosphate
Vitesse initiale en prsence
de b-glycrophsphate la
concentration de 2.10
-3
M
1.10
-4
83.10
-5
51.10
-5
2.10
-4
132.10
-5
88.10
-5
5.10
-4
200.10
-5
154.10
-5
(1) a partir des valeurs exprimentales ci-dessus, tracer, pour lenzyme
tudie la courbe 1/V = f (1/[S]) en absence de -glycrophosphate.
Dterminer les valeurs de Km et Vmax.
(2) Tracer sur le mme graphique que prcdemment la courbe 1/V = f (1/[S])
en prsence de -glycrophosphate. En dduire comment le -
glycrophosphate se comporte vis--vis du PNPP.
Exercice 8:
Une enzyme (Km = 2.10-4 M) est essaye en prsence de son substrat la concentration
2.10-4 M et dun inhibiteur comptitif la concentration de :
2,5. 10-3 M (Ki = 2,5.10-3)
(1) la Vmax(sans inhibiteur) est de 55 M/min. Calculer Vi, vitesse initiale de la raction
en prsence de linhibiteur.
(2) calculer Vo, vitesse initiale de la raction en absence dinhibiteur. En dduire le
pourcentage dinhibition.
Vous aimerez peut-être aussi
- Controle Microbio Des AlimentsDocument119 pagesControle Microbio Des AlimentsAmina94% (31)
- Serie9 Exos PDFDocument2 pagesSerie9 Exos PDFrahmani67% (3)
- ΔG ' conditions standard 1 M: Voir les énoncés des exercicesDocument9 pagesΔG ' conditions standard 1 M: Voir les énoncés des exercicesLAMINE DEGUISTAR100% (7)
- 07-3 Plantes MedicinalesDocument39 pages07-3 Plantes Medicinaleshamido17100% (2)
- Fumage Du Poisson PDFDocument48 pagesFumage Du Poisson PDFalphonse1988Pas encore d'évaluation
- Cahier D'exercice2Document15 pagesCahier D'exercice2GHERMI .M100% (11)
- GCH-2006: Calcul Des Réacteurs Chimiques - CoursDocument16 pagesGCH-2006: Calcul Des Réacteurs Chimiques - Courswilliambali100% (7)
- TD Peptitides Et Protéines 2000-2001Document3 pagesTD Peptitides Et Protéines 2000-2001Ikram FerPas encore d'évaluation
- TD2 CorigesDocument15 pagesTD2 CorigesDjawed BoutPas encore d'évaluation
- Manuel de Travaux Pratiques de MicrobiologieDocument27 pagesManuel de Travaux Pratiques de MicrobiologieAmina94% (96)
- Resumé ENZYMOLOGIEDocument13 pagesResumé ENZYMOLOGIEislamouahabiPas encore d'évaluation
- Correction TD Enzymologie 5 PDFDocument29 pagesCorrection TD Enzymologie 5 PDFSalah Eddine Msiky90% (10)
- TD 1 ChromatographieDocument16 pagesTD 1 Chromatographienassima chenikha0% (1)
- BIOCHIMIE METABOLIQUE ET ENZYMO - Sujet Et Corrigé H.HaidousDocument7 pagesBIOCHIMIE METABOLIQUE ET ENZYMO - Sujet Et Corrigé H.Haidousrobbihad95% (22)
- SVI4-M21-Enzymologie Et Biochimie Métabolique-Polycopié TP InvertaseDocument12 pagesSVI4-M21-Enzymologie Et Biochimie Métabolique-Polycopié TP InvertaseSioud Besma50% (2)
- Exercice Enzymologies INTERNET CORRECTIONDocument7 pagesExercice Enzymologies INTERNET CORRECTIONabdel krim100% (1)
- TD4 AaDocument4 pagesTD4 AaRadia Kadi100% (1)
- Examen 2017 Ratt CorrigeDocument10 pagesExamen 2017 Ratt Corrigefawzi badiPas encore d'évaluation
- Corrigé de L'examen de Remplacement de Biochimie (2016)Document7 pagesCorrigé de L'examen de Remplacement de Biochimie (2016)elhidhab2014Pas encore d'évaluation
- Corrigé de Lexamen de Biochimie 2017 FinalDocument4 pagesCorrigé de Lexamen de Biochimie 2017 FinalAmanda Laleye100% (2)
- ChapI ENZYMOLOGIE COENZYMES ET VITAMINESDocument49 pagesChapI ENZYMOLOGIE COENZYMES ET VITAMINESbessama84100% (2)
- FUMAGE DU POISSON, Valorisation Des Produits de La Mer PDFDocument178 pagesFUMAGE DU POISSON, Valorisation Des Produits de La Mer PDFalphonse1988Pas encore d'évaluation
- Exercice EnzymologieDocument6 pagesExercice EnzymologieXuan Carpentier100% (1)
- TD Série 2 EnzymologieDocument3 pagesTD Série 2 EnzymologieAzzeddine KhartaPas encore d'évaluation
- Enzymologie Et BioénergétiqueDocument15 pagesEnzymologie Et BioénergétiqueZorba ZorbaPas encore d'évaluation
- Fiche TD Enzymologie Réactions Enzymatiques - CopieDocument2 pagesFiche TD Enzymologie Réactions Enzymatiques - Copiebenali anfalPas encore d'évaluation
- Compilés EnzymologieDocument5 pagesCompilés EnzymologieHadrien De GreefPas encore d'évaluation
- Chapitre 2 La Cinétique EnzymatiqueDocument15 pagesChapitre 2 La Cinétique EnzymatiqueAbdouli RoukayaPas encore d'évaluation
- TD1 CorrigeDocument12 pagesTD1 CorrigeLinda KoundziPas encore d'évaluation
- TD Enzymologie + SolutionDocument5 pagesTD Enzymologie + SolutionAbdel SePas encore d'évaluation
- Voir Un Cours Sur Les Paramètres Cinétiques Des Réactions Ctalysées Par Les EnzymesDocument4 pagesVoir Un Cours Sur Les Paramètres Cinétiques Des Réactions Ctalysées Par Les EnzymesLAMINE DEGUISTARPas encore d'évaluation
- 2 Enzym BasesDocument2 pages2 Enzym BasesKhyarhoum Brahim100% (1)
- TD EnzymologieDocument9 pagesTD EnzymologieKaren Dominique0% (1)
- Exercices de Biochimie Métabolique: TweeterDocument7 pagesExercices de Biochimie Métabolique: TweeterLAMINE DEGUISTARPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- TD1 EnzymologieDocument7 pagesTD1 EnzymologieasmaPas encore d'évaluation
- TD3 CorrigesDocument18 pagesTD3 CorrigesDjawed BoutPas encore d'évaluation
- TD 2 D'enzymologieDocument3 pagesTD 2 D'enzymologieabdel krim100% (2)
- TD1 - Bioénergétique 2020 - 2021Document2 pagesTD1 - Bioénergétique 2020 - 2021Ayoub Vb100% (2)
- Centrifugation ExerciceDocument10 pagesCentrifugation Exercicesalima sousou0% (1)
- TD N2 +3 PR Aziz Enzymologie Et Métabolisme PDFDocument2 pagesTD N2 +3 PR Aziz Enzymologie Et Métabolisme PDFZineb DahmaniPas encore d'évaluation
- TD BioénergétiqueDocument14 pagesTD Bioénergétiquefawzi badi100% (2)
- TDN10 PDFDocument5 pagesTDN10 PDFJules TiyoumPas encore d'évaluation
- Support Correction TD Enzymologie L3 2019-2020 - Sans Exo 5Document26 pagesSupport Correction TD Enzymologie L3 2019-2020 - Sans Exo 5Jean Luc KonanPas encore d'évaluation
- BIOENERGETIQUE SNP 22-23 CorrigeDocument1 pageBIOENERGETIQUE SNP 22-23 CorrigeZahra IdPas encore d'évaluation
- Variation D'énergie Libre StandardDocument3 pagesVariation D'énergie Libre StandardLAMINE DEGUISTAR100% (1)
- Métabolisme Des GlucidesDocument5 pagesMétabolisme Des GlucidesKamel Ould Amrouche50% (2)
- TD 4 Avec SolutionDocument6 pagesTD 4 Avec Solutionmistic JayPas encore d'évaluation
- Corrigé de Lexamen de Biochimie 2016 PDFDocument4 pagesCorrigé de Lexamen de Biochimie 2016 PDFAbdellah Ait SoussPas encore d'évaluation
- Série TD Meta Des Lipides Avec CTDocument8 pagesSérie TD Meta Des Lipides Avec CTdouaa hadjer ghiabaPas encore d'évaluation
- TSTL - Bioch.Cours .Chap.2.Enzymologie - Correction Exercice.7Document3 pagesTSTL - Bioch.Cours .Chap.2.Enzymologie - Correction Exercice.7Chris Zericho0% (3)
- Série TD 1 Bioénergétique, Potentiel Oxydo-RéductionDocument4 pagesSérie TD 1 Bioénergétique, Potentiel Oxydo-RéductionMilka Diarra100% (2)
- Exercices 1-CorrectionDocument3 pagesExercices 1-CorrectionLAMINE DEGUISTARPas encore d'évaluation
- Correction TDDocument21 pagesCorrection TDKarim Pichou0% (1)
- TD Métabolisme 2005-2006Document4 pagesTD Métabolisme 2005-2006Hana Zidi100% (1)
- TD Metabolisme Des LipidesDocument1 pageTD Metabolisme Des LipidesJohns AtsacwounPas encore d'évaluation
- n-1 PDFDocument39 pagesn-1 PDFZineb DahmaniPas encore d'évaluation
- Emd Enzymo AppDocument1 pageEmd Enzymo AppSam Épse RbiPas encore d'évaluation
- TD (Métabolisme Des Glucides)Document1 pageTD (Métabolisme Des Glucides)يحيى بورغدة100% (1)
- TD 2 de Biochimie StructuraleDocument10 pagesTD 2 de Biochimie Structuraleachouake100% (1)
- Cours Proba 2GCDocument33 pagesCours Proba 2GCsalah zaidPas encore d'évaluation
- TD Lipides Mtabo 07Document4 pagesTD Lipides Mtabo 07Abdel Redhat67% (6)
- Corrigé 06Document2 pagesCorrigé 06lmd200975% (4)
- Cinétique EnzymatiqueDocument3 pagesCinétique EnzymatiqueChaka TraorePas encore d'évaluation
- Je partage « 4_5969563937924977041 » avec vousDocument6 pagesJe partage « 4_5969563937924977041 » avec vouskerdartsPas encore d'évaluation
- Biochimie Approfondie TD 4Document4 pagesBiochimie Approfondie TD 4Alhassane BahPas encore d'évaluation
- Recueil D Exercices EnzymesDocument6 pagesRecueil D Exercices EnzymesStephanie TollenaerePas encore d'évaluation
- Etude Activite Biologie Extrait Fruit PDFDocument88 pagesEtude Activite Biologie Extrait Fruit PDFalphonse1988100% (1)
- 5 Generalites ChromatographieDocument14 pages5 Generalites Chromatographiealphonse1988Pas encore d'évaluation
- Extrait Des Principes Actifs Et Test de Leur Bioactivité Bon PDFDocument125 pagesExtrait Des Principes Actifs Et Test de Leur Bioactivité Bon PDFalphonse1988Pas encore d'évaluation
- GACEM Mohamed Amine PDFDocument149 pagesGACEM Mohamed Amine PDFalphonse198850% (2)
- Correctioncontrolecontinubio2005 2006Document15 pagesCorrectioncontrolecontinubio2005 2006alphonse1988Pas encore d'évaluation
- TP Initiationidentificationbacteries GaleriesenteroDocument3 pagesTP Initiationidentificationbacteries Galeriesenteroalphonse1988Pas encore d'évaluation
- Degré Alcoolique Vin - CPF0708 PDFDocument4 pagesDegré Alcoolique Vin - CPF0708 PDFalphonse19880% (1)
- Strep To Co QuesDocument6 pagesStrep To Co Quesalphonse1988Pas encore d'évaluation
- Milieux Et Caractérisation MicrobienneDocument8 pagesMilieux Et Caractérisation Microbiennealphonse1988100% (1)
- Casimir Blonski - EnzymologieDocument35 pagesCasimir Blonski - Enzymologiealphonse1988Pas encore d'évaluation
- Biologie Structurale - E-Cours PDFDocument57 pagesBiologie Structurale - E-Cours PDFAziz DaqounePas encore d'évaluation
- Biochimie AgroDocument48 pagesBiochimie Agroalphonse1988100% (1)
- A Chaine Du Froid en Agroalimentaire Decembre 2001Document13 pagesA Chaine Du Froid en Agroalimentaire Decembre 2001alphonse1988Pas encore d'évaluation
- 191 Partiel TP de MicrobioDocument11 pages191 Partiel TP de Microbioalphonse1988Pas encore d'évaluation
- Cours 4 Acides Amines Et PeptidesDocument10 pagesCours 4 Acides Amines Et Peptidesalphonse1988Pas encore d'évaluation
- La Galerie Api20eDocument6 pagesLa Galerie Api20ealphonse1988Pas encore d'évaluation
- 3 - Exercices - Cinetiques EnzymatiqueDocument2 pages3 - Exercices - Cinetiques Enzymatique11anass07Pas encore d'évaluation
- ChampignonsDocument159 pagesChampignonsalphonse1988100% (1)
- Electrophorese Des AADocument3 pagesElectrophorese Des AAalphonse1988Pas encore d'évaluation
- Bon Exo Biochi ToutDocument70 pagesBon Exo Biochi ToutMomo MoumouPas encore d'évaluation
- Ensemencement D'une Galarie API 20Document50 pagesEnsemencement D'une Galarie API 20alphonse1988100% (3)
- 2007n39 PDFDocument37 pages2007n39 PDFalphonse1988Pas encore d'évaluation
- 2006n34 PDFDocument44 pages2006n34 PDFalphonse1988Pas encore d'évaluation
- Résumé EnzymologieDocument5 pagesRésumé EnzymologieSERIGNE MAYORO THIAMPas encore d'évaluation
- EMD Bioreacteurs M2 Pharm Et Envir-Sol-Converti - TextMarkDocument4 pagesEMD Bioreacteurs M2 Pharm Et Envir-Sol-Converti - TextMarkOmairPas encore d'évaluation
- Qcmexam S5 2018Document4 pagesQcmexam S5 2018Badr Eddine Hr50% (2)
- Projet de Module Bilan Macroscopique: Le Réacteur DiscontinueDocument7 pagesProjet de Module Bilan Macroscopique: Le Réacteur DiscontinueMarcil AlexandrePas encore d'évaluation
- Energie D'activationDocument34 pagesEnergie D'activationNadia amelPas encore d'évaluation
- Voir Un Cours Sur Les Inhibition Des Réactions EnzymatiquesDocument3 pagesVoir Un Cours Sur Les Inhibition Des Réactions EnzymatiquesbobPas encore d'évaluation
- RH TD CoursDocument84 pagesRH TD CoursDounia BenPas encore d'évaluation
- Corrigé Du Controle 2022 2023Document8 pagesCorrigé Du Controle 2022 2023My ProofPas encore d'évaluation
- Introduction À La Cinétique ChimiqueDocument59 pagesIntroduction À La Cinétique ChimiquemessaoudachoukaraPas encore d'évaluation
- Chapitre 3 - CatalyseDocument14 pagesChapitre 3 - CatalyseKevin RavelondrambalaPas encore d'évaluation
- TD 2 Bio IhnibiteursDocument1 pageTD 2 Bio IhnibiteursMohamed EL AminePas encore d'évaluation
- ENZYMOLOGIE II.2021pptDocument59 pagesENZYMOLOGIE II.2021pptKaren DominiquePas encore d'évaluation
- 3 Chapitre II EnzymesDocument62 pages3 Chapitre II EnzymesNour El HoudaPas encore d'évaluation
- Cca 2Document2 pagesCca 2Lamia ALACHAHERPas encore d'évaluation
- Devoir Maison ReacteursDocument7 pagesDevoir Maison ReacteursKhadidja Nora KIBBOUAPas encore d'évaluation
- Polymérisation Ziegler Natta - Recherche GoogleDocument2 pagesPolymérisation Ziegler Natta - Recherche Googleabdellatif.bouaallaPas encore d'évaluation
- Projet Cinitique GP l3 Section BDocument126 pagesProjet Cinitique GP l3 Section BokyPas encore d'évaluation
- Tpebhs 4346Document20 pagesTpebhs 4346Staline DonkengPas encore d'évaluation
- Cinetique Chimique (PR Belaribi)Document17 pagesCinetique Chimique (PR Belaribi)Zidani LinaPas encore d'évaluation
- C Ex13 Cin CaDocument2 pagesC Ex13 Cin CaHasan Rajawi100% (1)
- CM2 M1 EnzymesDocument43 pagesCM2 M1 EnzymesMaxøn ChöcølatPas encore d'évaluation
- Cours CinetiqueDocument16 pagesCours CinetiqueZogoPas encore d'évaluation
- Compte Rendu TP2 Cinétique ChimiqueDocument12 pagesCompte Rendu TP2 Cinétique ChimiquePONDIKPA KondiPas encore d'évaluation
- Fichier Produit 2658Document4 pagesFichier Produit 2658FlorinaPas encore d'évaluation
- 2003 Polynesie Correction Exo2 Cinetique 2 5ptsDocument2 pages2003 Polynesie Correction Exo2 Cinetique 2 5ptsdansoujosemorelePas encore d'évaluation
- Examen Cin Et Cat Avec Correction Session Normale 2017-2018Document7 pagesExamen Cin Et Cat Avec Correction Session Normale 2017-2018Chai MaePas encore d'évaluation
- Cour 1Document3 pagesCour 1Ñar ĎjesPas encore d'évaluation
- Vanhaverbeke Cecile p02 PDFDocument33 pagesVanhaverbeke Cecile p02 PDFMecheriPas encore d'évaluation
- Chapitre VDocument4 pagesChapitre VBelinda Dancheu100% (1)