Académique Documents
Professionnel Documents
Culture Documents
Sustitución Electrofílica Aromática
Transféré par
Victoria Daniela Quisberth Bautista50%(2)50% ont trouvé ce document utile (2 votes)
591 vues28 pagesTitre original
Sustitución electrofílica aromática
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
50%(2)50% ont trouvé ce document utile (2 votes)
591 vues28 pagesSustitución Electrofílica Aromática
Transféré par
Victoria Daniela Quisberth BautistaDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 28
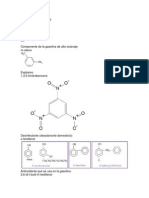
Sustitucin electroflica aromtica
La reaccin ms importante de los compuestos aromticos es la sustitucin
electroflica aromtica. Esto es, un electrfilo (E+) reacciona con un anillo aromtico y
sustituye uno de los hidrgenos.
Mediante este tipo de reaccin es posible anexar distintos sustituyentes al anillo
aromtico. Se le puede Halogenar (sustituir con halgeno: -F, -Cl, -I, -Br, -At), Nitrar
(sustituir por un grupo nitro: -NO2), Sulfonar (sustituir por un grupo cido sulfonico -
SO3H), Alquilar (sustituir por un grupo alquilo: -R), etc.
Todas estas reacciones pueden ser llevadas a cabo seleccionando los reactivos y
condiciones apropiadas.
Halogenacion:
a) Bromacin de anillos aromticos: Se hacen reaccionar los anillos aromticos con
bromo, con FeBr3 como catalizador dando como resultado bromobenceno como
producto de sustitucin.
b) Cloracin y Yodacin: El cloro y el yodo pueden introducirse en el anillo aromtico
mediante una reaccin electrofilica en las condiciones apropiadas. Los anillos
aromticos reaccionan en presencia de FeCl3 como catalizador, para producir
clorobencenos.
El yodo por si mismo no reacciona con los anillos aromticos y se necesita un
promotor para que efecte adecuadamente la reaccin. Los mejores promotores son
los oxidantes como el perxido de hidrogeno H2O2, o sales de cobre como CuCl2. Estos
promotores actan oxidando el yodo, convirtindola en una empresa electrfila ms
potente que reacciona como si fuera I+. Entonces el anillo aromtico ataca el I+, con lo
que forma un producto de sustitucin normal.
Nitracin Aromtica:
Los anillos se pueden nitrar con una mezcla de cido ntrico y cido sulfrico
concentrados. Se piensa que el electroflo es el ion nitronio, NO2
+
, que se genera del
cido ntrico, por protonacion y perdida de agua. Este ion genera un carbocatin
intermediario, cuando este pierde un protn se genera el nitrobenceno como producto
de sustitucin.
Este proceso es realmente importante para la industria de explosivos, pigmentos y
farmacia.
Nitrobenceno
Sulfonacion aromtica:
Los anillos aromticos pueden sulfonarse por reaccin con cido sulfrico fumante
(H2SO4 + SO3). El electrfilo reactivo es HSO3+ o SO3, dependiendo de las
condiciones de reaccin.
Este proceso ocurre similar a la bromacin y nitracin pero tiene la caracterstica de
que es reversible.
Esta reaccin tiene importancia en la elaboracin de colorantes y productos
farmacuticos.
Alquilacin de anillos aromticos:
Reaccin de Friedel-Crafts: Es una sustitucin electrofilica aromtica en la cual el
anillo ataca un carbocation electrofilo. Este carbocatin se genera cuando el
catalizador AlCl3, ayuda al halogenuro de alquilo a ionizarse. La reaccin finaliza con
la perdida de un protn.
Esta reaccin posee tres limitaciones fundamentales:
1. Solo se pueden usar halogenuros de alquilo.
2. La reaccin es ineficaz cuando los anillos aromticos se encuentran unidos a
grupos fuertemente desactivadores.
3. Es difcil controlar l numero de alquilaciones que se desea producir.
4. Pueden producirse transformaciones e el esqueleto del grupo alquilo. (pueden
anexarse un n-propil o un i-propil).
Fenoles y alcoholes aromticos. Quinonas:
Los fenoles son compuestos aromticos que contienen un grupo hidroxilo unido
directamente al ncleo. El ms simple de los fenoles es el hidroxi derivado del benceno
llamado fenol o cido carboxilico.
Fenol
Los fenoles se sintetizan por fusin de sulfonatos con lcalis, por descomposicin de
sales de diazonio en condiciones adecuadas, tratando los derivados halogenados de los
hidrocarburos bencenoicos con soluciones de lcalis a altas temperaturas.
Cresoles:
Son los homlogos ms cercanos al fenol, tambin se les conoce como hidrixitoluenos,
se obtienen del alquitrn de hulla. El p-cresol es uno de los compuestos de
putrefaccin de las protenas y posee al igual que los fenoles un gran poder bactericida
por lo que se le usa en medicina y veterinaria.
Fenoles dihidroxilicos:
Los ms simples son los derivados del benceno y se conocen tres ismeros de este p-
dihidroxibenceno (hidroquinona), m-dihidroxibenceno(resorcina) y o-
dihidroxibenceno(pirocatequina).
La hidroquinona se emplea como revelador fotogrfico; la resorcina se emplea para
fabricar plsticos, colorantes y sustancias medicinales.
Quinonas:
Al oxidarse la hidroquinona, se forma la quinona. Esta molcula posee la estructura
de un hexadieno unido a 2 oxigenos en forma para-.
Se utiliza para la fabricacin de muchos colorantes.
Fenoles trihidroxilicos:
Existen tres trihidroxibencenos posibles: 1,2,3- trihidroxibenceno(pirogalol);1,3,5-
trihidroxibenceno(floroglucina) y 1,2,4-trihidroxibenceno (hidroxihidroquinona); todas
son sustancias cristalinas. El pirogalol se obtiene calentando cido galico y
despresiandose el dixido de carbono y el contenido de oxigeno en mezclas gaseosas.
La floroglucina (floroglucinol), se obtiene al fundir potasa custica con resinas
vegetales.
Eteres aromticos: Estos se pueden dividir en dos grupos: a) del tipo Ar-o-Ar.
b) Eteres del tipo Ar-o-R, es decir, uno de sus radicales pertenece a la serie alifatica y
el otro a la aromtica y se pueden obtener de dos maneras: El primero es tratando los
derivados halogenados de los hidrocarburos con fenatos. El segundo es ms fcil y
menos costoso, se logra tratando el dimetilsulfato con fenoles en un medio alcalino.
Aldehdos aromticos: El ms simple es el benzaldehdo C6H5-CHO. Se conoce
tambin como esencia de almendras amargas, pues en la naturaleza se encuentra en
dichos frutos.
Industrialmente el benzaldehido se obtiene a partir del tolueno, el cual debe haber
sido clorado con anterioridad. El primer producto de la cloracin es el cloruro de
bencilo C6H5CH2Cl, el que en la cloracin posterior pasa a cloruro de
bencilidenoC6H5CHCl2. Al calentarlo en agua con pequeas cantidades de hidrxido
calsico o cido sulfrico, se forma benzaldehdo.
Otro mtodo de obtencin es la oxidacin directa de tolueno, hacindose pasar a altas
temperaturas sus vapores mezclados con aire, a travs de un tubo catalizador (oxido
frrico).
Cetonas aromticas: Pueden ser de dos formas: diaril - cetonas o aril - alquil cetonas,
es decir parte de la cetona puede contener un radical aliftico o alqulico.
Pueden ser sintetizadas por mtodo de Friedel-Crafts, tratando con cloruros de cidos
los hidrocarburos aromticos en presencia de cloruro de aluminio.
Aminas aromticas: La ms simple es la fenilamina o aminobenceno, C6H5-NH2
llamada anilina.
Existen muchos derivados de aminas aromticas y son de gran uso industrial, entre
ellos tenemos los tres ismeros de la toluidina(o-, m-, p-). Los de la nitroanilina (o-, m-
, p-), las aminas secundarias etc.
Benceno
________________________________________________
Perteneciente a la familia de los compuestos aromticos (anillo aromtico), de formula
C6H6, el cual posee una estructura electrnica nica de entre los compuestos
aromticos que le da un comportamiento qumico caracterstico.
Este compuesto presenta un alto grado de instauracin, y parece evidente que es una
molcula simtrica y que la instauracin de cualquier hidrgeno por el bromo es
equivalente a la sustitucin de cualquiera de los 5 hidrgenos restantes.
Se puede representar mediante las estructuras de Kekul, propuestas en 1865, sin
embargo ninguna de las dos son completamente correctas:
Propiedades Fsicas y Qumicas:
Es un compuesto particularmente estable, pues puede soportar el calor durante largo
tiempo y presin alta manteniendo su identidad estructural.
El benceno no reacciona tan fcilmente con reactivos que tpicamente lo hacen con
alquenos y alcadienos. Por ejemplo el Bromo Br2 en CCl4 o el Permanganato de
Potasio acuoso con el ciclohexeno y los ciclohexadienos. Se tiene que utilizar otro tipo
de condiciones y/o catalizadores, como el Bromo en presencia de FeBr3 a
temperatura ambiente, donde se da una reaccin de sustitucin entre el hidrgeno y
el bromo.
Las longitudes de enlace carbono - carbono son de 1.39 en el benceno y no el tpico
1.34 del C - C en un doble enlace, y mucho menos el 1.54 del enlace sencillo C -
C.
Los ngulos son de 120 y es completamente plana.
Respecto a su estructura electrnica, los tomos hbridos del carbono son sp2 dando
su planaridad a la molcula; y cada uno de estos tomos tiene un orbital p
perpendicular a los sp2 donde tiene un solo electrn.
Los orbitales p no se traslapan en pares aislados con enlace tipo
, mas bien los seis orbitales p se traslapan entre si para
formar una nube . Logrando con ello que los electrones
internos de la nube no estn relacionados con uno o dos tomos de carbono
especficos, proporcionando una deslocalizacin de los mismos aumentando la
estabilidad de la molcula al dispersar la carga sobre un rea mucho mayor. A esta
estabilidad adicional se le denomina Energa de Deslocalizacin.
Como se haba visto el benceno posee dos estructuras de kekul las cuales solo
difieren en la localizacin de los electrones de enlace. Por lo tanto se denominan
estructuras resonantes; sin embargo estas estructuras realmente no existen:
Estructuras Resonantes
Se representan mejor con su hbrido de resonancia:
De acuerdo a los calores de hidrogenacin (que se emplearon para determinar la
estabilidad de los alquenos), el benceno posee 36 Kcal/mol menos de energa de lo
que se esperara tener (se esperaba 85.8 Kcal/mol) si fuera 1,3,5 - ciclohexatrieno. O
sea es 36 Kcal/mol mas estable de lo esperado, y es la energa de deslocalizacin o
energa de resonancia (por los electrones deslocalizados).
La deslocalizacin de los electrones en el benceno es una cualidad que a menudo se
conoce como aromaticidad, y que aunque esta caracterstica no solo se limita al
benceno para que se pueda dar debe cumplir con los siguientes puntos:
Ser estructuras cclicas y cumplir con la premisa de tener 4n+2 electrones
deslocalizados (Regla de Hckel).
Ser molculas planas o por lo menos muy cercanas a las planas.
Cada tomo del anillo debe tener hibridacin sp2.
La molcula del benceno no es polar y es insoluble en agua.
Su punto de fusin es de 5.4C, de ebullicin 80.1C y su densidad a 20C
0.879g/cm3.
El benceno puede formar sistemas de anillos fusionados, como el naftaleno, el
antraceno o el fenantreno, pertenecientes a los hidrocarburos aromticos
polinucleares.
Por ejemplo:
La reaccin principal de los compuestos aromticos es la sustitucin aromtica
electroflica, donde un electrfilo ataca al anillo aromtico y da lugar a la
sustitucin., sustituyendo un Protn H+ por un electrfilo E+, preservando siempre la
integridad aromtica del sistema.
Reacciones del Benceno:
Sustitucin Aromtica Electroflica:
Los pasos son los siguientes:
Catalizador
E Nu E+ + -:Nu
trfilo sobre el ncleo aromtico: Paso lento determinante de la
velocidad.
ejemplo Nu:-) para dar lugar a un producto de sustitucin; reaccin rpida.
Reactividad Qumica:
Las reacciones del benceno mediante sustitucin aromtica son las siguientes:
Nitracin del Benceno: Monosustitucin.
Se deja reaccionar en una mezcla al benceno con el cido Ntrico y cido Sulfrico
concentrado a temperaturas de 50 y 60C, convirtindose suavemente a nitrobenceno.
A mas de 60C produce la disustitucin.
Halogenacin del Benceno: Monosustitucin.
Cuando se deja reaccionar el benceno con bromo o cloro en presencia de hierro
metlico o haluro frrico en cantidades catalticas la reaccin se lleva a cabo
suavemente y se forma el halobenceno; tambin se libera haluro de hidrgeno.
Sulfonacin del Benceno: Monosustitucin.
Se lleva a cabo normalmente con cido sulfrico fumante (contiene trixido de azufre,
SO3) aunque se emplea cido sulfrico concentrado (95% H2SO4, 5% H2O) para
anillos activados.
Alquilacin de Friedel - Crafts: Monosustitucin.
Esta reaccin es importante para introducir grupos alquilo en un anillo aromtico.
Involucra un haluro de alquilo y un catalizador cido de Lewis, generalmente
tricloruro de Aluminio, AlCl3: Falla con Haluros de arilo y vinilo.
Alquilacin del Benceno por Alcoholes:
La reaccin entre el alcohol tert - butlico y el benceno, en presencia de cido sulfrico
concentrado, produce tert - butilbenceno.
Alquilacin del benceno con Alquenos:
Cuando se deja que un alqueno entre en contacto con el benceno en presencia de un
catalizador cido ocurre la Alquilacin.
Introduccin de un segundo grupo en un derivado de Benceno Monosustituido:
Disustitucin:
En la disustitucin diferentes sustituyentes orientan a un grupo entrante a distintas
posiciones. La nitracin del tolueno produce orto- y para- nitrotolueno, en tanto que la
misma reaccin con nitrobenceno produce meta - dinitrobenceno. Conviene
Considerar dos factores importantes:
Tanto la orientacin como la reactividad dependen del grupo que inicialmente est
presente en la molcula. Puede haber dos tipos de grupos orientadores orto, para y
orientadores meta.
Por ejemplo:
Factores que influyen en la Orientacin y la Reactividad de la Sustitucin
Electroflica Aromtica:
Efecto Inductivo:
La orientacin depende de los sustituyentes que donan o sustraen electrones por
medio de dicho efecto. Es responsable de la determinacin de la reactividad
Efectos de Resonancia:
Es causante de la determinacin de la orientacin en las reacciones de los haluros de
arilo.
Reacciones de disustitucin de derivados monosustituidos del benceno.
Reacciones de compuestos nitro:
El nitro desactiva al anillo hacia una mayor sustitucin y tambin orienta a los
grupos entrantes a la posicin meta. Por tal motivo se debern utilizar
condiciones mas vigorosas para introducir un segundo grupo a una molcula que
contiene el grupo nitro.
Las reacciones de Friedel - Crafts no se pueden realizar en compuestos que presentan
un orientador meta o con anillos aromticos que contienen los grupos -OH, -OCH3, -
NH2, -NHR y NR2.
La reaccin general es:
Donde E = NO2 X, SO3H
Reacciones de Alquilbencenos:
Los Alquilbencenos son ms reactivos que el benceno, y el grupo alquilo orienta un
electrfilo entrante a las posiciones orto - para. La reactividad aumenta cuando hay un
grupo alquilo, y un problema al que se puede enfrentar en la reaccin de Alquilacin
de Friedel - Crafts es la formacin de alquilbencenos disustituidos.
La reaccin general es:
E = R, SO3H, NO2, X
Reacciones de cidos Bencensulfnicos:
Los cido Bencensulfnicos se pueden nitrar y halogenar, y es posible introducir un
segundo cido sulfnico en la molcula. Dado que el grupo -SO3H orienta a meta, las
reacciones de Friedel - Crafts no se pueden llevar a cabo en cidos aril - sulfnicos. El
grupo de cido sulfnico desactiva el anillo para una mayor sustitucin.
Donde E = NO2, X, SO3H
Reacciones de Halobencenos:
El tomo de halgeno desactiva el anillo aromtico, pero orienta un grupo entrante a
las posiciones orto y para. Los halobencenos se pueden sulfonar, alquilar y nitrar en
condiciones normales.
Su reaccin general es:
E = R, SO3H, NO3, X
reacciones del benceno mediante Adicin al Anillo Aromtico:
Hidrogenacin y Cloracin:
El anillo aromtico se puede hidrogenar y clorar en condiciones drsticas.
La reaccin del cloro con benceno en presencia de luz o altas temperaturas y
presiones adiciona 3 moles de cloro por mol de benceno.
Oxidacin de Cadenas Laterales de Alquilo:
La oxidacin de la cadena lateral de alquilo en los alquilbencenos (Ar - R) se logra por:
KMnO4 en base acuosa.
cido Crmico, H2CrO4 formado a partir de la reaccin de dicromato de potasio
(Kr2Cr2O7) y H2SO4
Las reacciones requieren de un calentamiento vigoroso.
En el caso mas sencillo, el grupo metilo en el tolueno se oxida al grupo cido
carboxlico, -COOH.
Otros sustituyentes rara vez afectan esta reaccin de oxidacin, pero cuando hay
varios grupos metilo, todos son oxidados de igual manera.
La reaccin general es la siguiente:
Halogenacin de la Cadena Lateral de Alquilbencenos:
Radicales Bencilo
Los alquilbencenos, Ar - C, contienen un anillo aromtico y una cadena lateral alquilo.
El anillo experimenta la sustitucin electroflica con reactivos inicos, y los alcanos
experimentan reacciones de sustitucin por radicales libres. Por esto no debe
sorprender que los alquilbencenos sufran ambas reacciones dependiendo de las
condiciones de reaccin empleadas.
Por ejemplo, el tolueno reacciona con cloro en presencia de cloruro frrico para dar
lugar a la cloracin del anillo. En tanto que con cloro en presencia de luz produce
sustitucin en el grupo metilo.
Resulta de la sustitucin Resulta de la Halogenacin
Electroflica Aromtica por radicales libres
en el grupo CH3
Sntesis de Compuestos Aromticos que Contienen Tres o Mas sustituyentes:
La sntesis de compuestos con tres o ms sustituyentes requiere que se consideren
efectos de la orientacin y de la reactividad de los grupos del anillo. Para evaluar
adecuadamente donde es ms posible que valla un grupo entrante. Hay que
considerar lo siguiente:
Los sustituyentes que ya estn en el anillo son los causantes de la
orientacin del grupo entrante. La orientacin no depende mucho de la
naturaleza del electrfilo entrante.
En algunos casos los sustituyentes presentes en el anillo orientan a un grupo
entrante a la misma posicin que ya ocupa uno de ellos.
mayor poder de activacin por lo regular determina la orientacin del grupo entrante.
Usos y Aplicaciones del Benceno:
Durante muchos aos, la principal salida para el benzol fue como combustible de
motores de automviles, sobre todo mezclado con gasolina. Ese uso se extendi
principalmente en Europa, donde se hicieron minuciosas investigaciones sobre las
mezclas de benzol y gasolina y sus efectos en el funcionamiento del motor. Antes de la
segunda Guerra mundial , el orden de importancia de los usos del benceno era como
sigue:
Combustible para motores.
Disolventes
Materia prima para la industria qumica.
Durante la guerra , aumentaron muchsimo los usos qumicos y llegaron a superar a
todos los dems usos juntos.
Hay varias razones para el uso del benzol como combustible coadyuvante en los
motores de compresin elevada.
El benceno tiene un valor antidetonante mayor que el de la gasolina. La volatilidad
total relativamente elevada (vaporizacin rpida en el carburador) de las mezclas de
benzol disminuye las dificultades para el arranque de los motores en tiempo fro
observados con la gasolina ordinaria , y por la ausencia de componentes muy voltiles
, el benzol es menos propenso a producir obstrucciones por formacin de bolas de
vapores en los conductos de combustible. Todos los combustibles para motores
forman carbn al quemarse. El carbn formado por el benzol es blando y no adherente
, y no se acumula en las paredes de los cilindros. El benzol sigue siendo empleado en
el mtodo de la ASTM para determinar el carcter detonante de los combustibles para
motores.
La cloracin del benceno da monoclorobenceno, que por hidrlisis se convierte en
fenol. As se fabrica gran cantidad de fenol en los E.U. La cloracin puede prolongarse
para dar diclorobencenos, de los cuales el ms conocido es el para por su uso como
insecticida y como preventivo de la polilla.
El Benceno se utiliza como constituyente de combustibles para motores, disolventes
de grasas, aceites, pinturas y nueces en el grabado fotogrfico de impresiones.
Tambin se utiliza como intermediario qumico.
El Benceno tambin se usa en la manufactura de detergentes, explosivos, productos
farmacuticos y tinturas.
Una lista parcial de ocupaciones con riesgo de exposiciones incluye:
Fabricantes de cido carblico.
Fabricantes de cido maleico. .
Fabricantes de bateras secas.
Fabricantes de caucho.
Fabricantes de colorantes.
Fabricantes de detergentes.
Fabricantes de estireno.
Fabricantes de hexacloruro de benceno.
Fabricantes de linleo.
Fabricantes de masilla.
Fabricantes de nitrobenceno.
Fabricantes de pegamentos.
Impregnadores de productos de asbestos.
Qumicos.
Soldadores.
Terminadores de muebles.
Trabajadores con clorobenceno.
trabajadores de la industria petroqumica
Entre los usos del Benceno se encuentra la fabricacin de medicamentos, tintes,
detergentes, plsticos, explosivos, aplicaciones como disolventes, y en la sntesis de
otros compuestos aromticos. Tambin como parasiticida en las heridas (veterinaria),
como disolvente de lacas, ceras y aceites. En las Gasolina se emplea como
antidetonante.
El benceno se conoce desde 1825 y actualmente es quiz el compuesto orgnico
estudiado mas a fondo y mejor conocido. La estructura de su molcula supuso un
problema extraordinariamente difcil para los primero qumicos orgnicos, no porque
tuviese complicacin excesiva, sino mas bien por ser el primer caso de enlaces
deslocalizados con el que se encontraron que no pareca encargar en lo que se saba
acerca de estructura molecular.
Los resultados de una gran cantidad de cuidadosas investigaciones condujeron a
aquellos qumicos a la conclusin de que el par de frmulas de Kekul era la mejor
representacin para el benceno. No fue posible comprender por qu se requeran dos
frmulas para describir la estructura del benceno hasta que aparecieron los conceptos
de electrones deslocalizados y de resonancia, al final de la dcada de 1920. Ni tampoco
estaba claro por qu el benceno era tan estable. Se aceptaban simplemente los hechos
experimentales de que una molcula como el benceno, para la que podan escribirse
dos frmulas de
Kekul, quedaba descrita mejor por la suma de ambas frmulas y que cualquier
compuesto similar exhiba una estabilidad mayor que los compuestos anlogos para
los que slo se poda escribir una nica estructura de Kekul.
HALGONENACIN
La molcula de Br2 es dbilmente electrfila y por ello no reacciona con el benceno a
una velocidad suficiente para que el proceso sea til. Sin embargo la adicin de un
cido de Lewis como catalizador hace que la reaccin benceno-bromo transcurra
rpidamente. La misin del cido de Lewis es convertir el Br2 dbilmente electrofilo en
Br+ que es fuertemente electrofilo. Lo que ocurre luego no es la adicin de dos tomos
de bromo a un enlace doble sino la sustitucin de un hidrogeno por un bromo:
La reaccin del Br+ con un alqueno es anloga a la del Br2 con el mismo alqueno:
Ambos tipos de intermedios pueden formularse para la reaccin entre el bromo y el
benceno:
En el caso del benceno el ion carbonio no es tan poco favorable. La carga est
deslocalizada sobre cinco tomos de carbono en vez de estar concentrada en uno. Si el
bromo se adiciona tambin al carbono contiguo para dar un intermedio de tres
centros, la carga quedara ms localizada sobre el bromo en vez de estar muy
deslocalizada. Esto parece desfavorable y por tanto muy poco probable; se cree que el
intermedio tiene de hecho la estructura de un ion carbonio abierto Esta clase de
estructura como un intermedio definido de la reaccin corresponde aun mnimo de
energa en el diagrama de la coordenada de reaccin, fue propuesto por Wheland hace
muchos aos por lo que se le conoce como intermedio de Wheland. Este intermedio de
Wheland puede ser atacado por el ion bromuro para dar el dibromoderivado:
O bien el ataque del ion bromuro puede transcurrir actuando como una base y
extrayendo un protn del carbono donde est unido ya el bromo como se indica a
continuacin:
La mejor demostracin de que el intermedio de Wheland es en efecto un intermedio no
un simple estado de transicin procede de los efectos isotpicos. En la mayora de las
reacciones de sustitucin electrfila del benceno la velocidad de la reaccin es la
misma independientemente de que el electrfilo reemplace a un hidrgeno, a un
deuterio o a un tritio. Por lo tanto el enlace C-H no debe romperse en la etapa lenta de
la reaccin. Tienen que existir forzosamente dos etapas, una lenta y otra
independiente en la que se rompa el enlace C-H. Puesto que los enlaces C-H del
benceno no tienen ninguna tendencia a romperse espontneamente, esa etapa debe ir
a continuacin de la otra . Estos hechos exigen que el diagrama de la coordenada de la
reaccin para la sustitucin electrofila del benceno sea como en la siguiente figura:
G
El mecanismo completo de la bromacin del benceno puede formularse as:
El benceno y otros compuestos aromticos experimentan de una forma anloga una
reaccin de cloracin en presencia de catalizadores adecuados. La reaccin entre el
cloro y un cido de Lewis produce un ion cloronio Cl+ que ataca al anillo aromtico
como lo hace el Br+.
NITRACIN
La nitracin del benceno puede llevarse a cabo mezclando cido ntrico con benceno,
en presencia de cido sulfrico concentrado, y calentando la mezcla:
Esta reaccin es una sustitucin electrfilica anloga a las halogenaciones recin
discutidas. El agente electrfilico es el NO2; los cidos ntrico y sulfrico se limitan a
producir el NO2+.
La sustitucin electrfila comienza cuando el cido sulfrico, por ser
extraordinariamente fuerte, protona al ntrico dando H2N03+ que puede perder agua
para formar NO2+. El cido sulfrico facilita esta ultima reaccin capturando el agua
formada. Entonces el ion NO2+ ataca al anillo del benceno y despus ocurren los
pasos ya conocidos. Podemos formular el mecanismo completo as:
SULFUNACIN
El benceno reacciona lentamente con el cido sulfrico a temperaturas elevadas. El
producto de la reaccin es el cido bencenosulfnico:
El mecanismo de la reaccin implica la formacin del trixido de azufre (SO3) a partir
del cido sulfrico. El trixido de azufre es un electrfilo relativamente fuerte porque el
tomo de azufre necesita ms electrones y ataca al anillo bencnico de la forma
acostumbrada. La produccin del trixido de azufre a partir del cido sulfrico y los
pasos restantes de la reaccin suceden as:
La reaccin transcurre mas fcilmente si se emplea cido sulfrico undamentalmente
en vez del concentrado porque la concentracin de SO3 es mayor. Si se diluye el cido
sulfrico con agua se solvatada y desactiva tanto que la reaccin no tiene lugar.
Tampoco tiene lugar la sulfonacin si el cido sulfrico se diluye con cido ntrico,
pues entonces se verifica la nitracin. La sulfonacin del benceno se diferencia algo de
las reacciones discutidas previamente ya que es reversible a temperaturas elevadas. Si
se trata el cido bencenosulfnico con vapor sobrecalentado se convierte en benceno y
cido sulfrico:
La sulfonacin tambin se diferencia de las otras sustituciones electrfilas aromticas
del benceno en que se observa un pequeo efecto isotpico cuando se emplean
bencenos deuterados. Como el efecto es pequeo, parece que las barreras energticas
para el ataque por el SO3 y para la eliminacin del protn son de una magnitud
similar.
BIBLIOGRAFA
*Principios de Qumica
Dic Kerson; Gray Darensbourg, M.; Darensbours, D.
Ed Revert 3ed., Barcelona, 1989
*Qumica. Preuniversitario
Ortin, Jos
Ed. Tibidabo, Barcelona 1964
*Qumica Organica
Alhinger, Cava de Jongh, Johnson; Lebel, Stevens
Ed. Barcelona, 1988
DIRECCIONES DE INTERNET CONSULTADAS:
BENCENO Y AROMATICIDAD
El benceno, C
6
H
6
es el prototi po de l os compuestos aromti cos, l os cual es son i nsaturados
y muestran un bajo grado de reactividad. La denominada estructura de
Kekul(1865) para el benceno.Tiene nicamente un producto mono sustituido
(C6H5 Y) pues todos los 6 hidrgenosson equivalentes. Hay tres bencenos
disustituidos- los ismeros de posicin 1,2, 1,3 Y 1,4-designados como
orto, meta
y
para,
respectivamente.
Estructura del Benceno
a)
Efecto de Resonancia : El benceno es un hbrido de dos estructuras de
igualenerg a ( Kekul ) que di fi eren ni camente en l a l ocal i zaci n de l os
enl acesdobles:
b)
Grfica orbital: Cada C est hibridado
Sp
2
y tiene enlace con los otros dos C yun H. Estos enlaces comprenden el esqueleto
de la molcula. Cada C tambintiene un electrn en un orbital
p
formando ngulo recto con el plano del anillo.Estos orbitales
p
se superponen
igualmente
con cada uno de los dos orbitales
p
adyacentes para formar un sistema
7T
paral el o a y por enci ma y debaj o del plano del anillo (Fig. 10-2). Los seis
electrones
p
del sistema estn asociadoscon todos los 6 C. Por lo tanto estn ms
deslocalizados
y esto tiene que ver conla gran estabilidad y la mayor energa de resonancia de los
anillos aromticos.
c)
Los 6
OAp,
interactan para formar 60M
.
Como el benceno es c cl i co, l asondas estacionarias que representan nubes
de electrones son cclicas y tienen pl anos nodal es, l os cual es se muestran
baj o l a forma de l neas, en l ugar de puntos nodales. Ver problema 9.26
para el significado de un signo O. Los seiselectrones
p
llenan los tres OM enlazantes, incidiendo en la estabilidad del C
6
H
6
.
Las propiedades poco usuales del benceno, conocidas como carcter aromtico,
son:1. Est abi l i dad t r mi ca.
2.
Reacciones de sustitucin en lugar de reacciones de adicin con reactivos
polarescomo el HNO
3
, e l H
2
S0
4
y Br
2
. En estas reacci ones se conserva el ani l l o nosaturado.
3.
Resistencia a la oxidacin con KMnO
4
(ac), HNO
3
y todos los oxidantes msvigorosos.4.Espectros de resonancia magntica
nuclear nicos.
Aromaticidad y regla de Hckel
La regla de Hckel (1931) para la aromaticidad dice que si el nmero de electrones
esigual a 2 +
4n,
donde
n
es igual a cero o igual a un nmero entero, el sistema es aromtico.La regla se aplica
a
monocclicos que contienen carbono y en los cuales cada e puede ser hibridado
Sp2
para dar un orbital
p
para enlace
extendido. Esta regla se ha extendido a loscompuestos heteroc cl i cos no
saturados y compuestos de ani l l o fusi onado. Todos l ostomos que
participan en el enlace deben alinearse en el mismo plano. El sistema puede ser un
ion.
Los nmeros de electrones
que satisfacen la regla de Hckel son:2
(n
= O), 6
(n
= 1), 10
(n
= 2), 14
(n
= 3), 18
(n
= 4), etc.; el benceno tiene 6.
Anti aromaticidad
Las especies conjugadas planas cclicas, menos estables que las especies
acclicas nosaturadas correspondientes, se denominan anti aromticas. Tienen
4n
electrones
.
El, 3-ciclobutadieno
(n
= 1) , para el cual podemos escri bi r dos estructuras
contri buyentesequivalentes, es una molcula anti aromtica sumamente, inestable.
Esto demuestra que lahabi l i dad para escri bi r estructuras contri buyentes
equi val entes no es sufi ci ente para predecir la estabilidad.
SUSTITUCIN ELECTROFLICA AROMTICA
La sustitucin electroflica aromtica se lleva a cabo mediante electrfilos (cidos
deLewis, E
+
o E).
Mecanismo:
o
Reacciones:
Orientacin y actividad de los sustituyentes
L o s 5
H del ani l l o de l os bencenos mono-susti tui dos, C
6
H
5
G, no son i gual mentereactivos. La introduccin de E en C
6
H
5
G raramente da la distribucin estadstica de 40%
orto,
40%
meta
y 20%
para
de bencenos di-sustituidos. El o los sustituyentes determinan
(a)
la orientacin de E
(meta
o una mezcla de
orto
y
para)
y
(b)
la reactividad del anillohacia la sustitucin.
Efecto de la resonancia
SustituyenteActivador:
Desactivador:Un G donant e de el ect r ones puede est abi l i zar el
i nt er medi ar i o cuando st e est di r ect ament e uni do a l os C
(op)
cargados posi ti vamente. Tal es G estn efectuandodireccin
op.
Un G que retira electrones desestabiliza el
ion en mayor grado cuando estunido a carbonos cargados positivamente
(op).
Estos se desestabilizan menos
cuando tienenunin
meta
siendo entonces orientadores
m.
Tales G tienen, unido al anillo de benceno, untomo con
carga completa, p. ej. NR
3
, o con una carga parci al como resul tado de unadistribucin electrnica
desigual en un
enlace
,
por ejemplo:o como resultado de estar unido a los grupos que retiran electrones:
Donante de electrones (activadores, orientadores op):
a)
Aquel l os que t i enen un par de el ect r ones no compar t i do en el
t omoenl azado al ani l l o, que puede desl ocal i zarse haci a el ani l l o
medi ante unenlace
extendido.Otros ejemplos son , (halgeno) y .
b)
Aquel l os que no t i enen un par no compar t i do, que son donant es
deelectrones, por induccin o por hiperconjugacin (ausencia de resonancia),
p. ej., grupos alquilo. En la hiperconjugacin el enlace sigma C-H en un C
alfa est deslocalizado con el orbital
p
vaco de un C==C o un carbocatin.El H
+
resultante no cambia su posicin.
c)
Aquellos que estn unidos a un tomo que participa en un enlace
rico enelectrones, p. ej.
*
Retiro de electrones (desactivadores, orientadores
m
):El tomo unido no tiene un par de
e
-
sin compartir y s tiene alguna carga positiva:
Reglas para predecir la orientacin de los bencenos sustituidos
1.
Si todos los grupos se
refuerzan
entre s, no hay problema.
2.
Si un orientador
op
y uno
m no se estn reforzando,
el orientador
op
controlal a ori entaci n. ( El grupo entrante se di ri ge pri nci pal mente
orto
haci a el orientador
m.)
3.
Un
grupo fuertemente activador,
que compi t e con un gr upo
dbilmenteactivador,
controla la orientacin.
4.
Cuando compiten dos grupos
dbilmente activadores o desactivadores
o dosgrupos
fuertemente activadores o desactivadores,
se obti enen canti dadesconsiderables de ambos ismeros; hay muy
poca preferencia.
5.
En la posicin de
impedimento estrico
entre los sustituyentes
meta
hay muy poca sustitucin.
Ejemplos:
Sustituciones nucleoflicas y por radical libre
Las sustituciones aromticas nucleoflicas del H son raras. El bencenanin
intermediarioen las sustituciones aromticas nucleoflicas es anlogo al ion
intermediario bencenonio enla sustitucin aromtica electroflica; la carga negativa se
dispersa hacia las posiciones
op.
Los oxidantes como el O
2
y el K
3
Fe(CN)
6
facilitan el segundo paso, que puede permitir el control de la velocidad, mediante
la oxidacin del :H
-
lanzado, una base poderosa y ungrupo de salida muy pobre, a H
2
O.Las sustituciones por radical libre se efectan a travs de un intermediario
similar, elcual tiene carcter de radical libre distribuido hacia las posiciones
op.
Para las sustituciones aromticas radicales se resumen los efectos de los
sustituyentesas:
1.
Los sust i t uyent es t i enen un ef ect o mucho menor que en l as
sust i t uci oneselectroflicas o nucleoflicas.
2.
Los grupos que retiran y donan electrones aumentan la reactividad en las posiciones
orto
y
para.
Excepto cuando los grandes grupos producen impedimento estrico, la posicin
orto
es un poco ms reactiva que la posicin
para.
Arenos
Los derivados del benceno con carbonos saturados o no saturados que contienen
cadenaslaterales, se denominan arenos. Ejemplos de stos son el cumeno o
isopropilbenceno,C
6
H
5
CH(CH
3
)
2
, y el estireno,
BIBLIOGRAFA
*
Qumica Orgnica. Serie SchaumHerbert Meislich, Howard Nechamkin y Jacob
SharefkinEditorial Mc Graw HillPginas 161-167 y 174-184
*
Qumica Orgnica, 7 edicin.John Mc MurryCengage LearningPgina 561
Vous aimerez peut-être aussi
- Estructuras de LewisDocument8 pagesEstructuras de LewisKarouRb100% (1)
- Bonos EjerciciosDocument34 pagesBonos EjerciciosPaulo Cesar Huaman ApazaPas encore d'évaluation
- Reacciones de Halogenuros de AciloDocument6 pagesReacciones de Halogenuros de AciloNnaLupiz0% (1)
- Ejercicios Resueltos SERIE 2 Aula VirtualDocument9 pagesEjercicios Resueltos SERIE 2 Aula VirtualMilagros NatalePas encore d'évaluation
- Alcanos, Alquenos y AlquinosDocument13 pagesAlcanos, Alquenos y AlquinosNidiazamPas encore d'évaluation
- Hidrocarburos Alifaticos y Aromaticos Quimica 2Document16 pagesHidrocarburos Alifaticos y Aromaticos Quimica 2Rodrigo Loyola LunaPas encore d'évaluation
- Sustitución Electrofílica AromáticaDocument5 pagesSustitución Electrofílica AromáticaAngel AlcazarPas encore d'évaluation
- Hidrocarburos Reacciones de CaracterizaciónDocument12 pagesHidrocarburos Reacciones de CaracterizaciónRosario Huaman Mondragon0% (1)
- Sintesis de MetadinitrobencenoDocument16 pagesSintesis de Metadinitrobencenojeremias75% (4)
- Química OrgánicaDocument81 pagesQuímica OrgánicaLuis AndreaniPas encore d'évaluation
- Bolas Contra Las PolillasDocument7 pagesBolas Contra Las PolillasvictormmcPas encore d'évaluation
- Hidrocarburos AromáticosDocument7 pagesHidrocarburos AromáticosAna Paola Q VPas encore d'évaluation
- Marco Teorico Laboratorio 8Document4 pagesMarco Teorico Laboratorio 8Luis Cossa100% (3)
- Hidrocarburos - Alcanos - Alquenos - AlquinosDocument28 pagesHidrocarburos - Alcanos - Alquenos - AlquinosDORITA FELY CHAVEZ LLANOS DE GUEREPas encore d'évaluation
- Presentación Trabajo de Química y Ciencia Ilustraciones Moléculas Verde TurquesaDocument47 pagesPresentación Trabajo de Química y Ciencia Ilustraciones Moléculas Verde TurquesaAna Belen ZuritaPas encore d'évaluation
- HIDROCARBURODocument14 pagesHIDROCARBUROmiguelPas encore d'évaluation
- Fichas BiocaDocument6 pagesFichas BiocaAllen zenerePas encore d'évaluation
- Hidrocarburos Alifáticos y Aromáticos TrabajoDocument6 pagesHidrocarburos Alifáticos y Aromáticos TrabajoRossanaMarquezDiazPas encore d'évaluation
- Previo Acido PicricoDocument7 pagesPrevio Acido PicricoJesús LozanoPas encore d'évaluation
- TP 2 HidrocarburosDocument6 pagesTP 2 HidrocarburosLeonardo AredresPas encore d'évaluation
- Compuestos AromaticosDocument28 pagesCompuestos AromaticosvictoriaPas encore d'évaluation
- Generalidades de Los HidrocarburosDocument10 pagesGeneralidades de Los Hidrocarburoselkin vargas martinezPas encore d'évaluation
- Tema No 7 Hidrocarburos Aromaticos GuiaDocument13 pagesTema No 7 Hidrocarburos Aromaticos GuiaLuis Daniel Barrios BarriosPas encore d'évaluation
- Halogenuros Ortega JesusDocument21 pagesHalogenuros Ortega JesusMastur 26Pas encore d'évaluation
- Practica Nº6 BenzofenonaDocument8 pagesPractica Nº6 BenzofenonaLucia Rafaela Paredes MamaniPas encore d'évaluation
- Guia 1 Aromaticos P3Document6 pagesGuia 1 Aromaticos P3Valery florezPas encore d'évaluation
- Unidad 2Document10 pagesUnidad 2Reynaldo SorucoPas encore d'évaluation
- Derivados Del BencenoDocument30 pagesDerivados Del BencenoAlan ContrerasPas encore d'évaluation
- Primero 2 Talleres de QuímimcaDocument24 pagesPrimero 2 Talleres de QuímimcaCliché90Pas encore d'évaluation
- Compuestos - Aromaticos 20-21Document42 pagesCompuestos - Aromaticos 20-21Manuel GordilloPas encore d'évaluation
- Hidrocarburos AromáticosDocument5 pagesHidrocarburos AromáticosDANIEL BRANDO OBESO HUAMANPas encore d'évaluation
- Hid Ro Carb UrosDocument16 pagesHid Ro Carb UrosManuel Alejandro RuízPas encore d'évaluation
- Acido PicricoDocument2 pagesAcido PicricoDaniiel VillegasPas encore d'évaluation
- FenolDocument27 pagesFenolDébora LazzeriPas encore d'évaluation
- Alquenos y AlquinosDocument7 pagesAlquenos y AlquinosJesúsHenriquezPas encore d'évaluation
- Hidrocarburos AROMÁTICOS 5Document44 pagesHidrocarburos AROMÁTICOS 5Frank WiderPas encore d'évaluation
- Hidrocarburos AromaticosDocument5 pagesHidrocarburos AromaticosLeidy Yuliana100% (1)
- Arom 5Document12 pagesArom 5O5mi AlvPas encore d'évaluation
- Trabajo de AromaticosDocument35 pagesTrabajo de Aromaticosdamelismolina100% (3)
- ExpoDocument12 pagesExpobahena aguilar marthaPas encore d'évaluation
- Reglas de Nomenclatura Iupac para Escribir Nombres y Formulas de Los Compuestos Orgánicos Oxigenados y Halogenuros de AlquiloDocument17 pagesReglas de Nomenclatura Iupac para Escribir Nombres y Formulas de Los Compuestos Orgánicos Oxigenados y Halogenuros de AlquiloHJMPPPas encore d'évaluation
- Sustitución Nucleofílica Aromática Halogenuros de AriloDocument12 pagesSustitución Nucleofílica Aromática Halogenuros de AriloWendy Olmos100% (2)
- Compuestos Aromaticos 2FDocument14 pagesCompuestos Aromaticos 2FValeria HaroPas encore d'évaluation
- RESUMENDocument7 pagesRESUMENSalma MedinaPas encore d'évaluation
- Reacciones de EliminacionDocument4 pagesReacciones de EliminacionRicardoPas encore d'évaluation
- Compuestos AromaticosDocument34 pagesCompuestos AromaticosHector Cabrera Madrid100% (1)
- Hidrocarburos AromaticosDocument37 pagesHidrocarburos AromaticosValentina OrtizPas encore d'évaluation
- Alcoholes y ÉteresDocument35 pagesAlcoholes y Éteresreyes.sammyPas encore d'évaluation
- t9 Compuestos HeterociclicosDocument13 pagest9 Compuestos HeterociclicosMacarena GuzmanPas encore d'évaluation
- Teoría Qo 05 Mat Abr.23 2023-IDocument24 pagesTeoría Qo 05 Mat Abr.23 2023-IAlvaro CotrinaPas encore d'évaluation
- Exposicion de Hidrocarburos Alifaticos ListaDocument55 pagesExposicion de Hidrocarburos Alifaticos ListaGibran SolisPas encore d'évaluation
- Proyecto 1Document8 pagesProyecto 1blanca daniela amador ramirezPas encore d'évaluation
- BecenosDocument6 pagesBecenosAlex Gutierrez MarquezPas encore d'évaluation
- Trabajo Escrito Aromaticos 2Document11 pagesTrabajo Escrito Aromaticos 2Jose AntonioPas encore d'évaluation
- Alquenos y Dienos 20-21Document47 pagesAlquenos y Dienos 20-21Manuel GordilloPas encore d'évaluation
- Trabajo Escrito Aromaticos 2Document11 pagesTrabajo Escrito Aromaticos 2Josepepe Bedolla BPas encore d'évaluation
- Aromáticos 5Document16 pagesAromáticos 5Has Perez OvandoPas encore d'évaluation
- Halogenuros de AlquiloDocument33 pagesHalogenuros de AlquiloOscar AriasPas encore d'évaluation
- Práctica 4Document6 pagesPráctica 4Fabiola DannaPas encore d'évaluation
- Resumen de La Unidad 2Document21 pagesResumen de La Unidad 2Daniela ArguetaPas encore d'évaluation
- Derivados HalógenadosDocument2 pagesDerivados HalógenadosPaoPas encore d'évaluation
- Quimica EnlacesDocument7 pagesQuimica EnlacesJulieth MartinezPas encore d'évaluation
- Alcoholes Sin ConclusionDocument16 pagesAlcoholes Sin ConclusionEna Vega VPas encore d'évaluation
- Capacidad de Enlace Del CarbonoDocument8 pagesCapacidad de Enlace Del CarbonoDavid Gonzalez SotoPas encore d'évaluation
- InformeDocument8 pagesInformePAULA DANIELA BOTIA ORJUELAPas encore d'évaluation
- Quimica 4°año IiDocument46 pagesQuimica 4°año IiOscar Manuel Rodríguez GómezPas encore d'évaluation
- Practica Dirigida Nro 4 - Costo de Capital - Solucion (1) (Version 1)Document6 pagesPractica Dirigida Nro 4 - Costo de Capital - Solucion (1) (Version 1)Omar Osorio MontoyaPas encore d'évaluation
- Taller 11 - HIDROCARBUROS INSATURADOSDocument5 pagesTaller 11 - HIDROCARBUROS INSATURADOSCarlos GonzalezPas encore d'évaluation
- Presentación PolimerosDocument112 pagesPresentación PolimerospaulaPas encore d'évaluation
- Hid Ro Carb UrosDocument17 pagesHid Ro Carb UrosYaar RdPas encore d'évaluation
- Quimica 11, Periodo 2Document9 pagesQuimica 11, Periodo 2Guillermo FanParPas encore d'évaluation
- Alcanos UtesaDocument39 pagesAlcanos UtesaNitram JonsPas encore d'évaluation
- Alcoholes y Grupos Funcionales AfinesDocument69 pagesAlcoholes y Grupos Funcionales AfinesLeonardo EpifanioPas encore d'évaluation
- Hidrocarburos Aromáticos: Colegio Ciudadela Educativa de BosaDocument7 pagesHidrocarburos Aromáticos: Colegio Ciudadela Educativa de BosaJuan JaramilloPas encore d'évaluation
- Reaccion de Negishi y SuzukiDocument4 pagesReaccion de Negishi y SuzukiKarol Ayala GuerreroPas encore d'évaluation
- Estructuras de LewisDocument4 pagesEstructuras de LewisUrdaneta Rogelio100% (1)
- Informe #2Document7 pagesInforme #2SInamiPas encore d'évaluation
- Resumen Química Básica AlejandrinaDocument3 pagesResumen Química Básica Alejandrinarocio.herreraPas encore d'évaluation
- Trabajo-Clase Solución Ejercicio La Nación-Fondos-CorrectoDocument12 pagesTrabajo-Clase Solución Ejercicio La Nación-Fondos-CorrectoDaniel SanchezPas encore d'évaluation
- Alcoholes, Fenoles y ÉteresDocument43 pagesAlcoholes, Fenoles y ÉteresLarissa AndradePas encore d'évaluation
- Éteres 6Document10 pagesÉteres 6carlosPas encore d'évaluation
- Tema 6.-Enlace QuímicoDocument219 pagesTema 6.-Enlace QuímicoCearney InstitutePas encore d'évaluation
- HIBRIDACIONESDocument3 pagesHIBRIDACIONESSaulDeJesusGonzzalezPas encore d'évaluation
- AlquinosDocument21 pagesAlquinosRubén León SuarezPas encore d'évaluation
- Practica 7 de OrganicaDocument8 pagesPractica 7 de OrganicaHéctor Velázquez CastroPas encore d'évaluation
- 1 Info de Bioquimica 1 1Document7 pages1 Info de Bioquimica 1 1Maria Fernanda Lopez OrtizPas encore d'évaluation
- Fuerzas DebilesDocument15 pagesFuerzas DebilesBrayan Stiven RestrepoPas encore d'évaluation