Académique Documents
Professionnel Documents
Culture Documents
Air Dan Larutan
Transféré par
anon_655112622100%(1)100% ont trouvé ce document utile (1 vote)
153 vues53 pagestingkatan2
Titre original
air dan larutan
Copyright
© © All Rights Reserved
Formats disponibles
PPTX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documenttingkatan2
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PPTX, PDF, TXT ou lisez en ligne sur Scribd
100%(1)100% ont trouvé ce document utile (1 vote)
153 vues53 pagesAir Dan Larutan
Transféré par
anon_655112622tingkatan2
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PPTX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 53
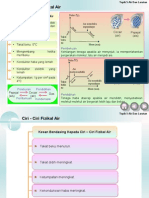
CIRI-CIRI FIZIKAL AIR
Tidak mempunyai warna, bau dan rasa
3 bentuk.. Gas, cecair dan pepejal
Peleburan
Pembekuan
Pendidihan
Kondensasi
Pemejalwapan
Pemejalwapan
Takat lebur
Takat beku
Takat didih
Takat lebur
ais= 0C
Takat beku
air= 0C
Takat didih
air = 100C
Suhu di mana
ais menjadi
cecair
Suhu di mana cecair
bertukar kepada ais
Suhu di mana cecair
menjadi wap/stim
Ciri-ciri Keterangan Catatan
Ketumpatan air adalah 1g per cm
3
. 1cm
3
air
mempunyai berat 1 gram.
Contoh :
50cm
3
air mempunyai berat 50g
Air merupakan konduktor haba yang lemah
KESAN BENDASING (cthnya garam)TERHADAP
CIRI FIZIKAL AIR TULEN
Meningkatkan takat didih air tulen
Mengurangkan takat beku air tulen
Meningkatkan ketumpatan air
RUJUK EKSPERIMEN:
Mengkaji takat beku dan takat didih air serta kesan
bendasing ke atas ciri fizikal air
Komposisi air
Air merupakan sebatian yang terdiri daripada
2 atom hidrogen dan 1 atom oksigen
Air boleh dileraikan kepada elemennya iaitu
hidrogen dan oksigen menerusi proses
elektrolisis
Elektrolisis merupakan proses pemisahan
(penguraian) air kepada hidrogen dan
oksigen
Elektrolit ditambah ke dalam air bagi
meningkatkan konduktiviti air dan
mempercepatkan proses elektrolisis asid
hidroklorik cair
Elektrod konduktor elektrik yang
berbentuk plat atau rod dan direndamkan
ke dalam elektrolit
H H
O
Elektrolisis
H
H
O
ELEKTROLISIS
Menentukan nisbah hidrogen dan oksigen dalam
molekul air
P Q
Bekas plastik
Air +
Asid hidroklorik cair
Elektrod karbon
(elektrod positif)
Elektrod
karbon
(elektrod
negatif)
anod
katod
Pemerhatian
Gas Kayu uji Inferens
Gas pada katod Kayu uji menyala -
Terbakar dengan
bunyi pop
Gas itu gas
hidgrogen
Gas pada anod Kayu uji berbara -
Membantu
pembakaran
Gas itu gas oksigen
Nisbah kedua-dua
gas
2 isipadu hidgrogen : 1 isipadu oksigen
Gelembung gas tidak bewarna dibebaskan di kedua-dua
elektrod karbon apabila suis dihidupkan
Jumlah gas yang terkumpul diakhir eksperimen pada
tabung uji Q adalah 2x berbanding gas yang terkumpul di
tabung uji P
Kesimpulan
Satu molekul air terdiri daripada 2 atom
hidrogen dan 1 atom oksigen
Proses cecair bertukar kepada gas yang
berlaku pada mana-mana suhu di bawah
takat didih cecair tersebut
Semasa proses penyejatan, air menerima
tenaga yang mencukupi bagi terbebas
daripada permukaan air
PENYEJATAN
FAKTOR-FAKTOR YANG MEMPENGARUHI KADAR
PENYEJATAN AIR
Kelembapan (jumlah air di udara)
Semakin tinggi kelembapan, semakin perlahan
proses penyejatan
Suhu sekeliling
Semakin tinggi suhu di sekeliling, semakin cepat
kadar penyejatan
Luas permukaan
Semakin besar luas permukaan, semakin cepat
proses penyejatan
Pergerakan udara
Kadar lebih cepat pada udara yang bergerak
berbanding yang statik
A B
Kertas turas
air
Kalsium klorida
kontang
Kalsium klorida kontang mengeringkan udara di B
Kadar penyejatan di B lebih cepat kerana udara yang kering
memudahkan molekul air terbebas ke udara lebih banyak ruang
kosong
kadar penyejatan di A lebih perlahan kerana udara tepu dengan
wap
air dan kurang ruang kosong
A
B
Dalam gelap
Air di A tersejat lebih cepat berbanding B
Apabila suhu di sekeliling meningkat, lebih banyak tenaga
haba dapat diserap lebih banyak tenaga kinetik
A
B
Kertas turas A tersejat lebih cepat daripada B
Apabila lebih besar luas permukaan, lebih banyak air
dapat bebas daripada permukaan lembap
A
B
Air pada B tersejat lebih cepat daripada A kerana terdapat
udara yang bergerak
udara yang berdekatan dengan air kurang tepu kerana
udara yang bergerak membawa molekul air ke tempat lain
Perbandingan antara pendidihan dan penyejatan
Penyejatan Pendidihan
Kadar Lambat Cepat
Suhu Berlaku pada mana-
mana suhu di bawah
takat didih air
Berlaku pada takat
didih air
Kawasan
proses
Hanya di permukaan
air
Berlaku di seluruh
bahagian air
Fakto-faktor - kelembapan
- suhu
- luas permukaan
- pergerakan udara
Bergantung kepada
tenaga yang
mencukupi
Mengeringkan rambut
Mengeringkan pakaian
Menyejukkan badan
Pengawetan hasil pertanian
Proses menghasilkan susu
tepung
Penghasilan garam makan
Aplikasi penyejatan dalam kehidupan seharian
Faktor manakah
yang memainkan
peranan????
LARUTAN DAN KETERLARUTAN SESUATU
ZAT TERLARUT
Pelarut cecair yang digunakan untuk melarutkan
sesuatu zat terlarutan (zat terlarut)
zat terlarut bahan yang larut di dalam pelarut
Larutan campuran yang terhasil daripada pelarut dan zat
terlarutan
Pelarut zat terlarut
Larutan
Adakah campuran
antara air dan pasir
membentuk larutan?
Terangkan kenapa
Larutan cair larutan yang mengandungi sedikit zat
terlarut
Larutan pekat larutan yang mengandungi banyak zat
terlarut
Larutan tepu Larutan yang mengandungi kuantiti zat
terlarut yang maksimum. Larutan tepu tidak dapat
melarutkan sebarang penambahan zat terlarut
Bagaimana mengasingkan pelarut dengan zat
terlarut??
Penyejatan dan pendidihan sehingga kering
Larutan cair Larutan pekat Larutan tepu
Bagaimana anda tahu larutan tersebut
telah tepu?
Kehadiran baki/sisa di bawah
bekas
Larutan cair
Mengandungi
sedikit zat terlarut
Boleh melarutkan lebih
banyak zat terlarut
Larutan pekat
Mengandungi banyak
zat terlarut
Boleh melarutkan
sedikit zat terlarut
Larutan tepu
Mengandungi zat
terlarut yang maksimum
Tidak dapat
melarutkan zat terlarut
Semua larutan merupakan larutan yang jernih,lutsinar
kepada cahaya dan tidak dapat diasingkan melalui penurasan
LARUTAN
KETERLARUTAN DAN FAKTOR YANG
MEMPENGARUHINYA
Keterlarutan zat terlarut kuantiti zat terlarut yang
maksimum (gram) yang boleh larut dalam 100cm
pelarut pada suatu suhu bagi membentuk larutan
tepu
Contohnya :
Keterlarutan kalsium klorida adalah 80g per
100 cm
3
pada 20 C
100 cm
3
air
80g of kalsium klorida
Larutan tepu
Ampaian cecair campuran yang mengandungi
zarah-zarah terapung/terampai yang tidak terlarut
dalam air
Larutan yang jernih, lut sinar kepada cahaya dan
tidak boleh diasingkan melalui proses penurasan.
Manakala ampaian pula kelihatan keruh, tidak larut
dalam air dan boleh diasingkan melalui
penurasan/pengemparan
Boleh terampai ataupun membentuk mendakan
Faktor yang mempengaruhi
keterlarutan:
Jenis zat terlarut
Lebih kecil partikel zat terlarut, lebih cepat ia
larut
Jenis pelarut
contohnya alkohol atau air
Suhu pelarut
Keterlarutan meningkat apabila pelarut
dipanaskan
Kadar kacauan
zat terlarut mudah larut apabila kadar kacauan
lebih cepat
Saiz zat terlarut
zat terlarut berbentuk serbuk lebih cepat larut
berbanding barbentuk ketulan (luas permukaan)
Saiz zarah pelarut
Semakin kecil saiz pelarut, semakin cepat kadar
keterlarutan
KADAR KETERLARUTAN DIPENGARUHI OLEH:
Dikenali sebagai pelarut universal kerana dapat
melarutkan kebanyakkan bahan
Kegunaan air
Melarutkan oksigen dan karbon dioksida bagi
organisma akuatik
Kebanyakkan tindakbalas kimia dalam badan
memerlukan air sebagai pelarut
Melarutkan kebanyakkan garam mineral bagi
membolehkan akar pokok menyerap mineral tersebut
Melarutkan oksigen dan makanan bagi
membolehkannya diangkut ke sel-sel badan
Kegunaan pelarut organik
Alkohol Iodin, dakwat, klorofil
Turpentin Cat, tar, gris
Kerosin Cat, gris
Petrol Tar, lilin, cat, gris
Benzena Getah, gris
Aseton Dakwat, varnis kuku, gincu, lilin
Kloroform Plastik
Eter Lemak, minyak
Amil asetat Gincu, varnis kuku, lilin
Ciri-ciri asid
Berasa masam
Bersifat menghakis
Nilai pH < 7
Menukarkan kertas litmus daripada biru kepada merah
Bertindakbalas dengan logam bagi menghasilkan gas hidrogen
Bertindakbalas dengan karbonat menghasilkan gas karbon
dioksida dan garam
ASID & ALKALI
Asid + Logam Garam + gas hidrogen
Asid + Karbonat Garam + Air + Gas Karbon dioksida
Ciri-ciri alkali
Berasa pahit
Bersifat menghakis
Nilai pH > 7
Menukarkan kertas litmus daripada merah kepada biru
Licin seperti sabun
Bertindakbalas dengan ammonium bagi membebaskan gas
ammonia dan garam lain
Alkali + Ammonium Gas ammonia + air + garam
Perbezaan antara asid dan alkali
Asid Alkali
Kedua-duanya menghakis
Menunjukkan sifat dengan kehadiran air
Rasa Masam Pahit
Keadaan Rasa seperti air Rasa seperti sabun
Kesan terhadap kertas
litmus
Biru kepada merah Merah kepada biru
Nilai pH < 7 > 7
Tindak
balas
terhadap
Logam Asid + logam =
garam + hidrogen
Tiada tindak balas
Karbonat Asid + karbonat =
garam + air + CO2
Tiada tindak balas
Ammonium Tiada tindak balas Asid + garam
ammonium = garam
+ air + garam
ammonium
KEGUNAAN ASID DAN ALKALI
ASID
KEGUNAAN
Asid asetik(cuka) Pengawet dan perisa makanan (jeruk, sos cili dan sos
tomato)
Asid askorbik
(vitamin C)
Kesihatan badan
Asid benzoik Pengawet makanan dan minuman
Asid borik Pengawet makanan
Asid sitrik Perasa makanan dan minuman
Asid formik Penggumpalan getah
Asid hidroklorik -Menanggalkan karat daripada besi
-Menghasilkan pewarna dna cecair pencuci
Asid nitrik Membuat baja, bahan letupan dan pewarna
Asid sufurik -Bateri kereta
-membuat cecair pencuci, baja dam polimer
Asid tartarik -Membuat kek dan biskut
-membuat minuman bergas
ALKALI
KEGUNAAN
Aluminium
hidroksida
Membuat antasid (ubat untuk gaster dan ubat gigi)
Ammonium
hidroksida
-Membuat baja
-Membuat cecair pencuci kaca
-Agen pencuci dan peluntur
-Penggumpalan getah
Kalsium
hidroksida(kapur
mati/air kapur)
-Menuetralkan tanah berasid
-Membuat simen
Megnesium
hidroksida
Membuat susus magnesia
Kalium hidroksida Membuat sabun, cecair pencuci dan penangggal cat
Natrium hidroksida Membuat sabun dan pencuci
Penunjuk pH
Penunjuk bagi menguji perubahan warna mengikut jenis
Penunjuk Asid Neutral Alkali
Kertas litmus merah Tiada
perubahan
warna
biru
Penunjuk Semesta Jingga/ku
ning
hijau biru
violet
Metil jingga merah jingga kuning
Fenolftalein Tiada
warna
Tiada
warna
Merah
jambu
Larutan Litmus merah ungu biru
PENEUTRALAN
Proses tindak balas antara asid dengan alkali
untuk menghasilkan garam dan air
Apabila asid ditambah ke larutan alkali, pH
larutan tersebut berkurangan
Nama kaedah yang digunakan semasa
peneutralan - Pentitratan
Takat akhir bagi peneutralan adalah apabila
semua alkali dalam kelalang kon dineutralkan
oleh asid
Asid + alkali garam dan air
Aplikasi peneutralan
1. Ubat gigi yang mengandungi magnesium hidroksida meneutralkan
asid yang dihasilkan oleh bakteria dalam gigi.
2. Antasid seperti susu magnesia diambil untuk melegakan sakit
gastrik yang disebabkan oleh asid hidroklorik berlebihan yang
dihasilkan dalam perut.
3. Sengatan lebah adalah berasid yang mengakibatkan bengkak,
boleh dirawat dengan alkali lemah seperti losen kalamin atau
serbuk bikarbonat.
4. Mencampurkan kalsium hidroksida (kapur mati)kepada tanah
akan mengurangkan keasidan tanah itu.
5. Syampu rambut biasanya sedikit beralkali. Penggunaan perapi
rambut yang berasid membuatkan rambut bersih dan lembut.
ASID ALKALI
PERSAMAAN DAN PERSAMAAN ASID DAN ALKALI
Sifat bahan
1. Kelaskan bahan-bahan dalam pilihan jawapan
kepada berasid, neutral dan beralkali
Berasid Neutral Beralkali
Vitamin C Air tulen Ubat gigi Cuka
Serbuk
penaik Syampu Jus limau
Amira menggunakan cara yang betul. Jika air dicampurkan
kepada asid pekat, haba yang terhasil mungkin akan
menyebabkan campuran terpercik keluar dan mengakibatkan
melecur. Radas juga mungkin akan pecah
2.Amira dan Syafiq mahu menyediakan larutan asid sulfurik cair.
Amira mencampurkan asid sulfurik pekat kepada air secara
perlahan-lahan sambil mengacaunya. Syafiq pula
mencampurkan air kepada asid sulfurik pekat secara perlahan-
lahan sambil mengacaunya.
Siapakah yang menggunakan cara dengan betul?beri alasan
anda.
3.Sebuah lori yang membawa asid terlibat dalam kemalangan.
Asid tertumpah ke atas jalan raya. Penutup yang diperbuat
daripada besi di tepi jalan itu mulai terhakis dan mengeluarkan
bunyi. Seorang pakar telah dipanggil untuk melihat sama ada
asid tersebut mencemari sungai yang berhampiran.
a. Jika anda ialah salah seorang daripada pasukan keselamatan
yang tiba di tempat kejadian, apakah yang akan anda lakukan
untuk meneutralkan asid yang tumpah di atas jalan raya?
b. Terangkan sebab kenapa penutup longkang mengeluarkan
bunyi apabila terkena asid.
c. Bagaimanakah pakar dapat menjalankan ujian untuk melihat
sama ada asid telah mencemari sungai yang berhampiran atau
tidak
Menabur serbuk penaik di atas jalan raya
Bunyi terhasil daripada gas hidrogen yang terbebas apabila asid
bertindakbalas dengan logam
Menguji sampel air sungai dengan menggunakan kertas litmus
biru. Jika ia bertukar kepada warna merah, maka air sungai
telah dicemari asid
Kaedah Pembersihan Air
Sumber air semulajadi
Sumber Kandungan dalam air
Air hujan I. Air yang paling bersih jika dibandingkan
dengan yang lain
II. Mengandungi gas terlarut dan habuk
Air bawah tanah I. Berasal dari air hujan yang meresap ke dalam
tanah
II. Mengandungi bahan terlarut, mineral dan
organisma
Air sungai I. Mengandungi bahan terlarut, bahan reput,
lumpur dan organisma
Air kolam I. Mengandungi bahan terlarut, bahan reput,
lumpur dan mikroorganisma
II. Air bertakung, lebih kotor daripada air sungai
Air laut I. Paling kotor
II. Mengandungi bahan terlarut seperti garam
terlarut
III. Terlalu masin untuk kegunaan manusia
Sebab-sebab penulenan air
Menghilangkan benda-benda terapung seperti
daun, ranting dan rumpai
Menghilangkan zarah-zarah habuk dan tanah
Menyingkirkan bahan-bahan terlarut
Menyingkirkan rasa, bau dan warna yang tidak
menyenangkan
Membunuh mikroorganisma dalam air
Kaedah pembersihan air
Kaedah Kebaikan Keburukan
Penurasan
mengunakan lapisan
yang terdiri daripada
pasir halus, pasir kasar,
batuan kecil dan batu
kerikil
air jernih dan bebas
daripada bahan
terampai
masih mengandungi
mikroorganisma dan
bahan terlarut(seperti
garam terlarut)
Penyulingan
menghasilkan air tulen
dihasilkan di makmal
bebas daripada
semua bahan terampai,
mikroorganisma dan
bahan terlarut
tidak bagus untuk
diminum kerana tiada
garam mineral untuk
kegunaan badan
Pendidihan dan
pengklorinan
digunakan bagi merawat
kuantiti air yang banyak
seperti dalam sistem
kumbahan
bebas daripada
mikroorganisma yang
berbahaya
masih mengandungi
bahan terlarut dan
bahan terampai
Penurasan
Penyulingan
PENAPISAN PENGGUMPALAN
PENGENAPAN
PENURASAN
PENGKLORINAN
DAN
PEMFLOURIDAAN
SIMPANAN
Distribution
SISTEM
BEKALAN AIR
FAKTOR PENCEMARAN AIR
LUMPUR
SISA
DOMESTIK
SISA
AGRIKULTUL
TUMPAHAN
MINYAK
SISA
INDUSTRI
Vous aimerez peut-être aussi
- 5 F2 Air Dan LarutanDocument32 pages5 F2 Air Dan LarutanarizasPas encore d'évaluation
- 5.1 Ciri Fizikal AirDocument51 pages5.1 Ciri Fizikal AirAzmi Yusof80% (5)
- 5 F2 Air Dan LarutanDocument29 pages5 F2 Air Dan LarutanRoslina AbdullahPas encore d'évaluation
- Air Dan Larutan Sains Tingkatan 2Document39 pagesAir Dan Larutan Sains Tingkatan 2Anonymous 8NvdEpfWUwPas encore d'évaluation
- Air Dan LarutanDocument20 pagesAir Dan LarutanWan RoziahPas encore d'évaluation
- Bab 5Document22 pagesBab 5syastiPas encore d'évaluation
- 5 F2 Air Dan Larutan Form 2 SainsDocument29 pages5 F2 Air Dan Larutan Form 2 SainsAnonymous tvI6PDN9Pas encore d'évaluation
- BT F2 Bab 5Document55 pagesBT F2 Bab 5NORAZIAN BINTI ITHNIN ABDUL MoePas encore d'évaluation
- BAB 5 Sains Form 2Document49 pagesBAB 5 Sains Form 2henryjamespasanPas encore d'évaluation
- Bab 5 Air Dan LarutanDocument40 pagesBab 5 Air Dan LarutanlapokPas encore d'évaluation
- Quiz Sains Tingkatan 2 Bab 5 Air Dan LarutanDocument79 pagesQuiz Sains Tingkatan 2 Bab 5 Air Dan LarutanMinh HayatPas encore d'évaluation
- Air Dan NewDocument11 pagesAir Dan Neworkid_ijaPas encore d'évaluation
- Bab 7 - Asid Dan BesDocument36 pagesBab 7 - Asid Dan BesThanabalan MunuswamyPas encore d'évaluation
- Sains Tingkatan 2/form 2 Bab 5Document15 pagesSains Tingkatan 2/form 2 Bab 5Farah Hidayah100% (1)
- Bab 5 - AIR DAN LARUTAN (NOTA)Document23 pagesBab 5 - AIR DAN LARUTAN (NOTA)Herbert Daryl M LaungPas encore d'évaluation
- Bab 5 Air & Larutan (Nota)Document17 pagesBab 5 Air & Larutan (Nota)Madyha Azmi100% (2)
- Asid Vs AlkaliDocument25 pagesAsid Vs AlkaliYusra AbllahPas encore d'évaluation
- Acid and AlkaliDocument31 pagesAcid and AlkaliShah Fiza0% (2)
- Asid & AlkaliDocument12 pagesAsid & AlkaliSipiahPas encore d'évaluation
- Asid Dan AlkaliDocument1 pageAsid Dan AlkaligidangPas encore d'évaluation
- Sebatian KarbonDocument14 pagesSebatian KarbonYasmeen Hussin100% (1)
- Sifat GasDocument20 pagesSifat GasRoslanRubiyah MingasTaerPas encore d'évaluation
- Bahan Kimia Untuk PenggunaDocument8 pagesBahan Kimia Untuk Penggunajohar7766Pas encore d'évaluation
- Sabun & DetergenDocument69 pagesSabun & DetergenPatrick TewPas encore d'évaluation
- Bahan Ujikaji Dan KesannyaDocument4 pagesBahan Ujikaji Dan KesannyaJennifer BakerPas encore d'évaluation
- Sains Tingkatan 1 Bab 5Document8 pagesSains Tingkatan 1 Bab 5Cikgu SitiPas encore d'évaluation
- Asid Dan AlkaliDocument24 pagesAsid Dan AlkaliFidree AzizPas encore d'évaluation
- Penulenan Bahan - THMX 1Document8 pagesPenulenan Bahan - THMX 1Ismaliza IshakPas encore d'évaluation
- Air Dan LarutanDocument17 pagesAir Dan LarutanmiszjanePas encore d'évaluation
- Asid Dan Alkali Sains Tingkatan 2Document12 pagesAsid Dan Alkali Sains Tingkatan 2Illiyas Aziz88% (8)
- Nota Sains f2 Asid Dan BesDocument2 pagesNota Sains f2 Asid Dan BesJuni FarhanaPas encore d'évaluation
- Bab 1 Pengenalan Kepada Sains MakananDocument29 pagesBab 1 Pengenalan Kepada Sains MakananShikinPas encore d'évaluation
- BAB 5 Air Dan LarutanDocument17 pagesBAB 5 Air Dan LarutanRahman Shui100% (3)
- Amali SainsDocument8 pagesAmali SainsFaizah Bt Musa FaizahPas encore d'évaluation
- Bab 4 SainsDocument12 pagesBab 4 SainsAnonymous LeXkWdfPas encore d'évaluation
- Bab 7 Asid Dan Bes 7.1 Asid Dan Bes (A) Asid: Asid Kuat: Asid LemahDocument8 pagesBab 7 Asid Dan Bes 7.1 Asid Dan Bes (A) Asid: Asid Kuat: Asid LemahMervixShasiPas encore d'évaluation
- Sifat Sifat Oksida Unsur Kala 3Document3 pagesSifat Sifat Oksida Unsur Kala 3Shaf Famei100% (2)
- Carta Aliran ProsesanDocument7 pagesCarta Aliran ProsesanPUTERA IDAMANPas encore d'évaluation
- Udara Sekeliling Kita (Autosaved) (Autosaved)Document20 pagesUdara Sekeliling Kita (Autosaved) (Autosaved)Muhammad Asri Jurubekam KlinikalPas encore d'évaluation
- Penyediaan LarutanDocument10 pagesPenyediaan LarutanLiany FirdayuPas encore d'évaluation
- Rawatan AirDocument29 pagesRawatan Airfarahazura100% (1)
- Asid Dan AlkaliDocument4 pagesAsid Dan AlkaliAziya YaacobPas encore d'évaluation
- Asid Dan Bes PrintDocument16 pagesAsid Dan Bes PrintRohayati Abdul WahabPas encore d'évaluation
- Laporan Tetap FFEDocument10 pagesLaporan Tetap FFEahmad abu bakarPas encore d'évaluation
- Eksperimen 3Document16 pagesEksperimen 3Nur Atikah Nasrudin100% (1)
- MsdsDocument5 pagesMsdsLynnPas encore d'évaluation
- Bahan UjiDocument2 pagesBahan UjiJesseca Siew Wey ChanPas encore d'évaluation
- Praktikal 6 Sabun FinalDocument11 pagesPraktikal 6 Sabun FinalSal RahmanPas encore d'évaluation
- KIMIA T4 KSSM BAB 6 Asid, Bes Dan Garam Zila Khalid )Document133 pagesKIMIA T4 KSSM BAB 6 Asid, Bes Dan Garam Zila Khalid )Shin ObiPas encore d'évaluation
- Sains Tingkatan 2Document20 pagesSains Tingkatan 2SITI FATIMAH BINTI MOHD ZAHID MoePas encore d'évaluation
- F1 Bab 5Document6 pagesF1 Bab 5Khairul Fahmi Ab WahabPas encore d'évaluation
- Pe Neutral AnDocument11 pagesPe Neutral AnKarmila Binti AbuPas encore d'évaluation