Académique Documents
Professionnel Documents
Culture Documents
Ejercicio Espectrofotometria PDF
Transféré par
ntvg_3Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ejercicio Espectrofotometria PDF
Transféré par
ntvg_3Droits d'auteur :
Formats disponibles
Ejercicio
Para realizar el anlisis de fsforo por espectrofotometra el Tcnico prepara una solucin madre de
fsforo donde se pesa al dcimo de mg, 0.1402 g de fosfato dicido de potasio y lleva a volumen con
agua de alta pureza en matraz aforado de 100 ml. Posteriormente se hace una dilucin de 10 ml en 100
ml de la solucin madre llamada solucin de trabajo.
Para realizar la curva de calibracin se pasa la masa del fosfato dicido de potasio a fsforo inorgnico.
Curva de calibracin: Colocar en cinco matraces aforados de 10 ml, alcuotas de 0.25, 0.50, 0.75, 1.0
y 1.5 ml de la solucin de trabajo de fsforo y realizar la reaccin colorimtrica.
Llevar a volumen con agua de alta pureza.
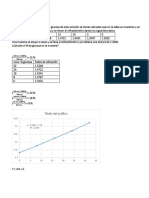
Standard
Absorbancia
Blanco
0,0498
0,1501
0,2533
0,342
0,4241
A partir de la curva se obtuvo Y = 0.0911 X
Las muestras analizadas son Leche en polvo, Aditivo para jamones, Jamn.
Cada muestra se mineraliza y posteriormente se lleva a 100 ml en matraz.
Luego se para la leche en polvo y el aditivo se realiza una dilucin de 10 ml de la solucin obtenida en
un matraz de 100 ml.
io
n
Para el jamn se toman 10 ml del matraz y se lleva a 200 ml
Del segundo matraz se toman 0.750 ml para realizar la reaccin colorimtrica y tambin llevar a 10 ml
ve
Leche en polvo descremada
12.3 g / 100g de muestra
65.6g / 100 g de muestra
Masa de muestra
Absorbancia
0.1253 g
0.2155
3.2712 g
6.1746 g
0.1953
0.2033
hi
Jamn crudo
2.8 g / 100 g de muestra
ne
Aditivo para jamones
Humedad
al
Muestra
tri
DATOS:
rs
en matraz.
fM
ac
1. Calcular la concentracin de los puntos de la curva expresado como Pi.
2. Calcular el porcentaje de fsforo para cada una de las muestras expresados en base seca.
1.
pd
RESULTADOS:
Sc Madre: 0.1402 g de KH2PO4
Desde la regla de tres:
PM (KH2PO4): 136.1
136.1g KH2PO4-------- 31g P
0.1402g KH2PO4 ---------- = (0.1402*31)/136.1= 0.03193 g Pi = 31.93 mg Pi / 100 ml
Sc. Trabajo:
10 ml Sc Madre tenemos 3.193 mg P
Entonces Ahora se lleva a 100 ml por lo que nos da una concentracin final de:
3.193mg de Pi/100ml = 0.03193 mg/ml = 31.93 g/ml
St1:
1 ml Sc trabajo ---------- 31.93 g P
0.25 ml Sc trabajo ------- = (31.93 * 0.25) /1 = 7.9825 g P
10 ml St 1 ---------- 7.9825 g P
St2:
1 ml St 1 ---------- 0.7983 g P
1 ml Sc trabajo ---------- 31.93 g P
0.50 ml Sc trabajo ------- = (31.93 * 0.50) /1 = 15.965 g P
10 ml St 2 ---------- 15.965 g P
1 ml St 2 ---------- 1.597 g P
2. Muestra Leche en polvo
3.2712g /100 ml
10 ml/100ml
0.750 ml/10ml
Absorbancia
La sntesis anterior es el esquema de las distintas diluciones que se hicieron para medir.
Los 0.750 ml es el volumen de muestra que se toman para realizar la reaccin y llevar finalmente a 10 ml
como se hace en la curva.
Desde la curva se obtiene que Y = 0.0911 X
Entonce con la absorbancia como dato despejamos X. X=Y/0.0911
gPi/ml en 10 ml = 21.437 g Pi
X=0.1953/0.0911 = 2.1438 g Pi
Eso 21.437 g de fsforo provenan originalmente de los 0.75 ml de solucin. Es decir que los
21.437 g estan en los 0.750 ml ahora calculamos en 100 ml por regla de tres.
io
n
0.750 ml ---------- 21.438 g P
Ahora una dilucin mas
al
10 ml ---------- 2858.27 g P
ve
rs
100 ml ------------ = X = 2858.27 g P
hi
fM
ac
Paso los g a gramos
ne
tri
100 ml ------------ = X = 28582.7 g P
1 g = 106 g
28582.7 g = 0.0285827 g
pd
0.02858 g de Pi estan en 3.2712 g de leche en polvo.
Por regla de tres
3.2712 g de muestra ---------- 0.02858 g P
100 g de muestra -------------- = X = 0.874 g de P / 100 g de muestra
Para expresar en base seca:
Masa hmeda = masa seca + humedad
100 = x + 2.8
X = 100 2.8 = 97.2 g de masa seca
Ahora para pasar a base seca:
97.2 g de muestra seca---------- 0.874 g P
100 g de muestra seca -------------- = X = 0.874 g * 100 / 97.2 = 0.899 g de Pi
pd
fM
ac
hi
ne
tri
al
ve
rs
io
n
Resultado: 0.90 g/100g de muestra seca.
Vous aimerez peut-être aussi
- Compuestos CuaternariosDocument6 pagesCompuestos CuaternariosFaby Cunalata56% (16)
- Agosto MoranDocument17 pagesAgosto MoranJulieth Castro Atencia100% (1)
- OsmolaridadDocument7 pagesOsmolaridadValeria Huapaya100% (2)
- Aspectos MayoresDocument188 pagesAspectos MayoresAstral Eleusino100% (1)
- Determinación de Azucares Reductores Por Método LaneDocument8 pagesDeterminación de Azucares Reductores Por Método LaneAngel MartinezPas encore d'évaluation
- PolimerosDocument32 pagesPolimerosCristina GonzálezPas encore d'évaluation
- La Conferencia Perdida de Feynman - David L GoodsteinDocument156 pagesLa Conferencia Perdida de Feynman - David L GoodsteinWilliam David Becerra ChaconPas encore d'évaluation
- Informe de Lab 1Document4 pagesInforme de Lab 1Alejandro Preciado60% (5)
- Informe #1 Metrologia y CalculosDocument9 pagesInforme #1 Metrologia y CalculosMaria Elena Mita CallahuancaPas encore d'évaluation
- Ejercicios Tarea de Curva de Calibracion Qui 144, 2022-2Document12 pagesEjercicios Tarea de Curva de Calibracion Qui 144, 2022-2Karolay De Los SantosPas encore d'évaluation
- Ejercicios ResueltosDocument4 pagesEjercicios ResueltosSebastian Roldan Zavaleta100% (1)
- Determinación de HumedadDocument7 pagesDeterminación de HumedadJandy MalagónPas encore d'évaluation
- 5546iuxDocument7 pages5546iuxKaylam Salazar LópezPas encore d'évaluation
- T-046 Prolina MielDocument3 pagesT-046 Prolina MielD'Aguiar SantamaríaPas encore d'évaluation
- Ejercicios de RevisionDocument5 pagesEjercicios de RevisionMiguel Augusto Solorzano Duran50% (2)
- Práctica #6Document5 pagesPráctica #6Mario ramirez del toroPas encore d'évaluation
- Taller 10 Ejercicios-SolucionesDocument7 pagesTaller 10 Ejercicios-SolucionesKris ArizaPas encore d'évaluation
- U4 - Resolución de Ejercicios de Aplicación - Bases Fisicoquímicas de La Vida - Física e Introducción de La BiofísicaDocument19 pagesU4 - Resolución de Ejercicios de Aplicación - Bases Fisicoquímicas de La Vida - Física e Introducción de La BiofísicaGuilherme S. Tenório FmaPas encore d'évaluation
- Analisis Intrumental BasicoDocument21 pagesAnalisis Intrumental BasicoRicardo Solis RomanPas encore d'évaluation
- Curva de Calibración de Proteínas TotalesDocument4 pagesCurva de Calibración de Proteínas TotalesEdwin ForeroPas encore d'évaluation
- Semana 08 2016Document28 pagesSemana 08 2016Juan De leonPas encore d'évaluation
- Bioquimica Informe 9Document5 pagesBioquimica Informe 9Jesus Miguel Velarde ValquiPas encore d'évaluation
- Parcial Rassoul Bustamante PDFDocument8 pagesParcial Rassoul Bustamante PDFYasmin RassoulPas encore d'évaluation
- Matematicas Basica en La Farmacia 21Document27 pagesMatematicas Basica en La Farmacia 21Maye JaimesPas encore d'évaluation
- InformeeeeeeeeeDocument14 pagesInformeeeeeeeeemari aisabelPas encore d'évaluation
- EJERCICIOS GalloDocument4 pagesEJERCICIOS GalloFranco LemosPas encore d'évaluation
- Informe 7 - Tabletas de RanitidinaDocument8 pagesInforme 7 - Tabletas de RanitidinaAlejandra Patiño100% (1)
- Lab - PHDocument15 pagesLab - PHbetincarlos3010Pas encore d'évaluation
- Cuestionario 6Document5 pagesCuestionario 6luuPas encore d'évaluation
- Calculos Farmaceuticos Conversion Gate01Document27 pagesCalculos Farmaceuticos Conversion Gate01Orangel Niño50% (2)
- Practica de Boro EaaDocument10 pagesPractica de Boro EaaSofía BenitezPas encore d'évaluation
- Examen Marta Cecilia AcostaDocument4 pagesExamen Marta Cecilia AcostaMarta Cecilia Acosta CallePas encore d'évaluation
- Curva de Calibración de Proteínas TotalesDocument5 pagesCurva de Calibración de Proteínas TotalesCarlos VillarrealPas encore d'évaluation
- Taller Química e Industria de AlimentosDocument8 pagesTaller Química e Industria de AlimentosCristian RiveraPas encore d'évaluation
- QuimicaDocument6 pagesQuimicaluis eduardoPas encore d'évaluation
- Cañuelo Noci AlfonsoJosé CapacidadantioxidanteDocument6 pagesCañuelo Noci AlfonsoJosé Capacidadantioxidantealfonsojocano15Pas encore d'évaluation
- Mescco Sacsahuillca Actividad - 20 - Mme - Recuperacion - Preparacion - de - Soluciones - NormalidadDocument10 pagesMescco Sacsahuillca Actividad - 20 - Mme - Recuperacion - Preparacion - de - Soluciones - NormalidadMariela MaldonadoPas encore d'évaluation
- Ejercicios de QuimicaDocument16 pagesEjercicios de QuimicaAndres Camilo Velez Herrera100% (1)
- TallDocument2 pagesTallShirley Maguiña anduhaga100% (1)
- Ejercicios Problemas I.Q.A.1Document4 pagesEjercicios Problemas I.Q.A.1DAVID ISRAEL MARTINEZ HERNANDEZPas encore d'évaluation
- TP 1Document8 pagesTP 1Facundo Santillan SuarezPas encore d'évaluation
- Taller QuimicaDocument3 pagesTaller QuimicaJuan Pablo Mugno VargasPas encore d'évaluation
- Taller QuimicaDocument3 pagesTaller QuimicaJuan Pablo Mugno VargasPas encore d'évaluation
- Informe - PermanganimetríaDocument5 pagesInforme - PermanganimetríaJime Flores ErquiciaPas encore d'évaluation
- A.alimentos ConservadoresDocument21 pagesA.alimentos Conservadoresscarlett_gallardo_1Pas encore d'évaluation
- TurbidimetríaDocument4 pagesTurbidimetríaFlorencia QuintanaPas encore d'évaluation
- Analisis N 10Document7 pagesAnalisis N 10Keyla AtencioPas encore d'évaluation
- Caraballo - Pamela - Guia #5 - SolucionesDocument4 pagesCaraballo - Pamela - Guia #5 - SolucionesPamela Maria Caraballo RoaPas encore d'évaluation
- Trabajo Quimica FinalDocument19 pagesTrabajo Quimica FinalKevin MolinaPas encore d'évaluation
- Informe 9 Bioquimica UnalmDocument5 pagesInforme 9 Bioquimica UnalmJesus Miguel Velarde Valqui0% (1)
- Método de BradfordDocument12 pagesMétodo de BradfordNayeli HernándezPas encore d'évaluation
- Quimica 2 Sistemas DispersosDocument10 pagesQuimica 2 Sistemas DispersosJu PePas encore d'évaluation
- Problemas Tipo de Cálculo de Actividad EnzimáticaDocument3 pagesProblemas Tipo de Cálculo de Actividad EnzimáticaRicardo David Cohen CarmonaPas encore d'évaluation
- ProblemasDocument20 pagesProblemasJimenaSanchezPas encore d'évaluation
- Examen Iv Modulo Quimica AnaliticaDocument5 pagesExamen Iv Modulo Quimica AnaliticaOrihuela Iparraguirre JuanaPas encore d'évaluation
- Practica LorwyDocument7 pagesPractica LorwyJose Cesar MamaniPas encore d'évaluation
- Volumetrías ÁcidoDocument91 pagesVolumetrías ÁcidoToru Lucis CaelumPas encore d'évaluation
- Taller PráDocument3 pagesTaller PráShirley Maguiña anduhagaPas encore d'évaluation
- Soluciones Dino CayraDocument29 pagesSoluciones Dino CayraDino CayraPas encore d'évaluation
- Tabla N°1 de Cálculos Por Fracción: 10 MG - 1ml X MG - 1200ml XDocument7 pagesTabla N°1 de Cálculos Por Fracción: 10 MG - 1ml X MG - 1200ml XMilagros Huaytalla RamirezPas encore d'évaluation
- Expresiones de ConcentraciónDocument14 pagesExpresiones de ConcentraciónarturoPas encore d'évaluation
- Cuestionario de Quimica 12Document5 pagesCuestionario de Quimica 12Evelyn Requena AstoPas encore d'évaluation
- CAHUANA LOPEZ ACTIVIDAD - 20 - MME - RECUPERACION - PREPARACION - DE - SOLUCIONES - NORMALIDAD - AutoguardadoDocument14 pagesCAHUANA LOPEZ ACTIVIDAD - 20 - MME - RECUPERACION - PREPARACION - DE - SOLUCIONES - NORMALIDAD - AutoguardadoMariela MaldonadoPas encore d'évaluation
- RamificaciónDocument1 pageRamificaciónntvg_3Pas encore d'évaluation
- Adaptaciones Del CormoDocument2 pagesAdaptaciones Del Cormontvg_3Pas encore d'évaluation
- Estructura de La FlorDocument4 pagesEstructura de La Florntvg_3Pas encore d'évaluation
- Introductorio MatematicaDocument44 pagesIntroductorio Matematicantvg_3100% (1)
- Aula Virtual Introd T Unid 5Document16 pagesAula Virtual Introd T Unid 5ntvg_3Pas encore d'évaluation
- Organizacion GeneticaDocument40 pagesOrganizacion Geneticantvg_3Pas encore d'évaluation
- Aula Virtual Introd T Unid 2Document31 pagesAula Virtual Introd T Unid 2ntvg_3Pas encore d'évaluation
- Biología reproductiva-GSDocument73 pagesBiología reproductiva-GSntvg_3Pas encore d'évaluation
- Módulo QuimicaDocument6 pagesMódulo Quimicantvg_3Pas encore d'évaluation
- Ficha Tipos de Tejido Vegetal para Quinto de PrimariaDocument3 pagesFicha Tipos de Tejido Vegetal para Quinto de Primariantvg_3100% (1)
- PRACTICA #8 Efecto Del Calor Sobre Los CuerposDocument4 pagesPRACTICA #8 Efecto Del Calor Sobre Los CuerposXaviier MeraPas encore d'évaluation
- 334 - 19 Octubre LUZ UV 2008 PDFDocument1 page334 - 19 Octubre LUZ UV 2008 PDFReyna Solís CiriacoPas encore d'évaluation
- Aplicaciones de Las Ecuaciones Diferenciales Movimiento Armonico SimpleDocument5 pagesAplicaciones de Las Ecuaciones Diferenciales Movimiento Armonico SimpleVictor Naynn Piñeros CuervoPas encore d'évaluation
- Guía y Taller 7Document5 pagesGuía y Taller 7JHEISSON DAVID JIMENEZ PERDOMOPas encore d'évaluation
- Tsunami - EjemplosDocument186 pagesTsunami - EjemplosAlvaro ManriquePas encore d'évaluation
- EXAMEN-FINAL-DE-FISICA-B - SICA-1-2-2015-1.pdf Filename UTF-8''EXAMEN-FINAL-DE-FISICA-BÁSICA-1-2-2015-1Document1 pageEXAMEN-FINAL-DE-FISICA-B - SICA-1-2-2015-1.pdf Filename UTF-8''EXAMEN-FINAL-DE-FISICA-BÁSICA-1-2-2015-1FranciscoPas encore d'évaluation
- InerciaDocument33 pagesInerciaLizbeth Q TitoPas encore d'évaluation
- Tesis de Secado PDFDocument160 pagesTesis de Secado PDFjohanna gutierrezPas encore d'évaluation
- ASTM D3080M 11.en - EsDocument9 pagesASTM D3080M 11.en - EsMercedes Villacis TroncosoPas encore d'évaluation
- Tema:: Trabajo Mecànico - Bombeo de Lìquidos Mg. Roger Abel Montoya JiménezDocument10 pagesTema:: Trabajo Mecànico - Bombeo de Lìquidos Mg. Roger Abel Montoya JiménezEmerson Terrones AguilarPas encore d'évaluation
- Quimica 8 Elmer Arenas RiosDocument3 pagesQuimica 8 Elmer Arenas RiosJulio Sangay Mantilla0% (1)
- 7 Unidad VII. QMA-103Document10 pages7 Unidad VII. QMA-103Omar SantosPas encore d'évaluation
- Semana 14 Cantidad de Movimiento Unac 2009 BDocument22 pagesSemana 14 Cantidad de Movimiento Unac 2009 BWalter Lauro Perez Terrel100% (2)
- PFC ACECAT v01p01Document168 pagesPFC ACECAT v01p01Enrique Giovanni EspinosaPas encore d'évaluation
- LipogenesisDocument16 pagesLipogenesisImasumac QuiritaPas encore d'évaluation
- API 3 Fisica SIGLO 21 100%Document2 pagesAPI 3 Fisica SIGLO 21 100%Ramiro PardoPas encore d'évaluation
- EcosistemasDocument8 pagesEcosistemasCanela BravoPas encore d'évaluation
- Absorcion Via Oral PDFDocument1 pageAbsorcion Via Oral PDFLinda Carol Ruiz García0% (1)
- Resumen Teoria de Bachillerato FisicaDocument79 pagesResumen Teoria de Bachillerato Fisicas zcPas encore d'évaluation
- Reporte Lab Fisiarq s10 MFDocument3 pagesReporte Lab Fisiarq s10 MFAloap VHPas encore d'évaluation
- Niveles de Organización de La Materia VivaDocument5 pagesNiveles de Organización de La Materia VivaLaura Patricia Espinosa FuentesPas encore d'évaluation
- Fisica - Icfes 2 - Alejandra ViafaraDocument8 pagesFisica - Icfes 2 - Alejandra ViafaraAlejandra ViafaraPas encore d'évaluation
- LowryDocument4 pagesLowryJonhy Garcia100% (1)
- Ficha N 2Document2 pagesFicha N 2Ayrton ChavezPas encore d'évaluation
- Química de CianuraciónDocument19 pagesQuímica de CianuraciónCarlos B AlfaroPas encore d'évaluation