Académique Documents
Professionnel Documents
Culture Documents
Combustão
Transféré par
diabrahao0 évaluation0% ont trouvé ce document utile (0 vote)
180 vues2 pagesTitre original
combustão
Copyright
© Attribution Non-Commercial (BY-NC)
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Attribution Non-Commercial (BY-NC)
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
180 vues2 pagesCombustão
Transféré par
diabrahaoDroits d'auteur :
Attribution Non-Commercial (BY-NC)
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
1-
INTRODUÇÃO
A combustão é o processo de reações químicas que se produzem durante a oxidação
completa ou parcial do carbono, do hidrogênio e do enxofre contidos em um
combustível. A análise destas reações é feita através de Balanço de Massas e de
Balanço Térmico.
No Balanço de Massas está em consideração a quantidade de ar empregada para a
combustão, sendo a referência a quantidade mínima exata para reagir completamente
o combustível, chamada estequiométrica.
No Balanço Térmico são analisadas as quantidades de calor liberadas, a temperatura
da combustão e a quantidade de calor perdido na exaustão.
São características importantes da combustão a composição do combustível e sua
temperatura, a pressão em que ocorre, seu estado e o formato da câmara de
combustão. Estes determinam a forma com que ocorrerá o processo, se por detonação
ou por deflagração.
2- COMBUSTÃO
2.1- Definição
É a reação química do oxigênio com materiais combustíveis em cujo processo se
apresentam luz e rápida produção de calor. A diferença entre a reação química de
oxidação clássica (ferrugem, zinabre, alumina, etc.) e a de combustão é a velocidade
com que esta última ocorre, independente da quantidade de calor liberado.
2.2- Combustão Estequiométrica
É a reação de oxidação teórica que determina a quantidade exata de moléculas de
oxigênio necessárias para efetuar a completa oxidação de um combustível;
2.3- Combustão Completa
É a reação de combustão em que todos os elementos oxidáveis constituintes do
combustível se combinam com o oxigênio, particularmente o carbono e o
hidrogênio(H), que se convertem integralmente em dióxido de carbono(CO2) e
água(H2O) independentemente da existência de excesso de oxigênio(O2) para a
reação;
2.4- Combustão Incompleta ou Parcial
Nesta reação aparecem produtos intermediários da combustão, especialmente o
monóxido de carbono(CO) e o hidrogênio(H2), resultado da oxidação incompleta dos
elementos do combustível. Ela pode ser induzida pela limitação na quantidade de
oxigênio oferecido para a reação, pelo resfriamento ou sopragem da chama;
2.5- Relação Ar/Combustível
É uma relação entre a quantidade de ar e a quantidade de combustível utilizadas na
reação de combustão. Para combustíveis sólidos e líquidos a relação é entre as
massas, para combustíveis gasosos a relação é calculada entre os volumes
envolvidos;
2.6- Ar Teórico
As reações de combustão são normalmente realizadas com o oxigênio(O2) contido
no ar atmosférico. A composição do ar atmosférico é, aproximadamente, 21 % de
oxigênio(O2) e 79 % de nitrogênio(N2). O ar teórico é a quantidade de ar atmosférico
que fornece a quantidade exata de moléculas de oxigênio necessárias para efetuar a
combustão estequiométrica;
2.7- Combustão Perfeita
É a combustão que, realizada com a quantidade de ar teórico ou de oxigênio(O2)
estequiométrico, resulta numa combustão completa. Por diversos motivos, entre eles
as características reais das reações químicas entre os elementos ou as condições
técnicas dos equipamentos, esta reação nunca se realiza na prática;
2.8- Excesso de Ar
Para reduzir ao mínimo a presença dos produtos intermediários em uma combustão,
tais como monóxido de carbono(CO) e hidrogênio(H2), aplica-se uma quantidade de
ar superior ao ar teórico, chamada ar real(AR), para que a abundância de
oxigênio(O2) proporcione uma reação próxima da Combustão Perfeita. A diferença
entre o ar teórico e o ar real é chamada de Excesso de Ar e é apresentada como uma
relação percentual;
2.9- Combustão Real
É a reação que ocorre na prática nos equipamentos combustores com maior ou
menor excesso de ar e com a presença de alguma quantidade mínima de produtos
intermediários da combustão;
Vous aimerez peut-être aussi
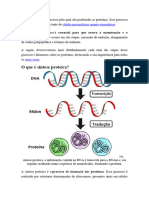
- Síntese ProteicaDocument6 pagesSíntese ProteicaDííh GarciaPas encore d'évaluation
- Lista Ligações, Geometria Prop PeriodicasDocument3 pagesLista Ligações, Geometria Prop PeriodicasAmandaMattosPas encore d'évaluation
- Quimica Inorganica ExperimentalDocument43 pagesQuimica Inorganica ExperimentalGoreth Ernane CastroPas encore d'évaluation
- Relatório 1, Calorimetria UC Físico-Química Versão FinalDocument7 pagesRelatório 1, Calorimetria UC Físico-Química Versão FinalAna Paula SousaPas encore d'évaluation
- ARTERIS ES 018. Gabiões Revestimento e DrenagemDocument6 pagesARTERIS ES 018. Gabiões Revestimento e DrenagemdevanirPas encore d'évaluation
- Utilização e Processamento Do CALDO DE CANADocument7 pagesUtilização e Processamento Do CALDO DE CANADOUGLAS ROBERTOPas encore d'évaluation
- Seleção de Refratários para Fornos de Cozimento de AnodoDocument7 pagesSeleção de Refratários para Fornos de Cozimento de AnodoAugusto CarvalhoPas encore d'évaluation
- Manual Prático de Sedação Avançada 3.0Document69 pagesManual Prático de Sedação Avançada 3.0jeffsmcosta91% (11)
- Apostila - Microbiologia UFVJM - 2020Document65 pagesApostila - Microbiologia UFVJM - 2020Guilherme DrumondPas encore d'évaluation
- Fisqp r22Document7 pagesFisqp r22Cristina ReisPas encore d'évaluation
- NP en Iso1460-1997Document5 pagesNP en Iso1460-1997veraPas encore d'évaluation
- Resultado de Análise Química de SoloDocument2 pagesResultado de Análise Química de SolofalcaoimaePas encore d'évaluation
- Sensores de Temperatura para SiderurgiaDocument11 pagesSensores de Temperatura para SiderurgiaDaniel DominguesPas encore d'évaluation
- Identificação Presuntiva de Cocos GPDocument3 pagesIdentificação Presuntiva de Cocos GPPoliana Lopes DE SiqueiraPas encore d'évaluation
- Aula 01 - Reações Pericíclicas (Cicloadição)Document27 pagesAula 01 - Reações Pericíclicas (Cicloadição)Anonymous UYDJtUnPas encore d'évaluation
- Simulado Unesp - 2 Fase - 1º Dia - 2° Semestre - 2023Document28 pagesSimulado Unesp - 2 Fase - 1º Dia - 2° Semestre - 2023zer0netwitchPas encore d'évaluation
- Desengraxante LG 08Document8 pagesDesengraxante LG 08idelfonsoPas encore d'évaluation
- FISPQ Glister Spray Refrescante BucalDocument12 pagesFISPQ Glister Spray Refrescante BucalGesiel de CastroPas encore d'évaluation
- Perkadox 1440BpdDocument5 pagesPerkadox 1440Bpdqualidade promasqPas encore d'évaluation
- Composição Das ÁguasDocument19 pagesComposição Das ÁguasManuel MarquesPas encore d'évaluation
- FISPQ - Acetato de Amila ISODocument4 pagesFISPQ - Acetato de Amila ISOThiago Alves Barroso MadalenaPas encore d'évaluation
- ANEXO IV - Decreto 3048 - Agentes NocivosDocument4 pagesANEXO IV - Decreto 3048 - Agentes NocivosRogério SilvaPas encore d'évaluation
- ALCOOL Gel - 70 SAFRADocument11 pagesALCOOL Gel - 70 SAFRARoberta Wildhagen Diniz NobrePas encore d'évaluation
- The Universal Antidote Interactive Reference Guidebook - En.ptDocument80 pagesThe Universal Antidote Interactive Reference Guidebook - En.ptEduardo RochaPas encore d'évaluation
- Moldagem para ProvisoriaDocument6 pagesMoldagem para ProvisoriaTATIANA RIBEIROPas encore d'évaluation
- 13415510012017quimica Inorganica II Aula 10Document9 pages13415510012017quimica Inorganica II Aula 10Érica LeticiaPas encore d'évaluation
- Meio Ambiente - Resíduos Classe I e IIDocument4 pagesMeio Ambiente - Resíduos Classe I e IIrododriveinstitucionalPas encore d'évaluation
- Capitulo 33 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOSDocument19 pagesCapitulo 33 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOSMOISES MOURA LIMAPas encore d'évaluation
- Riozyme NeutroDocument7 pagesRiozyme NeutroYuri SouzaPas encore d'évaluation
- Módulo de Química Técnica-1Document189 pagesMódulo de Química Técnica-1Carvalho celestino AntonioPas encore d'évaluation
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisD'EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisÉvaluation : 4.5 sur 5 étoiles4.5/5 (169)
- Trincas e Fissuras em Edificações: causadas por recalques diferenciaisD'EverandTrincas e Fissuras em Edificações: causadas por recalques diferenciaisPas encore d'évaluation
- O psicólogo clínico em hospitais: Contribuição para o aperfeiçoamento da arte no BrasilD'EverandO psicólogo clínico em hospitais: Contribuição para o aperfeiçoamento da arte no BrasilPas encore d'évaluation
- Inteligência artificial: O guia completo para iniciantes sobre o futuro da IAD'EverandInteligência artificial: O guia completo para iniciantes sobre o futuro da IAÉvaluation : 5 sur 5 étoiles5/5 (6)
- MANUAL INTERNACIONAL DE TRICOLOGIA AVANÇADA: Um guia completo sobre cabelo, couro cabeludo e doenças capilaresD'EverandMANUAL INTERNACIONAL DE TRICOLOGIA AVANÇADA: Um guia completo sobre cabelo, couro cabeludo e doenças capilaresÉvaluation : 4.5 sur 5 étoiles4.5/5 (6)
- Modelos De Laudos Para Avaliação De Imóveis Urbanos E RuraisD'EverandModelos De Laudos Para Avaliação De Imóveis Urbanos E RuraisPas encore d'évaluation