Académique Documents
Professionnel Documents
Culture Documents
Anemia Perniciosa Descripcion de Cuadro Clinico
Transféré par
Roberto AnguianoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Anemia Perniciosa Descripcion de Cuadro Clinico
Transféré par
Roberto AnguianoDroits d'auteur :
Formats disponibles
CASO CLÍNICO INTERINSTITUCIONAL
Anemia perniciosa: descripción de un caso
clínico
Pernicious anemia: a case report
Eduardo Contreras Zúñiga, MD,1 Julián Andrés Ramírez Cheyne, MD,2
Raúl Andrés Vallejo Serna, MD,3 Leidy Patricia Zúñiga Correa, MD.4
RESUMEN SUMMARY
La anemia se caracteriza por una disminución en la concentra- The anemia is characterized by a diminution in the concen-
ción de hemoglobina o en la capacidad de transportar oxíge- tration of hemoglobin or the capacity to transport oxygen
no en la sangre. En la anemia megaloblástica se produce una in the blood. In the megaloblastic anemia a red diminution
disminución del número de eritrocitos o glóbulos rojos, y un of the number of erythrocytes or globules takes place, and
aumento en el tamaño de los mismos debido a una deficiencia an increase in the size of such due to a deficiency of subs-
de sustancias que intervienen en la eritropoyesis o formación tances that take part in the eritropoyesis or formation of
de los glóbulos rojos, como es la vitamina B12. Sin embargo, la red globules, as it is the B12 vitamin. Nevertheless, the
carencia de esta vitamina es secundaria a la falta una proteína deficiency of this vitamin is secondary to the lack a protein
de la mucosa gástrica (factor intrínseco), ésta sí básica para of the gastric mucosa (intrinsic factor) this one yes basic
su absorción. En estos casos el factor intrínseco se produce y one for its absorption. In these cases the intrinsic factor
se secreta en cantidades mínimas, insuficientes para asegurar takes place and secret in minimum, insufficient amounts
una normal absorción intestinal de la vitamina, o no se produ- to make sure a normal intestinal absorption the vitamin or
ce en absoluto. it does not take place absolutely.
Palabras clave KEY WORDS
Anemia perniciosa, vitamina B12, megaloblastosis. Pernicious anemia, B12 vitamin, megaloblastosis.
DESCRIPCIÓN DEL CASO Se inicia reemplazo con vitamina B12. El paciente
asiste a control un mes después con mejoría signi-
Se trata de un paciente de 56 años quien con- ficativa de los síntomas.
sulta por cuadro clínico de 1 mes de evolución
consistente en ataxia, polineuropatía, pérdida del
sabor de los alimentos, deposiciones diarreicas y EPIDEMIOLOGÍA
mareo. Al examen físico se encuentra una marcha
atáxica, alteraciones sensitivas principalmente en La prevalencia del déficit de vitamina B12 varía
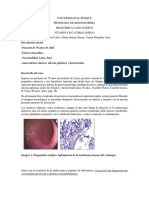
miembros inferiores, lengua lisa y brillante (figura entre 5 y 60% según la definición, pero se considera
1). Se toman diferentes exámenes entre ellos un que en países industrializados es aproximadamente
hemograma con anemia macrocítica hipercrómica, el 20% (1), en pacientes mayores sanos se estima
LDH aumentado y niveles bajos de vitamina B12. una prevalencia del 12% (2), pero entre los pacien-
1 3
Medicina Interna. Fellowship en Cardiología. Universidad del Valle. Medicina Interna. Universidad del Valle. Hospital Universitario del
Fundación Valle del Lili. Cali, Colombia. Valle. Cali. Colombia.
2 4
Medicina Interna. Universidad del Valle. Hospital Universitario del Medicina Interna. Universidad del Valle. Hospital Universitario del
Valle. Cali. Colombia. Valle. Cali. Colombia.
Fecha recibido: 20-03-07/ Fecha aceptado: 14-02-08
© 2008 Asociaciones Colombianas de Gastroenterología, Endoscopia digestiva, Coloproctología y Hepatología 83
Caso clínico interinstitucional
tes mayores enfermos o internados la prevalencia es ETIOLOGÍA
de 30 a 40% (3, 4). La incidencia de la enfermedad
es de 1:10.000 en Europa del Norte, aunque ocurre En estudios realizados en Gran Bretaña, la deficien-
en todas las razas, con un pico de incidencia a los 60 cia de vitamina B12 se debe usualmente a anemia
años, con un aumento en la frecuencia por encima perniciosa, la cual está asociada hasta con un 80%
de esta edad y una relación mujer: hombre de 1,6:1,0 de casos de anemia megaloblástica. Otras causas de
(5) y es mas común en pacientes con historia fami- deficiencia son malabsorción de cobalamina inge-
liar de ésta o enfermedades asociadas (enfermedad rida, anemia perniciosa, deficiencia dietaria, enfer-
de Hashimoto, enfermedad de Addison, hipoparati- medades hereditarias del metabolismo de la cobala-
roidismo, vitíligo) (6). mina (tabla 1).
MALABSORCIÓN DE COBALAMINA INGERIDA
Caracterizada por la imposibilidad de liberar las
moléculas de cobalamina de la dieta o a partir de los
transportadores intestinales y se define por la presen-
cia de ingesta suficiente, y un test de Schilling nega-
tivo. Las causas de esta entidad son: atrofia gástrica,
ser portador crónico de H. pylori u otras infecciones
intestinales, ingestión crónica de biguanidas como
la metformina, ingestión crónica de antiácidos, alco-
holismo crónico, cirugía gástrica o de reconstruc-
ción gástrica, falla pancreática exocrina, síndrome
de Sjörgren.
Figura 1.
Tabla 1. Causas de deficiencia de vitamina B12.
Etapa metabólica Causa de deficiencia de vitamina B12
Ingesta: Se obtiene cobalamina de alimento animal y entra unida a Causas: Vegetarianismo estricto sin suplementación de vitaminas.
proteínas animales.
Boca/esófago: las glándulas salivares secretan proteína R.
Estómago: Aclorhidria
- Pepsina y HCL: Separan cobalamina de proteína animal y producen Ausencia de factor intrínseco secundario a:
cobalamina libre. - Gastrectomía
- Proteína R: Mayor producción, unión a cobalamina - Anemia perniciosa.
- Factor intrínseco: Aún no se une a la proteína por tener menor
afinidad que proteína R.
Duodeno/yeyuno: - Falla pancreática exocrina que lleva a la no producción de cobalamina
1. Secreción de más complejos cobalamina-proteína R por vesicular biliar. libre
2. Secreción de proteasas que separan cobalamina de proteína R por - Proliferación bacteriana y parásitos aumentados, que consumen
pancreas. cobalamina.
3. Cobalamina libre se une a factor intrínseco.
Ileon: Complejo cobalamina-factor intrínseco se unen al receptor en la - Resección ileal.
membrana de células mucosas, las cuales los separan, posteriormente la - Defecto del receptor de mucosa.
cobalamina se une a sus transportadores (TCI, TCII, TCIII)
Sistémica: transporte sistémico vía porta. Deficiencia congénita de transportadores, especialmente TCII.
Célula: Entra por endocitosis y se metaboliza por enzimas intracelulares, - Deficiencia congénita de enzimas intracelulares.
formando 2 coenzimas.
84 Rev Col Gastroenterol / 23 (1) 2008
ANEMIA PERNICIOSA Gastrointestinales: Glositis de Hunter (atrofia de
papilas linguales que hace que la lengua luzca lisa
Es la enfermedad causada por deficiencia de vitamina y brillante), elevación de lactato deshidrogenada
B12, relacionada con la incapacidad del individuo de y bilirrubinas e incluso diarrea y malabsorción.
absorber cobalamina debido a la deficiencia de factor Ocasionalmente úlceras mucocutáneas recurrentes,
intrínseco por parte de las células parietales. El factor predisposición para adenocarcinoma gástrico, como
intrínseco se une ávidamente a la vitamina B12 pro- resultado de metaplasia intestinal y aclorhidria con
veniente de la dieta, formando un complejo que es posterior sobrepoblación bacteriana (creando ami-
transportado hasta el íleon terminal, donde es absor- nas carcinogénicas).
bido después de la unión a receptores de factor intrín-
seco de la membrana luminal de las células ileales. Hay Ginecológicas: Atrofia de la mucosa vaginal e
dos mecanismos que alteran la producción de factor infecciones crónicas urinarias y vaginales (micosis),
intrínseco, el primero se debe a una perdida de células infertilidad.
parietales de la mucosa gástrica que lleva a la falla en la
producción de factor intrínseco y el segundo debido
a la presencia de autoanticuerpos bloqueantes en el INMUNOPATOGÉNESIS DE LA GASTRITIS
jugo gástrico, que se pueden unir al sitio de unión de
la vitamina B12 con el factor intrínseco, evitando así El proceso patológico asociado con gastritis tipo A
la formación de este complejo. parece ser hacia células parietales gástricas: la lesión
patológica está restringida a células del fondo y
La enfermedad comprende un amplio espectro de
cuerpo del estómago. Las células parietales están en
síntomas, entre los cuales se incluyen: síntomas
la mucosa gástrica y los anticuerpos contra éstas y
constitucionales, alteraciones ginecológicas, neuro-
su producto de secreción, el factor intrínseco, están
lógicas y gastrointestinales.
presentes en el jugo gástrico.
Un gran avance en el entendimiento de la patogéne-
MANIFESTACIONES CLÍNICAS sis fue la demostración de H+/K+-ATPasa gástrica,
el cual es el antígeno reconocido por anticuerpos
Neurológicas: Entre las más frecuentes se encuen- contra las células parietales (9), aún no está bien
tran las polineuropatías (especialmente las sensitivas); establecido el rol de ésta en la inmunpatogénesis
ataxia; signo de Babinsky, de forma menos común de la anemia perniciosa. Los estudios en ratones
se puede encontrar incontinencias fecal y urinaria, sugieren que la lesión de la gastritis autoinmune
afección de pares craneales, incluyendo neuritis es iniciada por linfocitos T CD4 que reconocen la
óptica y atrofia óptica. Inician con desmielinización subunidad de H+/K+-ATPasa gástrico. Esta gas-
hasta llegar a degeneración axonal y muerte celular, tritis es caracterizada por la infiltración submucosa
que pueden no revertir con terapia suplementaria de de células mononucleares que se extienden en la
vitamina B12 (7). No se ha determinado el grado de lámina propia entre las glándulas gástricas, con
relación entre otras alteraciones en funciones menta- pérdida de células parietales y de zimógeno. Las
les superiores, como demencia, ECV, ateroesclerosis, células mononucleares en las lesiones tempranas
depresión e incluso síndromes parkinsonianos (7), son predominantemente macrófagos y células T
a pesar de esto se puede encontrar hasta en un 28% CD4 producen diversos tipos de citoquinas (10).
trastornos neuropsiquiátricos en pacientes con défi- Las células T CD4 reaccionan contra el H+/K+-
cit de cobalamina en los que aún no está presente la ATPasa gástrico, están presentes en los nódulos
anemia o la macrocitosis (8). linfáticos gástricos de estos ratones. Las células T
Hematológicas: Macrocitosis, hipersegmentación CD8 no parecen tener un rol importante en la
de neutrófilos, megaloblastosis medular. génesis de la gastritis.
Anemia perniciosa: descripción de un caso clínico 85
Caso clínico interinstitucional
DIAGNÓSTICO en el 70% de los pacientes (11). Por otro lado, los
anticuerpos contra célula parietal están presentes en
El reto principal en el diagnóstico es hacerlo tempra- plasma hasta en un 90% (5), pero son poco confia-
namente, incluso antes del desarrollo de anemia, para bles por su baja especificidad (11).
evitar el daño neurológico que es irreversible. Se usa
la medida plasmática de la vitamina B12, homocis- La determinación del pepsinogéno tiene una sensi-
teína y ácido metilmalónico, ya que estos dos últimos bilidad alta pero una especificidad baja (12), al igual
se acumulan en la deficiencia de B12 y se conside- que la gastrina plasmática (13).
ran marcadores bioquímicos tempranos. También se El gold standard para evaluar absorción es el test de
ha propuesto que un marcador sensible puede ser la Schilling, el cual se divide en dos tipos. Schilling I,
medición de la cobalamina unida a sus transportado- el cual consiste en medir la absorción de la cobala-
res (HoloTC), porque ésta representa la cantidad real mina, determinando cuanto de la cobalamina radio-
de cobalamina disponible para las células; en estudios marcada es excretada en orina en 24 a 48 horas y el
se ha mostrado que es un marcador temprano, pero test de Shilling II en el cual se administra junto a la
es muy debatible su verdadera utilidad y la manera cobalamina factor intrínseco, el cual debe normali-
apropiada de usarla. Lo recomendado hasta ahora zar la absorción en anemia perniciosa, pero no así en
es entonces utilizar, en primera instancia, los niveles malabsorción intestinal (tabla 2).
de cobalamina en plasma, y si éstos resultan 25% o
más por debajo del límite inferior del rango normal
(156pmol/lt), se confirma el diagnóstico. En cambio, Tabla 2.
si se encuentran valores de cobalamina en el área gris, Schilling I Schilling II
debe recurrirse a la medida del marcador ácido metil- Anemia perniciosa Bajo Normal
malónico, si nuevamente este valor queda en el área Gastrectomía Bajo Normal
gris debe repetirse ambas medidas, después de un año, Vegetarianismo Normal Normal
a no ser que el paciente esté sintomático, caso en el Resección Ileal Bajo Bajo
cual se debe iniciar tratamiento. Síndrome Blind-Loop Bajo Bajo
Luego de diagnosticar la deficiencia de la enzima lo Se ha propuesto el uso del test cobasorb (14) que
que sigue es diagnosticar la causa; se han desarrollado consiste en administrar una dosis oral de vitamina
numerosos test para estudiar la función de la mucosa B12 no radioactiva y posteriormente evaluar el incre-
gástrica, pero éstos no están estandarizados, ni uni- mento de holoTC, el cual debe elevarse en pacientes
ficadas las recomendaciones de su uso. Actualmente sanos con absorción activa de B12, pero permanecer
se propone iniciar tratamiento sin realizar test adi- invariable en ausencia congénita de factor intrínseco
cionales a cierto grupo de pacientes en los que el o en pacientes con síndrome de Imerslund-Grasbeck
diagnóstico es obvio: (anemia megaloblástica juvenil, enfermedad autosó-
mica recesiva con mutación en receptor de unión al
1. Historia que revela aporte nutricional inade-
complejo B12-Factor intrínseco –Cubulina–).
cuado.
2. Historia que revela resección gástrica o ileal. El aspirado de medula ósea debe reservarse para
pacientes con sospecha de malignidad.
3. Pacientes con hallazgos clínicos sugestivos y labo-
ratorio de primera línea positivos.
Para el resto de pacientes, especialmente en los que
DIAGNÓSTICO DIFERENCIAL
se sospecha anemia perniciosa, están recomendados
estudios posteriores.
Otras causas de macrocitosis
Los anticuerpos contra factor intrínseco son patog-
nomónicos, aunque sólo están presentes en plasma • Alcohol
86 Rev Col Gastroenterol / 23 (1) 2008
• Enfermedad hepática Al iniciar el suplemento de B12 es importante moni-
• Hipotiroidismo torizar y corregir los niveles de hierro, por la eleva-
• Anemia aplástica ción de demandas de este micronutriente por parte
de los eritrocitos. Con el suplemento de cianocoba-
• Mielodisplasia lamina se puede evidenciar deficiencia de folato.
• Fármacos citotóxicos
La recomendación para el seguimiento es la eva-
• Embarazo luación clínica, como resultado del tratamiento
• Dieta vegetariana de suplemento de cianocobolamina, excepto en el
• Periodo neonatal. caso de haberse encontrado anemia donde la reco-
mendación es el control por laboratorio solicitando
reticulocitos a la semana de iniciado el manejo con
TRATAMIENTO suplemento de cianocobalamina y hemoglobina a
4 semanas.
Se recomienda tratar a pacientes con signos severos
independientemente de los laboratorios (15); tam-
bién se trata a pacientes con síntomas inespecíficos
y laboratorios en línea de corte, donde se debe reali- REFERENCIAS
zar una prueba terapéutica evaluando los efectos del 1. Andres E, Loukili NH, Noel E, et al. Vitamin B12
tratamiento, que se sugiere debe ser continuado de (cobalamin) deficiency in elderly patients. CMAJ
demostrarse mejoría clínica. 2004; 171: 251-9.
En el paciente con deficiencia de la vitamina B12, 2. Lindenbaum J, Rosenberg IH, Wilson PWF, Stabler
pero absorción normal, el tratamiento es suplemen- SP, Allen RH. Prevalence of cobalamin deficiency in
tar 6 mcg/día de vitamina B12 (16), esto se corre- the Framingham elderly population. Am J Clin Nutr
laciona con los requerimientos día de 2 a 5 mcg 1994; 60: 2-11.
establecidos por American Society of Geriatrics y 3. Pautas E, Chérin P, De Jaeger C, Godeau P. Carence
la FDA. La clínica de la deficiencia de la vitamina en vitamine B12 chez le sujet âgé. Presse Med 1999;
puede aparecer de 5 a 10 años de consumo de dieta 28: 1767-70.
deficiente (17), explicable por los depósitos hepáti- 4. Van Asselt DZ, Blom HJ, Zuiderent R, Wevers RA,
cos y la circulación enterohepática. Jakobs C, van den Broek WJ, et al. Clinical sig-
nificance of low cobalamin levels in older hospital
Un 1% a 5% de la cobalamina libre y la cianoco- patients. Neth J Med 2000; 57: 41-9.
balamina se absorbe por difusión pasiva a lo largo 5. Hoffbrand V, Provan D. ABC of clinical haematology.
de todo el intestino. Esto soporta el dar suplemento Macrocytic anaemias. BMJ 1997; 314: 430-433.
oral de la vitamina en anemia perniciosa y malabsor-
6. Eisenbarth GS, Gottlieb PA. Autoimmune polyendo-
ción (18). crine syndromes. N Engl J Med 2004; 350: 2068-2079.
El esquema de tratamiento es el siguiente: 7. Toh B-H, Van Driel IR, Gleeson PA. Pernicious ane-
Cianocobalamina 1.000 mcg diario, por 7 días, luego mia. N Engl J Med 1997; 337: 1441-1448.
1.000 mcg cada semana por 4 semanas y posterior- 8. Lindenbaum J, Healton EB, Savage DG, et al.
mente 1.000 mcg cada mes de por vida. A pesar de Neuropsychiatric disorders caused by cobalamin
que la administración de cianocobalamina vía oral deficiency in the absence of anemia or macrocytosis.
(1.000 mcg), puede lograr concentraciones suficientes N Engl J Med 1988; 318: 1720-1728
en pacientes con manifestaciones hematológicas (19), 9. Gleeson PA, Toh BH. Molecular targets in perni-
no hay evidencia de esto en pacientes con manifesta- cious anaemia. Immunol Today 1991; 12: 233-8.
ciones neurológicas, razón por la cual actualmente se 10. Martinelli TM, van Driel IR, Alderuccio F, Toh BH.
recomienda el tratamiento parenteral (20). Analysis of mononuclear cell infiltrate and cyto-
Anemia perniciosa: descripción de un caso clínico 87
Caso clínico interinstitucional
kine production in murine autoimmune gastritis. 16. Bor MV, Lydeking-Olsen E, Moller J, Nexo E. A
Gastroenterology 1996; 110: 1791-802. daily intake of approximately 6 microg vitamin B-
11. Alderuccio F, Toh BH, Tan SS, Gleeson PA, van Driel IR. 12 appears to saturate all the vitamin B-12-related
An autoimmune disease with multiple molecular targets variables in Danish postmenopausal women. Am J
abrogated by the transgenic expression of a single autoan- Clin Nutr 2006; 83: 52-8.
tigen in the thymus. J Exp Med 1993; 178: 419-26. 17. Hershko C, Ronson A, Souroujon M, Maschler I,
12. Nishio A, Hosono M, Watanabe Y, Sakai M, Okuma Heyd J, Patz J. Variable hematologic presentation of
M, Masuda T. A conserved epitope on H1, K(1)-ade- autoimmune gastritis: age-related progression from
nosine triphosphatase of parietal cells discerned by a iron deficiency to cobalamin depletion. Blood 2006;
murine gastritogenic T-cell clone. Gastroenterology 107: 1673-9.
1994; 107: 1408-14. 18. Carmel R, Sinow RM, Karnaze DS. Atypical cobala-
13. Barrett SP, Gleeson PA, de Silva H, Toh BH, van min deficiency. Subtle biochemical evidence of
Driel IR. Interferon is required during the initia- deficiency is commonly demonstrable in patients
tion of an organ-specific autoimmune disease. Eur J without megaloblastic anemia and is often associated
Immunol 1996; 26: 1652-5. with protein-bound cobalamin malabsorption. J Lab
14. Taguchi O, Takahashi T. Administration of anti- Clin Med 1987; 109: 454-63.
interleukin-2 receptor a antibody in vivo induces 19. Bastrup-Madsen P. Treatment of vitamin B12 defi-
localized autoimmune disease. Eur J Immunol 1996; ciency. Evaluation of therapy with cyanocobalamin,
26: 1608-12. hydroxocabalamin, and depot cobalamin Betolvex.
15. Solomon LR. Cobalamin-responsive disorders in Scand J Gastroenterol Suppl 1974; 29: 89-95.
the ambulatory care setting: unreliability of cobala- 20. Lane LA, Rojas-Fernández C. Treatment of vitamin
min, methylmalonic acid, and homocysteine testing. B (12)- deficiency anemia: oral versus parenteral the-
Blood 2005; 105: 978-85. rapy. Ann Pharmacother 2002; 36: 1268-72.
88 Rev Col Gastroenterol / 23 (1) 2008
Vous aimerez peut-être aussi
- Baños Con Hierbas Naturales (Autoguardado)Document191 pagesBaños Con Hierbas Naturales (Autoguardado)Hipolito Montero Yañez100% (1)
- Factor ReumatoideDocument3 pagesFactor ReumatoideRoberto Anguiano100% (1)
- Anemia MegaloblasticaDocument20 pagesAnemia MegaloblasticaJazmin CrPas encore d'évaluation
- Síndrome de Malabsorción!Document31 pagesSíndrome de Malabsorción!Camila San Martín Ramírez50% (2)
- Anemias CarencialesDocument92 pagesAnemias CarencialesOscar OrtegaPas encore d'évaluation
- Resumen Anemia Megaloblastica - CompletoDocument7 pagesResumen Anemia Megaloblastica - CompletoDr. Jhonathan SosaPas encore d'évaluation
- Pae Hiperemesis Gravidica - NeoDocument54 pagesPae Hiperemesis Gravidica - NeoLuz Chumbiauca Huamani100% (1)
- Errores innatos del metabolismo en el recién nacido: Abordaje clínicoD'EverandErrores innatos del metabolismo en el recién nacido: Abordaje clínicoPas encore d'évaluation
- CrioaglutininasDocument1 pageCrioaglutininasRoberto AnguianoPas encore d'évaluation
- CrioaglutininasDocument1 pageCrioaglutininasRoberto AnguianoPas encore d'évaluation
- Trastornos Depresivos.Document20 pagesTrastornos Depresivos.Diego AndresPas encore d'évaluation
- Caso Clínico Deficiencia Vitamina B12 2008Document6 pagesCaso Clínico Deficiencia Vitamina B12 2008Pancho Francisco Adam VegaPas encore d'évaluation
- Caso Clínico Anemia MegaloblásticaDocument14 pagesCaso Clínico Anemia MegaloblásticaKedwin MontejoPas encore d'évaluation
- Manual 2020 CC 1 RevisadoDocument12 pagesManual 2020 CC 1 RevisadoMelanie FlowersPas encore d'évaluation
- Anemia Megaloblastica TrabajoDocument12 pagesAnemia Megaloblastica TrabajoIsabelly SanchezPas encore d'évaluation
- Anemia PerniciosaDocument8 pagesAnemia PerniciosaInternational Medical PublisherPas encore d'évaluation
- 05 - Anemia Megaloca 2010Document43 pages05 - Anemia Megaloca 2010GaBy BTPas encore d'évaluation
- ANEMIA PERNICIOSA SisisiDocument7 pagesANEMIA PERNICIOSA SisisiAmerica JerónPas encore d'évaluation
- Anemia MacrociticaDocument23 pagesAnemia MacrociticaLeo SuazoPas encore d'évaluation
- Anemia MegaloblasticaDocument36 pagesAnemia MegaloblasticaBryan ToapantaPas encore d'évaluation
- Cuestionarios - GruposDocument23 pagesCuestionarios - GruposXavier PilatuñaPas encore d'évaluation
- Anemia Megaloblastica Dr. AlvarezDocument5 pagesAnemia Megaloblastica Dr. AlvarezCristian Rivera ChuymaPas encore d'évaluation
- Diarrea CrónicaDocument7 pagesDiarrea CrónicaArleth MosquedaPas encore d'évaluation
- Farmacología - HematopoyesisDocument2 pagesFarmacología - HematopoyesisRoger Alejandro MontoyaPas encore d'évaluation
- Reporte de Caso ClínicoDocument14 pagesReporte de Caso ClínicoMarlenne Bautista AndradePas encore d'évaluation
- Anemia MegaloblásticaDocument22 pagesAnemia MegaloblásticaLuis Eduardo Padilla CanalesPas encore d'évaluation
- Clase 75 - Anemia MegaloblásticaDocument33 pagesClase 75 - Anemia MegaloblásticaAnggie CBPas encore d'évaluation
- Cuestionario - Patologia - Semana - 1 Zelene Ramírez SuárezDocument5 pagesCuestionario - Patologia - Semana - 1 Zelene Ramírez SuárezZelene Korith Suarez RamirezPas encore d'évaluation
- Diarrea Persistente 1Document22 pagesDiarrea Persistente 1Jean FilthPas encore d'évaluation
- Anemia MegaloblsticaDocument7 pagesAnemia MegaloblsticaDiana JimenezPas encore d'évaluation
- Anemia MegaloblásticaDocument17 pagesAnemia MegaloblásticaStefany SánchezPas encore d'évaluation
- Diabetes UchileDocument40 pagesDiabetes UchileEsteban MatusPas encore d'évaluation
- Fisiopatología de La Anemia MegaloblásticaDocument6 pagesFisiopatología de La Anemia MegaloblásticaKaty rc0% (1)
- Informe Caso Clínico de Anemia FerropénicaDocument3 pagesInforme Caso Clínico de Anemia FerropénicahottizdssPas encore d'évaluation
- Introducción Anemia Megaloblastica 1Document2 pagesIntroducción Anemia Megaloblastica 1baironPas encore d'évaluation
- Caso Clínico CobalaminaDocument3 pagesCaso Clínico CobalaminaDannaPas encore d'évaluation
- Anemia Perniciosa y Atrofia GastricaDocument4 pagesAnemia Perniciosa y Atrofia GastricaYAIRPas encore d'évaluation
- Seminario III ResolviendoDocument13 pagesSeminario III Resolviendofranko0287Pas encore d'évaluation
- Anemias en El AdultoDocument20 pagesAnemias en El AdultoGregory Palma MPas encore d'évaluation
- 5.-Anemias MegaloblásticasDocument4 pages5.-Anemias MegaloblásticasANGELA GISELLE RUIZ AVILAPas encore d'évaluation
- Anemias MegaloblásticasDocument14 pagesAnemias MegaloblásticasKevin MendizábalPas encore d'évaluation
- Vitaminas Liposolubles e Hidrosolubles, Funciones, Deficiencias. ROSIO PANDO LAZODocument91 pagesVitaminas Liposolubles e Hidrosolubles, Funciones, Deficiencias. ROSIO PANDO LAZOMax George Samame GomezPas encore d'évaluation
- Anemia Embarazo CorregidaDocument33 pagesAnemia Embarazo CorregidaMabel QuevedoPas encore d'évaluation
- Vitamina b12Document6 pagesVitamina b12Cristian_Romer_1852Pas encore d'évaluation
- Caso Clinico 1 Anemia MegaloblasticaDocument25 pagesCaso Clinico 1 Anemia MegaloblasticahaferPas encore d'évaluation
- Caso Clinico Vitamina B12Document13 pagesCaso Clinico Vitamina B12Alexander Mango TrejosPas encore d'évaluation
- Resumen de MalabsorciónDocument5 pagesResumen de MalabsorciónConstanzaNarváezJorqueraPas encore d'évaluation
- Taller Anemia MegaloblasticaDocument18 pagesTaller Anemia MegaloblasticaUrsula ARPas encore d'évaluation
- ZulfiqarDocument6 pagesZulfiqarSASMA ConsultoresPas encore d'évaluation
- Vit B12Document6 pagesVit B12yuel25Pas encore d'évaluation
- Caso Clínico-o4-Niño de 3 Años JRDocument28 pagesCaso Clínico-o4-Niño de 3 Años JRAT RicardoPas encore d'évaluation
- Trastornos de La Absorcion IntestinalDocument20 pagesTrastornos de La Absorcion IntestinalMelina MarisolPas encore d'évaluation
- Clase de Vitaminas 2021Document92 pagesClase de Vitaminas 2021Juan Jesús Acuña PėrezPas encore d'évaluation
- Anemia Por Deficiencia de Vitamina B12 Caso ClinicoDocument5 pagesAnemia Por Deficiencia de Vitamina B12 Caso ClinicoGerardo S. RojasPas encore d'évaluation
- RSAN - 22 - 3 - 88 b12 en Omnivoros SANDocument9 pagesRSAN - 22 - 3 - 88 b12 en Omnivoros SANClara ArlettazPas encore d'évaluation
- Caso ClinicoDocument7 pagesCaso ClinicoFlavia RomeroPas encore d'évaluation
- Anemia PerniciosaDocument31 pagesAnemia PerniciosaFrida Mdz RmrPas encore d'évaluation
- CC N°13 Evaluacion Del Estado NutricionalDocument6 pagesCC N°13 Evaluacion Del Estado NutricionalStefany GarcíaPas encore d'évaluation
- U2 NNCL3 290118Document29 pagesU2 NNCL3 290118Víctor López LedesmaPas encore d'évaluation
- Anemia PerniciosaDocument5 pagesAnemia PerniciosaIsaias MarquezPas encore d'évaluation
- Anemias MegaloblásticasDocument14 pagesAnemias MegaloblásticasELMER ELOY MAQUI SANTOPas encore d'évaluation
- U6 Nutricion y SueñoDocument14 pagesU6 Nutricion y SueñoOmar PeludheroPas encore d'évaluation
- Tema 8 Analisis Bioquimico AltamarDocument22 pagesTema 8 Analisis Bioquimico AltamarCHRISTIAN gamerPas encore d'évaluation
- Desnutricion VirtualDocument77 pagesDesnutricion VirtualBilly TvPas encore d'évaluation
- Caso Clinico AnemiaDocument4 pagesCaso Clinico AnemiaPame BenalcazarPas encore d'évaluation
- Manual Procedimientos Lab ClinicoDocument158 pagesManual Procedimientos Lab ClinicoIvan Alejandro Castillo Torres100% (1)
- 2 7 Patología Plaquetaria (Tema 15)Document44 pages2 7 Patología Plaquetaria (Tema 15)miguel angel100% (12)
- Caso Pacal 13Document6 pagesCaso Pacal 13Roberto AnguianoPas encore d'évaluation
- Aislamiento de InmunoglobulinasDocument2 pagesAislamiento de InmunoglobulinasRoberto AnguianoPas encore d'évaluation
- PRACTICA Cuenta DiferencialDocument4 pagesPRACTICA Cuenta Diferencialferchuaski100% (1)
- Coombs Indirecto en Columna Diana GelDocument1 pageCoombs Indirecto en Columna Diana GelRoberto AnguianoPas encore d'évaluation
- Indice de Yodo Aceites FAODocument14 pagesIndice de Yodo Aceites FAORoberto AnguianoPas encore d'évaluation
- Anemia Perniciosa Descripcion de Cuadro ClinicoDocument6 pagesAnemia Perniciosa Descripcion de Cuadro ClinicoRoberto AnguianoPas encore d'évaluation
- ICTERICIADocument60 pagesICTERICIAElmer Silva ReañoPas encore d'évaluation
- Human Autoimmune Diseases A Comprehensive Update - En.esDocument27 pagesHuman Autoimmune Diseases A Comprehensive Update - En.esNaye ApontePas encore d'évaluation
- Valores Normales de Urea en AdultosDocument2 pagesValores Normales de Urea en AdultosGiianHcPas encore d'évaluation
- Sesion 2 Sobre VirusDocument11 pagesSesion 2 Sobre VirusYamel FloresPas encore d'évaluation
- Aspectos Neuropsiquiátricos en Un Paciente Diagnosticado de Degeneración Corticobasal Caso Clínico de Baja Incidencia y Prevalencia en ColombiaDocument15 pagesAspectos Neuropsiquiátricos en Un Paciente Diagnosticado de Degeneración Corticobasal Caso Clínico de Baja Incidencia y Prevalencia en ColombiaNikolle Valeria ZamoraPas encore d'évaluation
- El Párkinson Es Una Enfermedad Que Suele Comenzar Con El Temblor en Una ManoDocument1 pageEl Párkinson Es Una Enfermedad Que Suele Comenzar Con El Temblor en Una ManoBritney ContrerasPas encore d'évaluation
- Normativas Del Servicio de UrgenciasDocument5 pagesNormativas Del Servicio de UrgenciasMendía Solís, Aylín AnabelPas encore d'évaluation
- Instructivo para El Uso de Bata Antifluido y Cofias Como Elementos de Protección Individual Durante La OperaciónDocument2 pagesInstructivo para El Uso de Bata Antifluido y Cofias Como Elementos de Protección Individual Durante La OperaciónDavid FlorezPas encore d'évaluation
- Akuerdo Di Gobernashon MFK I PNP 2021Document82 pagesAkuerdo Di Gobernashon MFK I PNP 2021MFK100% (2)
- VIH - Sida:: 1. GeneralidadesDocument5 pagesVIH - Sida:: 1. GeneralidadesruthPas encore d'évaluation
- Plan Anual de La Estrategia de Adulto Mayor 2024Document6 pagesPlan Anual de La Estrategia de Adulto Mayor 2024Marjorie MallquiPas encore d'évaluation
- OFFARM, MostradorDocument9 pagesOFFARM, MostradorFrancisco Pedraza HachoPas encore d'évaluation
- Historia Clinica GastritisDocument2 pagesHistoria Clinica Gastritisjoselyn22100% (1)
- 13 Lupus y EmbarazoDocument11 pages13 Lupus y EmbarazoGeNe Rosado-Pas encore d'évaluation
- Sesion 5 Practica Caso Clínico Enfermedades Reactivas 15 Marzo 2021 WordDocument6 pagesSesion 5 Practica Caso Clínico Enfermedades Reactivas 15 Marzo 2021 WordAlexis JhairPas encore d'évaluation
- Enfermedades BovinasDocument31 pagesEnfermedades BovinasRoberto Hernán MartínezPas encore d'évaluation
- Ayuda Familiares Cuidado ResDocument6 pagesAyuda Familiares Cuidado ResMaricely Cantun MejiaPas encore d'évaluation
- Psico HospitalariaDocument8 pagesPsico HospitalariaAndrea FloresPas encore d'évaluation
- Standard Q COVID-19 Ag Capacitacion Enviada A OOAD y UMAE VFDocument23 pagesStandard Q COVID-19 Ag Capacitacion Enviada A OOAD y UMAE VFJos Brnal100% (1)
- Recomendaciones - Parte I: Recomendaciones Operativas: Definición y Objetivo de Una UCIDocument36 pagesRecomendaciones - Parte I: Recomendaciones Operativas: Definición y Objetivo de Una UCItotoPas encore d'évaluation
- Fisiopatologia de AsmaDocument16 pagesFisiopatologia de AsmaPacayPas encore d'évaluation
- Tarea 3 PD IIDocument8 pagesTarea 3 PD IIJissellyPas encore d'évaluation
- Enfrentamiento Poliartritis JO 2020Document5 pagesEnfrentamiento Poliartritis JO 2020Pauline SancyPas encore d'évaluation
- Revista GaleaDocument12 pagesRevista GaleanathaliPas encore d'évaluation
- Malformaciones GeneticasDocument138 pagesMalformaciones GeneticasErymar RangelPas encore d'évaluation
- Comunicación de Nuevo Precio GESDocument14 pagesComunicación de Nuevo Precio GESGraciano SalazarPas encore d'évaluation
- BANCO Psicopato y PsiquiatriaDocument17 pagesBANCO Psicopato y PsiquiatriaVioleta Paredes ParedesPas encore d'évaluation