Académique Documents
Professionnel Documents
Culture Documents
TP1 (CR+correction) - Initiation Aux Dosages Spectrophotométriques
Transféré par
Raphaël RachediTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TP1 (CR+correction) - Initiation Aux Dosages Spectrophotométriques
Transféré par
Raphaël RachediDroits d'auteur :
Formats disponibles
Technologies CPGE TB - Travaux Pratiques
TP n1 Initiation aux dosages spectrophotomtriques
RACHEDI Raphal raphael.rachedi@gmail.com
2011/2012
Technologies CPGE TB - Travaux Pratiques
Objectifs : On cherche dterminer les spectres d'absorbance du PNP (paranitrophnol) et du PNPP (para-nitrophnyl phosphate) dans diffrentes conditions physico-chimiques afin de comprendre comment celles ci influencent les proprits spectrales des diffrents composants tudis, ceci sera trait dans la premire partie du TP. Dans la deuxime partie du TP, on apprhende la loi de Beer-Lambert et ses limites, en effectuant le dosage d'une solution de PNP l'aide d'une gamme d'talonnage.
Partie 1 : Spectres d'absorbance du PNPP et du PNP Principe
Les nitrophnols sont des composes ayant des proprits spectrales intressantes en biochimie, c'est dire qu'ils sont capables d'absorber des photons dans l'UV et/ou le visible On tudie les proprits spectrales de ces composs par spectrophotomtrie. Les molcules sont capables d'absorber de plus grandes gammes de longueurs d'onde que les atomes seuls, la ralisation d'un spectre d'absorbance permet de dterminer les longueurs d'onde pour lesquelles ces composs absorbent, et galement de dterminer max ou maximum d'absorbance qui correspond la longueur d'onde laquelle d'absorbance de la solution est la plus grande.
Mode opratoire
-Prparation de la solution fille de PNP On dispose d'une solution mre Sm de PNP de concentration initiale Ci = 10mmol/L pour prparer une solution fille Sf de concentration finale 0,2mmol/L : T= Cf/Ci = 0.2/10 = 1/50 Donc 2ml de Sm dans une fiole jauge de 100mL. -Prparation des tubes Essai et du tmoin
Essai 1 - 1 mL de PNPP 0,2mmol/L - 1 mL de HCl 0,2mol/L - ED qsp 10 mL. Essai 2 - 1 mL de Sf de PNP 0,2mmol/L - 1 mL de HCl 0,2mol/L - ED qsp 10 mL. Temoin - 1 mL de HCl - ED qsp 10 mL.
-1-
Technologies CPGE TB - Travaux Pratiques
Rsultats exprimentaux
A PNP (nm) A PNPP 200 0,036 210 0,013 220 0,042 230 0,026 240 0,028 250 0 260 0,033 270 0,113 272 0,127 274 0,136 276 0,146 278 0,155 280 0,161 282 0,166 284 0,171 286 0,174 288 0,175 290 0,176 292 0,175 294 0,175 296 0,172 298 0,168
A PNP
(nm) A PNPP 300 0,164 310 0,128 320 0,084 330 0,05 340 0,028 350 0,014 360 0,007 370 0,001 380 0 390 0 400 0 410 0 420 0 430 0 440 0 450 0 460 0 470 0 480 0 490 0 500 0
A PNP
A PNP
(HCl) (NaOH) 0,041 0,039 0,038 0,022 0,048 0,039 0,058 0,032 0,055 0,019 0,005 0 0,037 0 0,072 0,005 0,107 0,006 0,147 0,01 0,18 0,012 0,187 0,017 0,192 0,029 0,196 0,046 0,199 0,071 0,202 0,105 0,203 0,148 0,203 0,199 0,203 0,251 0,201 0,261 0,198 0,268 0,195 0,276
(HCl) (NaOH) 0,19 0,282 0,184 0,286 0,177 0,291 0,171 0,294 0,13 0,296 0,091 0,296 0,056 0,295 0,029 0,293 0,013 0,29 0,005 0,283 0,001 0,277 0 0,269 0 0,212 0 0,147 0 0,088 0 0,044 0 0,018 0 0,004 0 0 0 0 0 0
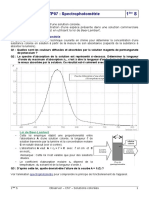
^ Fig.1 Tableau de valeurs
Dtermination graphique des max Le graphique a t ralis l'aide du logiciel Regressi, de plus le spectre d'absorbance du PNP en solution d'hydroxyde de sodium n'a pas t trait en TP mais sera tout de mme abord dans cette partie du compte rendu. < Fig.2 Spectres d'absorption du PNP et de ses drivs
-2-
Technologies CPGE TB - Travaux Pratiques
Interprtation des rsultats :
On remarque sur le graphique qu'a max(PNP forme phnol), le PNPP absorbe galement, si par exemple on dsire tudier la raction que catalyse la phosphatase alcaline (PAL) : PNPP + H2O PNP + Pi en dosant la quantit de produit apparu en fonction du temps, on ne doserais pas seulement le PNP apparu mais galement le PNPP restant en solution. La charge ngative porte par l'oxygne Le couple PNPP/PNP forme phnol ne peut se dlocaliser et modifier la semble pas acceptable pour tudier des polarisation statistique (c'est dire conduire un systme dlocalis) de la ractions enzymatiques. molcule et donc en modifier les proprits spectrales. En revanche, sous forme phnate, le max du PNP est assez loign de celui du PNPP pour faire du couple PNPP/PNP forme Conclusion : phnate un bon candidat l'tude des Les conditions physico-chimiques telles ractions enzymatiques ; que le pH peuvent grandement influencer Cependant pour valider cette hypothse, il les proprits spectrales des molcules en aurait fallu dresser le spectre particulier les molcules dont l'tat d'ionisation dpend du pH. d'absorbance du PNPP en milieu alcalin. On remarque galement que le PNP forme phnol donne une solution incolore contre une solution de couleur jaune pour le PNP forme phnate dans la partie 2. < Fig.4 Structure du PNP forme phnate
Fig.3 > Structure du PNP forme phnol
D'aprs la structure du PNP forme phnol, on peu imaginer qu'en milieu alcalin, l'hydrogne port par la fonction hydroxyle est arrach de faon former PNP- dtaille en Fig.4 . -3-
Technologies CPGE TB - Travaux Pratiques
Partie 2 : Limite de linarit et loi de Beer-Lambert ; Dosage dune solution de PNP de concentration inconnue. Principe
Le dosage spectrophotomtrique d'une substance x (ici le PNP forme phnate) repose sur la loi de Beer-Lambert dclarant que l'absorbance d'un compos en solution une longueur d'onde donne, est proportionnelle sa concentration et lpaisseur de solution traverse (trajet optique). A= .d.C
avec A: Absorbance de la solution : coefficient d'absorbance linique molaire en m.mol-1 d : trajet optique en m C : concentration du (des) solut(s) en mol.m-3
Cependant il y a des conditions la validit de cette loi : lumire monochromatique ; solution limpide et homogne ; concentration faible en solut , laquelle nous intresse ici. On dtermine alors la concentration laquelle la validit de la loi n'est plus vrifie l'aide d'une gamme d'talonnage de solutions de PNP. On dosera ensuite une solution inconnue de PNP, en utilisant cette gamme dtalonnage.
Mode opratoire
Prparation de la gamme dtalonnage du spectrophotomtre : Solution ED qsp Qtt PNP Solution de Tube fille de PNP NaOH A 410nm 10mL en PNP doser 0,2mol/L en mL mol/tube en mL 200mol/L en mL T 1 2 3 4 5 6 7 8 9 E1 E2 0 1 2 3 4 5 6 7 8 9 / / 1 1 1 1 1 1 1 1 1 1 1 1 9 8 7 6 5 4 3 2 1 0 7 7 0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 0,315 0,315 0,000 0,354 0,699 0,989 1,420 1,760 2,024 2,375 2,684 2,934 0,558 0,564 / / / / / / / / / / 2 2
-4-
Technologies CPGE TB - Travaux Pratiques
Rsultats exprimentaux
mol Graphiquement la quantit de PNP de E 1 et de E2 sont trs rapprochs on a donc nPNP(E) = 0,315mol / tube C = n/V C = 0,315/2x10-3 C = 157,5 mol.L-1 Calcul de la concentration massique Cmass en mg.L-1 :
Interprtation des rsultats
Cmass = Cmol x M On observe sur le graphique que pour une valeur de nPNP suprieure Cmol : concentration molaire en mol approximativement 1mol/tube soit M : masse molculaire du PNP- en g.mol-1 1/10x10-3 mol/L = 100mol/L, la courbe -1 cesse dtre linaire et la loi de Beer- et MPNP = 138 g.mol Lambert pour ces quantits n'est plus Cmass = 157,5 x 10-6 x 138 vrifie ; = 21,74 x 10-3 g.L-1 On ne peu donc plus utiliser le graphique = 21,74 mg.L-1 pour dterminer la concentration d'une solution inconnue au del de cette limite. Conclusion En revanche pour nos essais : C = n/V avec C : concentration molaire en mol.L-1 n : nombre de mol en mol V : Volume de prise d'essai en L La loi de Beer-Lambert est une relation linaire dont la proportionnalit entre l'absorbance et la concentration n'est plus vraie lorsque la concentration en solut est trop leve, ici la limite de linarit se trouve environ 1mol/tube. Il faut donc travailler avec des solutions assez dilues de faon se trouver dans la partie linaire de la relation. -5-
Vous aimerez peut-être aussi
- Spectrophotometrie MnO4Document4 pagesSpectrophotometrie MnO4Anaëlle Avril88% (8)
- TP DOSAGE DE Na+ ET K+ PAR EMISSION DE FLAMMEDocument7 pagesTP DOSAGE DE Na+ ET K+ PAR EMISSION DE FLAMMEmojakovich56% (9)
- Dosage Des Phenols Et Des Flavonoides TotauxDocument11 pagesDosage Des Phenols Et Des Flavonoides TotauxImane HaddadouPas encore d'évaluation
- TP03 TaDocument12 pagesTP03 TaManelPas encore d'évaluation
- TP Technique D AnalyseDocument10 pagesTP Technique D AnalyseAhmed YounsiPas encore d'évaluation
- TP SpecroDocument6 pagesTP SpecroNada Limeme100% (2)
- TP de M Thodes Spectrales 3L BIOCHIMIE S6Document43 pagesTP de M Thodes Spectrales 3L BIOCHIMIE S6EL Hassania EL HERRADIPas encore d'évaluation
- TP - Spectroscopie UV-VisibleDocument4 pagesTP - Spectroscopie UV-Visibleelhidhab201488% (8)
- TP 2 Tda L3 GDPDocument3 pagesTP 2 Tda L3 GDPLina alikh100% (2)
- TP de TA en PDFDocument9 pagesTP de TA en PDFSaiid AzPas encore d'évaluation
- TPDocument8 pagesTPKONANPas encore d'évaluation
- n-1 PDFDocument39 pagesn-1 PDFZineb DahmaniPas encore d'évaluation
- Chapitre 2Document19 pagesChapitre 2islam oo100% (1)
- Compte Rendu Biologie MoléculaireDocument19 pagesCompte Rendu Biologie MoléculaireAnia Izariren100% (1)
- TP 2 Dosage Par Etalonnage de L Eau de Dakin EleveDocument5 pagesTP 2 Dosage Par Etalonnage de L Eau de Dakin Elevekarim maziz100% (3)
- TP 02 Dosage Par SpectrophotométrieDocument3 pagesTP 02 Dosage Par SpectrophotométrieleilaPas encore d'évaluation
- Methodes de Dosage Des Proteines 2014Document12 pagesMethodes de Dosage Des Proteines 2014نعيمة جوهريPas encore d'évaluation
- Chromatographie Sur Couche MinceDocument25 pagesChromatographie Sur Couche MinceWinnie AhouhaPas encore d'évaluation
- Coefficient de Partage-CorrigeDocument2 pagesCoefficient de Partage-CorrigeHicham Ishem86% (7)
- Tp9 Suivi Reaction SpectrophotometrieDocument5 pagesTp9 Suivi Reaction Spectrophotometrieالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- TD 1 ChromatographieDocument16 pagesTD 1 Chromatographienassima chenikha0% (1)
- TD Chromatographie en Phase Gazeuse de L3 ProDocument6 pagesTD Chromatographie en Phase Gazeuse de L3 ProRicky Ranaivoson100% (5)
- Compte Rendu BiocDocument7 pagesCompte Rendu BiocMohamed EL AmriPas encore d'évaluation
- Chlorophylle PDFDocument10 pagesChlorophylle PDFsambaPas encore d'évaluation
- Titrage-Acides AminésDocument2 pagesTitrage-Acides Aminéslmd200950% (2)
- C514 TD Serie 5 CORRECTION - 2020-2021Document6 pagesC514 TD Serie 5 CORRECTION - 2020-2021simo Gri100% (2)
- HPLCDocument46 pagesHPLCDjoe LalaounaPas encore d'évaluation
- Corrigé Type de Lexamen de Micro 2017 Final LadjouziDocument3 pagesCorrigé Type de Lexamen de Micro 2017 Final LadjouziRahma100% (1)
- Extractions Et ChromatographiesDocument1 pageExtractions Et ChromatographiesAbderrahime Chikhaoui100% (6)
- Série 9 PR SBIRO AbdelkrimDocument5 pagesSérie 9 PR SBIRO Abdelkrimfouad elferdiPas encore d'évaluation
- TP SpectroDocument11 pagesTP SpectroMelvis LumièrePas encore d'évaluation
- But de TPDocument7 pagesBut de TPvisual and outfits victizmed kim taehyungPas encore d'évaluation
- Corrigé 06Document2 pagesCorrigé 06lmd200975% (4)
- TP FtirDocument10 pagesTP Ftiralexpagora100% (1)
- TP 9 Spectroscopie UV-visibleDocument2 pagesTP 9 Spectroscopie UV-visiblemousse201050% (2)
- Serie6 ExosDocument2 pagesSerie6 Exosrahmani0% (1)
- Photometriedeflamme PDFDocument2 pagesPhotometriedeflamme PDFreda100% (1)
- Série Dexercices 4 - Spectrométrie de MasseDocument4 pagesSérie Dexercices 4 - Spectrométrie de MasseMarius MissiPas encore d'évaluation
- TP La Potentiométrie À Intensité NulleDocument6 pagesTP La Potentiométrie À Intensité NulleHakim KhenichePas encore d'évaluation
- Exercices Corrigés en ChromatographieDocument13 pagesExercices Corrigés en ChromatographiePeti' Pou89% (66)
- TP Technique D'analyseDocument20 pagesTP Technique D'analyseSöû SøùSøú Mîã100% (2)
- Exercices Corrigs de Spectroscopie Infrarouge PDFDocument2 pagesExercices Corrigs de Spectroscopie Infrarouge PDFJeffrey75% (16)
- TP de L'invertaseDocument11 pagesTP de L'invertaseDrissZaoui82% (11)
- TP CCM MASTER 1Document8 pagesTP CCM MASTER 1Mimi lovePas encore d'évaluation
- Fiche TD 2 ChromatographieDocument3 pagesFiche TD 2 ChromatographieANes ツPas encore d'évaluation
- Chapitre III-Spectroscopie D'absorption Dans l'UV-VisibleDocument16 pagesChapitre III-Spectroscopie D'absorption Dans l'UV-VisibleYasmine Jasmine100% (2)
- TP UV VisibleDocument10 pagesTP UV VisibleOuss Ama100% (4)
- Absorption Atomique ExoDocument2 pagesAbsorption Atomique ExoZahra l زهرة67% (3)
- Compte Rendu TP PhosphataseDocument7 pagesCompte Rendu TP PhosphatasebesmaPas encore d'évaluation
- (PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2Document17 pages(PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2RastatePas encore d'évaluation
- (PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2 PDFDocument17 pages(PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2 PDFRastatePas encore d'évaluation
- TD RMN - 050302Document5 pagesTD RMN - 050302christmik286Pas encore d'évaluation
- Correction DST12015 16Document4 pagesCorrection DST12015 16cavabPas encore d'évaluation
- TP GENIE ENZYMATIQUE MAGBioDocument12 pagesTP GENIE ENZYMATIQUE MAGBioKHAOULAPas encore d'évaluation
- Chimie Baccalaureat Blanc N°2 - Session de Mai 2017Document5 pagesChimie Baccalaureat Blanc N°2 - Session de Mai 2017Junior NoulaPas encore d'évaluation
- Beis07-F Alp 2015Document1 pageBeis07-F Alp 2015Yacine YacinePas encore d'évaluation
- TP BiochDocument31 pagesTP BiochRoberta Vasques100% (3)
- Bts Tass 2011Document10 pagesBts Tass 2011Feroudja Taoues100% (1)
- Cours Sur La PotentiometrieDocument5 pagesCours Sur La PotentiometrieT3x_M3xPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- 1 - MOUVEMENT - Rotation - Exp - Et - SM PDFDocument4 pages1 - MOUVEMENT - Rotation - Exp - Et - SM PDFAzizElheni100% (1)
- Physique QuantiqueDocument23 pagesPhysique QuantiqueFabienPas encore d'évaluation
- Crison - PH PDFDocument2 pagesCrison - PH PDFmeriem ouaPas encore d'évaluation
- 5 - Intro Raman PDFDocument20 pages5 - Intro Raman PDFDjalal DaouiPas encore d'évaluation
- Calcul PDC Vitesse PuissanceDocument11 pagesCalcul PDC Vitesse PuissanceAbdoul Fatré KienouPas encore d'évaluation
- On Représente Un Système Mécanique ComplexeDocument3 pagesOn Représente Un Système Mécanique ComplexeAnonymous mBFHVAVxpPas encore d'évaluation
- TP N°2 Schéma D'installation PID PDFDocument5 pagesTP N°2 Schéma D'installation PID PDFchaima gasmiPas encore d'évaluation
- CCF T3 SciencesDocument4 pagesCCF T3 SciencesBouallegue MounirPas encore d'évaluation
- Chapitre 2 Controle US Docs Etudiants SiteDocument20 pagesChapitre 2 Controle US Docs Etudiants SiteAlemPas encore d'évaluation
- TDDocument2 pagesTDSohirSohirPas encore d'évaluation
- User Guide Residencia 3Document60 pagesUser Guide Residencia 3redo80Pas encore d'évaluation
- Lettre de Motivation 3Document2 pagesLettre de Motivation 3Diany Pau T H100% (5)
- Ue 55p Travaux PratiquesDocument82 pagesUe 55p Travaux PratiquesSouhaib LoudaPas encore d'évaluation
- EMD1Document6 pagesEMD1Amada TarekPas encore d'évaluation
- Livre Blanc Efficacite Energetique Des MachinesDocument16 pagesLivre Blanc Efficacite Energetique Des MachinesFx EtaixPas encore d'évaluation
- Optique AdaptativeDocument7 pagesOptique AdaptativeMoustafa KOULOUGHLIPas encore d'évaluation
- Dalles Et Escalier Préfab en B-A PDFDocument17 pagesDalles Et Escalier Préfab en B-A PDFRedouane TebbounePas encore d'évaluation
- PFEDocument23 pagesPFEKebciAdlenPas encore d'évaluation
- TD 8 Math PAPPDocument3 pagesTD 8 Math PAPPHaithem AminePas encore d'évaluation
- Chap 1 S3Document26 pagesChap 1 S3MomoBjPas encore d'évaluation
- Les PortraitsDocument18 pagesLes Portraitsricochet67Pas encore d'évaluation
- Robotique Ch4 PDFDocument35 pagesRobotique Ch4 PDFDoaa RachdiPas encore d'évaluation
- Série 7 Physique Changement Des États PhysiquesDocument3 pagesSérie 7 Physique Changement Des États PhysiquesSamou_haa100% (4)
- Fonction Affine 2Document2 pagesFonction Affine 2vivianesezinePas encore d'évaluation
- Irdh575 D00089 M XXFRDocument96 pagesIrdh575 D00089 M XXFRMh BengrinePas encore d'évaluation
- C2 120FR022007Document24 pagesC2 120FR022007Alfredho ShactarPas encore d'évaluation