Académique Documents
Professionnel Documents
Culture Documents
Cuadro Comparatico
Transféré par
Marceline Áerys PledgeTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Cuadro Comparatico
Transféré par
Marceline Áerys PledgeDroits d'auteur :
Formats disponibles
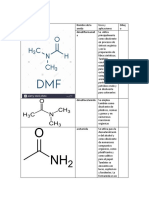
Nombre Amina
amida
Definicin Las aminas son compuestos qumicos orgnicos que se consideran como derivados del amonaco y resultan de la sustitucin de los hidrgenos de la molcula por los radicales alquilo. Compuesto orgnico que consiste en una Amina unida a un Acido Carboxlico convirtindose en una Amina acida (o amida).
Nomenclatura Se nombran cambiando la terminacin -oico del cido carboxlico por -amida. El grupo amida unido a ciclos se denomina carboxamida y como sustituyente carbamol.
Propiedades fsicas Las aminas son compuestas altamente polares. Las aminas primarias y secundarias pueden formar puentes de hidrgeno intramoleculares en el estado lquido y por tanto tienen puntos de ebullicin mayores que los alcanos de peso molecular equivalente. Una caracterstica de las aminas de bajo peso molecular es su olor a pescado, que en cierta medida es distintivo.
Propiedades qumicas Las aminas se comportan como bases. Cuando una amina se disuelve en agua, acepta un protn formando un ion alquil-amonio.
Regla 1. Las amidas se nombran como derivados de cidos carboxlicos sustituyendo la terminacin -oico del cido por amida. Regla 2. Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehdos y nitrilos. Regla 3. Las amidas actan como sustituyentes cuando en la molcula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamol
El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida (p.f.=2.5 C), sean todas slidas y solubles en agua. Sus puntos de ebullicin son bastante ms altos que los de los cidos correspondientes, debido a una gran asociacin intermolecular a travs de enlaces de hidrgeno, entre el oxgeno negativo y los enlaces NH, mucho ms polarizados que en las aminas. Los puntos de fusin y de ebullicin de las amidas secundarias son bastante menores, debido principalmente al impedimento estrico del radical unido al nitrgeno para la asociacin. Como es natural, las amidas terciarias (sin enlaces NH) no pueden asociarse, por lo que son lquidos normales, con puntos de fusin y de ebullicin de acuerdo con su peso molecular.
teres
ter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el tomo de oxgeno unido y se emplean pasos intermedios: ROH + HOR' ROR' + H2O Normalmente se emplea el alcxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte.
Deben nombrarse como alcoxialcanos, es decir, como si fueran sustituyentes. Se debe especificar al grupo funcional ter como de menor prioridad frente a la mayora de cadenas orgnicas. Cada radical ter ser acompaado por el sufijo oxi.
El ter metlico (P.e. -24C) y el ter metil etlico (P.e. 8C) son gases a temperatura normal. Ya el ter etlico (P.e. 35C) es un lquido muy voltil. Los teres con cadenas carbonadas mayores van teniendo mayor punto de ebullicin a medida que aumenta la longitud de la cadena. Los teres de cadena recta tienen un punto de ebullicin bastante similar a los alcanos con peso molecular comparable. Por ejemplo: el ter C2-H5-O-C2-H5, con peso molecular 74 tiene un punto de ebullicin de 35C, y el alcano CH3-CH2-CH2CH2-CH3 de peso molecular 72 tiene un punto de ebullicin de 36C. Los teres tienen una solubilidad en agua comparable con los alcoholes para peso molecular similar, as el ter C2-H5-O-C2H5 tiene la misma solubilidad que el alcohol CH3-CH2-CH2CH2-OH unos 8g/100ml de agua a 25C.
Basicidad Las amidas son solo muy dbilmente bsicas, debido a la interaccin mesmera entre el doble enlace carbonlico y el par de electrones del tomo de nitrgeno. La carga positiva parcial que resulta sobre el tomo de nitrgeno disminuye muchsimo su basicidad y la protonacin de las amidas que solo tiene lugar, de manera significativa en condiciones fuertemente cidas, ocurre sobre el tomo de oxgeno, ya que as la carga del catin resultante queda deslocalizada, lo que ocurrira si el catin se formase por protonacin del nitrgeno Hidrlisis cida de las amidas La hidrlisis cida de las amidas primarias produce cido orgnico libre y una sal de amonio. Las amidas secundarias y terciarias producen el correspondiente cido y una sal de amonio cuaternario Hidrlisis bsica de las amidas La hidrlisis bsica de las amidas produce una sal de cido orgnico y amonaco o aminas, segn el tipo de amida Los teres tienen muy poca reactividad qumica, debido a la dificultad que presenta la ruptura del enlace CO. Por ello, se utilizan mucho como disolventes inertes en reacciones orgnicas. En contacto con el aire sufren una lenta oxidacin en la que se forman perxidos muy inestables y poco voltiles. Estos constituyen un peligro cuando se destila un ter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el ter con hilo de sodio o aadiendo una pequea cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilacin.
Esteres
son compuestos orgnicos derivados de cidos orgnicos o inorgnicos oxigenados en los cuales uno o ms protones son sustituidos por grupos orgnicos alquilo
Los steres proceden de condensar cidos con alcoholes y se nombran como sales del cido del que provienen. La nomenclatura IUPAC cambia la terminacin -oico del cido por -oato, terminando con el nombre del grupo alquilo unido al oxgeno. Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehdos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el ster el grupo funcional. cidos carboxlicos y anhdridos tienen prioridad sobre los steres, que pasan a nombrarse como sustituyentes. Cuando el grupo ster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminacin carboxilato de alquilo para nombrar el ster.
Los steres pueden participar en los enlaces de hidrgeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrgeno les convierte en ms hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrgeno los hace ms hidrofbicos que los alcoholes o cidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrgeno ocasiona el que no pueda formar enlaces de hidrgeno entre molculas de steres, lo que los hace ms voltiles que un cido o alcohol de similar peso molecular. Los steres tambin participan en la hidrlisis esterica: la ruptura de un ster por agua. Los steres tambin pueden ser descompuestos por cidos o bases fuertes. Como resultado, se descomponen en un alcohol y un cido carboxlico, o una sal de un cido carboxlico
En las reacciones de los steres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxgeno y el alcohol o R, ya sea entre el oxgeno y el grupo R-CO, eliminando as el alcohol o uno de sus derivados. La saponificacin de los steres, llamada as por su analoga con la formacin de jabones, es la reaccin inversa a la esterificacin. Los steres se hidrogenan ms fcilmente que los cidos, emplendose generalmente el ster etlico tratado con una mezcla de sodio y alcohol (Reduccin de Bouveault-Blanc). El hidruro de litio y aluminio reduce steres de cidos carboxlicos para dar 2 equivalentes de alcohol.2 La reaccin es de amplio espectro y se ha utilizado para reducir diversos steres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietilborhidruro de litio o BH3 SiMe3 reflujado con THF. El dicloruro de titanoceno reduce los steres de cidos carboxlicos hasta el alcano (RCH3) y el alcohol R-OH.4 El mecanismo probablemente se debe a la formacin de un alqueno intermediario. El hidrgeno de muchos steres puede ser sustrado con una base no nucleoflica o el alcxido correspondiente al ster. El carbanin generado puede unirse a diversos sustratos en diversas reacciones de condensacin, tales como la condensacin de Claisen, la Condensacin de Dieckmann y la sntesis malnica. Muchos mtodos de sntesis de anillos heterocclicos aprovechan estas propiedades qumicas de los steres, tales como la sntesis de pirroles de Hantzsch y la sntesis de Feist-Benary. Existen reacciones de condensacin en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensacin acilonica. Los steres pueden dar alcoholes con dos sustituyentes idnticos por adicin de reactivos de Grignard. Una aplicacin de esta reaccin es la reaccin de Fujimoto-Belleau.
Vous aimerez peut-être aussi
- Práctica 1. Catalasa y Alfa-AmilasaDocument9 pagesPráctica 1. Catalasa y Alfa-AmilasaSandra SantosPas encore d'évaluation
- Usos y Aplicaciones de Las AmidasDocument3 pagesUsos y Aplicaciones de Las Amidasjuan diego lopez andradePas encore d'évaluation
- Cuadro Comparativo de GenomicaDocument3 pagesCuadro Comparativo de GenomicaSarah_1DPas encore d'évaluation
- Regla de MarkovnikovDocument7 pagesRegla de MarkovnikovFLORES05Pas encore d'évaluation
- 2.4. Volumetría en Reacciones de Formación de Precipitados.: RapidezDocument8 pages2.4. Volumetría en Reacciones de Formación de Precipitados.: RapidezALPHAPas encore d'évaluation
- CONSULTA Acido y BasesDocument7 pagesCONSULTA Acido y BasesDaniela AlejandroPas encore d'évaluation
- PLASTIDIOSDocument4 pagesPLASTIDIOSMayraTgPas encore d'évaluation
- Diagrama de Flujo Cromatografia - Diagrama de FlujoDocument1 pageDiagrama de Flujo Cromatografia - Diagrama de FlujoJosé Daniel Botina100% (1)
- Biomolculas Cuadro Comparativo PDFDocument1 pageBiomolculas Cuadro Comparativo PDFEmanuel Eduardo Hernandez EstradaPas encore d'évaluation
- Informe Practica LipidosDocument4 pagesInforme Practica LipidosjessaminPas encore d'évaluation
- Clasificacion de Los Metodos VolumetricosDocument1 pageClasificacion de Los Metodos VolumetricosGustavo DíazPas encore d'évaluation
- Caracteristicas de Los Enlaces QuimicosDocument2 pagesCaracteristicas de Los Enlaces QuimicosGabriel67% (3)
- Contaminantes InorganicosDocument28 pagesContaminantes InorganicoskarinaPas encore d'évaluation
- Caracteristicas de Las CetonasDocument2 pagesCaracteristicas de Las CetonasMaría Paula Caicedo100% (1)
- ¡Compuestos Organicos Introduccion y ConclusionDocument1 page¡Compuestos Organicos Introduccion y ConclusionAna Rincón50% (2)
- Cuadro SinopticoDocument1 pageCuadro SinopticoMark Cabrera100% (2)
- Cuadro Comparativo de Las Biomoleculas 2012 PDFDocument3 pagesCuadro Comparativo de Las Biomoleculas 2012 PDFJoa Alarcón100% (1)
- Mapa ConceptualDocument1 pageMapa ConceptualCarlosPas encore d'évaluation
- Identificación Del Nucleo CelularDocument8 pagesIdentificación Del Nucleo Celular.:("*"BLacK BuLLeT"*"):.75% (4)
- CaracteristicasyclasificaciondealgasDocument20 pagesCaracteristicasyclasificaciondealgasMARIA ALANOCA100% (1)
- Importancia de La Química Analítica.Document1 pageImportancia de La Química Analítica.reyser2001100% (1)
- Laboratorio de Organica IDocument16 pagesLaboratorio de Organica ITaniaOréToribio67% (3)
- Glosario de GlucolisisDocument4 pagesGlosario de GlucolisisClaudia Rodriguez0% (1)
- EnzimasDocument8 pagesEnzimasMARÍA VEGAPas encore d'évaluation
- CUESTIONARIODocument36 pagesCUESTIONARIOEduardo HernandezPas encore d'évaluation
- Diferencia Entre ADN y ARN - Diferenciador PDFDocument1 pageDiferencia Entre ADN y ARN - Diferenciador PDFJuan Pablo Perilla DiazPas encore d'évaluation
- Informe de Bioquimica PDFDocument4 pagesInforme de Bioquimica PDFValentina Ramírez100% (1)
- 10 Ejemplos de VulgarismoDocument4 pages10 Ejemplos de VulgarismoMarvin Ivan GutierrezPas encore d'évaluation
- Lípidos InsaponificablesDocument1 pageLípidos InsaponificablescarlosPas encore d'évaluation
- La Catalasa y La Peroxidasa Son La Misma CosaDocument2 pagesLa Catalasa y La Peroxidasa Son La Misma CosaEamc Massen100% (1)
- Reacciones IonicasDocument28 pagesReacciones IonicasMagali Isabel Pineda CamposPas encore d'évaluation
- Alquinos de Importancia IndustrialDocument4 pagesAlquinos de Importancia IndustrialAndrea Bedoya VasquezPas encore d'évaluation
- Observaciones y Resultados - LaboratorioDocument4 pagesObservaciones y Resultados - LaboratorioAli Giselle MaldonadoPas encore d'évaluation
- Digestión de Proteínas Y CONCLUSIONESDocument2 pagesDigestión de Proteínas Y CONCLUSIONESLuis Daniel60% (5)
- Sintesis de BiomoleculasDocument2 pagesSintesis de BiomoleculasDaleyla De La EspadaPas encore d'évaluation
- Marco TeoricoDocument8 pagesMarco TeoricoSebastian AlmeidaPas encore d'évaluation
- Azul de TimolDocument4 pagesAzul de TimolLaura Giraldo EscobarPas encore d'évaluation
- Investigacion CationesDocument16 pagesInvestigacion CationesVane QuintanaPas encore d'évaluation
- Informe Identificacion de AlcoholesDocument9 pagesInforme Identificacion de AlcoholesNicolas Carvajal Quintana100% (1)
- Informe GlucidosDocument4 pagesInforme Glucidosleidy natalia rosero flor75% (4)
- Enlaces Quimicos - Reporte EscritoDocument22 pagesEnlaces Quimicos - Reporte EscritoIRLANDAPas encore d'évaluation
- Mapa Conceptual Transcripcion ProcariotasDocument3 pagesMapa Conceptual Transcripcion ProcariotasLuz Teresa MartinezPas encore d'évaluation
- Introducción de Glucidos - PolisacaridosDocument1 pageIntroducción de Glucidos - PolisacaridosKevin Quispe Aliaga100% (1)
- Cuadro Comparativo 736452 Gerson CasanovaDocument2 pagesCuadro Comparativo 736452 Gerson CasanovaJuan David Casanova100% (3)
- Ensayo Números de OxidaciónDocument4 pagesEnsayo Números de OxidaciónMariana Ortiz Hernández100% (2)
- Reto Práctica 4Document2 pagesReto Práctica 4Pérez Tapia Mariana LizethPas encore d'évaluation
- Métodos de Preparación y Análisis de AminasDocument2 pagesMétodos de Preparación y Análisis de AminasMónica Hidalgo100% (2)
- Regulación MolecularDocument1 pageRegulación MolecularJorge AugustoPas encore d'évaluation
- METABOLISMO Aminoacidos.Document30 pagesMETABOLISMO Aminoacidos.ANDREA MILENA PRADA YARAPas encore d'évaluation
- Genes, Alelos, Herencia, CromosomasDocument6 pagesGenes, Alelos, Herencia, CromosomasClara ZabalaPas encore d'évaluation
- IMPACTO de Los Halogenos en El Medio AmbienteDocument5 pagesIMPACTO de Los Halogenos en El Medio AmbienteClaudia Sofia Dongo Sovero100% (3)
- Juicio Moral y EticoDocument10 pagesJuicio Moral y EticoJairo LasarinPas encore d'évaluation
- Historia de Los Métodos AnalíticoDocument3 pagesHistoria de Los Métodos AnalíticoAdrian Alberto López Cen33% (3)
- Halogenuros y AlcoholesDocument19 pagesHalogenuros y AlcoholesJose Alfredo RendonPas encore d'évaluation
- Articulo Cientifico Valoración de SolucionesDocument5 pagesArticulo Cientifico Valoración de SolucionesL Angel SanchezPas encore d'évaluation
- Distribución y Transporte de ProteínasDocument41 pagesDistribución y Transporte de ProteínasJhonny Ponce Agui100% (2)
- Sistemas Dispersos Mapa ConceptualDocument1 pageSistemas Dispersos Mapa ConceptualEduardo Maximo XD Hipolito Gutierrez100% (2)
- Macromoléculas de Los AlimentosDocument104 pagesMacromoléculas de Los Alimentosazura1950% (2)
- Compuestos OxigenadosDocument12 pagesCompuestos OxigenadosYohitza Galviz De PradaPas encore d'évaluation
- Funciones OxigenadasDocument26 pagesFunciones OxigenadasJasmin VegaPas encore d'évaluation
- Entrevista ComunicacionDocument2 pagesEntrevista ComunicacionMarceline Áerys PledgePas encore d'évaluation
- Metabolismo en Los Lípidos 2Document25 pagesMetabolismo en Los Lípidos 2Marceline Áerys PledgePas encore d'évaluation
- Proceso de TransporteDocument17 pagesProceso de TransporteMarceline Áerys PledgePas encore d'évaluation
- VitaminasDocument37 pagesVitaminasMarceline Áerys PledgePas encore d'évaluation
- ESTERILIZACIONDocument34 pagesESTERILIZACIONMarceline Áerys PledgePas encore d'évaluation
- Metabolismo EnergeticoDocument25 pagesMetabolismo EnergeticoMarceline Áerys PledgePas encore d'évaluation
- Cotización CTDocument3 pagesCotización CTMarceline Áerys PledgePas encore d'évaluation
- El Discurso Del ReyDocument1 pageEl Discurso Del ReyMarceline Áerys PledgePas encore d'évaluation
- Placenta y Anexos EmbrionariosDocument19 pagesPlacenta y Anexos EmbrionariosMartha Eugenia Pavòn AlvaradoPas encore d'évaluation
- Sueroterapia FluidoterapiaDocument8 pagesSueroterapia FluidoterapiaFabiola AlfaroPas encore d'évaluation
- Retraso MentalDocument7 pagesRetraso MentalMarceline Áerys PledgePas encore d'évaluation
- Plan de EstudiosDocument2 pagesPlan de EstudiosMarceline Áerys PledgePas encore d'évaluation
- Cotización CTDocument3 pagesCotización CTMarceline Áerys PledgePas encore d'évaluation
- Neofax en Español 18edDocument375 pagesNeofax en Español 18edMario montenegro dd100% (15)
- Planes de Cuidados Enfermer@s Estandarizados en Atención PrimariaDocument151 pagesPlanes de Cuidados Enfermer@s Estandarizados en Atención Primariaarlenago27Pas encore d'évaluation
- OXIGENOTERAPIADocument10 pagesOXIGENOTERAPIAMarceline Áerys PledgePas encore d'évaluation
- Rehabilitacion RespiratoriaDocument38 pagesRehabilitacion RespiratoriaMarcelo HorstmeierPas encore d'évaluation
- Neofax en Español 18edDocument375 pagesNeofax en Español 18edMario montenegro dd100% (15)
- GerontogeriatriaDocument8 pagesGerontogeriatriaMarceline Áerys PledgePas encore d'évaluation
- AclsDocument25 pagesAclsMarceline Áerys PledgePas encore d'évaluation
- John Dewey PreguntasDocument1 pageJohn Dewey PreguntasMarceline Áerys PledgePas encore d'évaluation
- Fri TurasDocument2 pagesFri TurasMarceline Áerys PledgePas encore d'évaluation
- Consentimiento InformadoDocument33 pagesConsentimiento InformadoMarceline Áerys PledgePas encore d'évaluation
- Planes de Cuidados Enfermer@s Estandarizados en Atención PrimariaDocument151 pagesPlanes de Cuidados Enfermer@s Estandarizados en Atención Primariaarlenago27Pas encore d'évaluation
- Trabajo GabyDocument2 pagesTrabajo GabyMarceline Áerys PledgePas encore d'évaluation
- AlzhimerDocument21 pagesAlzhimerMarceline Áerys Pledge100% (1)
- SARADocument3 pagesSARASebastian SierraPas encore d'évaluation
- ExairDocument17 pagesExaircarkarmarper 4.0Pas encore d'évaluation
- Actividades - 3º Eso - Física y Química - Pmar - 18-19 PDFDocument9 pagesActividades - 3º Eso - Física y Química - Pmar - 18-19 PDFmiscosasPas encore d'évaluation
- Medicion de Caudal y Calibración de RotámetrosDocument28 pagesMedicion de Caudal y Calibración de RotámetrosMaxi I. Céspedes GonzalesPas encore d'évaluation
- Empresas PetrolerasDocument3 pagesEmpresas PetrolerasDanilo Riofrío PadillaPas encore d'évaluation
- ABSTRACTDocument5 pagesABSTRACTkavia pamela trejo alayoPas encore d'évaluation
- Anexo 4 - Solidez de Los Agregados Frente A La Acción de Soluciones de Sulfato de Sodio o de Magnesio (I.n.v. E - 220)Document4 pagesAnexo 4 - Solidez de Los Agregados Frente A La Acción de Soluciones de Sulfato de Sodio o de Magnesio (I.n.v. E - 220)Liliana PaezPas encore d'évaluation
- Placa de FloculcionDocument2 pagesPlaca de FloculcionDaniela Valencia CanoPas encore d'évaluation
- Programa de Proteccion RespiratoriaDocument20 pagesPrograma de Proteccion RespiratoriaMilexa Maribel CarrilloPas encore d'évaluation
- Simulacion de Un Tren de DestilacionDocument14 pagesSimulacion de Un Tren de DestilacionKaren Gonzalez SPas encore d'évaluation
- Proceso 201603986 Notificacion Por Aviso No.2018001163 18-07-2017 Fecha de Publicacion 23-07-2017Document93 pagesProceso 201603986 Notificacion Por Aviso No.2018001163 18-07-2017 Fecha de Publicacion 23-07-2017jonh gutierrezPas encore d'évaluation
- Tecnicas de Muestreo para El Control MicrobiologicoDocument34 pagesTecnicas de Muestreo para El Control MicrobiologicoAlexandry Ocas JaraPas encore d'évaluation
- Medios Dirigidos: CablesDocument21 pagesMedios Dirigidos: CablesJaime Ulises RicoPas encore d'évaluation
- Libro de InstruccionesDocument128 pagesLibro de InstruccionesDmitryPas encore d'évaluation
- Losa Colaborante FinalDocument12 pagesLosa Colaborante FinalGianella BrendaPas encore d'évaluation
- Trabajo de Construccion Parte 1Document158 pagesTrabajo de Construccion Parte 1Christian CastroPas encore d'évaluation
- Mapa ConceptualDocument1 pageMapa ConceptualJuanma Rodriguez PlazasPas encore d'évaluation
- La Química y La CocinaDocument2 pagesLa Química y La CocinaSteven Nuñez0% (1)
- Guia de Estudio Seres VivosDocument32 pagesGuia de Estudio Seres VivosElGrillotx Tex MexPas encore d'évaluation
- Clase Sesión 24-25 Señalización IntracelularDocument35 pagesClase Sesión 24-25 Señalización IntracelularKhaterin CartesPas encore d'évaluation
- Cutura MochicaDocument11 pagesCutura MochicalucyaPas encore d'évaluation
- Tanque AtmosfericoDocument7 pagesTanque AtmosfericogladysPas encore d'évaluation
- Hydropower-Plus CLJ PDFDocument24 pagesHydropower-Plus CLJ PDFivan vuskovicPas encore d'évaluation
- Informe - VidriosDocument53 pagesInforme - VidriosMIRIAN ESTHER ROJAS LOZANOPas encore d'évaluation
- Insectrina 20 EC SegDocument4 pagesInsectrina 20 EC SegNaith MendezPas encore d'évaluation
- Tratamiento Con MTA en Molar Temporal Con Perforación en Furca y Reabsorción RadicularDocument4 pagesTratamiento Con MTA en Molar Temporal Con Perforación en Furca y Reabsorción RadicularJavier Farias VeraPas encore d'évaluation
- G - Jorge Alberto NiemetzDocument41 pagesG - Jorge Alberto Niemetzhector_ricardez09Pas encore d'évaluation
- Recuperacion MetalurgicaDocument14 pagesRecuperacion MetalurgicaSirThóny Marcelo RojasPas encore d'évaluation
- Electrometalurgia HuereDocument14 pagesElectrometalurgia HuereAlexander Wilfredo Tomas VelasquezPas encore d'évaluation
- Crucigrama BiologicosDocument5 pagesCrucigrama BiologicosRuben FonsecaPas encore d'évaluation