Académique Documents
Professionnel Documents
Culture Documents
Calor latente hielo
Transféré par
Delcys K. PazTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Calor latente hielo
Transféré par
Delcys K. PazDroits d'auteur :
Formats disponibles
REPBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DEPARTAMENTO DE QUMICA UNIDAD ACADEMICA DE FISICOQUMICA
MEDIDA DEL CALOR LATENTE DE FUSIN DEL HIELO.
Presentado por: Br. Renny Ochoa C.I. N 21.075.714
Maracaibo, julio de 2011
2 RESUMEN En la prctica se se determino que su capacidad calorfica de un calormetro (139,52 J/K), con dicho calormetro se determino el calor latente de fusin del hielo. Para ello se agrego dentro del recipiente del calormetro 50g de agua ligeramente caliente y se midi su temperatura. Luego se agrego pequeas cantidades de hielo y se agito hasta estabilizar. Se tomo la temperatura en equilibrio del agua con el hielo fundido. La experiencia se repiti con distintas cantidades de hielo picado. El H fusin del hielo obtenido fue de 463,23 kJ/kg con un error de 38,75%. Y un S de 21,56 J/K para el proceso.
INTRODUCCIN Es frecuente que una sustancia experimente un cambio de temperatura cuando se transfiere energa entre ella y su entorno. Hay situaciones, sin embargo, en las que la transferencia de energa no resulta en un cambio de temperatura. Este es el caso siempre que las caractersticas fsicas de la sustancia cambien de una forma a la otra; este cambio se conoce comnmente como cambio de fase. Estos cambios comprenden un cambio en energa interna, pero ningn cambio de temperatura. Como es de esperarse, diferentes sustancias responden de manera diferente a la suma o retiro de energa cuando cambian de fase porque varan sus distribuciones moleculares internas. Del mismo modo, la cantidad de energa transferida durante un cambio de fase depende de la cantidad de sustancia de que se trate. 1 La cantidad de calor por unidad de masa transferido durante un cambio de fase se llama calor latente (smbolo L) del proceso. El calor total transferido en un cambio de fase es entonces: Q = Lm Donde m es la masa de la muestra que cambia de fase. El calor transferido durante la fusin o la congelacin se llama calor de fusin (smbolo Lf).2 Ya que la entalpia se define como una funcin de estado extensiva que se utiliza para medir el calor absorbido o liberado por un sistema durante un proceso a presin
3 constante3. El total transferido durante el cambio de fase se conoce como entalpia de fusin. Para el caso de la fusin del hielo dentro de un calormetro adiabtico, la suma de los calores absorbidos y transferidos dentro del sistema es: Q1 + Q2 + Q3 + Q4= 0 Donde Q1 es igual al calor absorbido por el calormetro, Q2 calor absorbido por el hielo para el cambio de fase, y Q3 es el calor absorbido por el agua que proviene del hielo fundido y Q4 es el calor cedido por el agua caliente. Conociendo el calor especfico para el agua lquida, y para el agua en estado (solido), se determino la capacidad calorfica de un calormetro adiabtico y a su vez el calor latente para el proceso de fusin del hielo.
PARTE EXPERIMENTAL Para la prctica se arm un calormetro adiabtico. En el vaso interno del calormetro se agregaron 50mL de agua destilada a temperatura ambiente (agua fra) medidos con un cilindro graduado. Se tapo el calormetro y se dejo reposar para estabilizar la temperatura dentro del mismo, se anoto la temperatura inicial (T1). Luego se midieron 50mL de agua caliente y se midi su temperatura (T2), inmediatamente se agrego el agua caliente al recipiente interno del calormetro, cual previamente contena el agua fra. Se tapo el calormetro y se agito durante 2 min para estabilizar la temperatura del agua dentro del recipiente. Con el termmetro se midi la temperatura en equilibrio del agua dentro del calormetro (Te). El procedimiento se repiti 2 veces mas con diferentes mezclas de agua caliente y fra las cuales fueron: a) 70mL de agua fra con 30mL de agua caliente; b) 60mL de agua fra con 40mL de agua caliente.
4 Luego se agrego en el recipiente interno del calormetro 50 mL de agua ligeramente caliente (30 C aproximadamente), se cerr el calormetro, y se anoto la temperatura inicial luego de estabilizada. Se tomaron varios cubos de hielo y se trituraron y secaron. Al calormetro con agua caliente se le agregaron pequeas cantidades de hielo picado, se tapo y se agito durante 2 min hasta haberse fundido totalmente el hielo. Se anoto la temperatura final (asegurando que Tf >0 C) y se agrego la cantidad de agua total, la inicial mas la del hielo fundido, en un cilindro graduado y calculando la diferencia entre el volumen inicial de agua y el volumen final, se determino la cantidad de hielo agregado al calormetro. Esta experiencia se repiti 3 veces ms utilizando agregando diferentes cantidades de hielo, siempre tomando en cuenta que Tf >0 C.
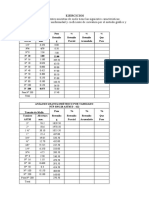
RESULTADOS Y DISCUSIN En la Tabla 1 se observan los valores de la capacidad calorfica del calormetro utilizando los datos obtenidos en la experiencia, masa de agua fra, masa de agua caliente, las cuales fueron obtenidas a partir del volumen de agua medido y asumiendo la densidad del agua 1 g/mL, las temperaturas tanto del agua fra como del agua caliente, y la temperatura en equilibrio de la mezcla de ambas dentro del calormetro. Para ver la tabla de datos de las temperaturas obtenidas, y los detalles de los clculos ir a anexos 1 y 3. El valor obtenido para la capacidad calorfica del calormetro obtuvo un coeficiente de variacin bastante alto, la diferencia de valores entre las experiencias puede ser explicada por errores personales que son los ms comunes dentro de un laboratorio, otra de las posibles causas es que no hubo concordancia entre las temperaturas de agua fra y de agua caliente entre los 3 ensayos, y como tambin para el clculos se utilizo la aproximacin de la densidad del agua a 1g/mL. Para obtener un clculo ms fiable se debi utilizar un entorno totalmente adiabtico, algo que en la prctica es casi imposible cumplir a cabalidad.
5 Tabla 1 Capacidades calorficas del calormetro adiabtico a diferentes temperaturas Ensayo
Capacidad Calorifica (J.K-1) Capacidad Calorifica (Cal .K-1)
Desviacion Estandar
Coeficiente de Variacion
1 2 3
44,81 139,45 234,30
Promedio=139,52
10,71 33,33 56
Promedio= 33,35
22,64
67,90%
Con el valor de la capacidad calorfica del calormetro presente en la tabla 1 se calculo el valor experimental de H de fusin del hielo y se comparo con un H tabulado. Tambin se calculo el valor de la entropa (S) para dicho proceso. Para ms detalles ir a anexos 2, 4 y 5. Los resultados se presentan a continuacin en la tabla 2:
Tabla 2 Valores obtenidos experimentalmente de H y S para el proceso de fusin del hielo.
Ensayo Hf (Cal/ g) Hf (kJ/kg) Hf Tabulado4 (kJ/kg) 1 2 3 4 Promedio 107,59 106,51 112,37 116,79 110,84 450,16 444,17 470,16 488,65 463,29 333,89 38,75% % Error S del proceso(J/K) 23,08 24,40 15,50 23,26 21,56
6 Como se puede observar en los resultados de la tabla 2 todos los valores de H para los ensayos de la fusin del hielo dan valores positivos. As como tambin los valores de la entropa dan positivos. Estos valores explican l porque para fundir el hielo hay que aplicar calor (proceso endotrmico), as como el valor de la entropa explica la fluidez de los lquidos y el porqu ellos se mueven mucho ms libremente que los slidos (un grado de desorden molecular mayor). La diferencia entre los valores experimentales y el valor terico puede deberse a muchas causas. La ms factible es el sistema del calormetro, que no es totalmente adiabtico, por pequeos orificios en la zona del agitador, o del termmetro pudo haber intercambio de calor con el exterior. Otros errores atribuibles son que el hielo no estuviera totalmente seco, la temperatura del hielo estuviera por debajo de los 0 C, incertidumbre del instrumento para medir el volumen de agua y el volumen del hielo, o la masa de agua y hielo dada por la aproximacin de la densidad a 1g/mL.
CONCLUSIONES Se determino el calor latente de fusin del hielo con un valor de 463,29 kJ/kg con un error de 38,75% con respecto al valor tabulado. La entropa para el proceso de fusin del hielo fue de 21,56 J/K El error obtenido en la experiencia fue por errores personales, de mtodo e instrumentales, en conjunto. El proceso de fusin del hielo es de naturaleza endotrmica. En el estado liquido el agua tiene mayor desorden molecular con respecto al estado slido. Algunas recomendaciones para la prctica son: utilizar instrumentos de mayor precisin para la medicin de volmenes, tomar en cuenta las densidades del agua a las temperaturas con la cual se trabajo, y a su vez asegurarse de tapar lo mejor posible los orificios del calormetro para asegurar el sistema adiabtico. Esto ayudara a evitar los errores y obtener unos resultados de mayor fiabilidad.
7 REFERENCIAS 1. SERWAY, Raymond. 2005. Fsica para ciencias e ingeniera, volumen 1. Ciudad de Mxico, Mxico. Editorial Thompson. 611p. 2. RESNICK, HALLIDAY. 2001. Fsica. cuarta edicin, volumen1. Ciudad de Mxico, Mxico, Editorial Continental. 610 p. 3. CHANG, Raymond. 2002. Qumica, sptima edicin, Ciudad de Mxico, Mxico, McGraw-Hill. 108 p 4. LIDE, David. 2010. Handbook of chemistry and physics. 90 edicion. Version de internet. CRC press. Capitulo 6-135. 5. LEVINE, Ira N. 2004. Fisicoqumica. 5ta edicin. Editorial Mc-Graw Hill. Madrid, Espaa. Pag. 103.
ANEXOS Anexo 1 tabla de temperaturas y masas de las mezclas de agua fra y caliente dentro del calormetro.
Experiencia 1 2 3 Masa agua fra (gr) 50 60 70 Masa agua caliente (gr) 50 40 30 Temperatur a agua fria 24 C 26 C 25 C Temperatura agua caliente 55 C 56 C 51 C Temperatura agua equilibrio 38 C 35 C 30 C
Anexo 2 tabla de temperaturas y masas de agua y hielo dentro del calormetro.
experiencia 1 2 3 4 Masa agua 50 gr 50 gr 50 gr 50 gr Masa hielo 14 gr 15 gr 9 gr 13 gr Temperatura caliente 30 C 29 C 29 C 29 C Temperatura fria 0 C 0 C 0 C 0 C Temperatura equilibrio 11 C 9 C 16 C 10 C
Anexo 3 Clculos de las capacidades calorficas de un calormetro adiabtico: Las formula utilizada en la practica fue;
m2c2 (T2 Tf) = m1c1 (Tf T1) q Donde m2: masa de agua caliente. m1: masa de agua fra. c2 = c1: calor especifico del agua (1 cal /g .K). Tf: temperatura de agua fra. Tc: temperatura de agua caliente. Te: temperatura en equilibrio. q: calor absorbido o transferido. Sustituyendo el calor de agua fra y agua caliente
( )
=
Ejemplo: ensayo 2
( )
= 139,45 J/K
Anexo 4 Calculo del calor latente de fusin de hielo. Dentro de un calormetro adiabtico se cumple que, la suma de los calores absorbidos y cedidos es igual a cero: Q1 + Q2 + Q3 + Q4 =0
m1. c1. (Te Tc) + Ccal. (Te Tc) + Lf . m2 + m2. c2. (Te Tf) = 0 donde: m1: masa de agua. m2: masa de hielo. c1: calor especifico del agua (1 cal /g .K). c2: calor especifico del hielo. (0,5 cal/g. K) Ccal: capacidad calorfica del calormetro. Lf: Calor latente de fusin. Tf: temperatura de agua fra. Tc: temperatura de agua caliente.
9 Te: temperatura en equilibrio.
( ) ( )
Lf =
Ejemplo: ensayo 2
( )
Lf =
Lf =
= 444,17 kJ/kg
Anexo 5 Calculo de la entropia para el proceso de fusin del hielo a partir del calor latente de fusin. S =
y para un sistema cerrado a presin constante como el
de la prctica H = qp entonces tenemos que5: S= Ejemplo: ensayo 2 La entalpia total del proceso de fusin del hielo viene dada por H = Hf .mh. Entonces H = 444170
. 15 g = 6662550 J
Y como el proceso de fusin se da a 0 C (273 K): S = = 24,40 J/ K
Vous aimerez peut-être aussi
- Manual técnico de refrigerantesD'EverandManual técnico de refrigerantesÉvaluation : 4 sur 5 étoiles4/5 (4)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Eficiencia energética en las instalaciones de climatización en los edificios. ENAC0108D'EverandEficiencia energética en las instalaciones de climatización en los edificios. ENAC0108Pas encore d'évaluation
- Diseño de GavionesDocument2 pagesDiseño de GavionesTavito ColonioPas encore d'évaluation
- Determinación Gravimétrica Del NíquelDocument17 pagesDeterminación Gravimétrica Del NíquelDelcys K. Paz0% (1)
- Taller de Calor LatenteDocument2 pagesTaller de Calor LatenteMaria VirginiaPas encore d'évaluation
- Espesamiento de RelavesDocument26 pagesEspesamiento de RelavesDevora Miluska Alfaro100% (2)
- Capacidad Calorífica y Entalpía de FusiónDocument8 pagesCapacidad Calorífica y Entalpía de FusiónVanessa Campos75% (4)
- Diseño de Un Controlador PID Difuso para Una Planta de Segundo Orden Sub-Amortiguada Usando LABVIEWDocument52 pagesDiseño de Un Controlador PID Difuso para Una Planta de Segundo Orden Sub-Amortiguada Usando LABVIEWcss_unac100% (2)
- Medida Del Calor Latente de Fusión Del HieloDocument7 pagesMedida Del Calor Latente de Fusión Del Hielojorgenitalesthe3rdPas encore d'évaluation
- INFORME de Entalpia de Fusion Del HieloDocument5 pagesINFORME de Entalpia de Fusion Del HieloJuan Pablo Toro Rojas0% (1)
- Calor de Fusion Del HieloDocument10 pagesCalor de Fusion Del HieloFranciscoLopezMartinezPas encore d'évaluation
- Calor latente hieloDocument6 pagesCalor latente hieloDisso SotoPas encore d'évaluation
- Calorimetría y calor de fusión del hieloDocument31 pagesCalorimetría y calor de fusión del hieloAnonymous oJFJP2BtwpPas encore d'évaluation
- Calor latente hieloDocument2 pagesCalor latente hieloJohn AndradePas encore d'évaluation
- Calor LatenteDocument6 pagesCalor LatenteJose Manuel RojasPas encore d'évaluation
- Practica 1 y 2Document15 pagesPractica 1 y 2Paola TorresPas encore d'évaluation
- Practica 5Document6 pagesPractica 5Verónica MoreiraPas encore d'évaluation
- Capacidad Térmica de Un CalorímetroDocument4 pagesCapacidad Térmica de Un CalorímetroKristhian Valenzuela RegaladoPas encore d'évaluation
- Informe N° 3Document2 pagesInforme N° 3Carolina Alejandra Cardenas JametPas encore d'évaluation
- Tarea - Laboratorio 06Document6 pagesTarea - Laboratorio 06LUIS JAIME RAMOS POMPAPas encore d'évaluation
- Calor Latente y Tranferencia de CalorDocument3 pagesCalor Latente y Tranferencia de CalorDANIELA ESTEFANNI CHAPARRO CHAPARROPas encore d'évaluation
- FQpractica 5Document6 pagesFQpractica 5Hugo GarayPas encore d'évaluation
- Fusion Del HieloDocument8 pagesFusion Del HieloAbbisita BarreraPas encore d'évaluation
- Lab de Fisica Calor Ondas 3Document5 pagesLab de Fisica Calor Ondas 3yirisPas encore d'évaluation
- 1º Informe de LaboratorioDocument15 pages1º Informe de LaboratorioLuis Castillo SandigaPas encore d'évaluation
- Informe 5. Entalpia de FusionDocument9 pagesInforme 5. Entalpia de FusionAlineTanemiMartinezOrtizPas encore d'évaluation
- Calor de Fusion y VaporizacionDocument4 pagesCalor de Fusion y Vaporizacionsilvia martinezPas encore d'évaluation
- CALORIMETRIADocument5 pagesCALORIMETRIARichard Arias HernandezPas encore d'évaluation
- 3 Medida Del Calor Latente de Fusión Del HieloDocument10 pages3 Medida Del Calor Latente de Fusión Del HieloNicole Machado TubiñezPas encore d'évaluation
- Termodinámica - Qumi IIDocument6 pagesTermodinámica - Qumi IIMarioPas encore d'évaluation
- Determinación experimental de la capacidad calorífica de un calorímetroDocument7 pagesDeterminación experimental de la capacidad calorífica de un calorímetroDojist RiugajPas encore d'évaluation
- Informe N°3 Calor Latente de Vaporizacion Del AguaDocument7 pagesInforme N°3 Calor Latente de Vaporizacion Del AguaAntonio Jose Salcedo MartinezPas encore d'évaluation
- Determinación capacidad calorífica calorímetroDocument2 pagesDeterminación capacidad calorífica calorímetroBrandon Calef Alain Estrada MartinezPas encore d'évaluation
- Practica 6. Calorimetría.Document6 pagesPractica 6. Calorimetría.sheshomaruPas encore d'évaluation
- Entalpia de FusionDocument5 pagesEntalpia de Fusionryuk28Pas encore d'évaluation
- Entalpía de Fusión Del HieloDocument4 pagesEntalpía de Fusión Del HieloVALENTINA GARCIA GARCIAPas encore d'évaluation
- Informe 5 Lab. FisicoquimicaDocument4 pagesInforme 5 Lab. Fisicoquimicajesid povedaPas encore d'évaluation
- preinformeDocument21 pagespreinformeMaria camila Padilla lozanoPas encore d'évaluation
- CalorLatenteFusiónDocument4 pagesCalorLatenteFusiónDavid DiazPas encore d'évaluation
- Calorimetría FisicoquímicaDocument13 pagesCalorimetría FisicoquímicaWiñay Mattaz Huampu100% (1)
- Practica 8 Calor LatenteDocument7 pagesPractica 8 Calor LatenteFDGH133333Pas encore d'évaluation
- Calor Latente de Fusion CompletoDocument4 pagesCalor Latente de Fusion CompletoJose Eduardo Villanueva FerrerPas encore d'évaluation
- FISICOQUIMICA Informe #1Document4 pagesFISICOQUIMICA Informe #1Valentina DiazPas encore d'évaluation
- Práctica Experimental de La CalorimetríaDocument5 pagesPráctica Experimental de La CalorimetríaJluis MendozaPas encore d'évaluation
- Labo SkyDocument5 pagesLabo SkyCielo HuallpanPas encore d'évaluation
- CalorLatenteFusionHieloDocument5 pagesCalorLatenteFusionHieloGinPas encore d'évaluation
- Tercer Laboratorio QiDocument3 pagesTercer Laboratorio QiAnonymous wHXJJSJoyEPas encore d'évaluation
- FQpractica 5Document6 pagesFQpractica 5Ana JuarezPas encore d'évaluation
- FQPractica 1-CALORIMETRÍADocument8 pagesFQPractica 1-CALORIMETRÍAAlfred VGPas encore d'évaluation
- Laboratorio de Termodinamica de Materiales N FinalDocument14 pagesLaboratorio de Termodinamica de Materiales N FinalGianellaApontePas encore d'évaluation
- Actividad Sustituta de Experimentos 11 y 12Document4 pagesActividad Sustituta de Experimentos 11 y 12Jose AlcantaraPas encore d'évaluation
- Informe 2 Qui-IiDocument14 pagesInforme 2 Qui-IiMilagros BacaPas encore d'évaluation
- Laboratorio 4Document9 pagesLaboratorio 4Maria Isabel Galindo BermeoPas encore d'évaluation
- Laboratorio 1Document6 pagesLaboratorio 1alejandro piranequePas encore d'évaluation
- Guia de Lab Fusion Del HieloDocument3 pagesGuia de Lab Fusion Del HieloJhojans Enrriquex riveraPas encore d'évaluation
- Determinación del equivalente térmico y calor específico del aguaDocument4 pagesDeterminación del equivalente térmico y calor específico del aguaHenry AcostaPas encore d'évaluation
- Termoqumica y Calor EspecificoDocument8 pagesTermoqumica y Calor EspecificoSantiago ValenciaPas encore d'évaluation
- Experiencia NEntropiadeprocesos Virtual 1Document7 pagesExperiencia NEntropiadeprocesos Virtual 1Marylin AlvarezPas encore d'évaluation
- Laboratorio #4 Determinación Del Cambio de Entropía para Un Calentamiento, Enfriamiento y Cambio de Estado Del Agua.Document10 pagesLaboratorio #4 Determinación Del Cambio de Entropía para Un Calentamiento, Enfriamiento y Cambio de Estado Del Agua.Maycol Richard Leyva PatricioPas encore d'évaluation
- CAMBIO DE ENTALPÍA DE FUSIÓN DEL HIELO TerminadoDocument7 pagesCAMBIO DE ENTALPÍA DE FUSIÓN DEL HIELO TerminadoStephany Nieto33% (3)
- Practica Calorimetría y Calor LatenteDocument5 pagesPractica Calorimetría y Calor Latentebiofisica2011Pas encore d'évaluation
- CatalizadoresDocument24 pagesCatalizadoresSergio Muñoz50% (2)
- FQ Aplicada 01Document125 pagesFQ Aplicada 01lilisacasPas encore d'évaluation
- Neutralizacion y Disposicion de DesechosDocument9 pagesNeutralizacion y Disposicion de DesechosDelcys K. PazPas encore d'évaluation
- Plantilla QuimicaDocument24 pagesPlantilla QuimicaDelcys K. PazPas encore d'évaluation
- Reacciones de AlcoholesDocument26 pagesReacciones de AlcoholesVeronica Hernandez BastarPas encore d'évaluation
- Plantilla QuimicaDocument24 pagesPlantilla QuimicaDelcys K. PazPas encore d'évaluation
- Mohr y Volhard (1) DelcysDocument14 pagesMohr y Volhard (1) DelcysDelcys K. PazPas encore d'évaluation
- Ciclohexeno Sintesis A Partir de Ciclohexanona - Proyecto de Organica2.Document10 pagesCiclohexeno Sintesis A Partir de Ciclohexanona - Proyecto de Organica2.Delcys K. PazPas encore d'évaluation
- Nuevaa Practica 2 OriginalllllDocument14 pagesNuevaa Practica 2 OriginalllllDelcys K. PazPas encore d'évaluation
- Ciclohexeno Sintesis A Partir de Ciclohexanona - Proyecto de Organica2.Document10 pagesCiclohexeno Sintesis A Partir de Ciclohexanona - Proyecto de Organica2.Delcys K. PazPas encore d'évaluation
- Delcys TernariaDocument12 pagesDelcys TernariaDelcys K. PazPas encore d'évaluation
- Acidobenzoico DelcysDocument13 pagesAcidobenzoico DelcysDelcys K. PazPas encore d'évaluation
- Exámen Hidráulica 2022 FinalDocument3 pagesExámen Hidráulica 2022 FinalJorge ReyesPas encore d'évaluation
- Laboratorio Virtual de Expansión TérmicaDocument6 pagesLaboratorio Virtual de Expansión TérmicaGiovanny Palomino AlarconPas encore d'évaluation
- Oferta y Uso de Aguas Subterráneas en Colombia (IDEAM, 2010)Document0 pageOferta y Uso de Aguas Subterráneas en Colombia (IDEAM, 2010)Luis Miguel Vargas CruzPas encore d'évaluation
- Trabajo de Gestión de Tecnologías IndustrialesDocument13 pagesTrabajo de Gestión de Tecnologías IndustrialesCamila LozadaPas encore d'évaluation
- Interconexion Guatemala Mexico 400kVDocument34 pagesInterconexion Guatemala Mexico 400kVcastillejosPas encore d'évaluation
- EJERCICIOS de GRANULOMETRIADocument4 pagesEJERCICIOS de GRANULOMETRIAevelin espinoza mamaniPas encore d'évaluation
- Jonas Montilva Capitulo 01Document16 pagesJonas Montilva Capitulo 01Ernesto Cesar GonzalezPas encore d'évaluation
- Trimble ReconDocument2 pagesTrimble ReconBiz SanPas encore d'évaluation
- Normas de seguridad en el laboratorioDocument4 pagesNormas de seguridad en el laboratorioEilithPas encore d'évaluation
- Ficha Tecnica PalletDocument1 pageFicha Tecnica PalletLorena Santos AlbinesPas encore d'évaluation
- Presentacion de Cañeria Guia-LodosDocument24 pagesPresentacion de Cañeria Guia-LodosLucia MoyanoPas encore d'évaluation
- Generacion de HidrocarburosDocument12 pagesGeneracion de HidrocarburosheydicruzPas encore d'évaluation
- 2022 Resueltos ParcialDocument24 pages2022 Resueltos ParcialSonia GautoPas encore d'évaluation
- Puente Baluarte BicentenarioDocument11 pagesPuente Baluarte BicentenarioAngel Hbt CartelPas encore d'évaluation
- Proy. Oblicua 2Document10 pagesProy. Oblicua 2Oscar GonzalezPas encore d'évaluation
- Municipalidad de UnquilloDocument148 pagesMunicipalidad de UnquilloVico CarballoPas encore d'évaluation
- Caminos Canales y PuertosDocument14 pagesCaminos Canales y PuertosAlberto Rosellon BarrosPas encore d'évaluation
- Baker HouseDocument2 pagesBaker HouseGeronimo FarinaPas encore d'évaluation
- VFD FLEXIBLE VF - Ne-Coperint-EsDocument2 pagesVFD FLEXIBLE VF - Ne-Coperint-Esjorgema34Pas encore d'évaluation
- Tarea Sesion 3-Google Earth ProDocument3 pagesTarea Sesion 3-Google Earth ProSebastian RosalesPas encore d'évaluation
- Taller Individual de Física SuperiorDocument2 pagesTaller Individual de Física Superiordjpazmiotec4414Pas encore d'évaluation
- 3 - Construccion de Localizacion de PerforacionDocument13 pages3 - Construccion de Localizacion de PerforacionWilfrido Flores MartínezPas encore d'évaluation
- GUIA 3er Dep - Quimica III 2017Document10 pagesGUIA 3er Dep - Quimica III 2017Emiliano Martin Torres PachecoPas encore d'évaluation
- 1N4000 Data SheetDocument3 pages1N4000 Data SheetJ Andres Buchan ColinPas encore d'évaluation
- Visión y Alcance ProyectoDocument11 pagesVisión y Alcance Proyectogniter10Pas encore d'évaluation
- Cmr357a-18serviciooverhauldeprensa-Exalmar 20181029224517.312 XDocument10 pagesCmr357a-18serviciooverhauldeprensa-Exalmar 20181029224517.312 XJames Brown0% (1)
- Análisis de Objeto Técnico La EscaleraDocument8 pagesAnálisis de Objeto Técnico La EscaleraIng. Gerardo Sánchez Nájera100% (2)