Académique Documents
Professionnel Documents
Culture Documents
Practica 1 Cinética Q y B Alumnos
Transféré par
Carlos TrujilloCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Practica 1 Cinética Q y B Alumnos
Transféré par
Carlos TrujilloDroits d'auteur :
Formats disponibles
Caractersticas del reporte de laboratorio PORTADA Deber incluir el logotipo y nombre de la institucin Nombre de la carrera que cursa Nombre
de la asignatura Nombre del profesor de la asignatura Nombre de la prctica Nombres de los integrantes del equipo Lugar y fecha INTRODUCCIN Aqu redactar de forma general el tema que ser analizado en sus experimentos OBJETIVO(S) Los objetivos se redactarn en verbos infinitivos y de forma impersonal MARCO TERICO Se describir el contexto del tema en estudio, solo deben incluirse aspectos relevantes que le ayuden a comprender e interpretar sus resultados. La informacin aqu descrita debe incluir las citas bibliogrficas de donde se obtuvo dicha informacin. METODOLOGA Describir de forma ordenada y clara la estrategia empleada durante los experimentos, puede emplear diagrama(s) de flujo. Indicando informacin acerca de condiciones tales como, temperatura, agitacin, concentraciones de soluciones, etc. RESULTADOS Y DISCUSIONES Citar en forma de tablas y/o grficas los resultados de cada experimento, en el orden descrito en la metodologa. Cada resultado deber analizarse y discutirse de acuerdo al comportamiento esperado y/o mencionado en las referencias bibliogrficas. CONCLUSIONES Describir las conclusiones que fueron logradas en relacin a los objetivos planteados en sus experimentos BIBLIOGRAFA Citar las referencias bibliogrficas empleadas en su reporte
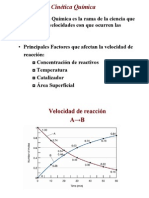
GUA DE PRCTICA NMERO 1 Estudio cintico de la reaccin de oxidacin de yoduro con persulfato OBJETIVOS: Determinar la ecuacin de velocidad de la reaccin de oxidacin de yoduro (I-) por persulfato (S2O8=). Determinar el orden de la reaccin y calcular la constante de velocidad. INTRODUCCIN: La cintica es la rama de la fisicoqumica que estudia la velocidad con que ocurren las reacciones. Los resultados experimentales de la dependencia de la velocidad de reaccin con las concentraciones de los componentes del sistema reaccionante, se resumen en la ecuacin cintica. Para determinar la velocidad de una reaccin es necesario saber como vara la concentracin de uno de los reactivos con respecto al tiempo. La reaccin a estudiar se puede representar mediante la siguiente ecuacin qumica: 2KI + K2S2O8 I2 + 2K2SO4
El avance de la reaccin se sigue por un mtodo discontinuo; es decir, una vez mezclados los reactivos en las condiciones deseadas (concentracin, temperatura...) se toman muestras cada cierto tiempo y se valora el yodo formado con tiosulfato sdico. MATERIAL 2 Matraces volumtricos de 250 ml 1 Matraz volumtrico de 100 ml 7 Matraces Erlenmeyer de 125 ml 2 Pipetas volumtricas de 50 ml 1 Pipeta graduada de 10 ml 1 Pipeta graduada de 1 ml 3 Vasos de precipitados de 200 ml 1 Vaso de precipitado de 500 ml 1 Soporte universal 1 Pinza para bureta 1 Bureta 1 Cronmetro 1 Agitador 1 Esptula 1 Termmetro REACTIVO Yoduro de potasio KI Persulfato de potasio K2S2O8 Tiosulfato de sodio Na2SO3 Almidn al 1% Agua destilada
PROCEDIMIENTO 1. Prepare las siguientes soluciones: a) Yoduro de potasio 0.2 M b) Persulfato de potasio 0.1 M c) Tiosulfato de sodio 0.01 M d) Almidn al 1% (ver observaciones) 2. Mida con una pipeta volumtrica 50 ml de yoduro de potasio 0.2 M y coloque la muestra en un Erlenmeyer de 125 ml. 3. Se pone el mismo volumen de persulfato de potasio 0.1 M en otro matraz Erlenmeyer de 125 ml. 4. Agregue el yoduro en el persulfato y mezcle muy bien el sistema formado, empiece a medir tiempo. 5. Se toma una muestra de 10 ml y se vierte a un Erlenmeyer. 6. Adicione al Erlenmeyer aproximadamente 1 ml de almidn. 7. Se titula rpidamente el yodo liberado con tiosulfato 0.01 M 8. Tome otras cinco muestras ms, a intervalos de 5 min. cada una. 9. Mida la temperatura de reaccin y anote su valor. 10. Complete la siguiente tabla: Tiempo Volumen gastado [ I2 ] [nI2] [nk2S2O8] [K2S2O8] 1/[K2S2O8]
11. Haga uso de los datos generados, determine el orden de reaccin y el valor
de la constante de velocidad. OBSERVACIONES:
1. Para preparar una solucin de almidn al 1% se pesa 1 g de almidn
soluble y se agrega 100 ml de agua caliente y se contina agitando hasta que la solucin sea clara, se deja enfriar a la temperatura ambiente. 2. Colocar un papel blanco abajo del matraz que contiene la mezcla reaccionante que se esta titulando, para facilitar la observacin del cambio de color de azul oscuro a incoloro. CUESTIONARIO:
1. Qu tipo de funcin se obtiene cuando se hace la grfica del inverso de la
2. 3. 4. 5.
6. Cmo se comprueba que la reaccin es de segundo orden y que significa esto?
concentracin de persulfato de potasio contra tiempo de reaccin? Qu indica la ordenada al origen de la grfica? Defina con sus propias palabras: velocidad y mecanismo de reaccin. Explicar en qu consiste la ley de accin de masas. Cul es la importancia de la cintica qumica en el anlisis de un sistema reaccionante y la aplicacin en la ingeniera qumica?
Vous aimerez peut-être aussi
- PROTOCOLO Carambola FinalDocument35 pagesPROTOCOLO Carambola FinalAndres MoralesPas encore d'évaluation
- Catalisis U 3Document24 pagesCatalisis U 3Carlos TrujilloPas encore d'évaluation
- Práctica 2Document4 pagesPráctica 2Carlos TrujilloPas encore d'évaluation
- Cinetica Quimica-GeneralidadesDocument27 pagesCinetica Quimica-GeneralidadesEdgar Esteban Espinoza CabreraPas encore d'évaluation
- Ensayo actividad invertasa levaduraDocument10 pagesEnsayo actividad invertasa levaduraTamara Elizabeth Sepúlveda Morales100% (1)
- Importancia de La Microbiología en La AgriculturaDocument14 pagesImportancia de La Microbiología en La AgriculturaCarlos Trujillo83% (6)
- Ensayo actividad invertasa levaduraDocument10 pagesEnsayo actividad invertasa levaduraTamara Elizabeth Sepúlveda Morales100% (1)
- Informe N. 3Document29 pagesInforme N. 3Sebastián AndrésPas encore d'évaluation
- Modelo atómico, estructura electrónica y propiedades periódicasDocument39 pagesModelo atómico, estructura electrónica y propiedades periódicasAldo Ortega González0% (2)
- Ansul 150 LBDocument4 pagesAnsul 150 LBEduleofPas encore d'évaluation
- Tarea#2 QuimicaDocument4 pagesTarea#2 QuimicaGerardo ArpaizPas encore d'évaluation
- Diseño de Cloración por Goteo Poblado KepashiatoDocument5 pagesDiseño de Cloración por Goteo Poblado KepashiatoLuis GarfieldPas encore d'évaluation
- Aminas NutricionDocument12 pagesAminas NutricioncarlosPas encore d'évaluation
- Sistemas de inyección electrónica de gasolina y dieselDocument61 pagesSistemas de inyección electrónica de gasolina y dieselEduardo Alejandro Diaz AlfaroPas encore d'évaluation
- Hoja de Datos de Seguridad - AVGAS 100LL - AeroGalvezDocument20 pagesHoja de Datos de Seguridad - AVGAS 100LL - AeroGalvezAERO COUTOPas encore d'évaluation
- Calculo Preparacion de Solucion Saturada de Sulfato de AmonioDocument4 pagesCalculo Preparacion de Solucion Saturada de Sulfato de AmonioRichard SalazarPas encore d'évaluation
- Remedios Con Peroxido de HidrogenoDocument15 pagesRemedios Con Peroxido de HidrogenoJimena Riquelme Rebolledo100% (2)
- Principios de La HidrometalurgiaDocument6 pagesPrincipios de La HidrometalurgiaJesùs Miguel Ramirez RojasPas encore d'évaluation
- Dismetriña 25 EC SDS: Insecticida piretroideDocument5 pagesDismetriña 25 EC SDS: Insecticida piretroidePablo ChamayPas encore d'évaluation
- Clase 6 Lagunas PDFDocument19 pagesClase 6 Lagunas PDFChristian Salinas VargasPas encore d'évaluation
- Plan de LubricacionDocument27 pagesPlan de LubricacionJOs Lagunes del VallePas encore d'évaluation
- Almibar de Durazno... Mendoza PDFDocument31 pagesAlmibar de Durazno... Mendoza PDFsheyla vanessa mendoza criolloPas encore d'évaluation
- Practica 4 - Carbohidratos en Los AlimentosDocument3 pagesPractica 4 - Carbohidratos en Los AlimentosJuliana ContrerasPas encore d'évaluation
- BPL para Laboratorios ClinicosDocument341 pagesBPL para Laboratorios Clinicosjrlr65Pas encore d'évaluation
- Pre-Informe N°6Document7 pagesPre-Informe N°6alexander0% (1)
- Evaluación Biología 2do BGUDocument3 pagesEvaluación Biología 2do BGUfranciscoPas encore d'évaluation
- IncaparinaDocument2 pagesIncaparinaLuisa Castro0% (1)
- El Flujo Axonico o AxonalDocument4 pagesEl Flujo Axonico o AxonalHiginioPas encore d'évaluation
- Polarización Azúcar NMX-F-079-1986Document5 pagesPolarización Azúcar NMX-F-079-1986Juan Sebastián Guzmán VásquezPas encore d'évaluation
- Cementos InkaDocument1 pageCementos InkaEscobar JavierPas encore d'évaluation
- Practica 5 Equipo 6Document12 pagesPractica 5 Equipo 6Espinosa Balderas GenaroPas encore d'évaluation
- Manual de Farmacologia 2018 PDFDocument130 pagesManual de Farmacologia 2018 PDFPaul Cedeño100% (1)
- Estado Del ArteDocument23 pagesEstado Del ArteSanti Osorio DiezPas encore d'évaluation
- Termoquímica: Calores de reacción, formación y combustiónDocument25 pagesTermoquímica: Calores de reacción, formación y combustiónElsa Marzana SanizoPas encore d'évaluation
- Sensor Cable Térmico TC172Document2 pagesSensor Cable Térmico TC172Carlos Alberto Merino ZambranoPas encore d'évaluation
- Acidos y Bases - PHDocument5 pagesAcidos y Bases - PHabe4245Pas encore d'évaluation
- Mapas Conceptuales-PpfDocument3 pagesMapas Conceptuales-PpfestefaniaPas encore d'évaluation