Académique Documents
Professionnel Documents
Culture Documents
5 Disoluciones
Transféré par
Kenia Marcela GonzalezTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
5 Disoluciones
Transféré par
Kenia Marcela GonzalezDroits d'auteur :
Formats disponibles
DISOLUCIONES
1. Mezcla Heterognea: (Ejemplo: arena y arcilla).
Las partculas individuales se observan con facilidad y
son mezclas separables fcilmente por algn
procedimiento mecnico.
2. Disoluciones Coloidales (Seudosoluciones): (Ejemplo:
lodo, arcilla y agua). Su tamao es superior al de
las que forman las soluciones verdaderas e
inferior al de las mezclas heterogneas; la
dispersin no es homognea.
3. Homognea (1 fase) (Solucin o disolucin): Los
constituyentes tienen tamao molecular o inico, lo cual
hace imposible observarlas a simple vista.
Clasificacin de las disoluciones
Dependiendo de la naturaleza de la fase:
Slida Lquida Gaseosa
Dependiendo del nmero de componentes:
* Binaria
* Ternaria
* Cuaternaria
.
.
.
Disolvente: Componente que est presente en mayor
cantidad o que la fase de la disolucin.
Solutos: Los restantes componentes.
Clasificacin de las disoluciones lquidas
Dependiendo del estado del soluto:
Soluto slido Soluto lquido Soluto gaseoso
Dependiendo del disolvente:
Acuosas
No acuosas
Dependiendo
de la naturaleza
del soluto:
Electrolticas: soluto se disocia en iones (ej. sal)
(conducen la corriente elctrica)
No electrolticas: soluto no se disocia en iones (ej. azcar)
(no conducen la corriente elctrica)
COMPOSICIN DE LA DISOLUCIN
Fraccin molar
Molaridad (M)
Molalidad (m)
EJ EMPLO 1
Calcule el nmero de moles de soluto de
HCl en cada una de las siguientes
disoluciones acuosas:
a. 145 mL de una disolucin de HCl con
molaridad 0.8n/dm
3
. RTA: 0.116
b. 145 g de una disolucin de HCl al 10%
en peso. RTA:0.398
c. 145 g de una disolucin cuya molalidad
en HCl es 4.85 molal. RTA: 0.598
ESTUDIAR
Numerales:
9.2. Magnitudes molares parciales
9.3 Magnitudes de mezcla
9.4. Determinacin de magnitudes
molares parciales
9.2 MAGNITUDES MOLARES PARCIALES:
Volmenes molares parciales
Se tiene una disolucin mezclando a temperatura y presin
constante n
1
, n
2
,, n
r
moles de las sustancias 1, 2,, r.
V
m1
*,, V
mr
* volmenes molares de las sustancias puras
1,2,, r a T y P.
V* el volumen total de los componentes sin mezclar (puros) a
T y P. El asterisco indica que la propiedad se refiere a una
sustancia pura o a un conjunto de sustancias puras.
Despus de la mezcla, por lo general el volumen V de la
disolucin no es igual al volumen sin mezclar
* V V =
= + + + =
1
, , 2 , 2 1 , 1
* * ... * * *
i m i r m n m m
V n V n V n V n V
Volmenes molares parciales
50 cm
3
H
2
0
50 cm
3
etanol
96.5 cm
3
Causas de las diferencias
entre V de la disolucin y V*:
Diferencias entre las fuerzas
intermoleculares existentes en la
disolucin y las existentes en los
componentes puros.
Diferencias entre el
empaquetamiento de las
molculas en la disolucin y su
empaquetamiento en los
componentes puros, debido a los
distintos tamaos y formas de las
molculas que se mezclan.
Diferencial total de V
r r n P T
r
n P T n T n P
dn
dn
dV
dn
dn
dV
dP
dP
dV
dT
dT
dV
dV
i i i i = =
+ + + + =
, , 1 , ,
1
, ,
) ( ... ) ( ) ( ) (
1
), ,..., , , , (
2 1 r
n n n P T V V =
Volmenes molares parciales
Volumen molar parcial de una
sustancia j en la disolucin:
j i
n P T
j
J
dn
dV
V
=
=
, ,
) (
V: volumen de la disolucin
i
i
i n T n P
dn V dP
dP
dV
dT
dT
dV
dV
i i
+ + =
, ,
) ( ) (
,...) , , , (
2 1
x x P T V V
i i
=
Relacin entre el volumen de la disolucin y los
volmenes molares parciales
,...) , , , (
2 1
x x P T nf V =
dn x x P T f dV ,...) , , , (
2 1
=
i
i
i
dn V dV
=
dn V x dV
i
i i
=
=
i
i i
V n V
) * ( *
,i m i
i
i mez
V V n V V V = A
Medida de los volmenes molares
parciales
Medida de los volmenes molares parciales
Nmero fijo de moles de A pero valores diferentes de n
B
Continuacin:
VOLMENES MOLARES PARCIALES
La ecuacin
se puede utilizar para expresar
cualquier propiedad extensiva como U,
H, S, G y C
P
. Cada una de estas
propiedades cambia al mezclar los
componentes a T y P constantes.
U, H, S, G y C
P
son funcin del estado de
la disolucin, como T, P, n
1
, n
2
n
r
.
= + + + =
1
, , 2 , 2 1 , 1
* * ... * * *
i m i r m n m m
V n V n V n V n V
) ,..., , , , (
2 1 r
n n n P T U U =
), ,..., , , , (
2 1 r
n n n P T V V =
9.3 Magnitudes de mezcla
* H H H
mez
A
* S S S
mez
A
* G G G
mez
A
MAGNITUDES TERMODINMICAS
DE MEZCLA.
Magnitud de mezcla: Diferencia entre el valor de la magnitud
en la disolucin y la de los componentes puros.
Compuestos puros Disolucin AY
M
= Y
disoluc
Y*
AV
M
= 0 no hay cambio de volumen al formarse la disolucin,
pues no cambia la estructura espacial.
En el caso de una disolucin ideal (T y P ctes)
AU
M
= 0 pues no cambia la energa de las interacciones al formarse.
AH
M
= 0 no hay calor de mezcla a P cte; ni absorbe ni desprende Q.
AS
M
> 0 aumenta el desorden.
AG
M
< 0 formacin de la disolucin: espontnea.
Propiedades termodinmicas de las
disoluciones ideales
9.4 Mtodo para determinar volmenes molares parciales
en una disolucin de dos componentes
para disoluciones agua-etanol
a 20C y 1 atm.
n V
mez
/ A
Volmenes molares parciales para disoluciones
agua etanol a 20C y atm.
MODELOS DE DISOLUCIONES
Modelo de disolucin ideal
Modelo de disolucin diluida ideal
MODELO DE LA DISOLUCIN IDEAL
Descripcin molecular:
Disolucin en la cual las molculas de las
distintas especies son tan semejantes unas a
otras que las molculas de uno de los
componentes pueden sustituir a las del otro
sin que se produzca variacin de :
Estructura espacial de la disolucin
Energa de interacciones
intermoleculares presentes en la misma.
Ejemplos:
n-pentano-n-hexano
benceno-tolueno
12
CH
3
I-
13
CH
3
I
DISOLUCIONES DILUIDAS IDEALES O
IDEALMENTE DILUIDA.
Muchas disoluciones se desvan bastante del modelo de disolucin ideal.
Por ello resulta til definir otro modelo:
Descripcin molecular
Disolucin en la cual las molculas de soluto
prcticamente slo interaccionan con molculas de
disolvente.
lmite: x(disolvente) 1 y x(solutos) 0
(Slo aplicable a disoluciones no electrolticas)
CARACTERSTICAS GENERALES
DE UNA SOLUCIN IDEAL
Una solucin ideal que contenga
constituyentes voltiles cumple la ley de
Raoult.
Como los componentes son voltiles, parte
de la solucin se evapora para llenar con
vapor el espacio encima del lquido.
Cuando la solucin y el vapor alcanzan el
equilibrio a la temperatura T, la presin
total en el recipiente es la suma de las
presiones parciales de los componentes de la
solucin.
LEY DE RAOULT
Con respecto al componente i :
Pi = x
i
.P
i
*
Donde:
P
i
: presin parcial de i en la fase vapor en
equilibrio con una solucin ideal a la
temperatura T.
x
i
: fraccin molar de i en la fase lquida.
P
i
*: presin de vapor del lquido puro i a la
temperatura del sistema.
LEY DE RAOULT
La ley de Raoult expresa que la presin de
vapor parcial del constituyente voltil de una
solucin es igual a la presin de vapor del
constituyente puro multiplicada por la
fraccin molar del constituyente en la
solucin.
Solucin binaria en la que ambos
componentes son voltiles:
x
1
+ x
2
= 1
P
1
= x
1
.P
1
*
P
2
= x
2
.P
2
*
= (1 x
1
) P
2
*
Si la presin total de la mezcla es P:
P = P
1
+ P
2
= x
1
P
1
*
+ (1 x
1
) P
2
*
P = x
1
.P
1
*
+ P
2
*
- x
1
.P
2
*
P = P
2
*
+ x
1
(P
1
*
- P
2
*
)
La expresin anterior relaciona la presin
total sobre la mezcla con la fraccin molar
del componente 1 en el lquido. Establece que
la presin es una funcin lineal de x
1
. Ver
Figura
LEY DE RAOULT
DIAGRAMA P-x (A T CTE, DISOLUCIN IDEAL)
LEY DE RAOULT
EJEMPLO 2
La presin de vapor del benceno es 74.7
torr a 20C, mientras que la presin de
vapor del tolueno es 22.3 torr a 20C.
Cierta disolucin de benceno y tolueno a
20C tiene una presin de vapor de 46
torr. Calcule la fraccin molar de benceno
en esta disolucin y en el vapor que se
encuentra en equilibrio con ella. Asuma que
la solucin se comporta como una disolucin
ideal. Haga una grfica de presin vs
composicin en fase lquida, en funcin del
componente ms liviano
SOLUCIN EJEMPLO 2
P*benceno = 74.7 torr a 20C
P*tolueno = 22.3 torr a 20C
P = 46 torr
P = P1 + P2 = x1 * 74.7 + x2 * 22.3
46 = x1 * 74.7 + (1 x1) * 22.3
46 = 74.7 x1 + 22.3 22.3 x1
46 = 52.4 x1 + 22.3
23.7 = 52.4 x1 x1 = 0.452
P2 = Presin parcial del benceno = 0.452*74.7 = 33.8
torr.
En el equilibrio las presiones son iguales, por tanto la
presin del benceno en fase lquida es igual a la
presin que ejerce el benceno en fase vapor.
Aplicando Dalton para calcular la composicin del
benceno en fase vapor:
CONTINUACIN SOLUCIN EJEMPLO
2
735 . 0
46
8 . 33
2
2
= = =
P
P
y
EJERCICIO 1
Una disolucin a 20C est
compuesta por 1.5 moles de benceno
y 3.5 moles de tolueno. Calcular la
presin y fraccin molar de benceno
en el vapor en el equilibrio con esta
solucin.
P*
benceno
= 74.7 torr a 20C
P*
tolueno
= 22.3 torr a 20C
Diagrama P-x (T cte, disolucin ideal)
P
1
, P
2
y P
TOT
en el equilibrio en funcin de la
composicin del lquido (x
1
)
P
TOT
P
1
P*
1
P
2
P*
2
Si P*
v1
> P*
v2
P
x
1
0
1
No informa
la composicin del
vapor
El disolvente obedece la ley de Raoult:
El soluto obedece la ley de Henry:
En condiciones de dilucin suficientemente
elevada, todas las disoluciones no
electrolticas pasan a ser disoluciones
diluidas ideales.
Aplicacin disolucin diluida ideal:
SOLUBILIDAD DE LOS GASES EN EL AGUA
Alguna fraccin de los
constituyentes del aire que entran
en contacto con el agua entran en
solucin como 0
2
, N
2
,CO
2
(gases
atmosfricos).
SOLUBILIDADES DE GASES EN EL AGUA
La concentracin del gas que se disuelve en el
agua est determinada por:
Presin parcial del gas por encima de la superficie
del agua.
Naturaleza del gas
Temperatura
Los gases como el N
2
, H
2
, O
2
y He, se disuelven
en el agua slo en ligera proporcin, mientras que
los gases como el cloruro de hidrgeno HCl y el
amonaco NH
3
son muy solubles.
LEY DE HENRY
K
Hi
= Constante de Henry del
componente i en unidades de presin
x
i
= Fraccin molar del gas i en la
solucin
P
i
= Presin parcial del gas i en unidades
de presin
Hi i i
K x P * =
i
Hi
i
P
K
x
1
=
OXGENO DISUELTO
O
2
(g)
O
2
(ac)
K
H
= Constante de equilibrio para la reaccin planteada
| |
| |
| |
2
2
2
2
H
O
O
= K'
O
ac
g
ac
P O
LEY DE HENRY
A temperatura constante la
solubilidad de un gas en un lquido
es directamente proporcional a la
presin del gas sobre el lquido.
S = K
Hi
* P
i
K H
i
= Constante de Henry en unidades Molaridad/atm
S = Concentracin de gas en la solucin en unidades de
Molaridad
P
i
= Presin parcial del gas en atm
CONSTANTES DE LA LEY DE HENRY PARA LOS GASES
COMUNES SOLUBLES EN AGUA , K
H
, atm
T (C) Aire N
2
O
2
CO
2
CO H
2
H
2
S CH
4
1 4.32x10
4
5.29x10
4
2.55x10
4
0.073x10
4
3.52x10
4
5.79x10
4
0.027x10
4
2.24x10
4
10 5.49x10
4
6.68x10
4
3.27x10
4
0.104x10
4
4.42x10
4
6.36x10
4
0.037x10
4
2.97x10
4
20 6.64x10
4
8.04x10
4
4.01x10
4
0.142x10
4
5.36x10
4
6.83x10
4
0.048x10
4
3.76x10
4
30 7.71x10
4
9.24x10
4
4.75x10
4
0.186x10
4
6.20x10
4
7.29x10
4
0.061x10
4
4.49x10
4
40 8.70x10
4
10.4x10
4
5.35x10
4
0.233x10
4
6.96x10
4
7.51x10
4
0.075x10
4
5.20x10
4
DATOS DE CONSTANTE DE HENRY PARA
COMPONENTES DEL AIRE A 25C. K
,
H
GAS P (atm) KH * mol L
-1
*
atm
-1
N
2
0.78 6.79 x 10
-4
O
2
0.21 1.34 x 10
-3
Ar 0.009 1.43 x 10
-3
CO
2
0.0003 3.79 x 10
-2
EJEMPLO 3
Determinar la concentracin de
saturacin en mg/L del O
2
en agua
a 10C y a 20C y 1 atm.
INFLUENCIA DE LA PRESIN EN LA
SOLUBILIDAD
La presin del gas varia con la altitud; se puede calcular con
la ecuacin de la ley de distribucin baromtrica.
P
i
= es la presin del gas a h y T especficas.
P
io
= Presin del gas a nivel del mar.
h = altura (m)
Mw
i
= Masa molar del gas en kg/mol
R = 8.3145J/mol-K
T = Temperatura (K)
T R
h g Mw
o i
i
e P P
.
. .
=
EJEMPLO 4
Cul es el nivel de saturacin del O
2
en mg/L a 298 K y a 900 m de
altura sobre el nivel del mar
SOLUCIN EJEMPLO 4
| |
L
mg
8.034 =
mol
mg
32000
L
mol
10 x 2.51 = L / mg
L
mol
10 x 2.51 = 0.187 x 10 x 1.34 O = *PO K'
atm. 0.187 = 0.892 x 0.21 = P
K 298 x Kg j/mol 314 , 8
e
atm 0.21 = P
4 -
4 - 3 -
2 2 H
i
m. 900 x
seg
m
9.80 x
mol
Kg
10 x 32 -
i
2
-3
ac
INFLUENCIA DE LA TEMPERATURA EN LA SOLUBILIDAD
La variacin de la solubilidad del
gas con la temperatura, se calcula
con base en la ecuacin de Vant
Hoff.
|
|
.
|
\
|
A
1 2 2
1
T
1
-
T
1
R
H
= )
KH
KH
( ln
EJEMPLO 5
Cul es el nivel de saturacin del O
2
a 50C ?
TEMPERATURA CONCENTRACION
1 13.47
2 13.1
3 12.76
4 12.42
5 12.1
6 11.79
7 11.5
8 11.22
9 10.95
10 10.69
11 10.45
12 10.21
13 9.98
14 9.76
15 9.55
16 9.35
17 9.15
18 8.96
19 8.78
20 8.61
21 8.44
22 8.28
23 8.12
24 7.97
25 7.82
26 7.68
27 7.54
28 7.4
29 7.27
30 7.15
31 7.03
CONCENTRACION DE OXIGENO Vs TEMPERATURA
450 msnm
7
8
9
10
11
12
13
14
0 1 2 3 4 5 6 7 8 9 101112131415161718192021222324252627282930313233
TEMPERATURA C
C
O
N
C
E
N
T
R
A
C
I
O
N
D
E
O
X
I
G
E
N
O
m
g
/
l
SOLUCIN EJEMPLO 5
K
H
a 25C = 1.34 x 10
-3
M/atm
( )
A A A Hr O - Hf O = -2.8Kcal
o
2 ac
o
2(g)
= H f
o
| |
6.24mg/L =
L
mg
atm. 0.21 x 10 x 9.24 PO x H K' = O
10 X 9.29 = H K'
10 x 1.34 ln +
323
1
-
298
1
1.987
2800 -
= KH ln
4 -
2 1 2
4 -
1
3 -
1
|
.
|
\
|
EJEMPO 6
El vapor en equilibrio con una disolucin
de etanol (et) y cloroformo (cl) a 45C
en la cual xcl= 0.9900, tiene una
presin de 438.59 torr y una fraccin
molar ycl = 0.9794. Se puede suponer
que la disolucin es ideal. a) Calcule las
presiones parciales en la fase vapor. b)
calcule la presin de vapor del
cloroformo puro a 45C. c) Calcule la
constante de la ley de Henry K
H
para el
etanol en cloroformo a 45C. RTAS: b)
433.9 torr. c) 903 torr.
Atkins, P. and de Paula, J. Physical Chemistry. Oxford.
Seventh Edition. 2002. Italy.
Levine I. Fisicoqumica. Volumen 1. McGraw-Hill. 5
Edicin. 2004.
McCain, William D. The Properties of Petroleum Fluids.
PennWell Books. 2 Edition. Tulsa, Oklahoma. 1990. Chapter 3.
Pages 90-127.
Pedersen, K.S., Christensen, P.L. Phase Behavior of
Petroleum Reservoir Fluids.Taylor Francis Group. Boca
Raton.
Prausnitz, J.M., Lichtenthaler, R.N.,Gomes de
Acevedo, E. Termodinmica molecular de los
equilibrios de fases. 3 edicin. Prentice Hall.
Madrid, 2000.
BIBLIOGRAFA
PROPIEDADES COLIGATIVAS.
1. Disminucin de la presin de vapor
2. Aumento de la temperatura de ebullicin
3. Descenso de la temperatura de fusin/congelacin
4. Presin osmtica
La formacin de una disolucin tiene consecuencias sobre
una serie de propiedades: propiedades coligativas.
Propiedades que dependen nicamente de la cantidad
(concentracin) de soluto aadida (moles o molculas
de soluto), pero no de su naturaleza (de qu soluto sea).
Disoluciones diluidas ideales (no electrolticas)
formadas por un disolvente voltil (1) y un soluto no voltil (2).
Descenso De La Presin De Vapor
La presin de vapor de la solucin desciende con
respecto a la presin de vapor del solvente puro. P
corresponde a la presin de vapor de la solucin. El
soluto es un componente no voltil.
P
1
= x
1
.P
*
1
AP = P
*
1
- P
1
AP= P
*
1
- x
1
.P
*
1
AP = P
*
1
(1 x
1
)
AP = P
*
1
.x
2
Completamente independiente tanto de la
naturaleza del soluto como del solvente.
EJEMPLO 7
Calcular la presin de vapor de la solucin que contiene
53.94 g de manita (PM = 182.11) en 1000 g de agua
a 20C. A esta temperatura la P
v
de agua es igual
a 17.51 mmHg.
5 . 17 0093 . 0 51 . 17 |
093 . 0 0053 . 0 51 . 17
0053 . 0
18
1000
11 . 182
94 . 53
11 . 182
94 . 53
.
1
*
1
2
2
1
*
= = A =
= = A
=
+
=
= A
P P P
mmHg x P
x
x P P
EJERCICIO 2
Se disuelven 24.63 g de una sustancia en
150 g de agua. A 23C la presin de vapor
de la solucin es 20.73 mmHg y la del agua
es 21.07 mmHg. Hallar el peso molecular
de la sustancia.
P = P
*
1
. x
1
AP = P
*
1
.x
2
Aumento de la Temperatura de
Ebullicin
Las soluciones que contienen solutos no
voltiles hierven a temperaturas ms
elevadas que las del solvente puro. La
diferencia entre los puntos de ebullicin de
la solucin y del solvente para una presin
constante se conoce como elevacin del punto
de ebullicin.
Aumento de la Temperatura de
Ebullicin
Aumento de la Temperatura de
Ebullicin
AT
b
= K
b
* m
2
1000 * ,
2
1
m Hv
RTo MW
Kb
A
=
Descenso de la Temperatura de
Congelacin
Descenso de la Temperatura de
Congelacin
ATc = Kc * m
2
1000 *
1
2
1
c Hm
RTo MW
Kc
A
=
1000 *
1
2
1
f Hm
RTo MW
Kf
A
=
Constantes de Elevacin del Punto de Ebullicin
y de Descenso del Punto de Congelacin
Solvente Punto Ebullicin
Normal (C)
Kb (C m
-1
) Pto Congelacin
Normal (C)
Kc (C m
-1
)
Agua 100.0 0.512 0.0 1.855
Benceno 80.2 2.53 5.5 5.12
cido Actico 118.5 3.07 16.6 3.9
Naftaleno 218.0 5.65 80.2 6.9
Alcanfor 208.3 5.95 178.4 40
PRESIN OSMTICA
PRESIN OSMTICA
Se llama presin osmtica de la
solucin, a la presin mecnica que
debe aplicarse sobre la solucin para
impedir la smosis del solvente hacia
la solucin a travs de una membrana
semipermeable.
= C
2
.RT
Presin osmtica.
Membrana semipermeable:
Permite que pequeas
molculas pasen a su travs,
pero las grandes no.
smosis: Flujo de disolvente a travs de una membrana
semipermeable hacia el seno de una disolucin ms
concentrada.
La presin necesaria para detener el flujo: Presin osmtica (t)
Presin Osmtica
t = c R T Ecuacin de vant Hoff
Molaridad
Importancia en los seres vivos:
Paredes celulares actan como membranas semipermeables:
permiten el paso de molculas pequeas (agua, molculas de
nutrientes) pero no de grandes (enzimas, protenas, ...).
Determinacin de pesos moleculares osmometra.
(especialmente para molculas con altos pesos
moleculares como, p.ej., macromolculas biolgicas).
smosis inversa desalinizacin
(aplicar a la disolucin una presin mayor que la t,
provocando un flujo de salida del disolvente).
Aplicaciones
EJERCICIO 3
A 25C una disolucin preparada
disolviendo 82.7 mg de un
compuesto no electrolito en
agua hasta alcanzar el volumen
de 100 mL tiene una H de 83.2
torr. Calcular el peso molecular
del compuesto no electrolito.
Rta: 184.7 g/n
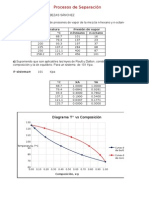
Diagramas P-x
Acetona + cloroformo
Diagramas P-x
Acetona + cloroformo
Desviaciones negativas
de la ley de Raoult
Ocurre cuando las interacciones
A-B son mayores
que las A-A y B-B
AH
M
< 0
AV
M
< 0
Diagramas P-x
Acetona + CS
2
Desviaciones positivas
de la ley de Raoult
Ocurre cuando las interacciones
A-B son menores
que las A-A y B-B
AH
M
> 0
AV
M
> 0
EJERCICIOS PROPUESTOS
1. Suponga que se disuelven 6 g de
una mezcla de naftaleno (C
10
H
8
) y
antraceno (C
14
H
10
) en 300 g de
benceno. Cuando la disolucin se
enfra, empieza a congelar a una
temperatura 0.7C por debajo del
punto de congelacin del benceno
puro (5.5C). Calcule la composicin
de la mezcla, teniendo en cuenta que
Kc es 5.1C .kg.n
-1
para el benceno.
RTAS:0.026n naft, 0.015 n antr.
EJERCICIOS PROPUESTOS
2. A 20C, 0.164 mg de H2 se disuelven en 100 g
de agua cuando la presin de H2 sobre el agua
es 1.0 atm. a) calcule la constante de la ley de
Henry para el H2 en agua a 20C. b) Calcule la
masa de H2 que se disuelve en 100 g de agua
a 20C cuando la presin de H2 es 10 atm.
Desprecie la variacin de Ki con la presin.
RTAS: a) 6.82*104 atm: b) 1.64 mg.
(1.64mg)
3. Se disuelven 0.572 g de resorcina en 19.31 g
de agua y la disolucin hierve a 100.14 C.
Calcular el peso molecular de la resorcina.
RTA: 110 g/mol.
EJERCICIOS PROPUESTOS
4. Calcular las constantes molales de los puntos de
ebullicin y de congelacin del agua con base en los
calores latentes de ebullicin y de fusin del agua.
RTA: 0.52C*m-1 y 1,86C*m-1 respectivamente.
5. La constante molal para el punto de congelacin del
alcanfor es 40 C/molalidad. Se prepara una mezcla de
23.7 mg de fenolftalena y 0.387 g de alcanfor, la cual
fundida empieza a solidificarse a 166.5 C. El punto de
fusin del alcanfor utilizado es de 174.4 C. Hallar el peso
molecular de la fenolftalena. RTA: 310 g/mol.
6. El acido actico puro solidifica a 16.6C y su constante
molal del punto de congelacin es 3.9 C/molalidad.
Calcular cul debe ser el punto de congelacin de un cido
actico que contienen 2.8 % de agua. RTA: 10.36C.
EJERCICIOS PROPUESTOS
7. Una disolucin que contiene 0.604 g de naftaleno
C10H8 en 20 g de cloroformo hierve a 62.11 C
mientras que el cloroformo puro hierve a 61.2 C.
Encuentre: a) Constante molal del punto de ebullicin
del cloroformo. RTA: 3.86C*m-1. b) Calor latente de
ebullicin por gramo de cloroformo RTA: 57.9 cal/g.
8. Hallar la concentracin en g/L de una disolucin de
glucosa C6H12O6, que a 25 C es isosmtica o
isotnica con una disolucin de urea CO(NH2)2 a 12
C, la cual contiene 3 g de urea en un volumen de 150
cm3. RTA: 57.36g/L.
9. Una disolucin de sacarosa C12H22O11 tiene a 20 C
una H de 1000 mm Hg. Si se enfran 100 gramos de
disolucin hasta 2,0 C, calcular la cantidad de hielo
que se separa. Suponer que la densidad de la
disolucin es igual a uno. RTA: 93.033 gramos.
EJERCICIOS PROPUESTOS
11. Cuando se disuelve 1g de rea [CO(NH2)2]
en 200g del solvente A, el punto de
congelacin de A disminuye en 0.25C;
cuando se disuelven 1.5 g de y en 125g del
mismo disolvente A, el punto de congelacin
de A diminuye en 0.2C ; calcule el peso
molecular de y. RTA: 180g/n
12. Calcule Kb del agua si Hm,vap = 40.6KJ/mol
para el agua a 100C.RTA_0.513C.kg.mol-1_
EJERCICIOS PROPUESTOS
13. Una mezcla que contiene 0.55g de alcanfor y
0.045g de un hidrocarburo funde a 157C. El
soluto tienen 93.54% de C y 6.46% de peso de
H.
Cul es la frmula molecular del hidrocarburo?
RTA: C11H9
Cul es el descenso relativo de la presin del
vapor de la solucin con respecto al solvente
puro? RTA: 0.081.P
*
1
Cal es el calor latente molar de fusin del
solvente RTA: 6.84 kJ/n
Datos alcanfor: Frmula molecular C
10
H
16
O,
temperatura de fusin178.8C, Kc = 37.7Cm-1
Vous aimerez peut-être aussi
- 5 Disoluciones PDFDocument77 pages5 Disoluciones PDFAna Veronica RPas encore d'évaluation
- 8 Disoluciones PDFDocument75 pages8 Disoluciones PDFSamuel F. MuñozPas encore d'évaluation
- Ingeniería química. Soluciones a los problemas del tomo ID'EverandIngeniería química. Soluciones a los problemas del tomo IPas encore d'évaluation
- 5 Disoluciones PDFDocument85 pages5 Disoluciones PDFVictoria LosadaPas encore d'évaluation
- Psicometría. Principios básicos y protocolos experimentales diversosD'EverandPsicometría. Principios básicos y protocolos experimentales diversosPas encore d'évaluation
- 5 DisolucionesDocument76 pages5 DisolucionesDaniel Camilo BustosPas encore d'évaluation
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesD'EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesPas encore d'évaluation
- Soluciones IdealesDocument31 pagesSoluciones Idealesalets_sashaPas encore d'évaluation
- Propiedades de Las SolucionesDocument31 pagesPropiedades de Las SolucionesFelipe AnabalónPas encore d'évaluation
- Termodinamica de Las DisolucionesDocument14 pagesTermodinamica de Las DisolucionesAlex Susanibar KlerPas encore d'évaluation
- Propiedades ColigativasDocument7 pagesPropiedades ColigativasjuanPas encore d'évaluation
- Propie. Parciales2Document44 pagesPropie. Parciales2Alam Hernán Alam AlamPas encore d'évaluation
- Guia de SolubilidadDocument10 pagesGuia de SolubilidadYarisbelPas encore d'évaluation
- Semana 3 - Ley de RaoultDocument20 pagesSemana 3 - Ley de Raoultclaudia cristina fernandez alvarezPas encore d'évaluation
- INVESTIGACIÓNDocument10 pagesINVESTIGACIÓNCamila BravoPas encore d'évaluation
- Propiedades MolaresDocument9 pagesPropiedades Molarescabrerajr7Pas encore d'évaluation
- Propiedades Coligativas de Las SolucioneDocument8 pagesPropiedades Coligativas de Las SolucioneFernando José RiveiroPas encore d'évaluation
- Ley de RaoultDocument6 pagesLey de RaoultCarlos ValdezPas encore d'évaluation
- Propiedades ColigativasDocument10 pagesPropiedades ColigativasElectromotrizTorres TorresPas encore d'évaluation
- Propiedades Coligativas de Las Soluciones.Document6 pagesPropiedades Coligativas de Las Soluciones.fernandoPas encore d'évaluation
- 3 - ColigativasDocument6 pages3 - Coligativasdarkwolf1003Pas encore d'évaluation
- 5 - Propiedades de Las DisolucionesDocument56 pages5 - Propiedades de Las DisolucionesSantiago PellejeroPas encore d'évaluation
- S07.s1 - Material FQDocument41 pagesS07.s1 - Material FQJanira DominguezPas encore d'évaluation
- Monografía Grupal FQ Tema 1 - Mod IVDocument17 pagesMonografía Grupal FQ Tema 1 - Mod IVAYRTON JOEL UZQUIANO NU�EZPas encore d'évaluation
- Termodinamica de DisolucionDocument24 pagesTermodinamica de DisolucionRoman ReynsPas encore d'évaluation
- ColigativasDocument26 pagesColigativasverushkitaPas encore d'évaluation
- Disoluciones IdealesDocument10 pagesDisoluciones IdealesCesar Augusto Torres LinaresPas encore d'évaluation
- Propiedades Molares Parciales de Las SolucionesDocument3 pagesPropiedades Molares Parciales de Las SolucionesFavio Andrés Chavez100% (1)
- Soluciones IdealesDocument9 pagesSoluciones Idealescampanas0Pas encore d'évaluation
- Aplicaciones de Las Leyes de Roult y Henry y MasDocument12 pagesAplicaciones de Las Leyes de Roult y Henry y MasJuan Pablo Galindo Beltran100% (1)
- Ley de RaoultDocument3 pagesLey de RaoultJocelyn GonzálezPas encore d'évaluation
- Exposicion SolucionesDocument43 pagesExposicion SolucionesJuan Villalobos NuñezPas encore d'évaluation
- Cap4 Sistemas Homogeneos Mul PDFDocument105 pagesCap4 Sistemas Homogeneos Mul PDFMarcelo TorresPas encore d'évaluation
- 4to. Introducción - Propiedades Coligativas de Solutos No ElectrolíticosDocument43 pages4to. Introducción - Propiedades Coligativas de Solutos No Electrolíticosdarwins pintoPas encore d'évaluation
- Propiedades Molares ParcialesDocument30 pagesPropiedades Molares ParcialesAnonymous Sk29Mht50% (2)
- Soluciones Quimicas - Propiedades ColigativasDocument43 pagesSoluciones Quimicas - Propiedades ColigativasAlfredo CruzPas encore d'évaluation
- PRÁCTICA 7 y 8 FQ 16Document20 pagesPRÁCTICA 7 y 8 FQ 16Alvaro CalderonPas encore d'évaluation
- Guia de Propiedades ColigativasDocument6 pagesGuia de Propiedades ColigativasMiriam Arriagada100% (1)
- S07.s1 - Material FQDocument37 pagesS07.s1 - Material FQPass25 2020Pas encore d'évaluation
- Ley de RaoultDocument16 pagesLey de RaoultMara ArellanoPas encore d'évaluation
- Propiedades Molares ParcialesDocument9 pagesPropiedades Molares ParcialesAnonymous Sk29MhtPas encore d'évaluation
- Separación de Líquidos InmisciblesDocument8 pagesSeparación de Líquidos Inmiscibleserick aldahirPas encore d'évaluation
- Soluciones de No ElectrolitosDocument14 pagesSoluciones de No ElectrolitosAnthony HuamanPas encore d'évaluation
- Exposicion 1, 2 y 3 SolucionesDocument44 pagesExposicion 1, 2 y 3 SolucionesAlfredo CruzPas encore d'évaluation
- Tema 5. Disoluciones Ideales y RealesDocument14 pagesTema 5. Disoluciones Ideales y RealesAlex BLPas encore d'évaluation
- Guia 4. Prop. ColigativasDocument6 pagesGuia 4. Prop. ColigativasLaura Rivera100% (1)
- FisicoquimicaDocument65 pagesFisicoquimicaAlfredo JbPas encore d'évaluation
- Sist Homog Multicom. - SOLUC NO ELECTROLI Parte 2Document76 pagesSist Homog Multicom. - SOLUC NO ELECTROLI Parte 2Austin de los BackyardigansPas encore d'évaluation
- TREMODINAMICADocument23 pagesTREMODINAMICAmanuel100% (3)
- Soluciones IdealesDocument7 pagesSoluciones Idealesruthayram26Pas encore d'évaluation
- DISOLUCIONESDocument44 pagesDISOLUCIONESMagaly BenaventePas encore d'évaluation
- Disoluciones No IdealesDocument17 pagesDisoluciones No IdealesChristine Cholula0% (1)
- PRACTICA #1 Propiedades Molares ParcialesDocument16 pagesPRACTICA #1 Propiedades Molares ParcialesCynthia NolascoPas encore d'évaluation
- Unidad SolucionesDocument67 pagesUnidad SolucionesLilibeth Pamela Arispe GuerraPas encore d'évaluation
- 5 Quimica 1.propiedades ColigativasDocument33 pages5 Quimica 1.propiedades ColigativasMa Vi Garzón PazmiñoPas encore d'évaluation
- Informe 5 Propiedades ColigativasDocument13 pagesInforme 5 Propiedades ColigativasMiguel ArvizuPas encore d'évaluation
- LETRERODocument1 pageLETREROKenia Marcela GonzalezPas encore d'évaluation
- Tablas Dinamicasporcentajedel TotalDocument18 pagesTablas Dinamicasporcentajedel TotalAndrés Felipe Calderón PalenciaPas encore d'évaluation
- Herramientas y MáquinasDocument28 pagesHerramientas y MáquinasKenia Marcela GonzalezPas encore d'évaluation
- Unidad Didc3a1ctica Castellano No2 Grado 6c2b0 PDFDocument36 pagesUnidad Didc3a1ctica Castellano No2 Grado 6c2b0 PDFyohanPas encore d'évaluation
- Ev.10 RoomanticismoDocument3 pagesEv.10 RoomanticismoKenia Marcela GonzalezPas encore d'évaluation
- Prueba Final de CompetenciasDocument16 pagesPrueba Final de CompetenciasKenia Marcela GonzalezPas encore d'évaluation
- Juegos DramáticosDocument2 pagesJuegos DramáticosKenia Marcela GonzalezPas encore d'évaluation
- Ensayo Miercoles BolivarDocument1 pageEnsayo Miercoles BolivarKenia Marcela GonzalezPas encore d'évaluation
- Sumasy ConteosDocument3 pagesSumasy ConteosKenia Marcela GonzalezPas encore d'évaluation
- Preguntas y Respuestas Textos Discontinuos PDFDocument74 pagesPreguntas y Respuestas Textos Discontinuos PDFStephany Paola Maldonado ArcePas encore d'évaluation
- Evaluación de Recuperación de LenguajeDocument3 pagesEvaluación de Recuperación de LenguajeKenia Marcela GonzalezPas encore d'évaluation
- Equidad de Genero GuiaDocument4 pagesEquidad de Genero GuiaKenia Marcela GonzalezPas encore d'évaluation
- Qué Es La Diversidad CulturalDocument6 pagesQué Es La Diversidad CulturalKenia Marcela GonzalezPas encore d'évaluation
- Ejercicios Adjetivo PDFDocument4 pagesEjercicios Adjetivo PDFRAÚL BLAYA0% (1)
- EVALUACION Generacion Del 98Document2 pagesEVALUACION Generacion Del 98Kenia Marcela GonzalezPas encore d'évaluation
- Sumasy ConteosDocument3 pagesSumasy ConteosKenia Marcela GonzalezPas encore d'évaluation
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Prueba Saber Grado Noveno y OctavoDocument9 pagesPrueba Saber Grado Noveno y OctavoKenia Marcela GonzalezPas encore d'évaluation
- Referencias Absolutas Relativas ExcelDocument58 pagesReferencias Absolutas Relativas ExcelOscar FernandoPas encore d'évaluation
- Pedro Paramo - Control de LectDocument7 pagesPedro Paramo - Control de LectKenia Marcela GonzalezPas encore d'évaluation
- PRUEBA SABER SEXTO Y SEPTIMO Tercer PeriodoDocument8 pagesPRUEBA SABER SEXTO Y SEPTIMO Tercer PeriodoKenia Marcela GonzalezPas encore d'évaluation
- Gráfica y Ocupacional de Accidentes Laborales en Los Trabajadores Informales en La Ciudad de Bogotá, Colombia 2014Document14 pagesGráfica y Ocupacional de Accidentes Laborales en Los Trabajadores Informales en La Ciudad de Bogotá, Colombia 2014Kenia Marcela GonzalezPas encore d'évaluation
- GUIA DE LENGUAJE Signos de PuntuacionDocument12 pagesGUIA DE LENGUAJE Signos de PuntuacionKenia Marcela GonzalezPas encore d'évaluation
- Juegos DramáticosDocument2 pagesJuegos DramáticosKenia Marcela GonzalezPas encore d'évaluation
- Actividad Grupal Trabajos Del FuturoDocument1 pageActividad Grupal Trabajos Del FuturoKenia Marcela GonzalezPas encore d'évaluation
- AtajosDocument9 pagesAtajosAnonymous 5cJtduEekKPas encore d'évaluation
- Byscar VDocument57 pagesByscar Vleonardo bapra0% (1)
- Prueba de LenguajeDocument7 pagesPrueba de LenguajeKenia Marcela GonzalezPas encore d'évaluation
- PRUEBA SABER SEXTO Y SEPTIMO Tercer PeriodoDocument8 pagesPRUEBA SABER SEXTO Y SEPTIMO Tercer PeriodoKenia Marcela GonzalezPas encore d'évaluation
- Actividad Grupal Entrega 26 de MayoDocument1 pageActividad Grupal Entrega 26 de MayoKenia Marcela GonzalezPas encore d'évaluation
- Control Electrico IndustrialDocument5 pagesControl Electrico IndustrialAngelica GuijarroPas encore d'évaluation
- Control Predictivo No Lineal de Orden ReducidoDocument8 pagesControl Predictivo No Lineal de Orden ReducidoMagnoPas encore d'évaluation
- La Luz y El Calor en Los LagosDocument18 pagesLa Luz y El Calor en Los LagosCarlos Sanda CruzPas encore d'évaluation
- Calibracion Del Avion PulverizadorDocument6 pagesCalibracion Del Avion PulverizadorJavier EncaladaPas encore d'évaluation
- Unidad 7 Equilibrio Químico SWDocument42 pagesUnidad 7 Equilibrio Químico SWAriana GonzálezPas encore d'évaluation
- Estudio de Las Propiedades Fisicas Del Los YacimientosDocument10 pagesEstudio de Las Propiedades Fisicas Del Los YacimientosM Roberto ArancibiaPas encore d'évaluation
- Correlación Gray Gas CondensadoDocument5 pagesCorrelación Gray Gas CondensadoFreddy MendozaPas encore d'évaluation
- Practica 4 - Teoría ElectromagnéticaDocument8 pagesPractica 4 - Teoría ElectromagnéticaPandaPas encore d'évaluation
- Analisis NodalDocument543 pagesAnalisis NodalOlvis GuillenPas encore d'évaluation
- Principio de BernoulliDocument1 pagePrincipio de BernoulliGera FJPas encore d'évaluation
- Ecuación de DiseñoDocument20 pagesEcuación de Diseño1Pas encore d'évaluation
- EXA RECU Corrección S1 P4 18 - 19Document6 pagesEXA RECU Corrección S1 P4 18 - 19Juan Juuzou SuzuyaPas encore d'évaluation
- Cartel Amisión Máster 22 23Document2 pagesCartel Amisión Máster 22 23Jose AndresPas encore d'évaluation
- PRACTICA #4 Síntesis de DiadasDocument5 pagesPRACTICA #4 Síntesis de DiadasJose Villegas100% (2)
- 1° Año-Práctica 5Document2 pages1° Año-Práctica 5Jackson López LaviPas encore d'évaluation
- Prueba 4Document9 pagesPrueba 4Rodrigo Alejandro Egaña GutierrezPas encore d'évaluation
- Evaluacion 1Document2 pagesEvaluacion 1ANDRES IRIARTE81% (16)
- Rectificador MultipulsoDocument5 pagesRectificador MultipulsoCamiQuintanillaDocmacPas encore d'évaluation
- PresionesAnormales 20% Primer CorteDocument4 pagesPresionesAnormales 20% Primer CorteMarian PosadaPas encore d'évaluation
- Modulo 1Document15 pagesModulo 1Jhonathan Fernandez TorresPas encore d'évaluation
- Explosiv OsDocument14 pagesExplosiv OsadonisPas encore d'évaluation
- Guía de Laboratorio Viscosidad - PresencialDocument12 pagesGuía de Laboratorio Viscosidad - Presenciallaura camila gonzalez bullaPas encore d'évaluation
- Protecciones A Sistemas de PotenciaDocument7 pagesProtecciones A Sistemas de PotenciaEnrique Guzmán RecinoPas encore d'évaluation
- Practica 4Document5 pagesPractica 4Miguel Angel HernandezPas encore d'évaluation
- Practica No.2 Equilibrio de Una ParticulaDocument2 pagesPractica No.2 Equilibrio de Una ParticulaCristian FonsecaPas encore d'évaluation
- Cuaderno y Ficha 4° Materia Propied GeneralesDocument2 pagesCuaderno y Ficha 4° Materia Propied GeneralesJunior C. ArrigoniPas encore d'évaluation
- Guía #5 Primer Principio de La TermodinámicaDocument3 pagesGuía #5 Primer Principio de La TermodinámicaDeb iiPas encore d'évaluation
- 1-Ecuaciones Diferenciales de Segundo Orden-Prop-BasicasDocument3 pages1-Ecuaciones Diferenciales de Segundo Orden-Prop-BasicaseladowskiPas encore d'évaluation
- Procesos de Separacion-Cabezas SanchezDocument12 pagesProcesos de Separacion-Cabezas SanchezSalustria Cabezas SánchezPas encore d'évaluation
- Primer Bimestre - Fisica Formato de Planeación Sec 21-22Document4 pagesPrimer Bimestre - Fisica Formato de Planeación Sec 21-22Gabriela CruzPas encore d'évaluation