Académique Documents
Professionnel Documents
Culture Documents
En Zimas
Transféré par
KaRen Daii QuiinTeroCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
En Zimas
Transféré par
KaRen Daii QuiinTeroDroits d'auteur :
Formats disponibles
Una revisin de los bioqumica, biotecnologa y otras aplicaciones de las enzimas
Las enzimas son protenas desarrolladas por las clulas de los organismos vivos. Su funcin es especfica para catalizar reacciones qumicas. Las enzimas aumentan la velocidad a la que se acercan a reacciones de equilibrio. Las enzimas se han encontrado usos amplios y diversos en diferentes disciplinas y campos de las actividades humanas. Las enzimas desempean un papel fundamental en las actividades metablicas de los organismos vivos, ya sean humanos, animales, plantas o microorganismos y se aplican ampliamente en la agricultura, bioqumica, biotecnologa, qumica, gentica, industria, medicina humana y veterinaria, farmacia, investigacin, etc diferentes aplicaciones de las enzimas abundan en la literatura. El objetivo de esta revisin es discutir las diversas aplicaciones de las enzimas para el propsito de la enseanza, la educacin y la investigacin. INTRODUCCION Las enzimas son catalizadores biolgicos que aumentan la velocidad de las reacciones qumicas que tienen lugar dentro de las clulas vivas sin que ellos mismos someterse a cualquier cambio global (Palmer, 2001). Las enzimas desempean un papel vital en los sistemas biolgicos, actuando como catalizadores. Un catalizador es necesario en tales sistemas, ya que, a la temperatura y el pH del cuerpo humano y de los animales, las reacciones no se producira a una velocidad suficiente para apoyar la actividad rpida, la generacin del impulso nervioso y muscular de todos los otros procesos necesarios para mantener la vida (Devlin, 1986). La investigacin y la interpretacin de los cambios en las enzimas sricas en las enfermedades es uno de los campos de ms rpida expansin en clnica bioqumica (Chatterjea y Shinde, 2002) Las enzimas son sin cambios por su accin sobre sus substratos, sino que permanecen como estn y activa hasta desnaturalizado por el calor u otros factores o hasta que se agota el sustrato. Dependiendo del proceso, las enzimas pueden ser retirados del producto final, o desnaturalizado y se dejaron en, o incluso pueden ser potencialmente activo. Cmo se etiquetan en las formulaciones del producto final debera depender de los resultados especficos para el producto en cuestin. Las enzimas tienen amplias aplicaciones o extensa en diferentes campos de la investigacin o de las reas de la vida. En la medicina humana y veterinaria, el ensayo de las enzimas de plasma puede ser muy til para ayudar a confirmar el diagnstico de enfermedades en los seres
humanos y los animales. En tecnologa de ADN recombinante (a veces llamada ingeniera gentica), se utilizan variedades de enzimas, por ejemplo, endo-nucleasas de restriccin (a partir de bacterias) y ligasas de ADN (a partir de bacterias o bacterifagos), para insertar genes adicionales en las clulas con la ayuda de vehculos denominados vectores. El diagnstico de un error innato del metabolismo puede ser establecida al demostrar la reduccin de la actividad de una enzima en particular en un tejido, o mediante la revelacin de una anormalidad de genes mediante tecnologa de ADN recombinante (Palmer, 2001). Las enzimas tambin se aplican en la gestin y el tratamiento de algunas enfermedades. Las enzimas se utilizan como reactivos en la bioqumica clnica y en la industria. Ensayo enzimtico es muy importante en las industrias de alimentos y bebidas en el seguimiento del tratamiento y el almacenamiento de alimentos y bebidas y como un medio para detectar la contaminacin microbiana. Todas estas aplicaciones se discutirn en detalles. Debido a la importancia de las enzimas y sus amplias aplicaciones en bioqumica, biotecnologa, qumica, gentica, industria, medicina humana y veterinaria, etc, este comentario es un intento de reunir a los diferentes usos y aplicaciones de las enzimas a los fines de la enseanza y la investigacin . IMPORTANCIA BIOMDICA DE ENZIMAS Las enzimas son polmeros biolgicos que catalizan los mltiples procesos dinmicos que hace posible procesos de la vida. Las enzimas desempean un papel central en la salud y la enfermedad, ya que son determinantes de las tasas a las que los eventos fisiolgicos tienen lugar. La composicin de los alimentos para abastecer de energa y componentes qumicos, el conjunto de estos bloques de construccin en protenas, membranas y el ADN que codifica la informacin gentica y el arns-sing de energa para producir el movimiento celular es todo hizo posible gracias a las acciones coordinadas de cuidado enzimas (Murray et al., 2000). Mientras que en la salud, todos los procesos bioqumicos y fisiolgicos ocurren en una, manera regulada y ordenada la homeostasis se mantiene, la homeostasis se puede profundamente perturbado en estados patolgicos. Por ejemplo, la lesin grave a los tejidos que cataliza la cirrosis heptica puede afectar profundamente a la capacidad de las clulas para formar las enzimas que catalizan un proceso metablico clave tales como la sntesis de urea. La incapacidad resultante para convertir el amonaco txico en urea no txica es seguida por intoxicacin por amonaco y en ltima instancia, coma heptico (Murray et al., 2000). Una serie de enfermedades genticas raras, pero con frecuencia debilitantes y a menudo fatales son ejemplos adicionales de las consecuencias fisiolgicas drsticas que pueden producirse por deterioro de la actividad de una nica enzima.
Despus de una lesin grave en los tejidos (por ejemplo, infarto cardiaco o pulmonar, la integridad fsica triturada, dao heptico o trauma en el hgado) o el crecimiento incontrolado de clulas (por ejemplo, carcinoma de prstata), enzimas que pueden ser nicos a los tejidos especficos se liberan en la sangre. La medicin de estas enzimas intracelulares en el suero sanguneo por lo tanto proporciona mdicos y veterinarios con valiosa informacin sobre el diagnstico y pronstico de enfermedades en el sistema del cuerpo / humana y animal. Comisin de Enzimas (E.C.) Se trata de una comisin especial de la Unin Internacional de Bioqumica (IUB), que hizo recomendaciones para la clasificacin y nomenclatura de las enzimas y de las definiciones de las constantes matemticas usadas en enzi-ga. Las recomendaciones fueron publicadas por primera vez en 1964 y se publicaron en forma revisada en 1972, 1978 y 1984 (Stenesh, 1989) CLASIFICACION DE LAS ENZIMAS Esta es la organizacin sistemtica y el nombramiento de las enzimas que se basa en las recomendaciones de 1972 de la Comisin de Enzimas de la Unin Internacional de Bioqumica (Stenesh, 1989). Las reacciones y las enzimas que las catalizan forman 6 clases, cada una con 4 a 13 subclases. El nombre de la enzima tiene 2 partes. EL PRIMERO nombres del sustrato o sustratos. El segundo, que termina en-asa, indica el tipo de reaccin catalizada (Murray et al., 2000). Cada enzima se indica mediante un nmero de compuesto de cuatro cifras. La primera cifra indica una de las seis divisiones principales: oxidoreductasas, transferasas, hidrolasas, liasas, isomerasas y ligasas. La segunda cifra indica la subclase y la tercera cifra indica la subsubclase. La ltima cifra indica el nmero de serie de la enzima en su sub-subclase. El nmero de enzimas est precedida de la abreviatura CE (Stenesh, 1989). Por ejemplo, EC2.7.1.1 denota la clase 2 (una transferasa), subclase 7 (transferencia de fosfato), sub-subclase 1 (un alcohol es el aceptor de fosfato). El ltimo dgito denota la hexoquinasa, o ATP: D-hexosa-6-fosfatophotransferase, una enzima que cataliza la transferencia de fosfato desde el ATP al grupo hidroxilo en el carbono 6 de la glucosa (Murray et al, 2000.). Hay 6 clases de enzimas. Ellos son:
Oxidorreductasas: Estas enzimas estn involucradas en oxidaciones y reducciones de sus sustratos, por ejemplo alcohol deshidrogenasa, lactato deshidrogenasa, xantina oxidasa, glutatin reductasa, glucosa-6-fosfato deshidrogenasa. Transferasas: Estas enzimas catalizan la transferencia de un grupo particular de un sustrato a otro, por ejemplo aspartato amino transferasa (AST), alanina aminotransferasa (ALT), la hexoquinasa, fosfoglucomutasa, hexosa-1-fosfato uridiltransferasa, ornitina carbamoil transferasa etc
Hidrolasas: Estas enzimas llevar a cabo la hidrlisis por ejemplo, glucosa-6-fosfatasa, pepsina, tripsina, esterasas, glucsido hidrolasas etc Liasas: Estas son enzimas que facilitan la elimina-cin de molcula pequea de un gran sustrato por ejemplo, fumarasa, argino succinase, histidina descarboxilasa .. Isomerasas: Estas enzimas estn involucradas en isomerizacin-cin del sustrato por ejemplo, UDP-glucosa, epimerasa, isomerasa de la retina, racemasas, triosa fosfato isomerasa. Ligasas: Estas enzimas estn implicadas en la unin de 2 sustratos, por ejemplo sintetasa alanil-t-RNA sintetasa glutamina, DNA ligasas (Chatterjea y Shinde, 2002)
Especificidad enzimtica La especificidad es una caracterstica importante de las enzimas. Los 3 tipos diferentes de enzima especificidad / particularidades son:
Especificidad estereoqumica. La especificidad de la reaccin. Especificidad de sustrato, que puede ser absoluta o especificidad de sustrato relativa (Chatterjea y Shinde, 2002).
CINETICA ENZIMATICA
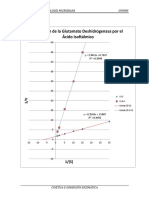
Esta es la cintica de las reacciones catalizadas por enzimas. Se incluye derivaciones de ecuaciones de velocidad y grficas anlisis de los datos experimentales para todos los tipos de reacciones enzimticas tales como las reacciones individuales o mltiples de sustrato, reacciones inhibidas o inhibido, o sistemas de equilibrio de estado estacionario (Stenesh, 1989). Enzima inmovilizada Esta es una enzima que se limita fsicamente mientras se lleva a cabo su funcin cataltica. Esto puede ocurrir naturalmente, como en el caso de las enzimas de partculas, o puede ser producida artificialmente por qumica o mediante mtodos fsicos (Stenesh, 1989). En los mtodos qumicos, la enzima est ligada covalentemente a un soporte. Estos mtodos incluyen la unin de la enzima a un soporte insoluble en agua, la incorporacin de la enzima en una cadena de polmero en crecimiento, o la reticulacin de la enzima con un reactivo de bajo peso molecular multifuncional. En los mtodos fsicos, la enzima no est ligado covalentemente a un soporte. Estos mtodos incluyen la adsorcin de la enzima a una matriz insoluble en agua, el atrapamiento de la enzima ya sea dentro de un gel insoluble en agua o un micro-cpsula, o la contencin de la enzima dentro de los dispositivos
especiales equipados con membrana semipermeable (Stenesh, 1989). Tcnica de inmovilizacin enzimtica tiene 2 ventajas: Las enzimas costosas se puede recuperar y volver a utilizar. La enzima tambin se puede usar en una variedad de configuracio-nes de biorreactores que permiten la operacin continua (Coombs, 1992)
LAS APLICACIONES COMERCIALES DE ENZIMAS INMOVILIZADAS Enzimas inmovilizadas se utilizan principalmente en la produccin de jarabes de alto contenido de fructosa (tambin conocido como HFCS o iso-glucosa). Otros usos comerciales incluyen la produccin de penicilinas semisintticas, la hidrlisis de almidn utilizando amiloglucosidasa y la resolucin de DLmezclas de aminocidos (Coombs, 1992). Enzimas inmovilizadas tambin tienen aplicaciones en las ciencias mdicas. Enzimas y coenzimas Muchas enzimas requieren una coenzima que funciona como reactivos de transferencia de grupo. Muchas enzimas que catalizan la transferencia de grupo y otras reacciones requieren, adems de su sustrato, una segunda molcula orgnica en general conocidos como coenzima, sin la cual estn inactivas. Coenzimas ampliar el repertorio de las capacidades catalticas de una enzima mucho ms all de los ofrecidos por los grupos funcionales por s solos de los aminocidos que constituyen la mayor parte de la enzima. Las coenzimas que estn estrechamente asociados con una enzima o bien a travs de unin covalente o fuerzas no covalentes se conocen como grupos prostticos (Murray et al., 2000) a menudo. Las coenzimas que son libremente difusible generalmente sirven como portadores continuamente reciclado de hidrgeno, dinucletido de flavina adenina (reducida) (FADH), hidruro de nicotinamida adenina dinucletido (reducido) (NADH) y nicotinamida adenina dinucletido fosfato (reducida) (NADPH), o qumicos unidades tales como grupos acilo (coenzima A) o grupos metilo (folatos), ellos yendo y viniendo entre sus puntos de generacin y consumo. Estos ltimos co-enzimas por lo tanto puede ser considerado como segundo sustratos (Murray et al., 2000). Las enzimas que requieren coenzimas incluyen aquellos que catalizan oxidoreductions, la transferencia de grupo y las reacciones de isomerizacin-zacin y reacciones que forman enlaces covalentes (IUB clases 1, 2, 5 y 6). Reacciones lticas, incluyendo las reacciones hidrolticas catalizadas por las enzimas digestivas, no requieren coenzimas. Clasificacin de las coenzimas Las coenzimas se pueden clasificar de acuerdo con el grupo cuya transferencia se facilitan. Basado en el concepto anterior, coenzimas se pueden clasificar de la siguiente manera: Las coenzimas que intervienen en la transferencia de grupos distintos de hidrgeno: Biotina, CoA-SH, (B12) coenzimas cobamida, coenzimas de folato, fosfato de piridoxal, cido lipoico, fosfatos de azcar, pirofosfato de tiamina. Las coenzimas participan en la transferencia de hidrgeno.
La nicotinamida adenina dinucletido (oxidado) (NAD +), nicotinamida adenina dinucletido fosfato (oxidado) (NADP +).
Mononucletido de flavina (FMN), la flavina adenina dinucle-otide (FAD), cido lipoico, coenzima Q (Murray et al., 2000). METODOLOGA DE LA PRODUCCIN DE ENZIMAS Las enzimas son producidas por el anabolismo celular, la natu-ralmente ocurre proceso biolgico de hacer ms molculas complejas a partir de otras ms simples. Fuente organismos incluyen bacterias, hongos, plantas y animales superiores (Blanco y Negro, 1997). Las enzimas pueden ser extradas de un organismo fuente dada por un nmero de diferentes mtodos (Nielsen et al., 1991). La mayora de los organismos que producen enzimas comerciales son los hongos. Estos organismos son moldes de Rhizopus oryzae, Aspergillus niger, Rhizomucor meihei, plagas tales como Endothia parasitica y levaduras tales como Saccharomyces spp. y Candida spp. Una cantidad considerable de investigacin ha sido con-canalizado sobre modificacin gentica de hongos u otros organismos para aumentar los rendimientos y las consistencias de las enzimas. Muchos de los organismos donantes potenciales son reportados como patgenos y estn siendo examinados para secuencias genticas que se insertarn en huspedes no patgenas (Surgey et al., 1996). Los mtodos clsicos de hibridacin tambin pueden ser utilizados para mejorar microorganismos productores de enzimas (Solis et al., 1997). Propiedades Los preparados enzimticos pueden consistir en clulas enteras, partes de clulas o extractos de clulas libres de la fuente utilizada. Las enzimas pueden estar en forma lquida, semilquida o seco. Las enzimas en general son fcilmente solubles en agua. Son prcticamente insoluble en alcohol, en cloroformo y en ter. El color de las preparaciones puede variar desde prcticamente incoloro a marrn oscuro. Preparaciones individuales son generalmente cha-caracterizada a por la funcionalidad y la actividad en lugar de las propiedades del producto (NAS, 1981). APLICACIONES DE ENZIMAS Las enzimas tienen una amplia variedad de usos (ETA, 1999). Se utilizan en las industrias (alimentos y bebidas, farmacutica, etc), que se utilizan para fines de investigacin, aplicaciones mdicas, aplicaciones comerciales, etc Las enzimas con aplicaciones bioqumicas Muchas enzimas se utilizan en sistemas bioqumicos. Algunos de estos son: a) aa-tRNA sintetasa: Se utiliza para la carga de una molcula de ARNt especfico con el aminocido apropiado. b) La adenilato ciclasa: produce monofosfato de adenosina cclico (cAMP). c) aspartoquinasa: Esta enzima cataliza la etapa inicial en la va para la biosntesis de varios aminocidos. Es un paso clave de la regulacin. d) -galactosidasa: Esta enzima se divide lactosa a la monosacridos constituyentes de glucosa y galactosa. Es el primer paso en la fermentacin de la lactosa.
e) -lactamasa: Esta enzima hidroliza el enlace -lactama en el ncleo de las penicilinas y cefalosporinas. Es responsable de la resistencia a la penicilina. f) El cloranfenicol acetiltransferasa (CAT): Esta enzima causa la resistencia a cloranfenicol, mediante la inactivacin del antibitico y se utiliza como un marcador selectivo y como un gen reportero. g) El glutamato deshidrogenasa: Es importante en la asimilacin de amonio. h) luciferasa: Esta enzima cataliza una reaccin de emisin de luz. Se utiliza como un reportero. i) resolvasa: Se cataliza la recombinacin especfica de sitio para resolver el co-integracin intermedia en la transposicin en dos molculas separadas. Las enzimas con aplicaciones biotecnolgicas Hay muchas enzimas empleadas en operaciones biotecnolgicas. Estos incluyen: 1) La fosfatasa alcalina: En la clonacin de genes, esta enzima se utiliza para eliminar los grupos fosfato desde el extremo 5I de molculas de ADN y tambin se utiliza como gen informador para la identificacin de seales de secrecin. 2) exonucleasa: Esta es una enzima que elimina los nucletidos de los extremos de fragmentos de ADN. A 5I ---- 3I exonucleasa elimina nucletidos del extremo 5I, mientras que un 3I ---- 5I exonucleasa elimina nucletidos del extremo 3I. 3) DNA polimerasa 1: Se le conoce principalmente como una polimerasa de "reparacin", que llena los vacos de cadena sencilla. Tambin est implicado en la reparacin de los huecos formados en el filamento de revestimiento durante la replicacin. Tambin posee tanto 5I --- 3I y 3I --- exonucleasa 5I. 4) fragmento de Klenow de la ADN polimerasa de E. coli 1: Esta enzima se utiliza para la secuenciacin de ADN utilizando el sistema de didesoxi de Sanger, llenando los extremos 3 empotradas de la enzima de restriccin de ADN tratado y tambin se utiliza para el etiquetado de los extremos de fragmentos de ADN (Daini, 2000) . La enzima tambin se utiliza para la segunda lnea de sntesis de ADNc en los procedimientos de ADNc. "Fragmento de Klenow 'es una escisin proteoltica de la ADN polimerasa I. Se deja un fragmento que carece de actividad exonucleasa 5I --- 3I. 5) ADN polimerasa III: Esta es la principal polimerasa 'replicacin'. 6) Helicase: Se desenrolla el ADN, por ejemplo, en la transferencia de plsmido conyugal. 7) ADN polimerasa de T4: Esta enzima se usa en el etiquetado de los fragmentos de ADN para su uso como sondas de hibridacin. 8) desoxinucleotidil transferasa terminal: Esta enzima se asla a partir de timo de ternera y cataliza la adicin de dNTP a los 3I-OH de las molculas de ADN. Uno de los principales usos de transferasa terminal es la cola de los vectores y de ADNc con las bases complementarias, lo que permite la clonacin de los fragmentos de ADNc (Daini, 2000). Tambin se puede utilizar para el etiquetado de 3I extremos de fragmentos de ADN. 9) polinucletido quinasa de T4: Esta enzima se asla de T4 infectadas por E. coli y cataliza la transferencia de fosfato de de ATP a un extremo 5I-OH en el ADN o ARN. Tambin se usa para el
etiquetado de los extremos 5I de ADN para la secuenciacin de ADN de Maxam y Gilbert y la fosforilacin de ADN que carece de terminales 5I-P. 10) La transcriptasa inversa: Esta es una enzima codificada por virus de la mieloblastosis aviar. Se cataliza la sntesis de ADNc a partir de una plantilla de ARN. Tambin se puede utilizar para el etiquetado de los extremos de ADN con extremos extendidos 5I. 11) Las endonucleasas de restriccin: endonucleasas de restriccin son enzimas que cortan molculas de ADN en posiciones especficas. Reconoce ADN "extrao" (no modificada) en algn lugar, y se degrada por escisin interna. Lo ms comnmente utilizados son las enzimas de restriccin de tipo II, que cortan en el sitio de reconocimiento. Algunos ejemplos son EcoRI a partir de E. coli, HindIII de Haemophilus influenzae, BamHI de Bacillus amyloliquefaciens, PstI de Providencia stuartii, SmaI de Serratia marcescens, Sau3A de Staphylococcus aureus, AluI de Arthrobacter luteus, TaqI de Thermus aquaticus y HpaII de Hae-mophilus parainfluenza . Una nomenclatura uniforme ha sido desarrollado para simplificar la nomenclatura de las endonucleasas de restriccin (Smith y Nathans, 1973). La designacin de estas enzimas provienen del organismo fuente, utilizando la primera letra del nombre del gnero ms los primeros 2 cartas de la especie, con las letras / nmeros adicionales para indicar la enzima especfica (ya que una especie pueden producir varios enzimas de res-triccin diferentes ) (Dale, 2001). 12) de ADN ligasa de T4: Esta enzima cataliza la formacin de un enlace fosfodister entre 3I-OH y 5Ifosfato termina en el ADN usando molculas de ADN con extremos cohesivos como sustrato (Daini, 2000). 13) exonucleasa III: Esta enzima se utiliza para la generacin de la plantilla de ADN lineal para la tcnica de dideoxysequencing y la generacin de extremos escalonados en ADN de doble cadena debido a su actividad de exonucleasa 5I ---- 3I. 14) exonucleasa : Esta enzima reconoce el terminal 5I -fosfato de ADN de doble cadena por su actividad de exonucleasa. Su uso principal es la eliminacin de terminal que sobresale 5I de ADN de doble cadena que es necesario para el terminal transferasa tizn de ADN (Daini, 2000). 15) SI endonucleasa: Esta enzima se asla de Aspergilus cryzae y acta exclusivamente en ssDNA o ARN. Se puede romper el ADN superenrollado, ya que contiene burbujas ss. Tambin se puede utilizar para distinguir superenrollado de ambos no supercoiled, crculos covalentes y ADN circular mellado, ambos de los cuales son resistentes a la enzima. 16): ligasa sella huecos de cadena sencilla (nicks) en el ADN de doble cadena. Tambin se utiliza para la formacin de molculas de ADN recombinantes en la clonacin de genes. 17) polinucletido quinasa: Se transfiere un grupo fosfato desde el ATP hasta el final 5I OH de ADN o ARN. 18) primasa: Esta es una ARN polimerasa especial, lo que hace que un cebador corto requerido para la sntesis de ADN. 19) Replicasa: Este es dirigida por ARN polimerasa de ARN utilizado en la replicacin de algunos virus de ARN. 20) La transcriptasa inversa: Este es dirigida por ARN polimerasa de ADN. Se sintetiza ADN (ADN complementario) usando molde de ARNm.
21) ribonucleasa (RNasa): Esta enzima degrada molculas de ARN. 22) Polimerasa de ARN: Esta enzima sintetiza ARN, usando una plantilla de ADN. 23) RNasa H: Esta es una ARNasa especfica que corta de ARN --- hbridos de ADN. Est implicada en la replicacin de plsmidos CoIE1-como. 24) nucleasa S1: Esta enzima degrada el ADN de cadena sencilla. 25) terminal transferasa: Esto aade nucletidos al extremo 3I de ADN, sin necesidad de una hebra molde. 26) La topoisomerasa: Esta es una clase de enzimas que altera la conformacin de ADN, por ejemplo, cambiando el grado de bobinado o superenrollamiento. 27) transposasa: Esta enzima cataliza los primeros pasos en la transposicin. Las enzimas como marcadores para la enfermedad Algunas enzimas se encuentran slo en tejidos especficos o en un nmero limitado de tales tejidos. Por ejemplo, la lactasa deshidrogenasa (LDH) tiene 2 formas diferentes, denominadas isoenzimas, en corazn y msculo esqueltico (Campbell, 1999). 2 Las formas difieren ligeramente en la composicin de aminocidos y se pueden separar sobre la base de la carga como resultado. Dado que la LDH es un tetrmero de cuatro subunidades, que tambin puede existir en 5 formas diferentes dependiendo de la fuente de las subunidades. Un aumento de cualquier forma de la LDH en la sangre indica algn tipo de dao en los tejidos. Un ataque al corazn por lo general se puede diagnosticar con certeza si hay un aumento de la LDH a partir de corazn. Tambin, hay diferentes formas de creatina quinasa (CK), una enzima que se produce en el msculo del cerebro, corazn y esqueltico. Apariencia del cerebro de tipo puede indicar un derrame cerebral o un tumor cerebral, mientras que el tipo del corazn indica un ataque al corazn. Despus de un ataque al corazn, CK aparece ms rpidamente en la sangre que el de LDH. El monitoreo de la presencia de ambas enzimas se extiende la posibilidad de un diagnstico, que es til, ya que un ataque al corazn muy leve puede ser difcil de diagnosticar. Un nivel elevado de la isoenzima de corazn en la sangre es una indicacin definida de daos en el tejido del corazn (Campbell, 1999). Otra enzima til ensayada es la acetilcolinesterasa (AChE), que es importante en el control de ciertos impulsos nerviosos. Muchos pesticidas afectan esta enzima, por lo que los trabajadores agrcolas a menudo se ponen a prueba para asegurarse de que no han recibido la exposicin inadecuada a estas toxinas agrcolas importantes (Campbell, 1999). Hay varias enzimas que se utilizan normalmente en el laboratorio clnico para diagnosticar enfermedades. Hay marcadores altamente especficos para enzimas activas en el pncreas, las clulas rojas de la sangre, el hgado, corazn, cerebro, glndula de la prstata y muchas de las glndulas endocrinas. Dado que estas enzimas son relativamente fciles de ensayo utilizando tcnicas automatizadas, son parte de las pruebas mdicas y veterinarias mdicos de sangre estndar son propensos a necesitar en el diagnstico y tratamiento / manejo de las enfermedades. Las enzimas utilizadas en los diagnsticos clnicos de enfermedades Muchas enzimas estn implicadas en los diagnsticos clnicos de diversas enfermedades en la medicina humana y veterinaria. Estas enzimas facilitan o mejoran diagnsticos rpidos de estas enfermedades. Estas enzimas se pueden clasificar en muchas clases. Ellos son:
1) Fosfatasa alcalina (ALP, EC 3.1.3.1): fosfatasas alcalinas son las enzimas sricas ms tempranos que se reconoce que tienen importancia clnica, cuando en la dcada de 1920, se descubri que aumentan en el hueso y las enfermedades del hgado (Kaneko, 1989). Desde entonces, han sido objeto de publicaciones ms que cualquier otra enzima (Stigbrand et al., 1984). Fosfatos alcalinos son un grupo de isoformas que hidrolizan muchos tipos de steres de fosfato, cuyo sustrato o sustratos naturales son desconocidos. El trmino'''' alcalina se refiere al pH alcalino ptimo de esta clase de fosfatasas in vitro. En los seres humanos y los animales, las fuentes principales de los Alpes son el hgado, los huesos, los riones y la placenta. En los humanos, est involucrado en el hueso y enfermedades hepatobiliares. ALP tambin son de importancia diagnstica en enfermedades de los animales. La actividad total ALP srica tiene valor diagnstico en las enfermedades del hgado y del hueso en los perros y gatos (Kaneko, 1989). Es de poco valor en las enfermedades hepticas de caballos y rumiantes, debido a la amplia gama de valores de referencia contra el que se debe comparar los valores de los pacientes. La gama de valor de ALP en suero en cabras puede ser 10 veces sin evidencia de dao heptico. Los valores dentro de la persona son bastante constantes para la evaluacin secuencial (Kaneko, 1989). 2) La creatina cinasa (CK; CE 2.7.3.2): isoenzimas de la creatina cinasa son la mayora de las enzimas sricas especficas de rgano en uso clnico (Kaneko, 1989). Ellos catalizan la fosforilacin reversible de la creatina por el ATP para formar fosfato de creatina, la forma principal de almacenamiento de alta energa de fosfato requerido por el msculo. Quinasas de creatina se encuentra en muchas partes del cuerpo como el corazn, cerebro, msculo esqueltico y msculo liso (Nduka, 1999), pero tienen su actividad especfica ms alta en el msculo esqueltico (Kaneko, 1989). En los seres humanos, la CK est asociada con el infarto de miocardio y enfermedades musculares (Nduka, 1999). Aumento de la CK en el fluido cerebroespinal se han asociado con una serie de trastornos en los perros, gatos, ganado vacuno y caballos (Mayhew et al, 1977;. Wilson, 1977). La CK son esos indicadores sensibles de dao muscular que, en general, slo un gran aumento en la actividad srica son de importancia clnica (Lewis, 1978). 3) La alanina aminotransferasa (ALT, EC 2.6.1.2): Anteriormente era conocida como transaminasa glutmico puruvate; GPT). Se cataliza la transaminacin reversible de L-alanina y 2-oxoglutarato a piruvato y glutamato en el citoplasma de la clula. ALT se puede encontrar en el hgado, el msculo esqueltico y el corazn (Nduka, 1999). La mayor actividad especfica de la ALT en los primates, perros, gatos, conejos y ratas es en el hgado. Es un hecho bien establecido, sensible indicador especfico de hgado de daos. Sin embargo, ALT en los tejidos de los cerdos, caballos, ganado, ovejas o cabras es demasiado bajo para ser de valor diagnstico (Boyd, 1983). Se utiliza como un indicador de la hepatopata en los estudios toxicolgicos que utilizan pequeos roedores de laboratorio as como los perros (Kaneko1989). 4) aspartato aminotransferasa (AST, EC 2.6.1.1): Antiguamente se llamaba transaminasa glutmico oxalactica; GOT). Se cataliza la transaminacin de L-aspartato y 2-oxo-glutarato de oxaloacetato y glutamato. AST se encuentra en el msculo esqueltico, corazn, hgado, rin y eritrocitos y est asociada con el infarto, del parnquima heptico y enfermedades musculares en los seres humanos y los animales. La pre-sencia de AST en tantos tejidos hacen su nivel srico un buen marcador de tejido blando, pero impide su uso como una enzima especfica de rgano (Boyd, 1983). Los glbulos rojos contienen una gran cantidad de AST, que las fugas en el plasma antes de que se observa hemlisis (Kaneko, 1989). 5) sorbitol deshidrogenasa (SDH, EC 1.1.1.14): Esto tambin se llama L-iditol deshidrogenasa; IDH. Se cataliza la oxidacin rever-sible de D-sorbitol a D-fructosa con el cofactor NAD (Gerlich, 1983; Lessing y McGuinness, 1982). La actividad plasmtica es baja en el perro y el caballo plasma, pero sensiblemente
mayor en el ganado bovino, ovino, caprino y suero. Aparte de los testculos, que se encuentra en cantidades apreciables slo en los hepatocitos (Boyd, 1983). Como resultado de esto, un aumento de la SDH de plasma es consistente con el dao de hepatocitos. SDH es especfica del hgado en los seres humanos (Nduka, 1999) y todas las especies de animales (Kaneko, 1989) y dao heptico parece ser la nica fuente de aumento de la actividad SDH. Aunque SDH es especfica del hgado en todas las especies, el uso ya establecido de ALT en perros y gatos ha limitado SDH como un indicador de diagnstico de dao hepatocelular a los caballos, vacas, ovejas y cabras (Kaneko, 1989). 6) Las deshidrogenasas lctica (LDH, EC 1.1.1.27): Se cataliza la oxidacin reversible de piruvato a lactato L (+) con el cofactor NAD. El equilibrio favorece la formacin de lactato, pero el mtodo de ensayo preferido es en la direccin de piruvato porque piruvato tiene un efecto inhibidor sobre la LDH. La lactato deshidrogenasa tiene isoenzimas. LDH se puede encontrar en el corazn, hgado, eritrocitos, msculo esqueltico, las plaquetas y los ganglios linfticos. En los seres humanos, que est implicada en el infarto de miocardio, hemlisis y enfermedad heptica (Nduka, 1999). Perfiles de isoenzima LDH fueron los primeros perfiles de isoenzimas utilizados en medicina veterinaria clnica en un intento para detectar daos en los rganos especficos (Kaneko, 1989). La introduccin de procedimientos ms altamente especfica de rgano se ha traducido en LDH ya no est en uso comn en la medicina veterinaria (Moore y Feldman, 1974). 7) la colinesterasa (ChE): la colinesterasa srica (ChE) se compone de dos colinesterasas distintas. El sustrato principal es la acetilcolina, el neurotransmisor encontrado en la unin neuromuscular. La acetilcolinesterasa (AChE, EC 3.1.1.7) que se encuentran en la unin neuromuscular es la verdadera ChE y es esencial en la hidrlisis de la acetilcolina por lo que la unin puede ser restablecido y se prepar para las seales adicionales (Whittaker, 1983). El mioneural AChE calle transversal tambin se encuentra en los glbulos rojos (RBC), ratn, cerdo, cerebro e hgado de rata. Slo una pequea cantidad de la AChE se encuentra en el plasma. El ChE de plasma es un pseudocolinesterasa, butilcolinesterasa (ButChE; EC 3.1.1.8), que hidroliza butirilcolina cuatro veces ms rpido que la acetilcolina y tambin se encuentra en la materia blanca del cerebro, hgado, pncreas y la mucosa intestinal (Kaneko, 1989) . Las disminuciones en ButChE se han reportado en los seres humanos con infeccin aguda, distrofia muscular, enfermedad renal crnica y el embarazo, as como insecticida intoxifi-cacin. 8) Lipasa (LIP): lipasas pancreticas en suero (EC 3.1.1.3; triacilglicerol lipasa) catalizan la hidrlisis de triglic-cridos preferentemente en las posiciones 1 y 3, la liberacin de dos cidos grasos y un 2'monoglicridos. La lipasa se puede encontrar en el pncreas y el tracto hepatobiliar y est implicado en la enfermedad pancreatitis y hepatobiliar (Nduka, 1999). 9) -amilasa (AMY; EC 3.2.1.1): -amilasas son metaloenzimas dependientes de calcio que catalizan la hidrlisis aleatoria de los hidratos de carbono complejos, por ejemplo, glucgeno en los 1 -4 vnculos. Los productos de esta accin son maltosa y dextrina lmite. La enzima es una metaloenzima de Ca2 +, que requiere uno de un nmero de iones activadores tales AscI-o Br-(Wahlefeld, 1983). Amilasa se puede encontrar en las glndulas salivares, pncreas y ovarios y se utiliza como una ayuda para el diagnstico de la pancreatitis. 10) -glutamiltransferasa (GGT; 2.3.2.2): Esta es una carboxipeptidasa, que escinde los grupos glutamil C-terminales y los transfiere a pptidos y otros aceptores adecuados. Se especula que la GGT se asocia con el metabolismo de glutatin (Kaneko, 1989). La principal fuen-tes son el hgado y el rin y est implicado en la enfermedad hepa-tobiliary y el alcoholismo. Trastornos colestticos de todas las especies examinadas resultado un aumento de la actividad de GGT en suero (Braun et al., 1987).
11) Tripsina (CE; 3.4.21.4): tripsinas son proteasas sricas que hidrolizan los enlaces peptdicos formados por lisina o arginina con otros aminocidos. Son secretadas por el pncreas como el tripsingeno zimgeno, que es conver-ted a la tripsina por enteroquinasa intestinal o tripsina en s. La tripsina se puede encontrar en el pncreas y est implicada en la pancreatitis, del tracto biliar y enfermedades fibroqusticos. En el ser humano, suero inmunorreactividad similar a la tripsina (TLI) aumenta en condiciones que tambin dan lugar a aumentos de la amilasa srica, incluyendo insuficiencia renal (Kaneko, 1989). Suero TLI disminuye en la insuficiencia pancretica exocrina canino (Williams y Batt, 1983, 1988). 12) El glutatin peroxidasas (GPx, EC 1.11.1.9): Estos son metaloenzimas que contienen cuatro tomos de selenio por molcula de enzima. Ellas catalizan la oxidacin de glutatin reducido por el perxido para formar agua y oxi-subsidiado glutatin (Kaneko, 1989). Debido a la alta concentracin de selenio en glutatin peroxidasas, hay una buena correlacin directa entre la cantidad de actividad GPx de glbulos rojos y la concentracin de selenio de otros rganos (Anderson et al, 1976;.. Ammerman et al, 1980) . Otras enzimas con aplicaciones de diagnstico de enfermedades son la fosfatasa cida (ACP), que se encuentra en la prstata y eritrocitos y se utiliza en el diagnstico del carcinoma de prstata. La aldolasa (ALD), que se encuentra en el msculo esqueltico y el corazn y los msculos involucrados en la enfermedad. El glutamato deshidrogenasa (GLDH), que se encuentra en el hgado se utiliza para diagnosticar la enfermedad del parnquima heptico. Hidroxibutirato deshidrogenasa (HBD), que es la forma del corazn de la lactato deshidrogenasa est implicada en el infarto de miocardio. As como ensayo de la enzima se utiliza para diagnosticar enfermedades en los seres humanos y los animales, sino que tambin se puede aplicar a la inve-jo la responsabilidad de las enfermedades en las plantas. Por ejemplo, se ha encontrado que una lesin (ya sea mecnica o patgenos) resulta en una marcada, aumento localizado en la actividad de la deshidrogenasa de glucosa-6-fosfato, pero no de la glucosa fosfato isomerasa, que indica la desviacin de degradacin de la glucosa de la gluclisis a la ruta de las pentosas fosfato. Las enzimas como antioxidantes Varios radicales pueden contribuir a la oxidacin de lpidos en los sistemas biol-gicos (Hundson, 1990). Los radicales superxido O2-, que puede ser producido por la enzima xantina oxidasa y perxido de hidrgeno (Kellogg y Fridovich, 1975) pueden ser eliminados mediante la enzima superxido dismutasa de acuerdo con (Endo et al., 1985).
La enzima catalasa tambin puede desempear un papel importante en la conversin de perxido de hidrgeno en agua y oxgeno (Foote y Denny, 1968).
Puesto que la leche contiene xantina oxidasa y la superxido dismutasa, Korycka-Dahl y Richardson, (1980) llegaron a la conclusin de que estas reacciones pueden contribuir a la estabilidad de la leche Las enzimas usadas en inmunoensayos Las enzimas tambin pueden ser utilizados como una alternativa a los radioistopos como marcadores en inmunoensayos (Palmer, 2001). Tales procedimientos, conocidos como inmunoensayos enzimticos, se han utilizado para la determinacin de una variedad de protenas y hormonas. El papel de las enzimas en los procedimientos de inmuno-ensayo es un papel secundario, que se utilizan para reemplazar radioistopos como marcadores, ya que no son peligrosas para la salud y pueden ser detectados por tcnicas que son ms generalmente disponible. Cualquier enzima con un procedimiento de ensayo sensible y conveniente se puede utilizar para este propsito. Dos ejemplos comunes de inmunoensayo enzimtico (EIA) son procedimientos de ensayo inmunoabsorbente ligado a enzimas (ELISA) y la prueba de enzima-inmunoensayo multiplicado (EMIT). ELISA es un ensayo altamente sensible que puede ser utilizado para detectar un antgeno o anticuerpo (Engvall y Carlson, 1976). Aplicaciones de ELISA incluyen diagnsticos para enfermedades no infecciosas que implican hormonas, drogas, componentes del suero, protenas oncofetales, o enferme-dades autoinmunes, as como de diagnstico para enfermedades infecciosas causadas por organismos bacterianos, virales, micticas o parasitarias (Voller et al., 1979) . Las enzimas utilizadas con frecuencia en ELISA son peroxidasa de rbano picante, fosfatasa alcalina y beta-galactosidasa. En EMIT, la actividad de la malato deshidrogenasa se ensaya mediante la metodologa estndar de la enzima para la deteccin de tiroxina por inmuno-ensayo marcado con enzima. Las enzimas como agentes teraputicos En unos pocos casos, las enzimas han sido utilizados como medicamentos en el tratamiento de problemas mdicos especficos (Devlin, 1986). La estreptoquinasa es una mezcla de enzimas preparado a partir de estreptococos. Es til en la limpieza de los cogulos de sangre que se producen en las extremidades inferiores. La estreptoquinasa se activa la proenzima plasmingeno fibrinoltico que normalmente est presente en el plasma. La enzima activada es la plasmina. La plasmina es una proteasa de serina como la tripsina que ataca fibrina, escindir en varios componentes solubles (Devlin, 1986). Otra enzima de importancia teraputica es aspara-ginase. Tratamiento con asparaginasa se utiliza para algunos tipos de leucemia en adultos. Las clulas tumorales tienen un requi-sito nutricional para asparagina y deben limpiar que a partir de plasma del husped. Mediante la administracin de asparaginasa IV, nivel en plasma del husped de asparagina est notablemente deprimido, lo que resulta en deprimiendo la viabilidad del tumor (Devlin, 1986). Reemplazo enzimtico en individuos que son genticamente deficientes en una enzima particular tambin son aplicaciones de enzimas como agentes teraputicos. Adems, enzimas tales como u-activador del plasmingeno, anteriormente conocida como uroquinasa, extrada de la orina humana, puede ser infundido en el torrente sanguneo de los pacientes en riesgo de una embolia pulmonar (un fragmento de un alojamiento de cogulos de sangre en la arteria pulmonar): estas enzimas estimulan un sistema de cascada responsable de la produccin de plasmina activa, una enzima proteoltica que digiere la fibrina, el principal componente estructural de cogulos de sangre. Algunas enzimas tambin pueden ser utilizados para restringir el crecimiento de las clulas cancerosas, privndola de los nutrientes esenciales: por ejemplo, Lasaparaginase se puede usar en el tratamiento de varios tipos de leucemia, ya que las clulas tumorales, en contraste con las clulas normales, tener un requisito para exgeno L-asaparagine. Otro ejemplo de aplicacin teraputica de las enzimas es el uso de enzimas inmovilizadas como componentes de mquinas de rin artificial, que se utilizan para eliminar la urea y otros productos de desecho del cuerpo, donde la enfermedad de rin impide que esta se realiza por procesos naturales (Palmer, 2001). La urea entra en la mquina de la sangre, por dilisis (hemodilisis denominado) y se convierte en CO2 y NH4 + por la ureasa inmovilizada; txico NH4 + es entonces o bien atrapados en resinas de intercambio inico o incorporado en glutamato por la accin de inmovilizado de la glutamato
deshidrogenasa ligada a la alcohol deshidrogenasa para asegurar el reciclaje coenzima, antes de que se devuelva el fluido a la corriente de la sangre. Las enzimas y los errores congnitos del metabolismo Un error innato del metabolismo se caracteriza por la prdida de la actividad de una enzima especfica, como resultado de una mutacin gentica. Errores congnitos son raros, pero con-diciones posiblemente severa, a menudo causando retraso mental e incluso la muerte en la infancia (Palmer, 2001). Las enzimas tambin se utilizan en el tratamiento de algunos errores innatos del metabolismo. Idealmente, se lograra tratamiento completo si alguna enzima normal podra ser introducido en el sitio apropiado. En el caso de las enzimas del tracto gastrointestinal, esto se puede conseguir fcilmente mediante la administracin oral. Por ejemplo, donde hay una lactasa (-galactosidasa) deficiencia en las clulas del intestino, que puede ocurrir como un error innato o como una caracterstica secundaria de otras enfermedades, lactosa ingerida (en la leche)-no se puede descomponer a galactosa y glucosa, y los resultados de molestias graves. Esta condicin puede tratarse eliminando los productos lcteos de la dieta, o ms conve-nientemente mediante la adicin a la misma de -galactosidasa extrado de microorganismos para realizar la tarea normalmente realizada por la lactasa del cuerpo. Los ensayos enzimticos se utilizan para confirmar el diagnstico de errores innatos del metabolismo. Ejemplos son la enfermedad de Tay-Sachs, causado por una deficiencia de BN-acetylhexo-saminidase (tambin conocida como la hexosaminidasa A) la actividad. Un ejemplo de un error innato autosmico recesivo del metabolismo es la fenilcetonuria, donde el paciente tiene una capacidad muy limitada para convertir la fenilalanina en tirosina, debido a una reduccin de la actividad de fenilalanina-4monooxigenasa, mejor conocido como fenilalanina hidro-xylase. Un ejemplo de un error innato que parece ser transmitida por un modo dominante ligada al cromosoma X es la deficiencia de ornitina carbamoil transferasa (OCT), tambin conocido como hiperamonemia, un defecto del metabolismo del ciclo de la urea (Palmer, 2001). Otra ligada al cromosoma X, pero recesiva, la enfermedad es el sndrome de Lesch-Nyhan, un trastorno del metabolismo de la purina que resulta de una deficiencia de la hipoxantina fosforribosil transferasa actividad. Las enzimas como fuentes de biocombustibles Frances Arnold ha informado de que el diseo de mejores enzimas utilizadas para la fabricacin de biocombustibles a partir de celulosa (Goho, 2008). Las enzimas celulolticas se descomponen la celulosa que se encuentra en la biomasa de modo que se puede utilizar como materia prima para los biocombustibles. El aumento del uso de biocombustibles de celulosa podra reducir las emisiones de gases de casa verde y reducir la dependencia del suelo. Fuentes de los biocombustibles celulsicos son los residuos agrcolas, astillas de madera y hierbas de la pradera. Las ventajas de los biocombustibles celulsicos ms de la gasolina y el etanol de maz son (i). Quemar etanol celulsico en lugar de la glucosa podra reducir las emisiones de gases de efecto invernadero en un 87% y (ii). La celulosa es el material orgnico ms abundante en la tierra. Sin embargo, la conversin de almidn de maz en azcar requiere de una sola enzima, mientras que romper la celulosa implica una serie compleja de enzimas llamadas celulasas que trabajan jun-tos (Goho, 2008). El objetivo general de la investigacin es que cuando est completamente explotado, el etanol de celulosa se reduse significativamente el uso de la gasolina. Las enzimas en la investigacin Ensayo enzimtico se utiliza para la investigacin de procesos como el pardeamiento de los productos vegetales, que evita problemas durante la conversin de frutas y verduras en las bebidas y conservantes. Las enzimas tambin son importantes para la re-bsquedas en las enfermedades de los seres humanos y los animales de investigacin, la biotecnologa y otras reas de investigacin, es decir, las enzimas han sido utilizados en la investigacin para el tratamiento mejor y alter-nativa de enfermedades. Por ejemplo, Billigmann (1995) inform de la terapia enzimtica como una alternativa en los tratamientos de herpes zoster. Bartsch (1974) inform sobre el uso de enzimas proteolticas en el tratamiento del herpes zoster. Scheef (1987) tambin inform sobre el uso de enzimas con fines
teraputicos. Pathney y Pachori (1986) informaron de un estudio de las enzimas glucolticas suero y suero contra la hepatitis B en relacin a la terapia Liv.52. Adems, (Stauder y Kabil, 1997; Kabil y Stauder, 1997) informaron la terapia enzimtica oral en pacientes con hepatitis C. Nikolaev et al. (1998) reportaron el uso clnico de Belosorb y Wobenzyme en el tratamiento de la hepatitis viral B. Korpan et al. (1997) informaron el mecanismo de la eficacia teraputica de Wobenzyme en el tratamiento de la hepatitis txica. Jager (1990) inform de enzimas hidrolticas en el tratamiento de infecciones por el VIH. Mikazans (1997) inform de la posibilidad de tratar el Herpes Zoster usando enzimas. Mudrak et al. (1997) informaron de la terapia adyuvante con enzimas hidrolticas en papilomatosis larngea recurrente. La determinacin de la actividad de la enzima es de importancia en la determinacin del estado metablico de los tejidos de la fruta y su calidad de conservacin en almacenamiento. Por ejemplo, la actividad de la lipoxigenasa, pero-xidase y fosfatasa cida se mejoraron en frutos de tomate despus de los tratamientos con cido indol-actico, cido indol-butrico y cido actico naftaleno (Olaiya, 2006). Las enzimas como reactivos en la qumica clnica Las enzimas se utilizan como reactivos en la qumica clnica. D-glucosa en la sangre y otros fluidos fisiolgicos se analiza comnmente por medio de procedimientos que implican la glucosa oxidasa (Palmer, 2001). La reaccin catalizada por la glucosa oxidasa se utiliza en una tira de ensayo (Clinistix) para el cribado de muestras de orina. La glucosa oxidasa y los reactivos para una reaccin de indicador de produccin de color se impregnan en una tira de plstico, de modo que la intensidad del color azul obtenido cuando se sumerge en una muestra proporciona una indicacin del contenido de D-glucosa. Esto se puede utilizar en el diagnstico de la diabetes mellitus. D-glucosa tambin puede analizarse mediante una reaccin catalizada por la hexoquinasa-, a pesar de que esta enzima puede utilizar cualquier D-hexosa como sustrato, o mediante el uso de la glucosa deshidrogenasa (Palmer, 2001). Lactato de la sangre y del piruvato generalmente son determinados por medio de mtodos de lactato deshidrogenasa-catalizadas y urea en la sangre a veces se analizaron por procedimientos INVOL-Ving ureasa (Palmer, 2001). Adems, el colesterol en sangre se puede determinar por una reaccin catalizada por la colesterol oxidasa. Los triglicridos y cido rico tambin pueden ser analizados por mtodos enzimticos. Luciferasa es un Mg2 + - enzima activada. Procedimientos de luciferasa catalizadas se utilizan para el anlisis de trifosfato de adenosina (ATP) (por ejemplo, a partir de plaquetas de la sangre) y tambin se pueden usar para determinar el Mg2 + concentracin o la pO2. Las enzimas como reactivos analticos Las enzimas muestran varias caractersticas que los hace adecuados para aplicaciones analticas. Enzima CATALY-ses una reaccin que es a la vez especfico del sustrato y productos especficos. Como resultado de esto, las enzimas son muy valiosos como reactivos analticos. Pueden ser utilizados para la estimacin de sustancias especficas, eventualmente presentes en concentraciones muy bajas, en la presencia de otros, qumicamente similares, sustancias (Palmer, 2001). Mtodos analticos basados en enzimas son a la vez especfico y sensible, lo que significa poca o ninguna preparacin de la muestra se requiere en muchos casos. Otra caracterstica de las reacciones catalizadas por enzimas que los hace adecuados para aplicaciones analticas es que se desarrollen en condiciones relativamente suaves (por ejemplo, a un pH cercano al neutro y alrededor de temperatura ambiente). Como resultado de esto, son fcil de configurar y se pueden utilizar para el anlisis de sustancias que seran inestables en condiciones ms extremas. Procedimientos analticos basados en enzimas pueden ser diseados para determinar la concentracin de sustratos, coenzimas, activadores e inhibidores (Palmer, 2001). Sin embargo, todas las soluciones utilizadas en los procedimientos de anlisis enzimticos deben estar libre de contaminacin por microorganismos y los iones metlicos. Las enzimas con aplicaciones industriales
Las enzimas tienen amplias aplicaciones en diferentes industrias particularmente en las industrias alimentaria y farmacutica. La actividad de ciertas enzimas puede ser determinado antes y despus de la pasteurizacin y la esterilizacin procedimientos para acertain si stas se han realizado correctamente. Por ejemplo, la fosfatasa alcalina y la invertasa presente en la leche se inactivan dentro de la misma gama de temperatura como se requiere para la pasteurizacin. La activa-cin de estas dos enzimas, al final de todo el proceso podra dar una indicacin de su eficacia. El grado de contaminacin bacteriana de los productos alimenticios se puede estimar mediante el ensayo de enzimas microbianas no normalmente presentes en los alimentos. Este principio se aplica en el anlisis de la leche para determinar si su estado contaminada. La leche debe contener normalmente slo pequeas cantidades de reductasas, pero las bacterias produce grandes cantidades. Reductasas pueden ser fcilmente ensayadas, ya que catalizan la reduccin de azul de metileno a azul de metileno leuco-incoloro en condiciones anaerbicas (Palmer, 2001). Una tira de ensayo (Bactostrip) la incorporacin de sales de 2,3, 4-trifeniltetrazolio proporcionar una manera conveniente de las pruebas para detectar la presencia de bacterias Thr, un colorante formazan rojo que se produce como resultado de la accin de la reductasa. Las enzimas tambin se utilizan para determinar si los productos vegetales almacenados son adecuados para su uso como productos alimenticios. Por ejemplo, -amilasa debe estar presente en cantidades relativamente bajas en las semillas de trigo almacenados. Por lo tanto, la actividad de -amilasa de plantas de alimentos se puede determinar para determinar su grado de idoneidad para el uso para el propsito deseado. La frescura de la carne se puede determinar mediante el uso de la monoamina oxidasa para detectar aminas formados durante la degradacin. Tambin, enzima-inmunoensayo se utiliza para detec-tar adulteracin de los alimentos, por ejemplo, la adicin de caballo a los productos de carne de vacuno (Palmer, 2001). as concentraciones de varios azcares y aminocidos individuales en los productos alimenticios tambin pueden ser determinados por mtodos especficos de anlisis enzimtico. En la vinificacin, la concentracin de cido mlico a veces se determina por un mtodo que implica la malato deshidrogenasa. La aclaracin de la sidra, vinos y zumos de fruta (por ejemplo, manzana) se consigue normalmente mediante tratamiento con pectinasas fngicas (Palmer, 2001). La papana se utiliza a veces como un ablandador de carne. La papana (y otras proteasas) tambin puede ser utilizado en la industria de elaboracin de la cerveza para evitar brumas frialdad, causadas por la precipitacin de complejos de protenas y taninos a bajas temperaturas. -amilasa bacteriana (a partir de Bacillus subtilis), que es an ms estable al calor que el trigo -amilasa, es de importancia en la industria de elaboracin de la cerveza. El uso tradicional de levaduras (por ejemplo Saccharomyces carlsbergensis) en las industrias de coccin y elaboracin de la cerveza surgi debido a que contienen las enzimas para la fermentacin alcohlica, la alcohol deshidrogenasa (Palmer, 2001). El azcar invertido, una mezcla de glucosa y fructosa, se produce a partir de sacarosa por la accin de la levadura -fructo-furanosidase, ms conocido como la invertasa (una enzima que puede ser extrado por la ruptura de la pared celular de la levadura). Las enzimas tambin son de gran valor para la industria farmacutica. Por ejemplo, se utilizan para la conversin de origen natural penicilina G (bencilpenicilina) a cido 6-amino (6-APA). Esta reac-cin es catalizada por la penicilina amidasa (Palmer, 2001). Proteasas bacterianas tambin se utilizan en las industrias del cuero y textil para aflojar el pelo (o la lana) y permitir que sea separado de piel. Las enzimas tambin se utilizan en la produccin de molculas biolgicas (Daini, 2000). Las enzimas se utilizan en una variedad de formas mucho antes de que se reconocieron como bioqumicos componentes definidos en las clulas vivas. Los procesos para la fabricacin de pan, vino, queso, vinagre, alcohol, etc se han conocido desde anti-quity (Aurand et al., 1987). Las enzimas tienen varias caractersticas que los hacen significativa para su uso en procesos industriales. Ellos son: 1. Logran, aceleran la reaccin de manera eficiente. 2. Los tipos de la reaccin se pueden controlar fcilmente ajustando el tiempo de la temperatura, el pH y la reaccin.
3. La actividad enzimtica puede ser destruida por calentamiento a temperaturas de desnaturalizacin.. 4. Ellos son de origen natural y no txico y por lo tanto pueden permanecer en el producto sin ningn tipo de conos-cuencias perjudiciales. 5. Ellos exhiben gran especificidad y pueden ser utilizados general-mente a niveles de menos de 1% del lote de producto comercial (Aurand et al., 1987). Las enzimas y el sistema inmunolgico Las enzimas se convierten en parte del sistema inmunolgico (alfa-2-macroglobulina), trabajar con l y facilitar su funcin. (Laver et al., 2001) informaron de la modulacin de las propiedades de unin del factor de crecimiento de la alfa 2-macroglobulina por terapia de la enzima. Se encontr Ingestin de proteinasas para desencadenar la formacin de formas intermedias de alfa-2-macroglobulina mostrando una alta afinidad de factor de crecimiento transformante beta (TGF-). Observaron mxima unin de TGF- 1 - 2 h despus de la ingestin del bolo y estearato dily nivelado con el tiempo. Llegaron a la conclusin de que la absorcin intestinal de proteinasas desencadena la formacin de especies de unin a TGF- de alfa 2 macroglobulina en la sangre. Mediada por este proceso altas concentraciones de TGF- podran reducirse a travs de una mayor liquidacin de alfa-2-macroglobulina complejos TGF-. Por lo tanto, la terapia de proteinasa puede tener efectos beneficiosos en el tratamiento de la fibrosis y ciertos tipos de cncer acompaado por concentraciones excesivamente altas de TGF-. Desser et al. (2001) informaron que la terapia oral con enzimas proteolticas disminuye los niveles de TGF-beta excesivos en la sangre humana. En el estudio, que establecan que el tratamiento con enzimas proteolticas orales (OET) con productos de combinacin de frmacos que contienen la papana, bromelina, tripsina y quimotripsina han demostrado ser beneficioso en entornos clnicos, tales como la fibrosis inducida por la radioterapia, bleomicina pneumotoxicity y la inmuno-supresin en cncer, todos los cuales estn hoy en da knowned estar acompaado por el factor de crecimiento transformante excesiva - production.They beta (TGF-) lleg a la conclusin que sus resultados apoyan el concepto de que OET es beneficiosa en enfermedades caracterizadas, en parte, por la sobreproduccin de TGF- 1 Enzimas de origen animal Las enzimas derivadas de animales por ejemplo cuajo, hgado bovino catalasa, lipasa animales, pancreatina, pepsina, tripsina y la lisozima que no estn genticamente puede ser utilizado en alimentos procesados etiquetados como orgnicos''''. Aditivos en el fondo, incluidos los auxiliares tecnolgicos utilizados en la produccin de los preparados enzimticos, no debe ser sinttico o sean sustancias que figuren en la lista nacional de ingredientes autorizados para su uso en los alimentos etiquetados'' ecolgica'' (consenso). Cuajo de origen animal bovino y cuajo son sustancias alimenticias directos afirmaron que generalmente reconocido como seguro (GRAS) (FDA, 1995). Cuajo y cuajo bovina son extractos comerciales que contengan la enzima renina activa, tambin conocida como la quimosina. El cuajo es el extracto acuoso preparado a partir de limpiar, congelados, salados o cuarto estmagos secos de terneros, cabritos o corderos. Bovina cuajo es el producto de los adultos de los animales mencionados anteriormente. Ambos productos se llaman cuajo. La renina es la enzima de coagulacin de la leche de la mucosa del estmago'' cuarto'' verdadero (abomaso) de los terneros jvenes. La estructura de renina se compone de un nico polipptido con un puente de disulfuro interno (Budaveri, 1996). Los animales utilizados para la produccin de cuajo y cuajo bovino deben certificada libre de la encefalopata espongiforme bovina (EEB) (ganado bovino) o scrapie (ovejas, cabras). El cuajo es un coagulante utilizado para cuajar la leche para ser convertido en queso o crema agria. El efecto de coagulacin de leche de renina se debe a una hidrlisis limitada y especfica de la E-casena que rodea a las micelas de protena en la leche. Como resultado, las micelas pierden su carga electrosttica y son capaces de agregado con la ayuda de iones de calcio y fsforo para formar una red que atrapa las micelas de grasa y una estructura de gel se forma por lo tanto (Nelsen, 1992). Plantas y hongos derivados de enzimas
Hay muchas especies de plantas diferentes y enzimas de hongos utilizados en el procesamiento. Entre ellos se encuentra pectinasa, poli (1,4--D-galacturnido) glycanohydrolase, poli (1,4--galacturo-nide) liasa y pectylhydrolase (NOSB, 1995).
Vous aimerez peut-être aussi
- Enzimas Que Inhiben La Transcripción de DNADocument3 pagesEnzimas Que Inhiben La Transcripción de DNAJuan Carlos Bracamontes GutierrezPas encore d'évaluation
- Sistema Endocrino VeterinariaDocument45 pagesSistema Endocrino Veterinariayaeris camargoPas encore d'évaluation
- Propuesta Texto EAE (2011) - RAL-RMYDocument127 pagesPropuesta Texto EAE (2011) - RAL-RMYIsaac Pineda CarbajalPas encore d'évaluation
- Problemario Cinética Enzimática UpibiDocument8 pagesProblemario Cinética Enzimática UpibiLillian Alexa González IslasPas encore d'évaluation
- Informe Laboratorio 3B Grupo A 2022 - 2Document4 pagesInforme Laboratorio 3B Grupo A 2022 - 2Benjita NorambuenitaPas encore d'évaluation
- Flujograma de Actividad EnzimaticaDocument1 pageFlujograma de Actividad EnzimaticaIrene VidalPas encore d'évaluation
- Regulación Del Ciclo de KrebsDocument2 pagesRegulación Del Ciclo de KrebsRosa Marcela Rojas CorralesPas encore d'évaluation
- BioprocesosDocument149 pagesBioprocesosF CP100% (1)
- Practica 05 - Laboratorio - Análisis y Control de CalidadDocument16 pagesPractica 05 - Laboratorio - Análisis y Control de CalidadSheyla AguirrePas encore d'évaluation
- Tinto Pretratamiento F Proteicas LanaDocument46 pagesTinto Pretratamiento F Proteicas Lananicole talavera zeladaPas encore d'évaluation
- Universidad Nacional de IngenieriaDocument3 pagesUniversidad Nacional de IngenieriaalonsoPas encore d'évaluation
- Charla de ParationDocument9 pagesCharla de ParationJosé Eduardo PérezPas encore d'évaluation
- Informe Cinetica EnzimaticaDocument19 pagesInforme Cinetica EnzimaticacarmenPas encore d'évaluation
- Metabolismo EnzimasDocument46 pagesMetabolismo EnzimasMartinez Díaz Oscar EduardoPas encore d'évaluation
- Proteinas de La SalivaDocument10 pagesProteinas de La Salivaangelik89Pas encore d'évaluation
- Teoría Semana 2 Clase 1Document20 pagesTeoría Semana 2 Clase 1Alvaro SolisPas encore d'évaluation
- Clase 2 - Microbiología Grupo 19Document16 pagesClase 2 - Microbiología Grupo 19Yeris Valeria Mora OrjuelaPas encore d'évaluation
- BiocorrosionDocument16 pagesBiocorrosionFranklin RayoPas encore d'évaluation
- Alimentacion Natural HumanaDocument16 pagesAlimentacion Natural HumanamgiraldohPas encore d'évaluation
- Primer Examen No 1 27042021 FINALDocument3 pagesPrimer Examen No 1 27042021 FINALMarcelo Sebastian HerreraPas encore d'évaluation
- Dossier BiocatalizadoresDocument22 pagesDossier BiocatalizadoresJuan Jose ApazaPas encore d'évaluation
- BIOTECNOLOGIA Tarea 7Document18 pagesBIOTECNOLOGIA Tarea 7Alen Oscanoa CuadrosPas encore d'évaluation
- Práctica #2Document5 pagesPráctica #2Verónica LoaizaPas encore d'évaluation
- Hidrolizado de PescadoDocument2 pagesHidrolizado de PescadoCamila Escobar BetancourthPas encore d'évaluation
- Curso Bebidas 1Document76 pagesCurso Bebidas 1Ricardo CortezPas encore d'évaluation
- Costo de Producción de Humus y Bondades Agronomicas. 2019Document22 pagesCosto de Producción de Humus y Bondades Agronomicas. 2019sumitep bucaramangaPas encore d'évaluation
- Quimica Guia Docente PDFDocument12 pagesQuimica Guia Docente PDFsabrinaPas encore d'évaluation
- Clase 6 Enzimas y Metabolismo Celular - Extract - 1Document5 pagesClase 6 Enzimas y Metabolismo Celular - Extract - 1LuisPas encore d'évaluation
- Etapas y Equipos Del Proceso CerveceriaDocument59 pagesEtapas y Equipos Del Proceso CerveceriaYONH YUNIOR TICONA CALLAPas encore d'évaluation
- Enzimas, Cinetica y RegulaciónDocument55 pagesEnzimas, Cinetica y RegulaciónAlas25Pas encore d'évaluation