Académique Documents
Professionnel Documents
Culture Documents
Ejercicios de Cinetica Enzimatica
Transféré par
Jose Orbegoso LopezCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ejercicios de Cinetica Enzimatica
Transféré par
Jose Orbegoso LopezDroits d'auteur :
Formats disponibles
1
CINTICA ENZIMATICA
(Recopilacin por J. Orbegoso L.)
1-Orden de reaccin. La enzima Glicerol-3 fosfato deshidrogenasa se inactiva irreversiblemente
en presencia de ciclohehanediona con una cintica aparente de primer orden. Sin embargo,
cuando se vara la concentracin del agente inactivante en la cubeta se observa que la cintica se
modifica. Explique este resultado calcule el valor real de la constante de velocidad de la
reaccin.
[CHD] (mM) 0.2 1
t (min) + Enzima
activa
remanente
(%)
0 100.0 100.0
10 92.2 77.8
20 93.9 56.8
30 88.4 46.3
40 76.2 36.6
60 72.1 20.4
90 60.8 9.1
120 54.6 4.3
Sugerencias:
a)Demuestre que la cintica de inactivacin es de primer orden aparente y calcular la constante
de primer orden y la vida media (no olvide las unidades).
b)Determine si la constante de primer orden vara con la concentracin del reactante CHD y
escriba una expresin para la velocidad que incluya a todos los reactantes.
c) A partir de esta ecuacin identifique que es lo que vara en cada experimento y lo que se
mantiene constante y diga porque la cintica aparece como si fuese de primer orden.
2 Ensayo actividad de una enzima. La enzima mlico deshidrogenasa cataliza la reduccin de
oxaloacetato con NADH, a malato y NAD
+
. En el siguiente experimento se sigui la
desaparicin del NADH, midiendo su absorbencia a 340 nm (c = 6220 M
-1
cm
-1
). Si se
emplearon 35 ng de protena de la preparacin enzimtica, en una cubeta de 3 mL, para este
experimento, determine la actividad de la enzima en unidades internacionales y la actividad
especfica de esta preparacin.
tiempo (min) 0.00 0.10 0.20 0.30 0.50 0.85 1.50 2.00
Absorbencia 1.34 1.28 1.26 1.22 1.16 1.10 1.02 0.99
2
3 Efecto de la concentracin de enzima. En el siguiente experimento con la enzima fosfatasa
cida de semillas de trigo germinadas se vari la concentracin de la enzima en cubeta a dos
concentraciones de sustrato y se obtuvieron los resultados siguientes:
[enz] (l) [FP] 0.1 mM [FP] 10 mM
Vel
(nmol/min)
Vel
(nmol/min)
5 1.920 6.307
10 4.059 13.169
15 5.956 19.145
20 7.766 25.694
25 9.479 32.282
30 11.844 37.882
a) Como varia la velocidad de la reaccin en funcin de la cantidad de enzima aadida?
b) Qu pasa si dividimos la velocidad registrada por la cantidad de enzima aadida al ensayo?
c) Utilizando la ecuacin de Michelis-Menten explique sus respuestas a las preguntas
anteriores?
4-Cintica de una enzima. La actividad de la Acetil-CoA carboxilasa, medida con tres
diferentes concentraciones de enzima y a diferentes concentraciones de sustrato fu la siguiente:
[Enz] (g de
protena)
0.1 0.2 0.5
[AcetilCoA] (M) + Vel (mol / min)
0.05 0.275 0.546 1.373
0.14 0.482 1.001 2.502
0.23 0.580 1.185 2.891
0.32 0.642 1.385 3.463
0.50 0.755 1.494 3.656
0.59 0.766 1.497 3.810
a) Calcular para cada experimento el valor de Km y el valor de Vmax.
b) Son los valores de Km y Vmax iguales o diferentes?
c) Explique si lo que observ es lo que esperaba obtener
d) Sabiendo que la enzima pesa 220 000 grs/mol, haga una grfica de Vmax vs mol de enzima.
3
e) Qu represnta la pendiente de esta grfica?
f) En qu se parece el valor anterior a la Actividad especfica = Vmax/mg de protena en mol
min
-1
mg de enzima
-1
?
g) Qu pasa con la medida de actividad especfica cuando la enzima no est pura?
5-Problema sobre un ensayo de actividad enzimtica. Considere a la enzima Invertasa, que
cataliza la hidrlisis de Sacarosa a fructosa y glucosa. Esta enzima posee una Km para sacarosa
de 0.5 mM y una constante cataltica de 175 min
-1
. Si se mide su actividad en presencia de 0.25
mM de sacarosa con 25 pmol de enzima en la cubeta - qu velocidad de catlisis se observar? -
qu fraccin representa esto de la Vmax que se podra calcular en esta reaccin si se variase la
cantidad de sacarosa? - Cunto sustrato habra que aadir para que la velocidad observada
alcanzase 0.95% de la Vmax? - Qu importancia podra tener esto para la posible aplicacin
industrial de la enzima? - Explique sus respuestas.
6-Problema sobre una reaccin con dos sustratos.
La enzima Aspartato transaminasa, que cataliza la reaccin:
Aspartato + Oxoglutarato Glutamato + Oxaloacetato
se realizaron los siguientes tres experimentos el siguiente experimento:
[Asp] = 1 mM [OxG] = 0.02 mM [OxG] = 0.5 mM
[OxG]
(mM)
Vel
(mol/min)
[Asp]
(mM)
Vel
(mol/min)
[Asp]
(mM)
Vel
(mol/min)
0.002 0.444 0.007 0.411 0.007 0.468
0.018 2.031 0.048 1.268 0.048 2.017
0.037 2.781 0.171 1.722 0.171 3.317
0.063 3.336 0.335 1.850 0.335 3.866
0.094 3.756 0.547 1.983 0.547 4.123
0.493 4.324 1.016 2.031 1.016 4.324
a) Calcule Km y Vmax para cada sustrato.
b) Cambian las Vmax? Explique su respuesta
c) Explique que pas en el segundo experimento, con respecto al tercero.
d) Cantos y cules valores de Km debo considerar para describir la afinidad de la enzima por
sus substratos?
e) Qu conclusin se podra sacar de esos datos?
4
7- Problema sobre la energa de activacin.
Para la enzima catalasa se realiz un experimento en el que se determin la velocidad de
descomposicin del perxido de hidrgeno en ausencia en presencia de 10 nM de enzima en el
ensayo.
T vel(sin catalasa) vel(con catalasa)
(C) (mol/s) (mol/s con 10nM Et)
4 0.40E-08 0.0410
10 7.74E-09 0.0464
15 1.31E-08 0.0476
20 2.09E-08 0.0497
25 3.52E-08 0.0530
30 5.74E-08 0.0598
-Suponiendo que la concentracin de perxido de hidrgeno fue suficiente para garantizar la
saturacin de la enzima, calcular la energa de activacin de la reaccin con o sin enzima y
discuta sus resultados. (R=1.987 cal/mol/K)
8-Efecto de temperatura sobre una enzima:
Los valores de Km y Vmax siguientes se determinaron midiendo la hidrlisis de bromuro de
acetilcolina catalizada por la esterasa bovina a diferentes temperaturas:
T (C) K
M
(mM) k
cat
(mol min
-1
pmol_[E]t
-1
)
20 0.403 0.307
25 0.375 0.322
30 0.335 0.340
35 0.305 0.362
45 1.500 0.013
a) Qu intervalo de termperaturas deberan emplearse como datos para calcular la energa de
activacin de la reaccin catalizada por la enzima?.
c) Para ralizar el clculo anterior: debera emplearse los valores de Km o de k
cat
.
b)-Por qu vara K
M
con la temperatura? (sugerencia: vea la deficincin de K
M
).
9- Efecto del pH sobre la Vmax. Los siguientes valores de velcidad inicial de enzimas fueron
obtenidos para la o-Quimotripsina actando sobre un sustrato artificial (ester etlico de acetil-L-
triptofano):
5
pH Vel (unidades internacionales) pH Vel (ui)
5.4 10 6.8 192
5.6 19 7.2 260
5.8 32 7.4 280
6.4 99 7.8 300
6.5 112 8.0 328
6.6 141 8.4 331
sigue en las columna 3 y 4. 9.0 327
a) Determine los valores de pKa(s) del (los) grupo(s) involucrado(s) en este comportamiento.
b) Diga que residuos de aminocido podran responsables de esta respuesta.
c) Si el experimento se extendiera hacia la regin ms alcalina de la escala de pH que cabra
esperar (explique su respuesta).
10-Problemas sobre inhibicin:
Se realizaron estudios de inhibicin para dos enzimas diferentes presentes en el suero bovino. Se
vari la concentracin de sustrato a en ausencia y en presencia de tres concentraciones diferentes
de inhibidores de cada enzima. En cada caso encontrar:
a) El tipo de inhibicin.
b) El valor de Km y Vmax.
c) El valor de Ki para el inhibidor.
Enzima: Fosfatasa alcalina de suero bovino, inhibidor: Oxalato de Bromolevamisol
[Bromolevamisol]
(M)
0 8 16 40
[Sustrato]
+[FP](mM)
Velocidades iniciales (mol min
-1
mgProt.
-1
)
0.1 0.231 0.210 0.191 0.158
0.3 0.431 0.369 0.309 0.239
0.7 0.607 0.488 0.425 0.277
1.3 0.751 0.599 0.467 0.304
1.8 0.811 0.657 0.530 0.319
2.6 0.912 0.657 0.546 0.328
4.1 0.957 0.688 0.561 0.351
5.8 0.981 0.741 0.558 0.344
6
Enzima: Transaminasa Glutmico Pirvica.
[2hidroxisuccnico]
(mM)
0.0 1.0 2.0 5.1
[Sustrato]
+[Glu](mM)
Velocidades iniciales (mol / min / mgProt)
0.6 0.59 0.48 0.38 0.24
1.4 1.12 0.91 0.78 0.51
2.9 1.63 1.43 1.19 0.87
5.2 1.94 1.70 1.64 1.19
8.0 2.19 1.94 1.94 1.56
10.3 2.28 2.06 1.99 1.74
16.0 2.32 2.33 2.24 1.89
25.1 2.62 2.53 2.25 2.09
11-Problema sobre inhibicin:
El siguiente experimento fu realizado con la fosfoenolpyruvato:pyruvil tranferasa de
streptococcus sp. Este enzima participa en la sntesis de la pared celular de las bacterias y
cataliza la transferencia de un grupo piruvilo a un precursos del pptidoglicano, liberando
fosfato. La fosfomicina (FSM) es un antibitico sintetizado por ciertas bacterias del grupo
streptomyces que inhibe a esta enzima. Usando el fosfoenolpiruvato (PEP) como sustrato a dos
diferentes niveles de concentracin, se estudi la inhibicin de esta enzima por fosfomicina.
[PEP] (M) 75 200
[FSM] (M) +
Velocidad
(nmol min
-1
mgProt
-1
)
Velocidad
(nmol min
-1
mgProt
-1
)
0 0.73 2.49
5 0.53 2.29
10 0.42 2.15
25 0.26 1.78
50 0.16 1.4
100 0.09 0.98
a) Identifique el tipo de inhibicin que se presenta
b) Calcule el valor de la I
50
para este inhibidor a la concentraciones ms baja y ms alta de
sustrato empleadas en el experimento.
b) Qu diferencias observa entre este parmetro calculado con diferentes concentraciones de
sustrato?
7
c) Suponga que encuentra reportados en la literatura otros inhibidores de esta enzima que actan
por un mecanismo semejante a este compuesto, pero descubre que en varios casos los autores
emplearon diferentes concentraciones de PEP para estudiar el efecto del inhibidor. Sera vlido
comparar los valores de K
I
reportados? - explique su razonamiento.
1. Problemas sobre mecanismos de catlisis.
Esta seccin consta de 7 problemas.
1 2 3 4 5 6 7
1.- El RNA se hidroliza rpidamente en solucin alcalina. Sin embargo el DNA que carece del -
OH en la posicin 2'- del anillo furansido de la ribosa es resistente a esta condicin. Basado en
su conocimiento del mecanismo qumico de la RNAasa explique esta observacin.
2. En la lactonizacin siguiente:
La reaccin es 3.4 X 10
11
veces ms rpida cuando R1 es CH
3
que cuando R1= H. Explique este
resultado. Cmo se relaciona lo anterior con los mecanismos de catlisis enzimtica?
3.- Explique en trminos termodinmicos porque una enzima que pueda estabilizar el complejo
de Michaelis ES tanto como el estado de trasicin ES
#
, no cataliza la reaccin.
4.- Wolfenden afirma que carece de sentido distinguir entre sitios de unin y sitios catalticos en
una enzima. Discuta esta afirmacin.
5.- Una dificultad grande al estudiar las proteasas pancreticas es que, al ser ellas mismas
protenas. Son enzimas que se autodigieren. El problema es menos grave con la quimotripsina
que con la tripsina. Por qu?
6.- En la elaboracin del Tof, un preparado de la soya tambin llamado "queso de soya", se
emplea un tratamiento que elimina el inhibidor de tripsina normalmente presente en los frijoles
de soya, pero que, por lo dems, no afecta la apariencia, la textura o el sabor del producto.
a) Qu hace necesario este proceso?
b) Qu caractersticas cree usted que presenten las proteasas del aparato digestivo del Gorgojo
de la soya?
8
7.- Para muchas enzimas, el mecanismo qumico de accin implica catlisis cida (donacin de
un protn) sobre un grupo y catlisis bsica sobre otro. Si la enzima libre posee tanto a la base
como al cido, porqu estos no se neutralizan mutuamente.
RESPUESTAS.-
1. 1.- En este problema se nos pide analizar como progresa la inactivacin de una enzima en el
tiempo. Aqu, la ciclohexanodiona (CHD) es un reactivo que modifica qumicamente con la
enzima y el producto de esta reaccin es una protena que pierde su actividad enzimtica
original. Por tanto, en este experimento, la enzima es un reactante y su actividad enzimtica
es el recurso metodolgico que sirve para evaluar la concentracin remanente de protena no
modificada por la CHD, en cada uno de los tiempos muestreados.
Se puede determinar si la reaccin qumica es de primer orden, o se encuentra en condiciones
tales que progresa como si lo fuese (aunque estrctamente no lo sea); ello gracias a que la
reacciones con cintica de primer orden (o de pseudoprimer orden) muestran una relacin lineal
entre el logaritmo natural de la concentracin de reactante remanente y el tiempo transcurrido.
De modo que, si obtenemos los logartmos de los valores de concentracin de la enzima
remanente (no importa que se trate de un porcentaje) resultan las siguientes grficas.
9
La figura superior muestra la grfica logartmica, en la que se puede observar que ambos
conjuntos de puntos describen razonablemente una recta, no as en la grfica directa de
[E] vs. tiempo (panel inferior). Este resultado indica que la inactivacin observada sigue
una cintica de primer orden con respecto a la concentracin de enzima en la condiciones
empleadas. Las pendientes de estas lneas son numricamente iguales a las constantes de
primer orden, o de pseudoprimerorden, pero con signo negativo, de modo que basta
cambiar el signo para determinar el valor de las constantes buscadas.
Note que ambas rectas presentan pendientes muy distintas, esto significa que la
concentracin de CHD si tiene un efecto sobre la velocidad de la reaccin annque, en las
condiciones experimentales empleadas, este efecto no se manifiesta en los 120 minutos
que dura el experimento; posblemente porque este reactivo se encuentra en gran exceso.
Sin embargo, una expresin correcta para la velocidad de la reaccin debera incluir
ambos reactantes y la ley de velocidad indicara que el orden de reaccin es superior a 1
(uno para la enzima y no sabemos exactamente cuanto para la CHD).
Finalmente, el recuadro en la figura superior muestra que las constantes aparentes
calculadas varan linealmente con la cantidad de CHD empleada en el experimento y la
lnea cruza el punto x,y (0,0). Esto nos indica que el orden de reaccin para la CHD es
tambin de 1 y la pendiente de esta grfica nos indica el valor de la constante de 2o
orden. y la expresin final para la velocidad sera:
v= k
2
[CHD][E], en donde k
2
= 0.026 mM
-1
min
-1
= 0.43 M
-1
s
-1
.
En condiciones en las que [CHD] es mucho mayor que [E], la enzima se agota sin que la
[CHD] disminuya apreciablemente. Esto es muy frecuente en la inactivacin de enzimas,
ya que la concentracin de protena apenas alcanza los cientos de g/mL, lo que para una
molcula de 10000 gr/mol de PM (si se trata de na protena pequea) o ms, representa
concentraciones inferiores a 10
-5
M. Por su parte el agente qumico suele agragarse en
concentraciones superiores a 10
-4
M, es decir 10 veces por encima como mnimo.
Concencuentemente, el cambio en concentracin de reactante rramente rebaza el 10% a
lo largo de la incubacin.
2.- Para resolver este problema es necesario observar que la absorbencia registrada
representa la desaparicin del NADH, que es el sustrato de la reaccin. En este caso la
estequimetra de la reaccin implica que por cada evento de reaccin, una molcula de
NADH desaparece y, por tanto, lo que necesitamos hacer para calcular la velocidad es
determinar el Cambio de absorbencia del NADH por unidad de tiempo, para luego
convertirlo a cambio de concentracin de NADH mediante la ley de Lambert-Beer:
A = c c l Ac = AA/(e l)
de donde se sigue que
AA = c Ac l Ac/At = (AA/At)/(c l)
Si graficamos la absorbencia contra el tiempo transcurrido, la pendiente de la curva
descrita por la grfica ser (y
2
-y
1
)/(x
2
-x
1
) = AA/At. La que en este caso ser
numricamente negativa (por tratarse de la desaparicin de un producto). Sin embargo,
podremos notar en la figura inmediata inferior, que la relacin no describe una recta
perfecta, por lo que es necesario considerar tan slo el periodo inicial, en el que las
10
concentraciones de sustratos y productos no han cambiado apreciablemente y, por tanto,
los punto se aproximan razonablemente a una recta.
As, con una pendiente inicial de -0.3297 Uabs/min y una longitud para el paso de luz de
la celda del espectrofotmetro de 1 cm (l) se obtiene una velocidad de desaparicin de
NADH de 5.310
-5
M min
-1
, lo que en 3 mL del volumen de cubeta representa (5.310
-5
mol L
-1
min
-1
) (310
-3
L) = (1.5910
-7
mol min
-1
).
Las unidades internacionales (UI) de actividad enzimtica son moles de producto
formado o reactante consumido por minuto, de modo que si 1 mol equivale a 10
6
mol, la
velocidad ser (v = 1.5910
-1
mol min
-1
) 0.159 UI.
Finalmente, la actividad especfica es l actividad enzimtica dividida por la concentracin
de protena, es decir a.e. = 0.159 UI/35 ng, pero debido a que la concentracin de
protena suele expresarse en mg: a.e. = 0.159 UI / 3510
-6
mg = 4543 UI/mg de
protena.
3.- En este problema se nos pide determinar grficamente la relacin entre la velocidad
de la reaccin catalizada, vs. la cantidad de solucin de protena aadida al ensayo y
luego se nos pide calcular el cociente de la velocidad ( actividad de la enzima) y la
cantidad de solucin deprotena aadida al ensayo. Los resultados de tal representacin se
muentran en la siguiente figura:
11
En el panel inferior, apreciamos que la velocidad aumenta linealmente con la
concentracin de protena, esto es lo que cabra esperar, debido a que, si tomamos como
referencia la ecuacin de Michaelis-Menten, notaremos que la velocidad es proporcional
a la Velocidad mxima y a su vez la Vmax es proporcional a la concentracin total de
enzima aadida, i.e.:
Dado que en cada una de las dos series de determinaciones la concentracin de sustrato
se mantuvo constante, el factor k
CAT
S / (K
M
+ S) se mantiene constante y, por tanto,
podemos decir que mientras se emple la misma concentracin de sustrato en todas las
medidas, v = constante E
T
. Consecuentemente, cuando se grafica el cociente v/[E] el
resultado es una constante (vease panel superior de la figura anterior), mientras la
concentracin de sustrato no sea modificada.
Lo anterior significa que la velocidad de una reaccin enzimtica es proporcional a la
concentracin de enzima, lo que constituye la base terica de las mediciones de actividad
enzimtica como una estimacin de la cantidad de esta enzima presente en un fludo
biolgico. Este principio tiene, por ejemplo, mucha importancia en la prctica clnica, ya
que nos permite determinar alteraciones en los niveles de diversas enzimas, que pueden
relacionarse a diversos estados patolgicos. Tambin es importante en aplicaciones en la
industria de alimentos, ya que permite evaluar la cantidad de ciertas enzimas presentes en
los alimentos, cuya actividad puede ser indeseable, o bien, puede ser aadida ex professo
12
para modificar las propiedades de los preparados alimenticios. Todo ello, mediante un
ensayo enzimtico, generalmente sencillo, que tan slo requiere como condicin que la
concentracin de sustrato empleada, as como otras condiciones (pH, temperatura, etc.),
sean estandarizadas adecuadamente.
4.- En este problema se nos d el valor de la velocidad como funcin de la cantidad de
sustrato aadido a tres diferentes niveles de concentracin de enzima. El valor de Vmax y
Km puede calcularse a partir de estos datos de diversas maneras. La manera directa,
aunque no muy precisa, consiste en graficar los datos y estimar el valor de Vmax a partir
del valor al que tiende la velocidad cuando la concentracin de sustrato es muy elevada.
Como en realidad este valor es el lmite superir de la curva, pero esta se aproxima
indefinidamente a l sin llegar a tocarlo, estimar este techo resulta un poco impresiso.
Con el valor obtenido, es posible calcular el valor de la Km, ya que este representa la
concentracin de sustrato a la que 50% de los sitios activos de la enzima estn ocupados
con sustrato y 50% estn vacos. En estas condiciones, la velocidad observada deber ser
igual a la Vmax/2. (vase panel A de la figura que sigue a este prrafo). Como se
describi en el problema anterior, aumentar la concentracin de enzima resulta en un
incremento en la Vmax, ya que v = V
MAX
E
T
. Por tanto, las tres curva son semejantes en
su forma, pero a mayor cantidad de enzima tenemos curvas ms elevadas. Como es de
esperar, cuando dividimos la velocidad por la concentracin de protena empleada, la tres
curvas se superponen (ver panel B de la figura), dado que aqu la velocidad ya slo
depender de la concentracin de sustrato. Esta es una manera comn de representar las
curvas de saturacin por su sustrato de las reaccines enzimticas, ya que no su forma es
la misma sin importar cuanta enzima se emple en el experimento.
Los pneles de la derecha en la figura anterior (C,D) son representaciones de Linewaver-
Burk, en esta representacin se grafica 1/velocidad vs. 1/[sustrato], por lo que tambin se
le conoce como la grfica de dobles recprocos. Los valores de 1/v frente a la 1/S
describen una lnea recta, cuya pendiente es numricamente igual a K
M
/V
MAX
y que
13
intesecta al eje "Y" en un valor numrico igual a 1/V
MAX
y si la recta se prolonga a travs
del cuarto cuadrante intersecta al eje "X" en un valor numrico igual a -1/K
M
. En la
figura, el panel derecho inferior (C) muestra que la K
M
es independiente de la
concentracin de enzima aadida. Esto puede deducirse del hecho de que la
concentracin de enzima es casi siempre mucho menor que la de l sustrato (vease
problema 1), por lo que la cantidad de sustrato requerida para ocupar el 50% de los sitios
activos slo depende de la afinidad relativa entre la enzima y el sustrato, propiedad que
no cambia con la concentracin total de enzima. Esto mismo puede deducirse de la
ecuacin de Michaelis-Menten, ya que en ella, la concentracin de E
T
y la de sustrato no
son interdependientes. El panel superior dereho (D) reitera que al dividir la velocidad por
la concentracin de enzima empleada las tres lneas se superponen.
Si ahora graficamos velocidad mxima obtenida contra la cantidad de enzima aadida en
mol, asumiendo que cada molcula de enzima posee un slo sitio activo, la pendiente de
la grfica ser:
Este valor nos dice que una molcula de enzima es capz de convertir 33300 molculas
de sustrato a poducto por segundo y es equivalente a la actividad especfica de una
enzima pura (V
MAX
/[Protena]), excepto por la unidades empleadas. Dado que para
determinar este ltimo nmero no necesitamos una estimacin exacta del peso molecular
de la enzima, no del nmero de sitios activos por molcula de protena, este valor es el
ms frecuentemente reportado en diversas tablas de parmentros cinticos y propiedades
de enzimas. Sin embargo, cuando la preparacin no es pura el denominador de este
conciente ser mayor, debido a la contribucin de los contaminantes a la cantidad total de
protena, en consecuencia, la actividad especfica disminuir. De este modo, la actividad
especfica es un buen indicador del grado de pureza de una preparacin enzimtica.
5.- En este problema se nos pide determinar la actividad como fraccin de la V
MAX
para la
enzima invertasa, la manera ms simple de proceder es reordenar la ecuacin de Michalis
y Menten como sigue:
Lo que nos indica que se alcanza el 33% de la V
MAX
, como V
MAX
= k
CAT
E
T
, se tiene
vel = 175 min
-1
2.5 10
-6
mol 0.33 = una actividad de 0.00146 mol min
-1
. Ahora,
segn lo abtenido arriba, para obtener un 95 % de la V
MAX
bastar con que S/(K
M
+ S) =
0.95, de donde al despejar S tendremos S= K
M
0.95/(1-0.95) = 19 K
M
. Lo que significa
que habr que aadir 19 x 0.5 mM = 9.5 mM de sacarosa para que la actividad alcance
este valor.
Este problema sugiere que la cantidad de sustrato es uno de los factores importantes a
considerar cuando se desea emplear una enzima para aplicaciones inductriales. En otras
palabras, si el producto a tratar, que en este caso podra ser un almibar hecho a base de
14
sacarosa, posee un cancentracin de sustrato muy baja, o sea que nuestro jarabe est muy
diludo, deberemos aadr mucha ms enzima, puesto que sta estara trabajando muy por
debajo de su capacidad mxima. Por otro lado, una alternativa para ahorrar enzima, sera
tratar el jarabe concentrado y luego aadir el agua y los otros componentes de su almibar,
para tener el producto final.
6.- En este problema se pide calcular K
M
y V
MAX
para una enzima que posee dos
sustratos. En este caso, podemos variar la cancentracin de oxoglutarato y mantener la
concentracin de aspartato constante y viceversa. El problema consiste en saber que
concentracin de aspartato debo emplear cuando varo el oxoglutatato y que
concentracin de oxoglutaroto es recomendable mantener, al variar el osoglutarato. Aqu,
existen dos valores para la K
M
, dado que este valor representa la cocentracin de sustrato
que ocupa 50% de los sitios activos de la enzima en el estado estacionario, sin embargo,
se pueden ocupar estos sitios activos con ambos sustratos y, por tanto, habr una
K
M
(oxoglutarato ) y otra K
M
(aspartato).
La figura sigiente muestra la grfica de velocidad contra concentracin de sustrato (panel
izquierdo, para los 3 experimentos) y la de 1/v vs 1/s (panel derecho).
Puede observarse que las curvas y las rectas correspondientes a los experimentos 1 y 3
extrapolan a la misma V
MAX
, este es el primer diagnstico. La V
MAX
es la velocidad de
catlisis cuado la enzima se encuentra saturada con sus sustrato, pero dado que aqu hay
15
dos sustratos, habr que saturar con ambos. Esto significa que cuando variamos la
concentracin de aspartato, la concentracin de oxoglutarato debe estar saturante desde el
primero hasta el ltimo tubo medido y viceversa. Si esto no se asegura, entonces el
resultado ser como el mostrado en el experimento 2, en el que la V
MAX
determinada es
considerablemente inferior al valor real, decimos que se trata de un valor aparente. Ahora
-cmo sabemos que la concentracin de un sustrato es o no saturante?- bueno, como se
vi en el problema anterior, nosotros nos aproximamos al 95% de la V
MAX
cuando la
concentracin de sustrato es 19 veces K
M
. En este caso, habr que elegir una
concentracin de oxoglutarato igual a 19*K
M
(oxoglutarato ) cuando se vara el aspartato
y viceversa.
El problema es que de entrada, no sabemos cual es el valor de la K
M
para ninguno de los
sustratos y, por tanto, no es posible determinar a priori que concentracin ser saturante.
Para resolver este dilema se realiza un primer experimento y se determina el valor de KM
para un sustrato (el que se vari). En nuestro caso, se trata del experimento con
oxoglutarato variable. Con este resultado, se calcula el valor de K
M
(oxoglutarato )
aparente y se realiza entonces otro variando la concentracin de aspartato con una
concentracin de osoglutarato de al menos 20*K
M
(oxoglutarato ). De este nuevo
experimento se determina ahora la K
M
(aspartato), con lo que podemos saber si la
concentracin de aspartato empleada anteriormente fue realmente saturante. Si la
respuesta es afirmativa, ambos valores de V
MAX
deben ser muy cercanos. De lo contrario,
es necesario repetir el primer experimento con una concentracin de sustrato mayor a la
empleada inicialmente.
En nuestro caso, la K
M
(oxoglutarato) determinada en el primer experimento es 0.022 mM
y la V
MAX
4.54 mol min
-1
. En el segundo experimento, realizado con 0.02 mM de
oxoglutarato, la concentracin no fue realmente saturante y no es sorprendente ver que el
valor de Vmax es inferior al anterior (2.06 mol min
-1
) y la K
M
(aspartato) obtenida no es
necesariamente el valor real tampoco (0.03 mM). Sin embargo, en el tercer experimento,
la concentracin de oxoglutarato fue de 0.5 mM, es decir, 22 veces la K
M
(oxoglutarato)
del primer experimento (que por cierto, an no sabemos si es cercana al valor real), por
consiguiente la V
MAX
es ahora mayor (4.58 mol min
-1
, de hecho ms cercana a la
obtenida en el primer experimento) y el valor de K
M
(aspartato) es ahora 0.062 mM.
Es decir, ahora podemos determinar que la concentracin de aspartato empleada en el
primer experimento fue 16 veces K
M
(aspartato), cercano a la saturacin, pero se
deseamos resultados an ms limpios, habra que repetir este experimento con una
concentracin an mayor (digamos 2 mM).
7.- En este problema se nos pide calcular la energa de activacin de Arhenius, para ello,
el procedimiento ms sencillo es el obtener una grafca de Log(k) vs. 1/T (absoluta) y la
pendiente de esta grafica ser igual a -Ea/R (siendo R la constante universal de los gases).
En este caso no tenemos el valor de k, sino tan slo el valor de la velocidad de reaccin.
Sin embargo, la pendiente de una grfica de Arhenius es:
16
Ello gracias a que la velocidad es proporcional a la concentracin de reactante (v = k R) y
asumiendo que sta no se modific durante el experimento. Lo que significa que para
efectos del clculo de la pendiente y de la energa de Activacin, es equivalente graficar
la k o la velocidad directamente, siempre que las mediciones se hallan realizado con un
cantidad constante de reactante.
La fugura anterior muestra la grfica directa de velocidad vs. Temperatura, la que
muestra que la velocidad de la reaccin crece exponencialmente con la temperatura.
Tambin es claro, que en el caso de la reaccin catalizada, no se observa una cada en el
rango de temperatura empleado, lo que nos dice que no se presenta desnaturalizacin
trmica de la protena y, por ello, es posible emplear todos los puntos para construir el
grafico de Arhenius, mismo que se muestra a la derecha de la figura anterior. Note que
para realizar esta igura las temperaturas fueron primero convertidas a temperaturas
absolutas en
o
K.
De la pendiente de la grfica y sabiendo que R=1.987 cal mol
-1
o
K
-1
se obtienen los
valores para la energa de Activacin de la reaccin catalizada por la enzima y en
ausencia de catalizador, ya que E
A
= pendiente -1 R. Aqu se puede ver que la energa
de activacin de la reaccin catalizada por la enzima es cerca de 8 veces menor que la de
17
la reaccin en ausencia de enzima. Lo que confirma que las enzimas actan reduciendo el
tamao de esta barrera enegtica.
8.- Este es un problema en el que lo que tenemos que hacer es muy semejante a lo que
hicimos en el problema anterior. Aqu sin embargo hay que determinar que datos
debemos usar. Dado que la grfica de Arhenius implica la relacin entre Log(k) vs 1/T
absoluta, y k es una constante de velocidad, debemos identificar aqu la constante de
velocidad relacionada con el proceso de catlisis, esta el la k
CAT
. La KM como puede
verse, tambin puede ser modificada por la temperatura, debido a que su valor es una
relacin de varias constantes de velocidad (vease la definicin de K
M
en la deduccin de
la ecuacin de Michaelis y Menten), por tanto, al cambiar la temperatura las constantes
de velocidad cambin y esto afecta el valor de K
M
. Esto es lgico, ya que la temperatura
tambin puede afectar la unin del sustrato a la protena y este proceso se refleja en el
valor de K
M
.
Ahora, en adicin a lo anterior, se puede identificar en la siguiente figura que a las
temperaturas ms altas se observa un claro efecto de desnaturacin de la protena y por
tanto una caida en la catlisis. Dado que la energa de activacin que deseamos medir es
la del proceso cataltico, debemos considerar slamente los puntos que reflejan el efecto
de la temperatura sobre la reaccin catalizada y no acusan an efectos sobre la reaccin
qumica paralela de desnaturalizacin de la protena:
En la grfica de la derecha, se puede ver la recta que se obtiene en el grfico Ln(k) vs
1/T, del que se deduce una energa de activacin de 1.96 Kcal/mol. Ntese como
clramente el punto que corresponde a la mayor temperatura no cae sobre la recta. Esto
debido a que este punto presenta una mezcla de los efectos de la temperatura sobre la
velocidad de catlisis y sobre la velocidad de desnaturalizacin de la protena.
18
9.- En este problema se nos pide determinar el valor del pKa del grupo involucrado en la
respuesta de la enzima frente al pH. As, haciendo una grfica de la actividad frente al
pH, se obtiene la curva siguiente (lnea contnua):
Esta curva es equivalente a una curva de titulacin como las que se ven cuando se aade
base a un cido debil en solucin y se siguen los cambio de pH, slo que aqu, en lugar de
equivalentes de base aadida, lo que estamos modificando el el pH y observando los
equivalentes de enzima activa presentes. Dado que el intervalo de pH empleado no es
muy extremo, es de esperarse que la cada en la actividad hacia el pH de 6, se reflejo de
que la mayora de la enzima no est en su forma inica catalticamente competente, por
lo que no manifiesta su actividad, pero es improbable que est irreversiblemente
desnaturalizada. En cualquier caso, para estar completamente seguros de este hecho,
habra que hacer un experimento distinto, en el que la enzima se incubara a los diferentes
pH durante un cierto intervalo de tiempo y luego se regresara al pH de 8.5-9 (en donde
tiene su mxima actividad de acuerdo con la curva anterior) y se medira cuanta de la
enzima puede recuperarse despus del tratmiento. Este experimento nos dara la misma
actividada a todos los pH's en los que la enzima es estable y reportara bajas de la
actividad en las regiones en las que el pH desnaturaliza a una fraccin de la protena en
forma irreversible.
a) A partir de la curva dibujada, se puede ver que el punto de inflexin de la curva es
paroximadamente de 6.7, lo que se da a un valor de activida de aproximadamente la
mitad del mximo observado a un pH entre 8.5 y 9.
b) Lo anterior nos indica que podra tratarse de algn aminocido como la histidina.
Menos probables, pero no se pueden descartar, seran los carboxilatos de Asp y Glu o el
19
grupo SH de una cistena libre (es decir que no est formando puente de disulfuro.
Aunque los pKa de los grupos R de estos ltimos 3 aminocidos en su forma libre se
encuentran relativamente alejados de 7 (4.7 para los carboxilatos y 8 para el tiol), en el
interior de las protenas y especialmente en el sitio activo de las enzimas, se pueden
observar desviaciones impertantes de los pKa, causadas por las caractersticas de
polaridad del sitio activo, que son casi seimpre muy diferentes a las del medio acuoso
puro.
c) Fnalmente, la lnea punteada de la figura anteror indica de manera aproximada lo que
se espera observar a valores de pH mucho ms alcalinos. En esas condiciones, la
desprotonacin masiva de muchos aminocidos, es decir casi todas las histidinas, los
tioles y la gran mayora de lisinas, as como muchas argininas, perdern su carga positiva
provocando la desestabilizacin de numerosos puentes de sal en la protena, con lo que la
estructura se ver severamente afectada. Consicuentemente, se espera a que un pH
superior a 10 u 11, la actividad comenzar a desiminuir abruptamente y para un pH de 12
o 13 la enzima presentar una actividad nula. Esto es casi siempre cierto, pero cabe
aclarar que algunas protenas de bacterias alcaloflicas y que se encuentran en medios
extremos pueden soportar pH cercanos a 14 sin perdida de la actividad.
10.- parte a. En este problema, podemos graficar los valores de velocidad frente a la
concentracin de sustrato para las series obtenidas sin y con las distintas concentraciones
del inhibidor. Esto se muestra en la figura que sigue, en el panel inferior izquierdo.
Aunque es posible estimar los valores de Km y Vmax (en ausencia del inhibidor) y los
valores de las constantes aparentes en presencia del inhbibidor en esta figura, el estimado
ser difcil de hacer, debido a que la Vmax es una valor lmite que debe extrapolarse y el
valor de Km debe estimarse una vez que se conoce la Vmax, lo que significa que un mal
estimado de Vmax dar un mal estimado de Km. Una manera sencilla de resolver este
problema es realizar la grfica que se presenta en el lado izquierdo de la figura, la
representacin de 1/v vs. 1/s propuesta por Linewaver & Burk permite, unindo los
puntos con una recta, determinar los valores de 1/Vmax a partir de la intercepcin con el
eje ordenado y -1/Km a partir de la intercepcin de la recta extrapolada al eje de las
abscisas. Aunque existen otras formas de graficar estos datos que pueden ser ms
convenientes desde el punto de vista del estimado numrico obtenido, esta es la ms
extendida en la literatura.
a) A partir de la representacin mostrada en el panel derecho de la figura, puede tambin
determinarse el tipo de inhibidor que se tiene, que en este caso es acompetitivo (tambin
llamado incompetitivo), dado que las rectas que unen cada una de las series de puntos
son paralelas. Note que aqu de poco sirve emplear un anlisis de regresin lineal, dado
que los errores experimentales provocan que las rectas obtenidas por regresin no
presenten la misma pendiente. En estos casos, una vez que se ha decidido que los puntos
realmente representan rectas paralelas, lo mejor es tomar una regla y trazar todas las recta
paralelas buscando que el conjunto de lneas realmente describan, tan cercnamente
como sea posible, el conjunto de puntos experimentales.
b) Aqu, el nico valor de Vmax para la enzima es el determinado en ausencia del
inhibidor (O). Es decir 1/Vmax = 0.965 (mol
-1
min mg prot) Vmax = 1.04 (mol
min
-1
mg prot
-1
). Los valores obtenidos con las otras rectas representan tan slo parmetros
cinticos aparentes cuyo valor refleja las alteraciones impuestas sobre la actividad
20
enzimtica por la presencia del inhibidor. Km se determina por consiguiente del valor de
la intercepcin con las absisas de esta misma recta i.e. -1/Km = -2.4 mM
-1
Km = -1/-2.4
mM = 0.417 mM de p-nitrofenilfosfato. Esto significa que cuando la concentracin de p-
nitrofenilfosfato en el medio de reaccin (al pH y temperatura empleados en este
experimentos) alcanzan 0.417 mM, el 50% de los sitios activos de la enzima se
encontrarn saturados y por tanto la actividad der igual a la mitad de la mxima que
puede observarse en dichas condiciones.
c) Finalmente, dado que los inhibidores acompetitivos afectan al valor de la intercepcin
con la ordenada de la grfica de (1/v,1/s), los valores de este parmetro pueden emplearse
para calcular grficamente el valor de Ki sin recurrir al lgebra. Para ello, basta graficar
estos valores frente a la concentracin de inhibidor empleada en cada serie de
determinaciones, lo que se muestra en el panel izquierdo superior. Aqu, se unen los
puntos con una recta y se extrapolan al eje de las absisas, el punto de crte es
numricamente igual a -Ki = -20.47 M Ki = 20.47 M de bromolevamisol. Note que
el primer punto de la grfica representa el valor de la intercepcin cuando la
concentracin de inhibidor el cero, es decir, este punto es numricamente igual a
1/Vmax.
parte b. a) La solucin de este problema es muy semejante a la descrita para el problema
anterior, de manera que no abundaremos en los detalles. Aqu, el patrn del grfico de
Lineweaver-Burk es claramente no paralelo, sin embargo, habr que dterminar si las
rectas se cortan en un punto sobre el eje de las ordenadas, o sobre un punto en el segundo
o tercer cuadrante. La distincin entre ambos casos debe hacerse nuevamente al observar
todo el conjunto de puntos y el empleo de la regresin lineal aporta poco para una
21
eleccin adecuada del conjunto de rectas y del punto de corte entre ellas. En el caso
presente es claro que el mejor patrn es un abanico de rectas que se cortan en el eje de las
ordenadas, por lo que puede decirse con facilida que el inhibidor es competitivo. Note
que a pesar de tener la misma Vmax, las curva de la grfica directa no dan la apariencia
de tener la misma asntatota. Esto se debe a que en cada una de las series de
experimentos, al estar una concentracin de inhibidor distinta presente, se alcanza un
grado de saturacin distinta de la enzima y por ello es muy difcil decidir si todas las
rectas, dada una concentracion de sustrato suficientemente alta, alacanzarn el mismo
techo. Esto recalca la dificultad de emplear la representacin directa para el clculo
grafico de los valores de Vmax y Km. Sin embargo, con la ayuda de un programa de
regresin no lineal, es posible determinar un estimad de Km y Vmax a partir de esta
representacin, cuyo valor constituye un mejor estimado que el obtenido por cualquiera
de los mtodos grficos descritos en la literatura, salvo quiz una excepcin (ref).
b) los valores de Vmax y Km se obtiene de la serie realizada en ausencia de inhibidor
(O); aqu, Vmax = 1/0.38 (mol
min
-1
mg prot
-1
) = 2.63 (mol
min
-1
mg prot
-1
) y -1/Km =
-0.51 mM
-1
Km = -1/-0.51 mM = 1.95 mM de glutamato.
c) Finalmente, el valor de Ki puede obtenerse ahora del efecto que el inhibidor produce
sobre la pendiente de la grfica de Linewaver-Burk (que en ausencia de inhibidor es
numricamente igual a Km/Vmax). De nuevo, si se grafica el valor de estas pendientes
frente a la concentracin de inhibidor empleada (panel superior izquierdo). El valor
obtenido para Ki es ahora 2.38 mM de 2-hidroxisuccinato. Es importante recalcar que
cuando las rectas no se cortan en el eje "Y" como en este caso, esto significar que el
inhibidor ( no competitivo) producir alteraciones en los valores de la pendiente y de los
interceptos con la ordenada del grfico (1/v, 1/s), por tanto aqu se podrn obtener dos
valores de Ki (usualmente llamados Kiu y Kic, respectivamente). Lo que representa una
22
medida inversa de la fuerza con la que el inhibidor se une a la enzima cuando esta tiene
su sitio activo vaco (Kic) o de la fuerza de unin a la enzima con el sitio activo ocupado
(Kiu), por ello es que se obtienen dos valores de Ki. Si todas las rectas se cortasen en un
punto sobre el eje "X", esto significara que Kiu y Kic son numricmente idnticos, pero
esta coincidencia no es el caso ms comn.
11.- En este problema se presenta un caso comn en la investigacin farmacolgica. Se
trata de buscar un inhibidor que sea efectivo contra una enzima que resulta vital para un
microorganimo y, por tanto, nos puede servir para defendernos de l. Lo primero que
observamos, es que en lugar de hacer medidas a diferentes concentraciones de sustrato en
presencia y ausencia del activador, aqu se realizaron determinaciones de la actividad a
una u otra concentracin fija de sustrato y con cantidades crecientes del inhibidor.
a) Para identificar el tipo de inhibidor que acta, se pueden emplear diversas estrategias,
por ejemplo, se pueden ordenar los datos de manera que se tienen dos valores de
velocidad y dos concentraciones de sustrato para diferentes concentraciones de inhibidor.
Esto es lo que se hizo en la figura inferior (panel B). Ntese que si trazaraos rectas estas
cruzaran hacia el lado negativo del eje. Dado que las medidas de actividad se realizan sin
aadir producto, una velocidad negativa carece de sentido, porque tendra que generarse
sustrato en lugar de desaparecer y si no hay producto - de dnde puede aparecer
sustrato?
El resultado anterior nos indica que la cintica de esta enzima no es michaelina
(hiperblica), por lo que no podemos trazar rectas, sino que debera mos trazar curvas en
esta figura. Por lo que lo nico que podemos decir del tipo de inhibicin con estos datos
es que podra ser complejo y que se necesita ms informacin para determinarlo.
23
b) Respecto al valor de I50, las curvas y los valores correspondiente se muestran en la
figura inmediata superior, panel A. Como puede observarse el valor de I50 decrese
cuando hay menor cantidad de sustrato. El valor de I50 nos indica cuanto inhibidor
requerimos para inhibir la actividad de la enzima a la mitad en una cierta condicin. Es
evidente que el resultado nos dice que si hay ms sustrato disponible el inhibidor ser
menos efectivo y refleja la existencia de un componente competitivo en la inhibicin, lo
que no significa que la inhibicin sea realmente competitiva.
c) Como puede verse, si otros inhibidores se quisieran comparar con este, primero habra que
asumir que el mecanismo de inhibicin es el mismo. Esto suele hacerse en la investigacin
farmacolgica, ya que a menudo los compuestos a ensayar son iguales en su estructura qumica,
excepto por uno o dos substituyentes. En segundo trmino, los valores de I50 tendrn que haber
sido determinados con la enzima ensayada en condiciones idnticas, excepto por la adicin del
inhibidor en estudio. Por ello, la respuesta a la pregunta que se plantea en el problema es NO - no
es posible compara los valores puesto que no fueron medidos bajo las mismas condiciones.
2. Solucin a los problemas sobre los mecanismos de catlisis.
Esta seccin contiene 7 problemas y se encuentra an en contruccin.
1 2 3 4 5 6 7
1.- El mecanismo de catlisis de la Ribonucleasa indica que hay tres grupos qumicos
escenciales para la catlisis de la hidrlisis del enlace ester de fosfato del RNA. Dos de
ellos (la H12 y la H119) pertenecen a la enzima, mientras que el tercero el el propio
hidroxilo de la posicin 2 de la ribosa del RNA (el sustrato), el que, activado por la H119
24
(base general) se convierte en un nuclefilo activo capz de atacar el tomo de fosforo
iniciando as el rearreglo de diester fosfrico que lleva a la hidrlisis del RNA. Este
mismo mecanismo puede ser catalizado por otras bases, incudo el grupo hidroxilo, de
manera que se generen nucletiods 2',3' fosfato cclicos, con hidrlisis del enlace
5'fosfato adyacente. Por ello, el RNA se hidroliza fcilmente en medio ligeramente
alcalinos (pH >8). El DNA no cuenta con el OH de la posicin 2', ya que la azcar que lo
compone el la desoxirribosa. Consecuentemente es mucho ms estable a pH's alcalinos.
De hecho, esta caractrastica se emplea para purificar el DNA, ya que al incubarlo a pH
de 8 es posible eliminar el RNA que pueda venir como contaminante.
2.- En este caso, la presencia de grupos ms voluminosos en la molcula forza al grupo
carboxilo a aproximarse ms al -OH fenlico, lo que favorece la lactonizacin. De hecho,
la geometra de la molcula en tre dimensiones revela que a fin de acomodar los grupos
tan voluminosos el anillo benzenico debe permitir una leve pero apreciable desviacin de
la planaridad, por consiguiente, la eliminacin de un tomo de oxgeno como resultado de
la lactonizacin hace ms estable la geometra de toda la molcula.
En la imagen anterior se puede ver como la posicin de los metilos en la molcula (vista
aqu desde el canto superior del anillo bencnico) favorecen conformaciones en las que
hay mayor aproximacin de los grupos carboxilato y OH fenlico (identificados aqu por
el color amarillo de los tomos de oxgeno.
En las enzimas, la cudadosa orientacin geomtrica de los grupos qumicos en el sitio
activo de la enzima favorece la unin de los sustratos con geomietras predeterminadas,
de modo que se eleva notablemente la probabilidad de que los grupos que deben
reaccionar se orienten correctamente. Estos se denominan factores de proximidad y
orientacin, siendo uno de los efectos importantes en la catlisis enzimtica.
3.- La habilidad de una enzima para favorecer una reaccin qumica y aumentar la
velocidad con la que esta ocurre depende de que la barrera energetica que separa al
25
estado de transicin de los reactante pueda ser superada. Por ello, las enzima actan
empleando caminos qumicos distintos a los que se observan en solucin y modificando
el entorno qumicos de los reactantes y del estado de transin a fin de favorecer la
ocurrencia de este ltimo. Esto significa que la diferencia energtica entre reactantes y
estado de transicin debe reducirse. Pero si el complejo enzima sustrato al formarse
libera una gran cantidad de energa libre, esto significa que el estado basal de los
reactantes se encuentra a un nivel energtico an ms bajo, por consiguiente, alcanzar el
estado de transicin requerira ahora mucha ms energa, a menos que el complejo
enzima-estado de transicin sea todava ms estable con respecto al estado de transicn
en solucin, que lo que es el complejo enzima sustrato con respecto al reactante. Por ello,
una enzima que realmente catalice una reaccin debe estabilizar ms el estado de
transicin que lo que estabiliza al sustrato al interactuar con cada uno de ellos. De otra
manera, no habra reduccin de la energa de activacin efectiva y no se favorecer la
catlisis.
De hecho, una de las maneras en las que puede hacerse a una enzima peor catalizador, es
modificando ciertos grupos importantes en la interaccin enzima-sustrato de modo que la
unin sea ms fuerte, el resultado es una enzima que libera lentamente los productos y, en
consecuencia, cataliza ms lentamente la reaccin, an cuando si kcat (medida
cinticamente) cambie poco.
26
La figura anterior ilustra tres casos, la reaccin no catalizada, la reaccin en presencia de
la supuesta enzima descrita en el problema y el caso de una verdadera enzima en la que el
estado de transicin es estabilizado mucho ms que el sustrato al unirse con la enzima.
En los dos primeros casos la energa de activacin es la misma y por tanto no habra
aumento en la velocidad de la reaccin.
4.- Los estudios modernos sobre la catlisis enzimtica demuestran que cambios en
aminocidos cuyo papel se considera de unin pueden resultar en alteracines importantes
en la kcat y viceversa. El papel de estos grupos es asignado casi siempre con base a la
posicin del grupo en los cristales de la enzima obtenidos en presencia de analogos del
sustrato, datos que se compaginan con eltras evidencia experimentales diversas. Debido a
que la geometra completa del sitio activo ha sido diseada para favorecer una mayor
estabilidad del estado de transicin, an pequeos cambios en la polaridad de los grupos
y o su orientacin pueden tener efectos importantes sobre la catlisis. Por ello es muy
difcil asignar papeles especficos a los residuos de aminocido delimitando su fincin a
nicamente unin y nicamente catlisis, de hecho, basta recordar que durante la catlisi
27
los intermediarios deben permanecer unidos a la protena, de otro modo no podramos
adscribirle la catlisis a la enzima.
Sin embargo, cabe aclarar que las determinaciones cinticas demuestran que los eventos
de unin de los sustratos al sitio activo de la enzima y los evntos qumicos de catlisis
ocurren en ciertas secuencia y no son simultneos. Es por tanto factible pensar que
durante los eventos de unin hay grupos que no son importantes, sino hasta que se inicien
los eventos catalticos, en este sentido, quiz sea posible distnguir entre grupos que
participan en unin y en catlisis y grupos que participan principalmente en catlisis.
5.- La tripsina y la quimotripsina son proteasas muy activas pertenecientes a la familia de
las sern-proteasas. Estas protenas difieren en la especificidad por el enlace peptdico que
hidrolizan; mientra la tripsina es muy selectiva hacia enlaces peptdicos en los que
participan aminocidos bsicos con carga positiva (Lys y Arg), la quimotripsina prefiere
aminocidos aromticos y puede tambin atacar enlaces peptdicos en los que participen
aminocidos alifticos voluminosos, principalmente L, I y V. En consecuencia, la
quimotrispsina es menos activa frente a protena nativas, ya que es menos probable que
un enlace peptdico formado por aminocidos apolares se encuentre en la superficie de la
protena, generalmente estos se encuentran en el interior. Por el contrario, la tripsina
ataca aminocidos polares y cargados, que con mucha frecuencia se encuentran en la
superficien de la protena, expuestos al solvente. As, la quimotripsina es poco activa
contra si misma en su estado nativo, mientra la tripsina es muy activa contra su propio
estado nativo, por ello es una protena difcil de purificar. Afortunadamente, son tambin
protenas que recuperan fcilmente su plegamiento nativo y es posible purificarlas a pH's
extremos en los que su actividad es mnima y por tanto no se autodigieren, una vez
purificadas se pueden incubar al pH en el que son activas para que recuperen su
conformacin nativa y sirvan a los diversos fines cientficos y/o tecnolgicos que
requirieron su purificacin.
6.- a) El inhibidor de tripsina de soya es una pequea protena capz de unirse al sitio
activo de la tripsina con gran fuerza, de modo que aunque es hidrolizado uno de sus
enlaces peptdicos, la enzima no puede liberar el producto y esto evita que contine con
su actividad hidroltica. Dado que la tripsina es una de las enzimas importantes en la
digestin de las protenas que nos sirven como alimento, es necesario inactivarlo a fin de
que los productos elaborados con protena de frijol soya puedan ser digeridos por los
humanos. De hecho la ingestin de protena de soya cruda puede causar la muerte por
congestin digestiva.
b) En el caso del Gorgojo de la soya, es evidente que debe poseer proteasas especiales
cuya especificidas y bolsillo de unin sean diferentes de la de la tripsina, lo que las hace
insensibles al inhibidor.
7.- La respuesta a esta pregunta est en el cuidadoso balance entre rigidez y flexibilidad
de la estructura de la protena, que permite que cada grupo qumico se encuentre casi
contnuamente rodeado de un conjunto de aminocidos definidos. Esto es epecielmente
cierto en el sitio activo, en el que la disposicin y ordenamiento especial de los grupos
qumicos est cuidadosamente elegida para favorecer la catlisis. De este modo, un
protn, atrapado por un grupo qumico con baja afinidad protnica puede encontrarse
demasiado lejos de la base como para ser transferido a esta y con frecuencia, puede
28
adems estar estabilizado por la presencia de otros grupos con densidad electrnica, lo
que favorece que permanezca en dicho entorno, en lugar de migrar hacia el entorno de la
base, el que a su vez puede estar rodeado de grupos can baja densisdad electrnica
reduciendo la estabilidad de los protones que entren en este sitio.
Vous aimerez peut-être aussi
- Tema 8 ENZIMAS Y CATÁLISISDocument5 pagesTema 8 ENZIMAS Y CATÁLISISJohanna Castillo100% (1)
- Banco de Preguntas y Respuestas de Química PDFDocument51 pagesBanco de Preguntas y Respuestas de Química PDFfranjalgo80% (10)
- Problemario 3er ParcialDocument11 pagesProblemario 3er ParcialOz HdzPas encore d'évaluation
- Problemario de EspectrofotometriaDocument12 pagesProblemario de EspectrofotometriaDaniRobalinoPas encore d'évaluation
- Guia de Seminarios Unidad 2 y 3 FinalDocument13 pagesGuia de Seminarios Unidad 2 y 3 FinalFlorencia LoboPas encore d'évaluation
- Reporte P2Document10 pagesReporte P2Fernanda RuízPas encore d'évaluation
- Problemario BioenergeticaDocument1 pageProblemario BioenergeticaClaudia Itzel StaCruz SanMiguelPas encore d'évaluation
- E3P7J810Document12 pagesE3P7J810Betsua Belen A. JPas encore d'évaluation
- Manual de Laboratorio de BromatologíaDocument25 pagesManual de Laboratorio de Bromatologíamariela_mejiaPas encore d'évaluation
- RecubrimientoDocument94 pagesRecubrimientoMarco Hernàndez Nieto100% (3)
- Práctica de Mermelada de ManzanaDocument7 pagesPráctica de Mermelada de ManzanaMarlon Joel Leyva Rodriguez100% (2)
- Cuaderno de Actividades para Fortalecer El Aprendizaje de Ciencias III (Química) PDFDocument74 pagesCuaderno de Actividades para Fortalecer El Aprendizaje de Ciencias III (Química) PDFMalusita82% (45)
- ProblCineticaEnzimatica. ATCasaDocument3 pagesProblCineticaEnzimatica. ATCasaJohanna Pilar LlagllaPas encore d'évaluation
- Problemas Cinetica EnzimaticaDocument9 pagesProblemas Cinetica EnzimaticamichypaoPas encore d'évaluation
- Serie de Problemas de Cinética EnzimáticaDocument4 pagesSerie de Problemas de Cinética EnzimáticaCristina CrrsPas encore d'évaluation
- Problemas de BioquimicaDocument3 pagesProblemas de BioquimicaBryan LariosPas encore d'évaluation
- 4-Clase de Problemas Cinetica EnzimasDocument7 pages4-Clase de Problemas Cinetica EnzimasVictor Aguirre A75% (4)
- Ejercicios de Cinetica EnzimaticaDocument39 pagesEjercicios de Cinetica EnzimaticaMichael Thorn50% (2)
- Problemas de Enzimas 12 - 13 (Buenos)Document8 pagesProblemas de Enzimas 12 - 13 (Buenos)TonyFontanaPas encore d'évaluation
- Cinética EnzimáticaDocument3 pagesCinética EnzimáticaPrime VideoPas encore d'évaluation
- Guia de Ejercicios Cinetica EnzimaticaDocument2 pagesGuia de Ejercicios Cinetica Enzimaticarobert ocrospomaPas encore d'évaluation
- Taller Cinetica EnzimaticaDocument2 pagesTaller Cinetica Enzimaticalaura garcia100% (1)
- Práctica 7Document8 pagesPráctica 7Jose Luis Garcia MariscalPas encore d'évaluation
- Tarea de Problemas HechoDocument4 pagesTarea de Problemas HechoalexanderPas encore d'évaluation
- PROBLEMAS DE INHIBICIÓN ENZIMÁTICA AlumnosDocument6 pagesPROBLEMAS DE INHIBICIÓN ENZIMÁTICA Alumnosfernando MartinPas encore d'évaluation
- Tarea 1 CineticaDocument1 pageTarea 1 CineticaDaniela IbarraPas encore d'évaluation
- Guía de Ejercicios #1 Balances de Masa en BioprocesosDocument7 pagesGuía de Ejercicios #1 Balances de Masa en BioprocesosCatalina Zamora AstudilloPas encore d'évaluation
- CriomicroscopíaDocument7 pagesCriomicroscopíaedisonpampaPas encore d'évaluation
- Taller Cinetica Enzimatica Ii 019Document2 pagesTaller Cinetica Enzimatica Ii 019EDWARD ALEXIS GOMEZ GUACA100% (1)
- Fototrofía PDFDocument18 pagesFototrofía PDFKATHEPas encore d'évaluation
- Problemas de Cinética EnzimáticaDocument3 pagesProblemas de Cinética EnzimáticamcmmartinPas encore d'évaluation
- Guía N°2 - EnzimasDocument3 pagesGuía N°2 - EnzimasANA LAURAPas encore d'évaluation
- Resultados p4Document6 pagesResultados p4Juan Emanuel VGPas encore d'évaluation
- Guia Ejercicios Propuestos EnzimologíaDocument7 pagesGuia Ejercicios Propuestos EnzimologíaJairo Quimbita ShadowssPas encore d'évaluation
- Bib1 U1 Ea JormDocument5 pagesBib1 U1 Ea JormJavier RangelPas encore d'évaluation
- Ejercicios Cinética Michaelis MentenDocument2 pagesEjercicios Cinética Michaelis MentenDavid Esteban Soler Camargo100% (1)
- Ejercicios Cinética Enzimática - 2Document2 pagesEjercicios Cinética Enzimática - 2Geovany Fuentes0% (1)
- Problemario 3er ParcialDocument6 pagesProblemario 3er ParcialokPas encore d'évaluation
- Ejercicios de CineticaDocument38 pagesEjercicios de CineticaCZCASEZATPas encore d'évaluation
- 4efecto de La Actividad Enzimática de Inulinasas Usando Metales MG y Co Como Posibles Activador o Inhibidor Utilizando Kluyveromyces MarxianusDocument8 pages4efecto de La Actividad Enzimática de Inulinasas Usando Metales MG y Co Como Posibles Activador o Inhibidor Utilizando Kluyveromyces MarxianusEnrique GomezPas encore d'évaluation
- Guía Seminario ResueltaDocument2 pagesGuía Seminario ResueltaCamila Paulina Aravena SotoPas encore d'évaluation
- Solucionario Actividad EnzimaticaDocument6 pagesSolucionario Actividad EnzimaticaDago OrtizPas encore d'évaluation
- S3. Ejercicios KM y VmaxDocument4 pagesS3. Ejercicios KM y VmaxKaren Tafur100% (1)
- Lab 8Document11 pagesLab 8Santiago Bonilla VelasquezPas encore d'évaluation
- Problemas de Bioquímica - Primer Curso Del Grado en Bioquímica - Curso 2010 11Document8 pagesProblemas de Bioquímica - Primer Curso Del Grado en Bioquímica - Curso 2010 11cristipisti88Pas encore d'évaluation
- ProblemasDocument7 pagesProblemasJuce ChipanaPas encore d'évaluation
- Presetación Resultados LaboratorioDocument32 pagesPresetación Resultados LaboratorioCarlos Israel Esparza AndradePas encore d'évaluation
- Reacciones BisustratoDocument24 pagesReacciones BisustratoMichelle HidroboPas encore d'évaluation
- 12 Cinetica MicrobianaDocument24 pages12 Cinetica MicrobianaLalix LeePas encore d'évaluation
- Gravimetría de Neutralización Informe AnaliticaDocument9 pagesGravimetría de Neutralización Informe AnaliticajosePas encore d'évaluation
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaD'EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaÉvaluation : 5 sur 5 étoiles5/5 (1)
- Cinetica Enzimatica Ejercicios ResueltosDocument26 pagesCinetica Enzimatica Ejercicios Resueltospvv1963100% (1)
- Problemas Aqf Tema7 Inhibicion 19may13Document4 pagesProblemas Aqf Tema7 Inhibicion 19may13Juan Gabriel FernándezPas encore d'évaluation
- Taller I - Bioquímica (Química-Farmacia)Document8 pagesTaller I - Bioquímica (Química-Farmacia)Oscar Andres Pinzon GarciaPas encore d'évaluation
- Problemas de Enzimas. AGRONOMÍA 2015Document3 pagesProblemas de Enzimas. AGRONOMÍA 2015andrewn21Pas encore d'évaluation
- Cinetica Enzimatica Ejercicios ResueltosDocument26 pagesCinetica Enzimatica Ejercicios ResueltosCarlos A. Olivares SalasPas encore d'évaluation
- Ejercicios Cinetica EnzimaticaDocument4 pagesEjercicios Cinetica EnzimaticaAlejandra PeñaPas encore d'évaluation
- Cinetica Enzimatica Ejercicios ResueltosDocument30 pagesCinetica Enzimatica Ejercicios ResueltosAndres Suarez100% (1)
- Documents - MX Cinetica Enzimatica Ejercicios ResueltosDocument26 pagesDocuments - MX Cinetica Enzimatica Ejercicios ResueltosSebastian RubatPas encore d'évaluation
- Seminario 5Document4 pagesSeminario 5Mar ValenciaPas encore d'évaluation
- Rxns EnzDocument7 pagesRxns EnzLuis Gustavo Nolasco LeónPas encore d'évaluation
- Banco de PreguntasDocument10 pagesBanco de PreguntasAlejandro VanegasPas encore d'évaluation
- Problemas C.E 2Document5 pagesProblemas C.E 2Alejandro PeñafielPas encore d'évaluation
- Relacion de Problemas EnzimologiaDocument5 pagesRelacion de Problemas EnzimologiaCarmen Rincón100% (1)
- Taller 1 de BioquímicaDocument8 pagesTaller 1 de BioquímicaManuel Alejandro Armero QuinteroPas encore d'évaluation
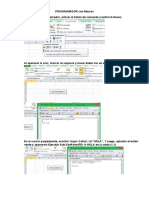
- Práctica 3 - Las Fórmulas Matriciales en ExcelDocument43 pagesPráctica 3 - Las Fórmulas Matriciales en ExcelJose Orbegoso LopezPas encore d'évaluation
- Balances Con MatricesDocument4 pagesBalances Con MatricesJose Orbegoso LopezPas encore d'évaluation
- Destilación y Ejercicios de AplicaciónDocument11 pagesDestilación y Ejercicios de AplicaciónJose Orbegoso LopezPas encore d'évaluation
- SolverDocument4 pagesSolverJose Orbegoso LopezPas encore d'évaluation
- Práctica 3 - Las Fórmulas Matriciales en ExcelDocument43 pagesPráctica 3 - Las Fórmulas Matriciales en ExcelJose Orbegoso LopezPas encore d'évaluation
- Práctica de Programador Con MacrosDocument14 pagesPráctica de Programador Con MacrosJose Orbegoso LopezPas encore d'évaluation
- Clase Nro 2 - Formatos en Excel, Impresiones, Gráficos y FuncionesDocument77 pagesClase Nro 2 - Formatos en Excel, Impresiones, Gráficos y FuncionesJose Orbegoso LopezPas encore d'évaluation
- Práctica de FuncionesDocument7 pagesPráctica de FuncionesJose Orbegoso LopezPas encore d'évaluation
- ConteoONPE y Minimos CuadradosDocument3 pagesConteoONPE y Minimos CuadradosJose Orbegoso LopezPas encore d'évaluation
- Clase Nro 3 (1) - Arreglos Unidimensionales y Bidimensionales - Vectores y MatricesDocument20 pagesClase Nro 3 (1) - Arreglos Unidimensionales y Bidimensionales - Vectores y MatricesJose Orbegoso LopezPas encore d'évaluation
- Clase Nro 4 - Comandos CondicionalesDocument13 pagesClase Nro 4 - Comandos CondicionalesJose Orbegoso LopezPas encore d'évaluation
- Práctica 1 Matlab ExcelDocument1 pagePráctica 1 Matlab ExcelJose Orbegoso LopezPas encore d'évaluation
- Ejercicios para Elaborar Programas de Algoritmo y ProgramaciónDocument3 pagesEjercicios para Elaborar Programas de Algoritmo y ProgramaciónJose Orbegoso LopezPas encore d'évaluation
- Clase Nro 3 - ESCALARES Y VECTORESDocument41 pagesClase Nro 3 - ESCALARES Y VECTORESJose Orbegoso LopezPas encore d'évaluation
- Tercer Examen Algoritmo y Programación2019iiDocument1 pageTercer Examen Algoritmo y Programación2019iiJose Orbegoso LopezPas encore d'évaluation
- Práctica Nro 1Document6 pagesPráctica Nro 1Jose Orbegoso LopezPas encore d'évaluation
- Clase Nro 1 - ALGORITMOS - PROGRAMACIÓN EN COMPUTADORAS - LENGUAJES DE PROGRAMACIÓNDocument16 pagesClase Nro 1 - ALGORITMOS - PROGRAMACIÓN EN COMPUTADORAS - LENGUAJES DE PROGRAMACIÓNJose Orbegoso LopezPas encore d'évaluation
- Examen 2 de Ingeniería de BiorreactoresDocument5 pagesExamen 2 de Ingeniería de BiorreactoresJose Orbegoso LopezPas encore d'évaluation
- Primera Clase Algoritmos - Programación en Computadoras - Lenguajes de ProgramaciónDocument16 pagesPrimera Clase Algoritmos - Programación en Computadoras - Lenguajes de ProgramaciónJose Orbegoso LopezPas encore d'évaluation
- Primera Clase Algoritmos - Programación en Computadoras - Lenguajes de ProgramaciónDocument16 pagesPrimera Clase Algoritmos - Programación en Computadoras - Lenguajes de ProgramaciónJose Orbegoso LopezPas encore d'évaluation
- Tercer Examen Algoritmo y Programación2019iiDocument1 pageTercer Examen Algoritmo y Programación2019iiJose Orbegoso LopezPas encore d'évaluation
- Ingredientes y Procedimiento de Preparación Del Plato Ritual y FestivoDocument2 pagesIngredientes y Procedimiento de Preparación Del Plato Ritual y FestivoJose Orbegoso LopezPas encore d'évaluation
- Práctica #6 - Gráficas 2D, 3D y MúltiplesDocument23 pagesPráctica #6 - Gráficas 2D, 3D y MúltiplesJose Orbegoso LopezPas encore d'évaluation
- Práctica Nro 1Document6 pagesPráctica Nro 1Jose Orbegoso LopezPas encore d'évaluation
- Guia #5 de Programación en Computadoras (Bucles) 1Document4 pagesGuia #5 de Programación en Computadoras (Bucles) 1Jose Orbegoso LopezPas encore d'évaluation
- Aprendizaje, Imprimir y Leer HoyDocument3 pagesAprendizaje, Imprimir y Leer HoyJose Orbegoso LopezPas encore d'évaluation
- Ejemplos de Diferencia FinitaDocument4 pagesEjemplos de Diferencia FinitaJose Orbegoso LopezPas encore d'évaluation
- Formato Carga NO Lectiva SRA. LIZ - 2019-IIDocument2 pagesFormato Carga NO Lectiva SRA. LIZ - 2019-IIJose Orbegoso LopezPas encore d'évaluation
- Plan de Estudios 05-MallaCurricular de Ingenieria QuímicaDocument60 pagesPlan de Estudios 05-MallaCurricular de Ingenieria QuímicaJose Orbegoso LopezPas encore d'évaluation
- Guia #1 de Programación en ComputadorasDocument31 pagesGuia #1 de Programación en ComputadorasJose Orbegoso LopezPas encore d'évaluation
- Sintesis Prueba Quimica MOLINADocument36 pagesSintesis Prueba Quimica MOLINAsebastkmPas encore d'évaluation
- Entrevista MorfologiaDocument5 pagesEntrevista MorfologiaIván D. Solarte SarastiPas encore d'évaluation
- DETERMINACIÓN DEL PH y La Turbidez Con Intrumentos de LaboratorioDocument10 pagesDETERMINACIÓN DEL PH y La Turbidez Con Intrumentos de LaboratorioLupeLupitaPecheVillafane100% (2)
- Informe Practica 4Document51 pagesInforme Practica 4angiePas encore d'évaluation
- Tipos de GlicolesDocument7 pagesTipos de GlicolesMiguel Angel Lopez50% (2)
- Tesis Del Empleado Del Yacon y De-Una Cepa Probiotica para Obtener Una BebidaDocument7 pagesTesis Del Empleado Del Yacon y De-Una Cepa Probiotica para Obtener Una BebidaJulie DZPas encore d'évaluation
- Trabajo Final MineralurgiaDocument19 pagesTrabajo Final MineralurgiaJorge ParraPas encore d'évaluation
- Quimica Problemas IbarzDocument106 pagesQuimica Problemas IbarzAlex Vargas77% (13)
- Trabajo Prescrito 2 - Estimación de La OsmolaridadDocument18 pagesTrabajo Prescrito 2 - Estimación de La OsmolaridadSteven Zúñiga67% (6)
- 4 ManualAntifngicos2012Document123 pages4 ManualAntifngicos2012Adela AmpueroPas encore d'évaluation
- Informe 3 de Fisicoquímica.Document14 pagesInforme 3 de Fisicoquímica.Jorge CastroPas encore d'évaluation
- BWT ManualDocument86 pagesBWT Manualsalvador_kuzPas encore d'évaluation
- Tipos de EvaporadoresDocument6 pagesTipos de EvaporadoresAlfonso Castañeda GraceyPas encore d'évaluation
- 16reportes de BiofarmaciaDocument12 pages16reportes de BiofarmaciaRuben Miguel SanchezPas encore d'évaluation
- Solución de Cuestionario-Gas NaturalDocument17 pagesSolución de Cuestionario-Gas Naturalgroub100% (2)
- Cuestionario de Propiedades ColigativasDocument8 pagesCuestionario de Propiedades Coligativaselias cantoPas encore d'évaluation
- Trazabilidad en Quimica - CENAMDocument20 pagesTrazabilidad en Quimica - CENAMImmerPas encore d'évaluation
- Formato Informe EscritoDocument9 pagesFormato Informe EscritoabrahamdaneiPas encore d'évaluation
- Manual de Rescate de MinasDocument100 pagesManual de Rescate de MinasJuan Pablo Romero RiveraPas encore d'évaluation
- Pruebas Saber Concentración SolucionesDocument5 pagesPruebas Saber Concentración SolucionesJohanna Corredor50% (2)
- Equilibrio Liquido Vapor Mezclas BinariasDocument6 pagesEquilibrio Liquido Vapor Mezclas Binariasarmando gPas encore d'évaluation
- Abl 80 EettDocument4 pagesAbl 80 EettFernando Manuel Gomez GuevaraPas encore d'évaluation
- Material de Estudio - Parte I (Diap. 1-86)Document43 pagesMaterial de Estudio - Parte I (Diap. 1-86)JWBRAVORPas encore d'évaluation
- Practica 3 SolubilidadDocument6 pagesPractica 3 SolubilidadHec ValenciaPas encore d'évaluation
- LAB 3 Maduracion Artificial de FrutasDocument28 pagesLAB 3 Maduracion Artificial de FrutasElvia Gómez Villacorta67% (3)