Académique Documents
Professionnel Documents
Culture Documents
Física e Química A - Curva de titulação Na2CO3-HCl
Transféré par
Ana SilvaDescription originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Física e Química A - Curva de titulação Na2CO3-HCl
Transféré par
Ana SilvaDroits d'auteur :
Formats disponibles
FSICA E QUMICA A
Ano lectivo 2012/2013
12 Ano Turma B
Ana Filipa Sovelas da Silva Daniela Cristina Caramelo Leal Gabriela Astride dos Santos Macedo Joo Francisco Susano Canelas Joo Miguel Casmarrinha Barras Relatrio de uma Actividade Experimental Ttulo Estudo de uma soluo-tampo
Objectivos: Neutralizar uma soluo aquosa de Na2CO3 com HCl, numa titulao base fraca/cido forte; Medir o pH da soluo ao longo do processo e traar a curva de titulao com o intuito de identificar as zonas com efeito tampo, de forma a compreender o funcionamento de um sistema tampo; Fundamento terico: Este trabalho experimental consiste na observao de efeito tampo atravs da determinao sucessiva do pH do titulado durante uma titulao de uma soluo aquosa de Na2CO3 com uma soluo de cido clordrico. Assim, um dos conceitos que se torna importante definir o conceito de pH. Este mede a concentrao de ioes H 3O+ em determinada soluo. Matematicamente, calcula-se o pH da seguinte forma: pH = - log ([H3O+]) O pH ainda pode ser medido de diversas maneiras, tais como: por adio de um indicador de pH na soluo em anlise. A, a cor do indicador varia consoante o pH da soluo (papel indicador universal ou solues proprias para o efeito); usando um medidor de pH que um multmetro com uma escala que converte o valor de tenso do elctrodo de pH em unidades de pH. Segundo a teoria de Bronsted-Lowry, um cido toda a espcie qumica que cede protes (H+), fazendo aumentar a concentrao de H 3O+ em soluo aquosa e diminuindo o pH. Por outro lado, uma espcie qumica que capta protes uma base. Em contacto com a gua, uma base d origem a ies HO-, que por sua vez se ligam a ies H3O+, dando origem a gua. Podemos ento deduzir que uma base faz diminuir a concentrao de H3O+, aumentando o pH.
N 5 N 14 N 17 N 20 N 21
___________________________1___________________________
O processo de titulao acido-base feito em aula, assim como qualquer outro, consiste numa reao de neutralizao que ocorre entre um cido e uma base, dando origem a um sal e gua. Quando o nmero de moles de cido igual ao nmero de moles de base, atinge-se o ponto de equivalncia da titulao. Porm, atingir o ponto de equivalncia no significa necessariamente que o pH seja neutro. O pH no ponto de equivalncia depende das caractersticas do sal formado. Caso este sofra hidrlise, o pH ser diferente do pH neutro. O traado do grfico de variao do pH em funo do volume adicionado de titulante designa-se por curva de titulao. Nas titulaes do tipo da realizada na atividade experimental (base fraca - cido forte) h uma fase antes do ponto de equivalncia em que acrscimos considerveis de titulante provocam variaes de pH diminutas. Nesta fase temos, ento, aquilo a que se chama efeito tampo. Um tampo uma mistura de compostos qumicos capaz de resistir a variaes de pH, visto apresentar em soluo um consumidor e dador de protes, como explicaremos mais de seguida. Uma soluo tampo pode ser uma soluo concentrada de um cido forte, de uma base forte, uma soluo de um cido fraco com a sua base conjugada ou ainda uma soluo de base fraca com o seu cido conjugado. No caso da nossa experincia em concreto, o titulante uma soluo aquosa de HCl e o titulado uma soluo aquosa de Na2CO3. Os ies resultantes da dissoluo do carbonato de sdio so: Na+ - que no sofre hidrlise, pois inerte do ponto de vista cido-base. CO32- - que uma base diprtica, podendo, assim, captar dois protes.
Antes de ser atingido o primeiro ponto de equivalncia temos em soluo ies CO32- e HCO3-, o par acido-base responsvel pelo comportamento tampo . (Neste caso, o CO32serviria como consumidor e o HCO3- como dador de protes).Quando, medida que adicionamos titulante, se consumirem os ies CO32- atinge-se o primeiro ponto de equivalncia. Aps o primeiro ponto de equivalncia temos em soluo com ies HCO 3- e H2CO3. Este o par acido-base responsvel pelo comportamento tampo desta fase da titulao. (Neste caso, o HCO3- serviria como consumidor de protes e o H 2CO3 como dador de protes). Quando, medida que adicionamos titulante, se consumirem os ies HCO 3- atinge-se o segundo e ltimo ponto de equivalncia . Assim, o grfico resultante das medies de pH durante a titulao ter de ter o seguinte aspeto:
Grfico 01
___________________________2___________________________
Material: Bureta 25mL (1); Gobel 100mL (2); 3x Gobel 50mL (3); Suporte universal e
garra para bureta (4); Medidor de pH (5); Calculadora grfica (6); Papel absorvente (7); Esguicho com gua destilada (8); Funil (9); Pompete; Pipeta graduada 25mL (10); Balana automtica; Vidro de relgio; Esptula; Vareta de vidro; Balo Volumtrico; Conta-gotas
Reagentes: 100mL de soluo aquosa Na2CO3 0,1M 100mL de soluo aquosa HCl 0,1M gua destilada Soluo tampo de pH 7,0 (fosfatada) Soluo tampo de pH 4,0 (fosfato/acdo ctrico)
Procedimento Experimental: 1. 2. 3. 4. 5. 6. 7. 8. Preparao da soluo de Na2CO3 com a concentrao (0,1 mol/dm3):
Enxaguar a esptula com gua destilada; Secar a esptula cuidadosamente; Medir a massa necessria de reagente num vidro de relgio; Dissolver todo o reagente utilizando apenas uma parte de gua destilada e agitando com uma vareta de vidro; Verter a soluo para um balo volumtrico com um auxlio de um funil, lavando o gobel, a vareta de vidro e o funil com gua destilada, de modo a arrastar todo reagente; Adicionar gua destilada at marca, primeiro com o esguicho e, depois, com um contagotas; Tapar e homogeneize a soluo, invertendo vrias vezes o balo volumtrico; Elaborar uma etiqueta para rotular a soluo.
___________________________3___________________________
Preparao da soluo de HCl com concentrao (0,1 mol/dm 3)
1. Calcular o volume necessrio de soluo-me e medi-lo com uma pipeta graduada; 2. Verter a quantidade de volume medido, para um balo volumtrico de 100mL; 3. Adicionar gua destilada at marca, primeiro com o esguicho e, depois, com um contagotas; 4. Elaborar uma etiqueta para rotular a soluo. A etiqueta deve conter o nome da soluo, a frmula qumica, a concentrao e a data da preparao. -Nota: Para o manuseamento do cido clordrico (HCl) necessrio usar culos de segurana e luvas de borracha, pois trata-se de um cido corrosivo para a pele, quando concentrado, e perigoso se ocorrerem salpicos para os olhos.
Titulao e Medio do pH
1. Calibrar o aparelho medidor de pH, utilizando solucoes tampes de pH 7 e 4 respectivamente; 2. Utilizar uma pipeta graduada e de um pompete para medir 10mL da soluo do Na2CO3; 3. Lavar o eltrodo e o sensor de aparelho medidor de pH com gua destilada antes de iniciar a experincia; 4. Depositar uma pequena poro de cido na bureta, lavando-a; 5. Encher completamente a bureta com uma soluo de HCl, 0,10mol/dm3; 6. Montar a bureta e o sensor; 7. Registar o valor do volume inicial de titulante na bureta; 8. Introduzir o eltrodo do medidor de pH na soluo a titular e registar o seu valor de pH; 9. Adicionar 0,5mL de HCl soluo de Na2CO3 e registar o valor de pH, repetindo o processo at serem gastos os 25mL desta mesma soluo; 10. Lavar e limpar a bureta.
___________________________4___________________________
Registo dos Resultados Experimentais:
Vtitulante/(mL) 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0 5,5 6,0 6,5 7,0 7,5 8,0
pH 11,11 10,85 10,70 10,57 10,48 10,38 10,29 10,23 10,14 10,08 10,01 9,95 9,88 9,82 9,76 9,69 9,65
Vtitulante/(mL) 8,5 9,0 9,5 10,0 10,5 11,0 11,5 12,0 12,5 13,0 13,5 14,0 14,5 15,0 15,5 16,0 16,5
pH 9,56 9,50 9,42 9,33 9,24 9,14 9,03 8,88 8,69 8,11 7,70 7,42 7,27 7,16 7,10 7,04 6,95
Vtitulante/(mL) 17,0 17,5 18,0 18,5 19,0 19,5 20,0 20,5 21,0 21,5 22,0 22,5 23,0 23,5 24,0 24,5 25,0
pH 6,84 6,74 6,69 6,63 6,57 6,50 6,39 6,33 6,25 6,18 6,09 6,01 5,86 5,77 5,54 5,37 5,04
Tratamento dos Resultados Experimentais: Clculo da massa de Na2CO3 necessrio para preparar a soluo de concentrao (0,1 mol/dm3):
M (Na2CO310 H2O)=2x22,99+12,01+3x16+20x1,01+10x16=286,19g/mol C (Na2CO3)=0,1 mol/dm3 V (Na2CO3)=100 mL=0,100 dm3 n=CxV n=0,1x0,100 n=0,01 mol de Na2CO3 n=m/M m=0,01x286,19 m=2,8619 2,86g de Na2CO3 Clculo da volume de HCl de soluo-me necessrio para preparar a soluo de concentrao (0,1 mol/dm3):
M (HCl)=1,01+35,45=36,46g/mol C (HCl)=0,1 mol/dm3 V (HCl)=100 mL=0,100 dm3 n=CxV n=0,1x0,100 n=0,01 mol de HCl n=m/M m=0,01x36,46 m=0,3646 g de HCl
___________________________5___________________________
%(m/m)= 37% m=0,3646x0,37=0,985 g densidade=1,19 g/cm3 d=m/V V=m/dV=0,985/1,19 V 0,83 cm3 de HCl Clculo do pH inicial do titulado:
Grfico respetivo curva de titulao de Na2CO3 com HCl:
Grfico 02
___________________________6___________________________
Concluses: Apartir do grfico 01 podemos claramente distinguir a existncia de um ponto de equivalncia (B) e duas zonas tampo com variao de cerca de 2,5 valores de pH (A e C), como podemos ver no seguinte grfico:
Grfico 03 Na sequncia da anlise do traado do grfico e em comparao com o grfico 01, o grupo inferiu a existncia de um segundo ponto de equivalncia (D), que teria sido obtido experimentalmente caso a titulao se tivesse prolongado e mais cido tivesse sido adicionado. Uma vez que, tendo em conta o protocolo, era suposto termos atingido o segundo ponto de equivalncia antes dos 25 mL de titulante, podemos claramente dizer que a experiencia no correu como previsto. Associados ao mau resultado do trabalho laboratorial podero estar muitas razes, entre elas consifdermos as mais possiveis e significativas: uma m calibrao ou utilizao do medidor de pH ou uma m preparao das solues. No entanto, uma m calibrao ou utilizao do medidor de pH apenas nos daria erro nos valores absolutos de pH, ou seja, a curva teria o mesmo aspeto, mantendo-se o problema. Sabemos que o ponto de equivalencia se daria quando nA=nB e, logo, quando CAxVA=CBxVB. Uma vez que acido e base apresentam a mesma concentrao, o ponto de equivalncia dar-se-ia quando a quantidade de cido adicionado igualasse a quantidade de base do gobl, ou seja, quando fossem adicionados 10 mL de titulante., verificmos que o ponto de equivalencia experimental deu-se aos 13 mL de titulante adicionado ( e tambm importante notar que, como previsto, o segundo ponto de equivalncia se deu aps a adio do dobro desse volume).
___________________________7___________________________
Tal coerente com um erro associado a uma m preparao das solues. Agora vejemos: nA=nB CA x VA = CB x VB CA x 13 = CB x 10 logo CA<CB Da anterior igualdade resulta que: Ou a concentrao da soluo cida medida era menor que o suposto Ou a concentrao da soluo basica medida era superior ao suposto
Uma vez que o pH inicial experimental significativamente inferior ao pH inicial terico, conclumos que, mais provavelmente, a concentrao da soluo cida medida poder ter sido menor que o suposto (uma vez que a anterior condio no indica que a soluo basica estaria em concentrao insuficiente). Aparte de erros experimentais, toda a atividade decorreu sem qualquer imprevisto ou acidente e ajudou, de facto, o grupo a compreender o funcionamento de uma soluo tampo.
Bibliografia consultada: DANTAS, Maria da Conceio; RAMALHO, Marta Duarte; Jogos de Partculas, Qumica 12 ano, Caderno de Actividades Laboratoriais, Texto Editores, 1 edio, 3 tiragem, Lisboa, 2009 DANTAS, Maria da Conceio; RAMALHO, Marta Duarte; Jogos de Partculas, Qumica 12 ano, Manual do Aluno, Texto Editores, 1 edio, 4 tiragem, Lisboa, 2009 http://www.notapositiva.com/pt/trbestbs/quimica/12_funcionamento_de_um_sistema_ta mpao_d.htm - consultado no dia 15 de maio de 2013; http://www.scribd.com/document_downloads/direct/25347305? extension=pdf&ft=1368275309<=1368278919&user_id=111224002&uahk=9bka2X3rBX pJVat9KbRKPjgmoRY
AVALIAO:
A Professora _______________________
(Maria da Conceio Pires)
___________________________8___________________________
Vous aimerez peut-être aussi
- Relatório do Trabalho Prático de Química Aplicada sobre Titulação de Ácido AcéticoDocument13 pagesRelatório do Trabalho Prático de Química Aplicada sobre Titulação de Ácido AcéticoPedro GasparPas encore d'évaluation
- Relatório Actividade ExperimentalDocument10 pagesRelatório Actividade Experimentalvalsassina100% (3)
- Relatorio de Quimica - TAMPAODocument11 pagesRelatorio de Quimica - TAMPAOFilipa MendesPas encore d'évaluation
- Preparo Solução HClDocument4 pagesPreparo Solução HClElisangelasilverioPas encore d'évaluation
- Padrão Ácido-BaseDocument8 pagesPadrão Ácido-BaseGessiele RochaPas encore d'évaluation
- Relatório de Química Analítica - Barbarah e ItaloDocument7 pagesRelatório de Química Analítica - Barbarah e ItaloItalo SoaresPas encore d'évaluation
- Determinação do teor de NaOH em soda cáustica comercialDocument6 pagesDeterminação do teor de NaOH em soda cáustica comercialSamuel AguiarPas encore d'évaluation
- Potenciometria de NeutralizaçãoDocument12 pagesPotenciometria de NeutralizaçãoFlavia MelloPas encore d'évaluation
- Relatório 03Document12 pagesRelatório 03anon_48619145975% (4)
- Análise de AlcalinidadeDocument5 pagesAnálise de AlcalinidadeLaise GobiraPas encore d'évaluation
- Relatório VolumetriaDocument6 pagesRelatório VolumetriaCarla Carolina Correa AlexandrePas encore d'évaluation
- Mistura de soluções químicas e titulaçãoDocument12 pagesMistura de soluções químicas e titulaçãoSr. OrthusPas encore d'évaluation
- Relat TP4Document12 pagesRelat TP4Mike RadaPas encore d'évaluation
- Aula 7Document10 pagesAula 7Aline CalazansPas encore d'évaluation
- Determinação de concentração por titulaçãoDocument7 pagesDeterminação de concentração por titulaçãoNatália RodriguesPas encore d'évaluation
- Titulacao Acido BaseDocument7 pagesTitulacao Acido BaseSónia RibeiroPas encore d'évaluation
- Determinação da concentração de ácido fosfórico em Coca-ColaDocument12 pagesDeterminação da concentração de ácido fosfórico em Coca-ColaHellen MacêdoPas encore d'évaluation
- Arcimboldo: O pH da águaDocument52 pagesArcimboldo: O pH da águaMadalena FreitasPas encore d'évaluation
- Relatório - SoluçõesDocument12 pagesRelatório - SoluçõesRicardo Vital BarrosoPas encore d'évaluation
- Relatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoDocument5 pagesRelatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoleonorPas encore d'évaluation
- Apl 1.6Document12 pagesApl 1.6Daniela CoelhoPas encore d'évaluation
- Relatório - Volumetria de NeutralizaçãoDocument19 pagesRelatório - Volumetria de NeutralizaçãoGabi Bitto86% (7)
- Ae q11 Guiao Expl Al 2 1Document6 pagesAe q11 Guiao Expl Al 2 1Luísa PintoPas encore d'évaluation
- Preparação HCLDocument9 pagesPreparação HCLestevancescPas encore d'évaluation
- Relatório de Aula Prática Preparo e PadronizaçãoDocument6 pagesRelatório de Aula Prática Preparo e PadronizaçãoJoao NetoPas encore d'évaluation
- Preparo Soluções RefrescoDocument6 pagesPreparo Soluções RefrescobjuandantasPas encore d'évaluation
- Analexp 2 - Experimento 4 - Ac. FosforicoDocument6 pagesAnalexp 2 - Experimento 4 - Ac. FosforicoSamuel AguiarPas encore d'évaluation
- Análise de H2O2 por permanganometriaDocument7 pagesAnálise de H2O2 por permanganometriaLuiz Carlos SantanaPas encore d'évaluation
- Ácido fosfórico Coca-ColaDocument9 pagesÁcido fosfórico Coca-ColaKiany SirleyPas encore d'évaluation
- Relatorio de Quimica AnaliticaDocument43 pagesRelatorio de Quimica Analiticawilianinacio84100% (1)
- Determinação da pureza de hidróxido de magnésio em leite de magnésiaDocument13 pagesDeterminação da pureza de hidróxido de magnésio em leite de magnésiakakadfPas encore d'évaluation
- Preparação e Padronização de SoluçõesDocument15 pagesPreparação e Padronização de SoluçõespaivadinizPas encore d'évaluation
- Apostila 2 FS I DOCAlexDocument20 pagesApostila 2 FS I DOCAlexjudje0812Pas encore d'évaluation
- Experiência 8Document5 pagesExperiência 8rubensrssPas encore d'évaluation
- Relatorio 3Document6 pagesRelatorio 3Joyce ThayanePas encore d'évaluation
- Relatório 7Document6 pagesRelatório 7Gabriel SilvaPas encore d'évaluation
- LuizMaistrelo Atividade2Document5 pagesLuizMaistrelo Atividade2Luiz Henrique MaistreloPas encore d'évaluation
- Relatório Analitica 4Document7 pagesRelatório Analitica 4Jose SouzaPas encore d'évaluation
- Relatório Faculdade 28-06Document6 pagesRelatório Faculdade 28-06Italo SoaresPas encore d'évaluation
- Apostila de Quimica Geral e Experimental II 2013Document28 pagesApostila de Quimica Geral e Experimental II 2013Lucas CostaPas encore d'évaluation
- Exp 04 - Resinas de Troca-iônica Análise de Um Sal HidratadoDocument14 pagesExp 04 - Resinas de Troca-iônica Análise de Um Sal Hidratadothhwd2fqkkPas encore d'évaluation
- PREPARAÇÃO E PADRONIZAÇÃO DE SOLUÇÕES DE HCL E H2SO4Document12 pagesPREPARAÇÃO E PADRONIZAÇÃO DE SOLUÇÕES DE HCL E H2SO4Efrero RochyPas encore d'évaluation
- Titulação de vinagre e leite de magnésiaDocument26 pagesTitulação de vinagre e leite de magnésiaMarcello TrevisanPas encore d'évaluation
- EXPERIENCIA-8-Titulação_bnu-1Document4 pagesEXPERIENCIA-8-Titulação_bnu-1Matheus CostaPas encore d'évaluation
- Agua OxigenadaDocument11 pagesAgua OxigenadafabisimanPas encore d'évaluation
- Aula 5 Introducao VolumetriaDocument21 pagesAula 5 Introducao VolumetriaMatheus José100% (1)
- Padronização de HClDocument9 pagesPadronização de HClBrenoPas encore d'évaluation
- Padronização de SoluçõesDocument9 pagesPadronização de SoluçõesLetícia Sigrid100% (2)
- Diluição, Mistura de Soluções e Titulação1Document12 pagesDiluição, Mistura de Soluções e Titulação1Peter BontadiniPas encore d'évaluation
- Roteiro de Aula PráticaDocument7 pagesRoteiro de Aula PráticaFabio WuPas encore d'évaluation
- Relatorio Experi 10Document7 pagesRelatorio Experi 10Fernanda ElizaPas encore d'évaluation
- Determinação da acidez total em frutas cítricasDocument9 pagesDeterminação da acidez total em frutas cítricasEmílioDosSantosPas encore d'évaluation
- Curva de Titulação de Ácido Forte Com Base ForteDocument13 pagesCurva de Titulação de Ácido Forte Com Base ForteJulio GonçalvesPas encore d'évaluation
- Tratamento de Lodos de Estações de Tratamento de ÁguaD'EverandTratamento de Lodos de Estações de Tratamento de ÁguaPas encore d'évaluation
- Biofísica para ciências biomédicas – 4ª ediçãoD'EverandBiofísica para ciências biomédicas – 4ª ediçãoPas encore d'évaluation
- Projetos Com Esp8266 Programado Em Lua - Parte XxiD'EverandProjetos Com Esp8266 Programado Em Lua - Parte XxiPas encore d'évaluation
- Projetos Em Clp Ladder Baseado No Twidosuite Parte XiiD'EverandProjetos Em Clp Ladder Baseado No Twidosuite Parte XiiPas encore d'évaluation
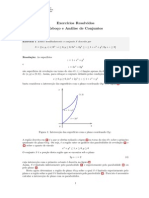
- Esboço detalhado de conjuntos limitados em R3Document176 pagesEsboço detalhado de conjuntos limitados em R3Ana Silva100% (1)
- Ficha 1 SolDocument5 pagesFicha 1 SolAna SilvaPas encore d'évaluation
- Exame Portugues 2faseDocument8 pagesExame Portugues 2faseMUIJPas encore d'évaluation
- Sinaletica CartaoDeControle OrientacaoDocument16 pagesSinaletica CartaoDeControle OrientacaoEmanuel VieiraPas encore d'évaluation
- Trig On ExDocument6 pagesTrig On ExAna SilvaPas encore d'évaluation
- Qual É o Significado Da VidaDocument1 pageQual É o Significado Da VidaAna SilvaPas encore d'évaluation
- Um Homem para A Eternidade - Ficha Do FilmeDocument1 pageUm Homem para A Eternidade - Ficha Do FilmeAna SilvaPas encore d'évaluation
- Avaliação de Matemática AplicadaDocument4 pagesAvaliação de Matemática AplicadaHenrrykePas encore d'évaluation
- Relatório 03 - 03Document14 pagesRelatório 03 - 03Paloma Medeiros BaquerPas encore d'évaluation
- Teste Global 6ºDocument6 pagesTeste Global 6ºMaria Da Guia FonsecaPas encore d'évaluation
- Como Abrir Uma Empresa Offshore Hoje?Document2 pagesComo Abrir Uma Empresa Offshore Hoje?STLAPas encore d'évaluation
- Indicadores Astrológicos para SaúdeDocument25 pagesIndicadores Astrológicos para SaúdeMichele PóPas encore d'évaluation
- Apostila AnatomiaDocument60 pagesApostila AnatomiaPhelipe DiasPas encore d'évaluation
- Inglês OffshoreDocument19 pagesInglês OffshoreThainá Mendes Nunes Arceneaux100% (1)
- Vol I - Memorial e OrçamentoDocument35 pagesVol I - Memorial e OrçamentoRosileide SilvaPas encore d'évaluation
- Solo Network - Proposta P22-403036A - Autodesk - 1 Civil 3dDocument7 pagesSolo Network - Proposta P22-403036A - Autodesk - 1 Civil 3dvncs08Pas encore d'évaluation
- Construção e minas: soluções Atlas CopcoDocument20 pagesConstrução e minas: soluções Atlas CopcoTiago HenriquesPas encore d'évaluation
- Vivaz Taboão Da SerraDocument25 pagesVivaz Taboão Da SerraIsaac SilvaPas encore d'évaluation
- 2201 Livro Ergonomia PGR GRODocument151 pages2201 Livro Ergonomia PGR GROJaqueline Fernandes Silva100% (2)
- Diabetes: Definição, Tipos, Fatores de Risco e TratamentosDocument6 pagesDiabetes: Definição, Tipos, Fatores de Risco e TratamentosJúlia VianaPas encore d'évaluation
- O Método Da Cruz CeltaDocument4 pagesO Método Da Cruz CeltaJoão PauloPas encore d'évaluation
- O Que É Pós ModernoDocument36 pagesO Que É Pós Modernojhcg13100% (1)
- P7 - Ebook - XIX - ALFAL - Capítulo Coautoria Bruna 2022Document296 pagesP7 - Ebook - XIX - ALFAL - Capítulo Coautoria Bruna 2022khvcyqbsg6Pas encore d'évaluation
- Cuidados com máquinas de corte e proteção da saúde no açougueDocument3 pagesCuidados com máquinas de corte e proteção da saúde no açougueRafaela Grande Pereira100% (1)
- O Homem Do Princípio Ao Fim - Millôr FernandesDocument62 pagesO Homem Do Princípio Ao Fim - Millôr FernandesGustavo LemosPas encore d'évaluation
- Como Configurar As Cobranças Cartão para o Reconhecimento Automático de Bandeiras Na Rotina 2075 - PC Sistemas - TDNDocument2 pagesComo Configurar As Cobranças Cartão para o Reconhecimento Automático de Bandeiras Na Rotina 2075 - PC Sistemas - TDNRenatto CruzPas encore d'évaluation
- XL-fios CabosDocument3 pagesXL-fios Cabosfredrider2009Pas encore d'évaluation
- Normas para monografias de pós-graduação em DireitoDocument17 pagesNormas para monografias de pós-graduação em DireitoOsmar Alves BocciPas encore d'évaluation
- Receita caseira para cerveja artesanal de até 50 litrosDocument4 pagesReceita caseira para cerveja artesanal de até 50 litrosLuis Augusto PereiraPas encore d'évaluation
- Plano - Base Nacional ComumDocument16 pagesPlano - Base Nacional ComumCarmem NetoPas encore d'évaluation
- Checklist de Auditoria Departamento PessoalDocument2 pagesChecklist de Auditoria Departamento Pessoalrroricardo83% (12)
- Atividade QDT Julia e MilenaDocument9 pagesAtividade QDT Julia e MilenaMaria Julia Rodrigues Lopes de PaivaPas encore d'évaluation
- Ed - 1819 - Clique e LeiaDocument193 pagesEd - 1819 - Clique e LeiaHélber RolembergPas encore d'évaluation
- Edital de LeilãoDocument41 pagesEdital de LeilãoHendrick MenezesPas encore d'évaluation
- Manual CadnormaDocument69 pagesManual CadnormaMarcelo José Santos Ferreira100% (1)
- Comércio Internacional: INCOTERMS e ContratosDocument70 pagesComércio Internacional: INCOTERMS e ContratosPaulist Pessoa BatutaPas encore d'évaluation
- Aula Conjunto MóvelDocument40 pagesAula Conjunto MóvelThiago ValentePas encore d'évaluation