Académique Documents
Professionnel Documents
Culture Documents
Nomenclatura Totale
Transféré par
Roberta BasiricòTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Nomenclatura Totale
Transféré par
Roberta BasiricòDroits d'auteur :
Formats disponibles
Nomenclaturachimica
PrimapaginadellaChymical Nomenclature diLavoisier
La nomenclatura chimica regolamentata dalla IUPAC (International Union for Pure
Nomenclaturachimica
La nomenclatura chimica regolamentata dalla IUPAC (International Union for Pure
and Applied Chemistry), un'associazione internazionale che periodicamente si riunisce
per aggiornare le regole della "sintassi chimica" alla luce delle nuove conoscenze. Le
regole della nomenclatura presentate qui e tuttora valide sono state elaborate regole della nomenclatura, presentate qui e tuttora valide, sono state elaborate
durante il congresso IUPAC del 1959, basato sulle precedenti proposte di Alfred Stock.
l d d ll Antoine Lavoisier, intorno al 1787, diede per primo una sistemazione alla
nomenclatura chimica rendendola simile alla moderna. I suffissi ico oso ato ito uro,
usati ancora oggi, furono introdotti dal chimico francese. Per gli elementi, Lavoisier
propose dei simboli geometrici, poi sostituiti da John Dalton, che all'inizio
dell'Ottocento usava segni circolari.
I simboli degli elementi come li conosciamo oggi furono introdotti da Jhn Jacobs
Berzelius nel 1813. La loro semplicit ha contribuito, a poco a poco, alla definitiva
affermazione di tale simbologia affermazione di tale simbologia.
I simboli degli elementi sono costituiti da una, due o tre lettere che derivano dal nome
originale, spesso latino dell'elemento chimico. Per esempio, la lettera C rappresenta il
carbonio (dal latino carbo) O l'ossigeno (dal greco oxis e genes) U l'uranio (dal pianeta carbonio (dal latino carbo), O l ossigeno (dal greco oxis e genes), U l uranio (dal pianeta
Urano, scoperto pochi anni prima dell'elemento), Cu il rame (dal latino cuprum), Uuq
l'ununquadio ecc.
Nomenclaturachimica
La nomenclatura chimica permette di identificare i composti mediante un nome
specifico, che si definisce a partire dalla formula della sostanza.
Alcuni composti sono indicati prevalentemente con il loro nome comune: sono un Alcuni composti sono indicati prevalentemente con il loro nome comune: sono un
esempio l'acqua (H
2
O) e l'ammoniaca (NH
3
). Nella maggior parte dei casi per per
attribuire il nome ai differenti composti si utilizzano alcune regole codificate. Esistono
diversi sistemi di nomenclatura: la nomenclatura tradizionale quella IUPAC e la diversi sistemi di nomenclatura: la nomenclatura tradizionale, quella IUPAC e la
nomenclatura di Stock.
1 L l t t di i l b t i i l t ll di i i d li l ti 1.La nomenclatura tradizionale basata principalmente sulla divisione degli elementi
in metalli e non metalli e tiene conto dello stato di ossidazione degli atomi che
formano la molecola. Tale approccio stato spesso fonte di ambiguit
nell'identificazione delle sostanze.
2.La nomenclatura IUPAC basata sulle regole redatte dalla IUPAC nel 1959, riviste nel g
1971 e nel 1990; essa ci consente di evidenziare, in modo chiaro e immediato, la
relazione fra il nome di un composto e la sua formula chimica.
La notazione di Stock, ufficializzata dalla IUPAC nel 1940, fornisce informazioni pi chiare sullo stato di
ossidazione degli elementi; essa infatti indica gli stati di ossidazione con cifre romane poste tra parentesi.
L t t b ll t l di i d i i di l i l ti t
Nomenclaturachimica
Elemento Radice del nome
La seguente tabella mostra le radici dei nomi di alcuni elementi usate per
attribuire i nomi ai composti.
Elemento Radice del nome
Idrogeno idr
Fluoro fluor
Cloro clor
Bromo brom
Iodio iod
Zolfo solf
Selenio seleni Selenio seleni
Azoto nitr
Fosforo fosf
Carbonio carb o carbon
Silicio silic
Boro bor
Nomenclaturachimica Compostibinari
Icompostibinaridell'idrogeno(conimetalli)
Icompostibinaridell'ossigeno
Isalibinari
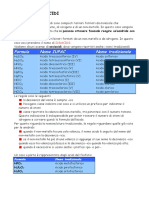
Formula Caratteristiche Nometradizionale Nomecomune NomeIUPAC
LiH solido,ionico idrurodilitio idrurodilitio
BaH
2
solido,ionico idrurodibario diidrurodibario
l
solidocovalentecontinuo,
id di ll i i
triidruro di
AlH
3
,
parzialmenteionico
idrurodialluminio
alluminio
CH
4
gasmolecolare,infiammabile metano
tetraidrurodi
carbonio carbonio
SiH
4
gasmolecolare,siincendiaall'aria silano tetraidrurodisilicio
NH
3
gas molecolare, solubile in acqua ammoniaca triidruro di azoto NH
3
gasmolecolare,solubileinacqua ammoniaca triidrurodiazoto
PH
3
gasmolecolare,siincendiaall'aria fosfina triidrurodifosforo
AsH gas molecolare si incendia all'aria arsina triidruro di arsenico AsH
3
gasmolecolare,siincendiaall aria arsina triidruro diarsenico
Nomenclaturachimica Compostibinari
Icompostibinaridell'idrogeno(coninonmetalli)
Icompostibinaridell'ossigeno
Isalibinari
Formula Nome IUPAC Nome tradizionale
HF fluoruro d'idrogeno acido fluoridrico
HCl cloruro d'idrogeno acido cloridrico g
HBr bromuro d'idrogeno acido bromidrico
Hl ioduro d'idrogeno acido iodidrico
lf d d d d lf d H
2
S solfuro di diidrogeno acido solfidrico
HCN cianuro d'idrogeno acido cianidrico
Nomenclaturachimica Compostibinari
Icompostibinaridell'idrogeno
Icompostibinaridell'ossigeno(conimetalli)
Isalibinari
Elemento
Statodi
ossidazione
Formula Nometradizionale NomeIUPAC(Stock)
Cu
+1 Cu
2
O ossidorameoso ossidodidirame(I)
Cu
+2 CuO ossidorameico ossidodirame(II)
Sn
+2
+4
SnO
SnO
2
ossidostannoso
ossidostannico
ossidodistagno(II)
diossidodistagno(IV)
Fe
+2
+3
FeO
Fe
2
O
3
ossidoferroso
ossidoferrico
ossidodiferro(II)
triossidodidiferro (III)
Nomenclaturachimica Compostibinari
Icompostibinaridell'idrogeno
Icompostibinaridell'ossigeno(coninonmetalli)
Isalibinari
Elemento
Statodi
ossidazione
Formula Nometradizionale NomeIUPAC
B +3 B
2
O
3
anidrideborica triossidodidiboro
C
+4
+2
CO
2
CO
anidridecarbonica
ossido di carbonio
diossidodicarbonio
monossido di carbonio +2 CO ossidodicarbonio monossidodicarbonio
+1
+2
+3
N
2
O
NO
N
2
O
3
protossidodiazoto
ossidodiazoto
anidride nitrosa
monossidodidiazoto
monossidodiazoto
triossido di diazoto
N
+3
+4
+4
+5
N
2
O
3
NO
2
N
2
O
4
N
2
O
5
anidridenitrosa
ipoazotideodiossidodiazoto
ipoazotide
anidride nitrica
triossidodidiazoto
diossidodiazoto
tetrossidodidiazoto
pentossido di diazoto 5 N
2
O
5
anidridenitrica pentossidodidiazoto
P
+3
+5
P
2
O
3
P
2
O
5
anidridefosforosa
anidridefosforica
triossidodidifosforo
pentossidodidifosforo
+4 SO anidride solforosa diossido di zolfo
S
+4
+6
SO
2
SO
3
anidridesolforosa
anidridesolforica
diossidodizolfo
triossidodizolfo
Nomenclaturachimica Compostibinari
Icompostibinaridell'idrogeno
Icompostibinaridell'ossigeno(coninonmetalli)
Isalibinari
Elemento
Statodi
id i
Formula Nometradizionale NomeIUPAC
ossidazione
+1
+3
Cl
2
O
Cl
2
O
3
anidrideipoclorosa
anidrideclorosa
monossidodidicloro
triossidodidicloro
Cl +4
+5
+7
ClO
2
Cl
2
O
5
Cl
2
O
7
diossidodicloro
anidrideclorica
anidrideperclorica
diossidodicloro
pentossido didicloro
eptossido didicloro
Cr
+2
+3
+6
CrO
Cr
2
O
3
CrO
3
ossidocromoso
ossidocromico
anidridecromica
monossidodicromo
triossidodidicromo
triossidodicromo
Mn
+2
+3
+4
MnO
Mn
2
O
3
MnO
2
ossidomanganoso
ossidomanganico
diossidodimanganese
monossidodimanganese
triossidodidimanganese
diossidodimanganese
+6
+7
MnO
3
Mn
2
O
7
anidridemanganica
anidridepermanganica
triossidodimanganese
eptossido didimanganese
Nomenclaturachimica Compostibinari
Icompostibinaridell'idrogeno
Icompostibinaridell'ossigeno
Isalibinari
F
Cl
Br
S
2
N
3
fluoruro cloruro bromuro ioduro solfuro nitruro
Formula Nome tradizionale Nome IUPAC (Stock)
FeCl
2
cloruro ferroso dicloruro di ferro (II)
Cl l f i i l di f (III) FeCl
3
cloruro ferrico tricloruro di ferro (III)
Al
2
S
3
solfuro di alluminio Trisolfuro di dialluminio
CuCl cloruro rameoso monocloruro di rame (I)
CuCl
2
cloruro rameico dicloruro di rame (II)
Nomenclaturachimica Compostiternari
Gliidrossidi
Gliossoacidi
Isali contenentiossigeno
Formula generale: M(OH)
x
Formula Nome tradizionale Nome IUPAC (Stock)
Formulagenerale:M(OH)
x
Ca(OH)
2
idrossido di calcio diidrossido di calcio
Fe(OH)
2
idrossido ferroso diidrossido di ferro (II)
Fe(OH)
3
idrossido ferrico triidrossido di ferro (III)
3
Sn(OH)
2
idrossido stannoso diidrossido di stagno (II)
Sn(OH)
4
idrossido stannico tetraidrossido di stagno (IV)
Al(OH) id id di ll i i t iid id di ll i i Al(OH)
3
idrossido di alluminio triidrossido di alluminio
Nomenclaturachimica Compostiternari
Gliidrossidi
Gliossoacidi
Isali contenentiossigeno
Formula
Statodiossidazionedel
non metallo
Nome tradizionale NomeIUPAC(Stock)
nonmetallo
H
2
SO
3
+4 acido solforoso triossosolforato(IV)didiidrogeno
H
2
SO
4
+6 acido solforico tetraossosolforato(VI)didiidrogeno
HNO
2
+3 acido nitroso diossonitrato(III)diidrogeno
HNO
3
+5 acido nitrico triossonitrato(V)diidrogeno
H
2
CO
3
+4 acido carbonico triossocarbonato(IV)didiidrogeno
2 3
( ) g
H
3
PO
3
+3 acido fosforoso triossofosforato(III)ditriidrogeno
H
3
PO
4
+5 acido fosforico tetraossofosforato(V)ditriidrogeno
HClO 1 id i l l (I) di id HClO +1 acido ipocloroso ossoclorato(I)diidrogeno
HClO
2
+3 acido cloroso diossoclorato(III)diidrogeno
HClO
3
+5 acido clorico triossoclorato(V)diidrogeno
HClO
4
+7 acido perclorico tetraossoclorato(VII)diidrogeno
Nomenclaturachimica Compostiternari
Gliidrossidi
Gliossoacidi
Isali contenentiossigeno
Gli acidi meta, piro, orto , p ,
Rapporto Reazione Nomedell'acido
1molecoladianidride+1molecolad'acqua P
2
O
5
+1H
2
O2HPO
3
acidometafosforico
1molecoladianidride+2molecoled'acqua P
2
O
5
+2H
2
OH
4
P
2
O
7
acidopirofosforico
1molecoladianidride+3molecoled'acqua P
2
O
5
+3H
2
O2H
3
PO
4
acidoortofosforico (ofosforico)
Nomenclaturachimica Compostiternari
Gliidrossidi
Gliossoacidi
Isali contenentiossigeno
Formula
Statodiossidazione
del non metallo
Nome tradizionale NomeIUPAC(Stock)
delnonmetallo
Na
2
SO
3
+4 solfito di sodio triossosolforato(IV)didisodio
KHSO
4
+6
solfato monoacido di
potassio monoidrogeno
tetraossosolforato(VI)diidrogenoe
KHSO
4
+6 potassio monoidrogeno
solfato di potassio
potassio
Fe(NO
2
)
2
+3 nitrito ferroso didiossonitrato(III)diferro(II)
ortofosfato biacido di
Al(H
2
PO
4
)
3
+5
ortofosfato biacido di
alluminio
tritetraossofosfato(V)dialluminio
NaK(CO
3
) +4
carbonato doppio di
sodio e di potassio
triossocarbonato disodioepotassio
Cu(ClO
2
)
2
6H
2
O +3 clorito rameico esaidrato
didiossoclorato(III)dirame(II)
esaidrato
perclorato basico di
Ca(OH)ClO
4
+7 calcio perclorato di
calcio monobasico
idrossitetraossiclorato(VII)dicalcio
15
La nomen
Applied Ch
regole dell
presentate
sulle prece
Antoine L
rendendola
introdotti d
sostituiti d
I simboli d
1813. La
simbologia
I simboli d
spesso lati
carbo), O
prima dell'
nclatura ch
hemistry), u
la "sintassi
qui e tutto
edenti propo
avoisier, in
a simile all
dal chimico
a John Dalt
degli eleme
loro semp
a.
degli eleme
ino dell'elem
l'ossigeno
elemento),
Nom
Prima pagin
himica r
un'associazio
chimica" a
ra valide, s
oste di Alfre
ntorno al 17
la moderna
o francese.
ton, che all'i
enti come li
licit ha c
enti sono co
mento chim
(dal greco
Cu il rame
mencl
na della Chy
regolamenta
one interna
alla luce de
sono state e
ed Stock.
787, diede p
a. I suffiss
Per gli ele
inizio dell'O
i conosciam
ontribuito,
ostituiti da u
mico. Per es
oxis e gene
(dal latino c
latura
hymical Nom
ata dalla IU
zionale che
elle nuove
elaborate du
per primo u
i -ico -oso
ementi, Lav
Ottocento us
mo oggi fur
a poco a
una, due o
sempio, la l
es), U l'uran
cuprum), U
a chim
menclature d
UPAC (Int
e periodicam
conoscenze
urante il con
una sistema
o -ato -ito
voisier prop
sava segni c
rono introdo
poco, alla
tre lettere c
lettera C ra
nio (dal pia
Uuq l'ununqu
mica
di Lavoisier
ternational
mente si riun
e. Le regol
ngresso IUP
azione alla
-uro, usati
pose dei si
circolari.
otti da Jhn
definitiva
che derivan
appresenta i
aneta Urano
uadio ecc.
r
Union for
nisce per ag
le della nom
PAC del 19
nomenclatu
i ancora og
mboli geom
n Jacobs Be
affermazio
no dal nome
il carbonio
o, scoperto
r Pure and
ggiornare le
menclatura,
959, basato
ura chimica
ggi, furono
metrici, poi
erzelius nel
one di tale
e originale,
(dal latino
pochi anni
d
e
,
o
a
o
i
l
e
,
o
i
Indice
1 La valenza e lo stato di ossidazione
2 Leggere e scrivere le formule
3 La nomenclatura chimica
o 3.1 La nomenclatura dei composti binari
3.1.1 I sali binari
3.1.2 I composti binari dell'ossigeno
3.1.3 I composti binari dell'idrogeno
o 3.2 La nomenclatura dei composti ternari
3.2.1 Gli idrossidi
3.2.2 Gli ossiacidi
3.2.3 Gli acidi meta-, piro-, orto-
3.2.4 I sali ternari
La valenza e lo stato di ossidazione
Gli atomi formano legami utilizzando gli elettroni esterni: condividendoli, cedendoli o catturandoli
dagli atomi vicini. Da qui deriva il concetto di valenza.
In passato, quando non era chiara la natura del legame chimico, si confrontavano le formule dei
composti con quelle di composti analoghi contenenti idrogeno oppure ossigeno. La valenza di un
elemento era data dal numero di idrogeni o dal doppio degli ossigeni necessari per rimpiazzare
l'elemento considerato. Per esempio, in AgCl l'argento sostituisce un idrogeno di HCl, quindi Ag ha
valenza 1.
Conoscere la valenza degli elementi combinati di fondamentale importanza per assegnare i nomi e
scrivere le formule corrette dei composti. Per ricavare le valenze dobbiamo conoscere le
configurazioni elettroniche dei composti.
Nella moderna nomenclatura, al posto della valenza si preferisce utilizzare lo stato di ossidazione
(indicato con OX).
Questo stato viene assegnato sulla base di regole convenzionali che possono essere usate per
ricavare lo stato di ossidazione di qualunque elemento chimico combinato.
Regola Esempio
Gli atomi nelle sostanze elementari hanno sempre
stato di ossidazione zero.
In Cl
2
l'OX del cloro zero.
In S
8
lo zolfo ha OX zero.
Lo stato di ossidazione dell'ossigeno -2, tranne nei
perossidi, in cui vale -1, nei superossidi, dove vale -
0.5 (anione O
2
-
) e quando legato al fluoro, in cui
+2.
In Na
2
O, H
2
O, MgO, Al
2
O
3
l'ossigeno ha
stato di ossidazione -2.
Nei perossidi di idrogeno e di sodio (per
esempio, H
2
O
2
e Na
2
O
2
) ha stato di
ossidazione -1.
In F
2
O l'ossigeno ha stato di ossidazione +2.
In KO
2
(superossido di potassio) vale -0.5
Lo stato di ossidazione dell'idrogeno +1, fanno
eccezione i casi in cui H combinato con un metallo,
nel qual caso ha stato di ossidazione -1.
In H
2
O, HCl, H
2
SO
3
, HF, NH
3
, PH
3
, CH
4
l'idrogeno ha OX +1.
Negli idruri dei metalli, come LiH, CuH,
l'idrogeno ha OX -1 (notiamo che H posto
a destra della formula).
Gli ioni monoatomici hanno stato di ossidazione
coincidente con la carica elettrica.
Il ferro in Fe
3+
ha OX +3. Il sodio in NaCl
(Na
+
Cl
-
) ha OX +1. Il magnesio in MgO
(Mg
2+
O
2-
) ha OX +2.
In uno ione poliatomico la somma degli stati di
ossidazione deve equivalere alla carica dello ione.
In OH
-
l'ossigeno ha OX -2 e l'idrogeno ha
OX +1. La somma d -1.
In SO
4
2-
i 4 ossigeni danno -8. Perch avanzi
-2 allo ione, lo zolfo deve avere OX +6.
In Cr
2
O
7
2-
i 7 ossigeni danno -14; perch
restino due cariche negative i due atomi di
cromo devono avere +12, quindi +6
ciascuno.
In una molecola o in un composto ionico la somma
degli stati di ossidazione deve essere zero.
In H
2
O ogni idrogeno ha OX +1 e l'ossigeno
ha OX -2, quindi +1+1-2=0.
In PbO
2
i due ossigeni (con OX -2) danno -4;
perch il totale sia zero, il piombo deve avere
OX +4.
In un legame covalente gli elettroni condivisi sono
formalmente attribuiti all'atomo pi elettronegativo.
In PCl
3
il fosforo forma tre legami con il pi
elettronegativo cloro. Quindi il fosforo ha
OX +3 e il cloro ha OX -1.
Lo stato di ossidazione non fa distinzione tra valenza covalente o ionica, ma pu essere utile saper
distinguere i due casi poich i composti ionici hanno caratteristiche molto diverse da quelli
covalenti.
Per quanto riguarda gli stati ionici, in generale i non metalli si trasformano in anioni mentre i
metalli diventano cationi. Gli ioni negativi monoatomici con carica superiore a 1 (O
2-
, N
3-
, P
3-
) non
possono esistere nelle soluzioni acquose, poich reagiscono con l'acqua. Essi possono trovarsi solo
allo stato solido, combinati con ioni positivi.
Le cariche di tali ioni presentano un andamento periodico evidente, almeno per i gruppi principali.
Leggere e scrivere le formule
Ogni composto rappresentabile con una formula i cui simboli esprimono, sinteticamente, i tipi di
atomi e il loro numero. Per esempio una molecola di CO
2
, diossido di carbonio, contiene un atomo
di carbonio e due atomi di ossigeno. Il numero due, in basso a destra di O, si chiama indice
numerico e ci indica quanti atomi di ossigeno ci sono nella molecola o nella formula. A destra del C
non ci sono numeri; per convenzione il simbolo nudo sottintende il numero uno.
Nel leggere gli indici di una molecola usiamo i seguenti prefissi:
mono... = 1
di... = 2
tri... = 3
tetra... = 4
penta... = 5
esa... = 6
epta... = 7
otta... = 8
nona... = 9
deca... = 10
La maggior parte dei composti formato da due parti; una, quella a sinistra nella formula chimica,
costituita da un elemento con carattere metallico o da un catione, mentre l'altra (quella a destra nella
formula chimica) costituita da un non metallo o da un anione. In generale, scriviamo a sinistra
della formula l'elemento che ha stato di ossidazione pi positivo.
Per i composti binari, cio formati da due elementi, il nome si costruisce indicando per primo
l'elemento scritto a destra (che pi negativo) con la desinenza -uro seguito dal nome dell'altro
elemento. Fanno eccezione i composti dell'ossigeno, che vengono chiamati ossidi e non ossigenuri.
Per poter scrivere correttamente le formule bisogna rispettare la regola 6 degli stati di ossidazione,
in base alla quale la somma degli stati di ossidazione degli atomi pi positivi deve essere uguale e
opposta a quella degli elementi non metallici scritti a destra nel composto.
Se tutti e due gli ioni (catione e anione) hanno lo stesso stato di ossidazione in valore assoluto (+1 -
1, +2 -2, +3 -3 ecc.), otteniamo la formula scrivendo affiancati i simboli dei due ioni.
Se gli stati di ossidazione sono diversi, la strada pi veloce per arrivare alla formula consiste
nell'usare lo stato di ossidazione di un elemento come indice dell'altro e viceversa.
Nei composti binari, per esempio, il numero di atomi di ciascun elemento nella formula uguale
allo stato di ossidazione dell'altro elemento, come nella formula dell'ossido di piombo con stato di
ossidazione Pb
+4
.
1. Scriviamo i simboli con i rispettivi stati di ossidazione nell'ordine corretto: prima l'elemento
pi metallico (catione) e poi l'anione non metallico o poliatomico.
2. Lo stato di ossidazione del metallo diventa l'indice del non metallo e viceversa.
3. Nell'eventualit che i due indici della formula abbiano un divisore comune, la formula si
semplifica. Nel caso in esame, dividiamo gli indici per 2.
La semplificazione non va fatta in alcuni casi, come quello dell'acqua ossigenata (H
2
O
2
) o nel caso
in cui l'ossigeno forma un perossido con un elemento del primo gruppo.
Un altro metodo per determinare le formule chimiche basato sul calcolo del minimo comune
multiplo fra le valenze ioniche, che illustriamo nel seguente esempio.
La nomenclatura chimica
La nomenclatura chimica permette di identificare i composti mediante un nome specifico, che si
definisce a partire dalla formula della sostanza.
Alcuni composti sono indicati prevalentemente con il loro nome comune: sono un esempio l'acqua
(H
2
O) e l'ammoniaca (NH
3
). Nella maggior parte dei casi per per attribuire il nome ai differenti
composti si utilizzano alcune regole codificate. Esistono diversi sistemi di nomenclatura: la
nomenclatura tradizionale e quella IUPAC, a cui va aggiunta come informazione supplementare la
notazione di Stock.
1. La nomenclatura tradizionale basata principalmente sulla divisione degli elementi in
metalli e non metalli e tiene conto dello stato di ossidazione degli atomi che formano la
molecola. Tale approccio stato spesso fonte di ambiguit nell'identificazione delle
sostanze.
2. La nomenclatura IUPAC basata sulle regole redatte dalla IUPAC nel 1959, riviste nel
1971 e nel 1990; essa ci consente di evidenziare, in modo chiaro e immediato, la relazione
fra il nome di un composto e la sua formula chimica.
La notazione di Stock, ufficializzata dalla IUPAC nel 1940 ed utilizzata contestualmente alla
nomenclatura IUPAC, fornisce informazioni pi chiare sullo stato di ossidazione degli elementi;
essa infatti indica gli stati di ossidazione con cifre romane poste tra parentesi.
La seguente tabella mostra le radici dei nomi di alcuni elementi usate per attribuire i nomi ai
composti.
Elemento Radice del nome
Idrogeno idr-
Fluoro fluor-
Cloro clor-
Bromo brom-
Iodio iod-
Zolfo solf-
Selenio seleni-
Azoto nitr-
La nomenclatura dei composti binari
Ci sono due classi di composti binari (formati cio da due elementi chimici): i composti ionici e i
composti molecolari.
I composti ionici sono costituiti da un catione metallico (che si scrive per primo nella formula
chimica) e da un anione non metallico. I composti pi importanti appartenenti a questa classe sono
gli idruri, i sali binari (per esempio gli alogenuri e i solfuri) e gli ossidi basici.
L'altra classe, quella dei composti binari molecolari, comprende gli ossidi acidi (chiamati anidridi
nel linguaggio tradizionale) gli idracidi e gli idruri covalenti.
I sali binari
Le formule di questi composti ionici comprendono una parte metallica (la prima) e una non
metallica (la seconda).
Nella nomenclatura IUPAC, gli ioni monoatomici negativi sono denominati aggiungendo il suffisso
-uro al nome del non metallo da cui derivano.
F
-
Cl
-
Br
-
I
-
S
2-
N
3-
fluoruro cloruro bromuro ioduro solfuro nitruro
Nella denominazione di questi composti, contrariamente a quanto accade nella formula, il nome
dello ione positivo segue quello dell'anione.
Formula Nome
NaCl cloruro di sodio
CaS solfuro di calcio
NaH idruro di sodio
Se i due elementi si combinano in modi diversi, usiamo i prefissi mono-, di-, tri-, tetra-, penta-, esa-
, epta- a seconda del numero di atomi che entrano a far parte del composto.
Fosforo fosf-
Carbonio carb- o carbon-
Silicio silic-
Boro bor-
Come possiamo vedere nella tabella seguente, il suffisso -uro segue il nome dell'anione, che a sua
volta preceduto dal prefisso che indica il numero degli atomi presenti nella formula.
Formula Nome tradizionale Nome IUPAC (Stock)
FeCl
2
cloruro ferroso dicloruro di ferro (II)
FeCl
3
cloruro ferrico tricloruro di ferro (III)
Al
2
S
3
solfuro di alluminio trisolfuro di dialluminio
CuCl cloruro rameoso monocloruro di rame (I)
CuCl
2
cloruro rameico dicloruro di rame (II)
Per esempio in Fe
2
S
3
l'anione solfuro e gli atomi di zolfo sono tre: il nome quindi sar trisolfuro,
dove il prefisso tri- si riferisce ai tre atomi di zolfo. Poich allo zolfo sono legati due atomi di ferro
si aggiunger di diferro, dove il prefisso di- indica la presenza dei due atomi di ferro.
La notazione di Stock, che riportata nella tabella come informazione supplementare nella
nomenclatura IUPAC, prevede l'indicazione dello stato di ossidazione dello ione (numero romano
scritto in parentesi). Lo stato di ossidazione tra parentesi non va inserito quando lelemento ne
possiede uno solo.
Nel caso dei sali binari ancora in uso la nomenclatura tradizionale che utilizza i suffissi -oso e -ico
per indicare rispettivamente lo stato di ossidazione minore e quello maggiore dei cationi metallici.
I possibili stati di ossidazione degli elementi chimici si trovano sulla tavola periodica. Consideriamo
per esempio i due cloruri del ferro. Nel caso di FeCl
2
il ferro presenta stato di ossidazione +2; dato
che secondo la tavola periodica il ferro pu avere anche stato di ossidazione +3, nella molecola di
FeCl
2
il ferro presenta lo stato di ossidazione inferiore; il nome tradizionale sar perci cloruro
ferroso (cloruro + nome del catione con suffisso -oso).
Nella molecola FeCl
3
lo stato di ossidazione del ferro +3, ovvero lo stato di ossidazione maggiore
fra quelli possibili: il nome della molecola sar quindi cloruro ferrico (cloruro + nome del catione
con suffisso -ico).
Analogamente, i due cloruri del rame si chiamano cloruro rameoso e cloruro rameico.
I composti binari dell'ossigeno
L'ossigeno forma composti con quasi tutti gli elementi della tavola periodica; tali composti si
chiamano ossidi. In essi, l'ossigeno ha sempre stato di ossidazione -2. L'unica eccezione costituita
dal composto OF
2
, che non un ossido ma un fluoruro, nel quale O ha stato di ossidazione +2;
infatti il fluoro l'unico elemento pi elettronegativo dell'ossigeno.
Nella formula degli ossidi si scrive mettendo sempre l'ossigeno a destra, preceduto dall'altro
elemento. Nella tabella seguente, in base alla valenza dell'elemento E generico, indichiamo tutte le
possibili formule degli ossidi e alcuni esempi.
La nomenclatura IUPAC utilizza il termine ossido preceduto dai prefissi mono-, di-, tri- ecc. in base
al numero di atomi di ossigeno presenti nella molecola. A tale termine seguono di e il nome del
catione preceduto da un prefisso che specifica il numero di atomi con cui il catione compare nella
molecola. Secondo la notazione di Stock gli ossidi dei vari elementi, con stato di ossidazione
variabile, sono distinti indicando lo stato di ossidazione con un numero romano posto tra parentesi.
La nomenclatura tradizionale, a differenza delle altre due, distingue gli ossidi dei metalli (ossidi
basici) da quelli dei non metalli (ossidi acidi) e utilizza regole diverse nei due casi.
Gli ossidi dei metalli hanno in genere comportamento basico, indicato dalla reazione dell'ossido con
l'acqua in cui si formano ioni OH
-
(idrossido) capaci di colorare di blu la cartina universale del pH.
Le sostanze basiche insolubili in acqua sono invece riconoscibili dalla capacit di solubilizzarsi
negli acidi.
Stato di ossidazione dell'atomo E Formula generica Esempio Nome IUPAC
1 E
2
O Na
2
O ossido di disodio
2 EO MgO ossido di magnesio
3 E
2
O
3
Al
2
O
3
triossido di dialluminio
4 EO
2
CO
2
diossido di carbonio
5 E
2
O
5
V
2
O
5
pentossido di divanadio
6 EO
3
UO
3
triossido di uranio
7 E
2
O
7
Mn
2
O
7
eptossido di dimanganese
8 EO
4
OsO
4
tetrossido di osmio
Nella seguente tabella riportiamo alcuni esempi di ossidi basici e i relativi nomi, utilizzando sia la
nomenclatura IUPAC, sia quella tradizionale.
Elemento
Stato di
ossidazione
Formula Nome tradizionale Nome IUPAC (Stock)
Cu
+1
+2
Cu
2
O
CuO
ossido rameoso
ossido rameico
ossido di dirame (I)
ossido di rame (II)
Sn
+2
+4
SnO
SnO
2
ossido stannoso
ossido stannico
ossido di stagno (II)
diossido di stagno (IV)
Fe
+2
+3
FeO
Fe
2
O
3
ossido ferroso
ossido ferrico
ossido di ferro (II)
triossido di diferro (III)
Come vediamo nella tabella, secondo la nomenclatura tradizionale si utilizza il suffisso -oso quando
il metallo ha stato di ossidazione minore e il suffisso -ico quando il metallo ha stato di ossidazione
maggiore.
Gli ossidi dei non metalli hanno invece comportamento acido; tale comportamento caratterizzato
dalla capacit degli ossidi di reagire con l'acqua sviluppando ioni H
+
solvatati (H
3
O
+
o ioni idronio).
Le soluzioni acide risultanti sono riconoscibili dalla cartina universale del pH, che assume
colorazione rossa o arancio.
Nel caso degli ossidi acidi, la nomenclatura tradizionale utilizza il termine anidride al posto di
ossido. Tale denominazione, molto comune in passato, non pi utilizzata in chimica.
1. Quando il non metallo ha un solo stato di ossidazione, allora il composto prende il nome di
anidride seguito dal nome del catione con il suffisso -ica: anidride borica.
2. Se il non metallo ha due stati di ossidazione, utilizziamo come al solito i suffissi -osa (stato
di ossidazione minore) e -ica (stato di ossidazione maggiore): anidride solforosa, anidride
solforica.
3. Se infine il non metallo presenta pi di due stati di ossidazione aggiungiamo il prefisso ipo-
(stato di ossidazione minimo) e il prefisso per- (stato di ossidazione massimo): anidride
ipoclorosa, anidride clorosa, anidride clorica, anidride perclorica.
Per complicare la situazione, esistono composti che non seguono neppure le regole della
nomenclatura tradizionale; il caso degli ossidi dell'azoto, del carbonio, del manganese e del
cromo. Questo uno dei motivi per cui consigliabile utilizzare sempre la nomenclatura IUPAC.
Per quanto riguarda la notazione di Stock, la regola la stessa degli ossidi basici: ossido di + nome
del non metallo, seguito dallo stato di ossidazione scritto in numeri romani tra parentesi: ossido di
zolfo(IV), ossido di zolfo(VI).
Un tipo particolare di ossidi, i perossidi, contiene due atomi di ossigeno legati tra loro: -O-O-
oppure O
2
2
, dove l'ossigeno ha stato di ossidazione -1. In questi composti, l'atomo di ossigeno
presente in pi rispetto ai normali ossidi tende a essere rilasciato facilmente.
La nomenclatura IUPAC, cos come quella tradizionale, utilizza il termine perossido seguito dal
nome dell'altro elemento: H
2
O
2
perossido di idrogeno; Na
2
O
2
perossido di sodio (un solido di
colore giallo). Il perossido di idrogeno, noto anche come acqua ossigenata, un liquido che usiamo
comunemente come disinfettante proprio grazie alla sua capacit di liberare ossigeno, tossico per gli
organismi patogeni.
Elemento Stato di ossidazione Formula Nome tradizionale Nome IUPAC
B +3 B
2
O
3
anidride borica triossido di diboro
C
+4
+2
CO
2
CO
anidride carbonica
ossido di carbonio
diossido di carbonio
monossido di carbonio
N
+1
+2
+3
+4
N
2
O
NO
N
2
O
3
NO
2
protossido di azoto
ossido di azoto
anidride nitrosa
ipoazotide o diossido di azoto
monossido di diazoto
monossido di azoto
triossido di diazoto
diossido di azoto
+4
+5
N
2
O
4
N
2
O
5
ipoazotide
anidride nitrica
tetrossido di diazoto
pentossido di diazoto
P
+3
+5
P
2
O
3
P
2
O
5
anidride fosforosa
anidride fosforica
triossido di difosforo
pentossido di difosforo
S
+4
+6
SO
2
SO
3
anidride solforosa
anidride solforica
diossido di zolfo
triossido di zolfo
Cl
+1
+3
+4
+5
+7
Cl
2
O
Cl
2
O
3
ClO
2
Cl
2
O
5
Cl
2
O
7
anidride ipoclorosa
anidride clorosa
diossido di cloro
anidride clorica
anidride perclorica
monossido di dicloro
triossido di dicloro
diossido di cloro
pentossido di dicloro
eptossido di dicloro
Cr
+2
+3
+6
CrO
Cr
2
O
3
CrO
3
ossido cromoso
ossido cromico
anidride cromica
monossido di cromo
triossido di dicromo
triossido di cromo
Mn
+2
+3
+4
+6
+7
MnO
Mn
2
O
3
MnO
2
MnO
3
Mn
2
O
7
ossido manganoso
ossido manganico
diossido di manganese
anidride manganica
anidride permanganica
monossido di manganese
triossido di dimanganese
diossido di manganese
triossido di manganese
eptossido di dimanganese
I composti binari dell'idrogeno
Possiamo distinguere i composti binari dell'idrogeno in tre gruppi: idruri salini, idruri molecolari e
idracidi.
Gli idruri salini sono composti dell'idrogeno con metalli fortemente elettropositivi,
tipicamente i metalli del I e del II gruppo. Si tratta di composti ionici in cui l'atomo di
idrogeno presente sotto forma di ione idruro H
-
con stato di ossidazione -1. La formula di
questi composti si scrive mettendo sempre per primo l'altro elemento e poi l'idrogeno: LiH.
Gli idruri molecolari o covalenti sono composti dell'idrogeno con semimetalli e non
metalli (IV, V, VI gruppo); esempi di tali composti sono il metano e l'ammoniaca. Anche in
questo caso, nella formula scriviamo prima il nome dell'altro elemento e poi quello
dell'idrogeno: CH
4
, NH
3
. A differenza dei precedenti, questi composti sono costituiti da
molecole e sono spesso liquidi o gassosi, mentre gli idruri salini sono solidi.
Idruri salini Idruri covalenti
Sono formati da un metallo + idrogeno. Non metallo o semimetallo + idrogeno.
Sono solidi (tranne GaH
3
che liquido). Sono gas, spesso infiammabili all'aria, o liquidi.
Hanno un'elevata percentuale di carattere ionico.
Sono tutti covalenti, con molecole poco polari o
apolari, tranne NH
3
che molto polare.
Tendono a reagire con l'acqua sviluppando
idrogeno gassoso e lasciando una soluzione
basica di idrossido del metallo.
A contatto con l'acqua reagiscono in modo vario;
CH
4
, per esempio, non solubile in acqua e non
reagisce con essa.
La tabella mostra le differenze tra queste due classi di composti.
La nomenclatura IUPAC di questi composti unica: usiamo infatti il termine idruro preceduto dal
prefisso mono-, di-, tri-, ecc. (che indica il numero di atomi di idrogeno) seguito da di e dal nome
dell'elemento legato all'idrogeno: tetraidruro di carbonio. Nella nomenclatura tradizionale, il
termine idruro seguito dal nome dell'altro elemento con il suffisso -oso oppure -ico a seconda
dello stato di ossidazione.
importante ricordare che per molti idruri continuiamo a utilizzare il nome comune, il cui uso
permesso dalla IUPAC.
Formula Caratteristiche
Nome
tradizionale
Nome
comune
Nome IUPAC
LiH solido, ionico idruro di litio idruro di litio
BaH
2
solido, ionico idruro di bario diidruro di bario
AlH
3
solido covalente continuo,
parzialmente ionico
idruro di
alluminio
triidruro di
alluminio
CH
4
gas molecolare, infiammabile
metano
tetraidruro di
carbonio
SiH
4
gas molecolare, si incendia all'aria
silano
tetraidruro di
silicio
NH
3
gas molecolare, solubile in acqua ammoniaca triidruro di azoto
PH
3
gas molecolare, si incendia all'aria
fosfina
triidruro di
fosforo
AsH
3
gas molecolare, si incendia all'aria
arsina
triidruro di
arsenico
Gli idracidi sono un piccolo gruppo di sei composti binari di natura molecolare, costituiti da
idrogeno e da un non metallo. La formula degli idracidi si scrive indicando sempre per primo
l'atomo di idrogeno: HI, HF, HCl. Come dice il loro nome, questi composti hanno carattere acido:
ci significa che in soluzione acquosa le loro molecole si ionizzano liberando ioni H
+
e anioni (per
esempio ioni I
-
, F
-
oppure Cl
-
). La presenza degli ioni H
+
conferisce una forte acidit alla soluzione,
che diventa irritante e colora di rosso la cartina indicatrice.
La nomenclatura IUPAC denomina queste sostanze aggiungendo il suffisso -uro al nome del non
metallo e aggiungendo poi di idrogeno: ioduro di idrogeno, fluoruro di idrogeno, cloruro di
idrogeno.
Formula Nome IUPAC Nome tradizionale
HF fluoruro d'idrogeno acido fluoridrico
HCl cloruro d'idrogeno acido cloridrico
HBr bromuro d'idrogeno acido bromidrico
HI ioduro d'idrogeno acido iodidrico
H
2
S solfuro di diidrogeno acido solfidrico
HCN cianuro d'idrogeno acido cianidrico
molto usata anche la nomenclatura tradizionale, che aggiunge il suffisso -idrico al nome del non
metallo e lo fa precedere dal termine acido: acido iodidrico, acido fluoridrico, acido cloridrico.
La nomenclatura dei composti ternari
I composti ternari sono formati dalla combinazione di tre differenti elementi. I principali composti
ternari sono gli idrossidi, gli ossiacidi (detti anche ossoacidi) e i sali degli ossiacidi.
Gli idrossidi
Gli idrossidi sono composti di tipo ionico che otteniamo facendo reagire gli ossidi basici con
l'acqua.
Il gruppo monovalente caratteristico degli idrossidi l'ossidrile (OH) presente come ione idrossido
(OH
-
).
Nella formula, il simbolo del metallo precede il gruppo ossidrile OH. Per i metalli bivalenti,
trivalenti, ecc., il gruppo OH si racchiude tra parentesi: Ca(OH)
2
e non CaOH
2
.
La nomenclatura IUPAC assegna a questi composti il nome idrossido preceduto dal suffisso -
mono, -di, -tri, ecc. per indicare il numero di gruppi OH presenti nella molecola, seguito dal nome
del catione, per esempio idrossido di sodio. Nella notazione di Stock facciamo seguire al nome del
catione il numero romano tra parentesi che indica il suo stato di ossidazione; secondo la
nomenclatura tradizionale, infine, distinguiamo i due stati di ossidazione per mezzo dei suffissi -oso
e -ico. Dato che il gruppo OH monovalente e forma un legame ionico, lo stato di ossidazione del
catione coincide con il numero di gruppi OH che fanno parte della molecola. La tabella seguente
riporta alcuni esempi di idrossidi con i relativi nomi.
Formula Nome tradizionale Nome IUPAC
Ca(OH)
2
idrossido di calcio diidrossido di calcio
Fe(OH)
2
idrossido ferroso diidrossido di ferro (II)
Fe(OH)
3
idrossido ferrico triidrossido di ferro (III)
Sn(OH)
2
idrossido stannoso diidrossido di stagno (II)
Sn(OH)
4
idrossido stannico tetraidrossido di stagno (IV)
Al(OH)
3
idrossido di alluminio triidrossido di alluminio
Gli ossiacidi
Otteniamo gli ossiacidi facendo reagire l'acqua con gli ossidi acidi o anidridi. Secondo la
nomenclatura tradizionale, ancora in uso, il nome di ciascun ossoacido deriva direttamente dalla
corrispondente anidride.
L'unica differenza consiste nella sostituzione della parola anidride con acido; il suffisso terminale
passa da femminile a maschile.
Secondo la nomenclatura tradizionale, quindi, il termine acido seguito dal nome del non metallo
con il suffisso -oso se il non metallo presenta stato di ossidazione minore e il suffisso -ico se
presenta stato di ossidazione maggiore. Come nel caso delle anidridi, se gli stati di ossidazione del
non metallo sono pi di due utilizziamo anche i suffissi ipo- e per-.
La nomenclatura IUPAC chiama l'ossiacido con il nome del non metallo terminante in -ico
indipendentemente dallo stato di ossidazione, che indicato tra parentesi scritto in numeri romani.
Il nome dell'elemento preceduto dal suffisso osso- che se necessario riporta anche il numero di
atomi di ossigeno che compaiono nella molecola; per esempio, acido diossonitrico.
Come gli idracidi, anche gli ossoacidi liberano ioni H
+
quando vengono messi in soluzione acquosa.
Formula
Stato di ossidazione del non
metallo
Nome
tradizionale
Nome IUPAC
H
2
SO
3
+4 acido solforoso triossosolfato(IV) di diidrogeno
H
2
SO
4
+6 acido solforico
tetraossosolfato(VI) di
diidrogeno
HNO
2
+3 acido nitroso diossonitrato(III) di idrogeno
HNO
3
+5 acido nitrico triossonitrato(V) di idrogeno
H
2
CO
3
+4 acido carbonico
triossocarbonato(IV) di
diidrogeno
H
3
PO
3
+3 acido fosforoso triossofosfato(III) di triidrogeno
H
3
PO
4
+5 acido fosforico
tetraossofosfato(V) di
triidrogeno
HClO +1 acido ipocloroso ossoclorato(I) di idrogeno
HClO
2
+3 acido cloroso diossoclorato(III) di idrogeno
HClO
3
+5 acido clorico triossoclorato(V) di idrogeno
HClO
4
+7 acido perclorico tetraossoclorato(VII) di idrogeno
Gli acidi meta-, piro-, orto-
Gli ossoacidi derivano dalla reazione di un'anidride con una molecola d'acqua. Alcune anidridi,
per, possono combinarsi con l'acqua in rapporti diversi:
1:1 oppure 1:2 oppure 1:3
A seconda dei casi, otteniamo ossoacidi diversi. In situazioni come questa la nomenclatura
tradizionale utilizza i prefissi meta-, orto- e piro-. La seguente tabella mostra un esempio che
riguarda l'anidride fosforica P
2
O
5
.
Rapporto Reazione Nome dell'acido
1 molecola di anidride + 1 molecola d'acqua P
2
O
5
+ 1H
2
O 2HPO
3
acido metafosforico
1 molecola di anidride + 2 molecole d'acqua P
2
O
5
+ 2H
2
O H
4
P
2
O
7
acido pirofosforico
1 molecola di anidride + 3 molecole d'acqua P
2
O
5
+ 3H
2
O 2H
3
PO
4
acido ortofosforico (o
fosforico)
Questo comportamento tipico delle anidridi di fosforo, arsenico, antimonio, silicio e boro.
I poliacidi sono acidi che otteniamo facendo reagire due o pi molecole di anidridi con una o pi
molecole d'acqua; per denominare questi acidi si usano i prefissi tri- e tetra-.
I sali ternari
I sali ternari sono composti ionici che derivano dagli acidi per sostituzione di uno o pi idrogeni con
un catione metallico o con lo ione ammonio NH
4
+
.
Per la nomenclatura tradizionale dei sali ternari valgono le seguenti regole:
1. Se l'acido termina in -oso il sale assume il suffisso -ito;
2. Se l'acido termina in -ico il sale assume il suffisso -ato.
Per esempio, dall'acido solforico (H
2
SO
4
) otteniamo i solfati. Se la sostituzione degli ioni idrogeno
parziale, al nome dell'anione poliatomico si fa precedere la dizione: mono-, di- .... idrogeno:
monoidrogeno solfato. Al nome dell'anione segue poi quello del catione: solfato di sodio. Se gli
stati di ossidazione sono pi di due utilizziamo, come per gli acidi, i prefissi ipo- e per-: ipoclorito
di sodio.
I sali binari derivano invece dagli idracidi per sostituzione di uno o pi atomi di idrogeno.
Ricordiamo che in questo caso il nome dell'acido termina in -idrico e il nome del sale assume il
suffisso -uro (per esempio, dall'acido cloridrico HCl deriva il cloruro di sodio NaCl).
La nomenclatura IUPAC utilizza le stesse regole viste per gli ossoacidi: all'anione poliatomico (o
residuo) si aggiunge il suffisso -ato indipendentemente dallo stato di ossidazione del non metallo,
che indicato tra parentesi in numeri romani; il nome dell'anione seguito dal nome del catione,
anch'esso, se necessario, seguito dal proprio stato di ossidazione: tetraossosolfato(IV) di ferro(II). I
prefissi mono-, di-, tri- servono a specificare il numero di atomi.
Per ogni idrogeno che viene tolto si aggiunge una carica negativa al residuo. Gli acidi che
contengono pi di un idrogeno sono detti poliprotici. Da essi possiamo togliere un numero
variabile di atomi di idrogeno, ottenendo sali acidi. Per esempio, l'acido carbonico, H
2
CO
3
, pu
originare lo ione CO
3
2-
(carbonato), perdendo due idrogeni, o lo ione HCO
3
-
, idrogenocarbonato,
perdendone uno solo.
Esistono inoltre sali basici, che uniscono uno o pi ioni OH
-
(idrossido) all'anione dell'acido. Tali
sali sono denominati con l'aggiunta monobasico o dibasico, a seconda del numero di gruppi OH,
che sono indicati tra parentesi.
I cosiddetti sali doppi sono sali composti da due diversi cationi metallici, entrambi legati all'anione
poliatomico. La loro denominazione segue le stesse regole degli altri acidi: aggiungiamo
semplicemente il termine doppio dopo il nome dell'anione: il nome del composto NaK(CO
3
)
carbonato doppio di sodio e potassio.
Infine, i sali idrati sono sali le cui molecole sono legate a una o pi molecole d'acqua; in questo
caso aggiungiamo al nome del sale il termine idrato preceduto dal prefisso mono-, di-, tri- ecc. in
base al numero di molecole d'acqua indicate dalla formula.
Table IR-8.1 Acceptable common names and systematic (additive) names for oxoacid and related structures
This Table includes compounds containing oxygen and hydrogen and at least one other element and with at least one OH group; certain isomers; and examples of
corresponding partially and fully dehydronated species. Formulae are given in the classical oxoacid format with the 'acid` (oxygen-bound) hydrogens listed frst, followed
by the central atom(s), then the hydrogen atoms bound directly to the central atom, and then the oxygen atoms (e.g. HBH
2
O, H
2
P
2
H
2
O
5
), except for chain compounds such
as e.g. HOCN. In most cases formulae are also written as for coordination entities, assembled according to the principles of Chapter IR-7 (e.g. the Table gives
'HBH
2
O h[BH
2
(OH)]` and 'H
2
SO
4
h[SO
2
(OH)
2
]`). More names of oxoanions are given in Table IX.
Note that Section P-42 of Ref. 1 lists a great many inorganic oxoacid species for use as parent structures in the naming of organic derivatives. (See the discussion in
Section IR-8.1.) Most of those species, but not all, are included here. In particular, several dinuclear and polynuclear acids are not explicitly included.
Formula Acceptable common name
(unless otherwise stated)
Systematic additive name(s)
H
3
BO
3
h[B(OH)
3
] boric acid
a
trihydroxidoboron
H
2
BO
3
h[BO(OH)
2
]
dihydrogenborate dihydroxidooxidoborate(1)
HBO
3
2
h[BO
2
(OH)]
2
hydrogenborate hydroxidodioxidoborate(2)
[BO
3
]
3
borate trioxidoborate(3)
(HBO
2
)
n
h -(B(OH)O-)
n
metaboric acid catena-poly[hydroxidoboron-4-oxido]
(BO
2
)
n
h-(OBO-)
n
n
metaborate catena-poly[(oxidoborate-4-oxido)(1)]
H
2
BHO
2
h[BH(OH)
2
] boronic acid hydridodihydroxidoboron
HBH
2
Oh[BH
2
(OH)] borinic acid dihydridohydroxidoboron
H
2
CO
3
h[CO(OH)
2
] carbonic acid dihydroxidooxidocarbon
HCO
3
h[CO
2
(OH)]
hydrogencarbonate hydroxidodioxidocarbonate(1)
[CO
3
]
2
carbonate trioxidocarbonate(2)
HOCN h[C(N)OH] cyanic acid hydroxidonitridocarbon
HNCO h[C(NH)O] isocyanic acid azanediidooxidocarbon, (hydridonitrato)oxidocarbon
OCN
h[C(N)O]
cyanate nitridooxidocarbonate(1)
HONC h[N(C)OH]
b
carbidohydroxidonitrogen
HCNO h[N(CH)O]
b
(hydridocarbonato)oxidonitrogen
ONC
h[N(C)O]
b
carbidooxidonitrate(1)
H
4
SiO
4
h[Si(OH)
4
] silicic acid
a
tetrahydroxidosilicon
[SiO
4
]
4
silicate tetraoxidosilicate(4)
(H
2
SiO
3
)
n
h-(Si(OH)
2
O-)
n
metasilicic acid catena-poly[dihydroxidosilicon-4-oxido]
(continued)
1
2
7
I
N
O
R
G
A
N
I
C
A
C
I
D
S
A
N
D
D
E
R
I
V
A
T
I
V
E
S
I
R
-
8
.
2
Table IR-8.1 Continued
Formula Acceptable common name
(unless otherwise stated)
Systematic additive name(s)
-(SiO
3
-)
n
2n
metasilicate catena-poly[(dioxidosilicate-4-oxido)(1)]
H
6
Si
2
O
7
h[(HO)
3
SiOSi(OH)
3
] disilicic acid
c
4-oxido-bis(trihydroxidosilicon)
[Si
2
O
7
]
6
h[O
3
SiOSiO
3
]
6
disilicate 4-oxido-bis(trioxidosilicate)(6)
H
2
NO
3
|
h[NO(OH)
2
]
| d
dihydroxidooxidonitrogen(1|), dihydrogen(trioxidonitrate)(1|)
HNO
3
h[NO
2
(OH)] nitric acid hydroxidodioxidonitrogen
[NO
3
]
nitrate trioxidonitrate(1)
H
2
NHO h[NH
2
OH] hydroxylamine
e
dihydridohydroxidonitrogen
H
2
NHO
3
h[NHO(OH)
2
] azonic acid hydridodihydroxidooxidonitrogen
HNO
2
h[NO(OH)] nitrous acid hydroxidooxidonitrogen
[NO
2
]
nitrite dioxidonitrate(1)
HNH
2
O
2
h[NH
2
O(OH)] azinic acid dihydridohydroxidooxidonitrogen
H
2
N
2
O
2
h[HONhNOH] diazenediol
f
bis(hydroxidonitrogen)(N-N), or 1,4-dihydrido-2,3-diazy-1,4-dioxy-[4]catena
HN
2
O
2
h[HONhNO]
2-hydroxydiazene-1-olate
f
hydroxido-11O-oxido-21O-dinitrate(N-N)(1),
or 1-hydrido-2,3-diazy-1,4-dioxy-[4]catenate(1)
[N
2
O
2
]
2
h[ONhNO]
2
diazenediolate
f
bis(oxidonitrate)(N--N)(2), or 2,3-diazy-1,4-dioxy-[4]catenate(2)
H
3
PO
4
h[PO(OH)
3
] phosphoric acid
a
trihydroxidooxidophosphorus
H
2
PO
4
h[PO
2
(OH)
2
]
dihydrogenphosphate dihydroxidodioxidophosphate(1)
HPO
4
2
h[PO
3
(OH)]
2
hydrogenphosphate hydroxidotrioxidophosphate(2)
[PO
4
]
3
phosphate tetraoxidophosphate(3)
H
2
PHO
3
h[PHO(OH)
2
] phosphonic acid
g
hydridodihydroxidooxidophosphorus
[PHO
2
(OH)]
hydrogenphosphonate hydridohydroxidodioxidophosphate(1)
[PHO
3
]
2
phosphonate hydridotrioxidophosphate(2)
H
3
PO
3
h[P(OH)
3
] phosphorous acid
g
trihydroxidophosphorus
H
2
PO
3
h[PO(OH)
2
]
dihydrogenphosphite dihydroxidooxidophosphate(1)
HPO
3
2
h[PO
2
(OH)]
2
hydrogenphosphite hydroxidodioxidophosphate(2)
[PO
3
]
3
phosphite trioxidophosphate(3)
HPO
2
h[P(O)OH] hydroxyphosphanone
h
hydroxidooxidophosphorus
HPO
2
h[P(H)O
2
] 2
5
-phosphanedione
h
hydridodioxidophosphorus
H
2
PHO
2
h[PH(OH)
2
] phosphonous acid hydridodihydroxidophosphorus
1
2
8
I
N
O
R
G
A
N
I
C
A
C
I
D
S
A
N
D
D
E
R
I
V
A
T
I
V
E
S
I
R
-
8
.
2
HPH
2
O
2
h[PH
2
O(OH)] phosphinic acid dihydridohydroxidooxidophosphorus
HPH
2
O h[PH
2
(OH)] phosphinous acid dihydridohydroxidophosphorus
H
4
P
2
O
7
h[(HO)
2
P(O)OP(O)(OH)
2
] diphosphoric acid
c
4-oxido-bis(dihydroxidooxidophosphorus)
(HPO
3
)
n
h-(P(O)(OH)O-)
n
metaphosphoric acid catena-poly[hydroxidooxidophosphorus-4-oxido]
H
4
P
2
O
6
h[(HO)
2
P(O)P(O)(OH)
2
] hypodiphosphoric acid bis(dihydroxidooxidophosphorus)(P-P)
H
2
P
2
H
2
O
5
h[(HO)P(H)(O)OP(H)(O)(OH)] diphosphonic acid 4-oxido-bis(hydridohydroxidooxidophosphorus)
P
2
H
2
O
5
2
h[O
2
P(H)OP(H)(O)
2
]
2
diphosphonate 4-oxido-bis(hydridodioxidophosphate)(2)
H
3
P
3
O
9
cyclo-triphosphoric acid tri-4-oxido-tris(hydroxidooxidophosphorus), or
2,4,6-trihydroxido-2,4,6-trioxido-1,3,5-trioxy-2,4,6-triphosphy-[6]cycle
H
5
P
3
O
10
catena-triphosphoric acid
triphosphoric acid
c
pentahydroxido-11
2
O,21O,31
2
O-di-4-oxido-trioxido-11O,21O,31O-
triphosphorus, or 4-(hydroxidotrioxidophosphato-11O,21O)-
bis(dihydroxidooxidophosphorus),
or 1,7-dihydrido-2,4,6-trihydroxido-2,4,6-trioxido-1,3,5,7-tetraoxy-2,4,6-
triphosphy-[7]catena
H
3
AsO
4
h[AsO(OH)
3
] arsenic acid, arsoric acid
i
trihydroxidooxidoarsenic
H
3
AsO
3
h[As(OH)
3
] arsenous acid, arsorous acid
i
trihydroxidoarsenic
H
2
AsHO
3
h[AsHO(OH)
2
] arsonic acid hydridodihydroxidooxidoarsenic
H
2
AsHO
2
h[AsH(OH)
2
] arsonous acid hydridodihydroxidoarsenic
HAsH
2
O
2
h[AsH
2
O(OH)] arsinic acid dihydridohydroxidooxidoarsenic
HAsH
2
O h[AsH
2
(OH)] arsinous acid dihydridohydroxidoarsenic
H
3
SbO
4
h[SbO(OH)
3
] antimonic acid, stiboric acid
i
trihydroxidooxidoantimony
H
3
SbO
3
h[Sb(OH)
3
] antimonous acid, stiborous acid
i
trihydroxidoantimony
H
2
SbHO
3
h[SbHO(OH)
2
] stibonic acid hydridodihydroxidooxidoantimony
H
2
SbHO
2
h[SbH(OH)
2
] stibonous acid hydridodihydroxidoantimony
HSbH
2
O
2
h[SbH
2
O(OH)] stibinic acid dihydridohydroxidooxidoantimony
HSbH
2
O h[SbH
2
(OH)] stibinous acid dihydridohydroxidoantimony
H
3
SO
4
|
h[SO(OH)
3
]
| d
trihydroxidooxidosulfur(1|), trihydrogen(tetraoxidosulfate)(1|)
H
2
SO
4
h[SO
2
(OH)
2
] sulfuric acid dihydroxidodioxidosulfur
HSO
4
h[SO
3
(OH)]
hydrogensulfate hydroxidotrioxidosulfate(1)
[SO
4
]
2
sulfate tetraoxidosulfate(2)
HSHO
3
h[SHO
2
(OH)] sulfonic acid
j
hydridohydroxidodioxidosulfur
H
2
SO
3
h[SO(OH)
2
] sulfurous acid dihydroxidooxidosulfur
(continued)
1
2
9
I
N
O
R
G
A
N
I
C
A
C
I
D
S
A
N
D
D
E
R
I
V
A
T
I
V
E
S
I
R
-
8
.
2
Table IR-8.1 Continued
Formula Acceptable common name
(unless otherwise stated)
Systematic additive name(s)
HSO
3
h[SO
2
(OH)]
hydrogensulfte hydroxidodioxidosulfate(1)
[SO
3
]
2
sulfte trioxidosulfate(2)
HSHO
2
h[SHO(OH)] sulfnic acid
j
hydridohydroxidooxidosulfur
H
2
SO
2
h[S(OH)
2
] sulfanediol
k
dihydroxidosulfur
[SO
2
]
2
sulfanediolate
k
dioxidosulfate(2)
HSOH h[SH(OH)] sulfanol
k
hydridohydroxidosulfur
HSO
h[SHO]
sulfanolate
k
hydridooxidosulfate(1)
H
2
S
2
O
7
h[(HO)S(O)
2
OS(O)
2
(OH)] disulfuric acid
c
4-oxido-bis(hydroxidodioxidosulfur)
[S
2
O
7
]
2
h[(O)
3
SOS(O)
3
]
2
disulfate 4-oxido-bis(trioxidosulfate)(2)
H
2
S
2
O
6
h[(HO)(O)
2
SS(O)
2
(OH)] dithionic acid
c,l
bis(hydroxidodioxidosulfur)(S-S), or
1,4-dihydrido-2,2,3,3-tetraoxido-1,4-dioxy-2,3-disulfy-[4]catena
[S
2
O
6
]
2
h[O
3
SSO
3
]
2
dithionate bis(trioxidosulfate)(S-S)(2),
or 2,2,3,3-tetraoxido-1,4-dioxy-2,3-disulfy-[4]catenate(2)
H
2
S
3
O
6
h[(HO)(O)
2
SSS(O)
2
(OH)] trithionic acid
c,m
1,5-dihydrido-2,2,4,4-tetraoxido-1,5-dioxy-2,3,4-trisulfy-[5]catena
H
2
S
4
O
6
h[(HO)(O)
2
SSSS(O)
2
(OH)] tetrathionic acid
c,m
1,6-dihydrido-2,2,5,5-tetraoxido-1,6-dioxy-2,3,4,5-tetrasulfy-[6]catena
H
2
S
2
O
5
h[(HO)(O)
2
SS(O)OH] disulfurous acid
n
dihydroxido-11O,21O-trioxido-11
2
O,21O-disulfur(S-S)
[S
2
O
5
]
2
h[O(O)
2
SS(O)O]
2
disulfte
n
pentaoxido-11
3
O,21
2
O-disulfate(S-S)(2)
H
2
S
2
O
4
h[(HO)(O)SS(O)(OH)] dithionous acid
c,l
bis(hydroxidooxidosulfur)(S-S),
or 1,4-dihydrido-2,3-dioxido-1,4-dioxy-2,3-disulfy-[4]catena
[S
2
O
4
]
2
h[O
2
SSO
2
]
2
dithionite bis(dioxidosulfate)(S-S)(2),
or 2,3-dioxido-1,4-dioxy-2,3-disulfy-[4] catenate(2)
H
2
SeO
4
h[SeO
2
(OH)
2
] selenic acid dihydroxidodioxidoselenium
[SeO
4
]
2
selenate tetraoxidoselenate(2)
H
2
SeO
3
h[SeHO
2
(OH)] selenonic acid
j,o
hydridohydroxidodioxidoselenium
H
2
SeO
3
h[SeO(OH)
2
] selenous acid
o
dihydroxidooxidoselenium
[SeO
3
]
2
selenite trioxidoselenate(2)
HSeHO
2
h[SeHO(OH)] seleninic acid
j
hydridohydroxidooxidoselenium
H
6
TeO
6
h[Te(OH)
6
] orthotelluric acid
a
hexahydroxidotellurium
[TeO
6
]
6
orthotellurate
a
hexaoxidotellurate(6)
1
3
0
I
N
O
R
G
A
N
I
C
A
C
I
D
S
A
N
D
D
E
R
I
V
A
T
I
V
E
S
I
R
-
8
.
2
H
2
TeO
4
h[TeO
2
(OH)
2
] telluric acid
a
dihydroxidodioxidotellurium
[TeO
4
]
2
tellurate
a
tetraoxidotellurate(2)
H
2
TeO
3
h[TeO(OH)
2
] tellurous acid dihydroxidooxidotellurium
HTeHO
3
h[TeHO
2
(OH)] telluronic acid
j
hydridohydroxidodioxidotellurium
HTeHO
2
h[TeHO(OH)] tellurinic acid
j
hydridohydroxidooxidotellurium
HClO
4
h[ClO
3
(OH)] perchloric acid hydroxidotrioxidochlorine
[ClO
4
]
perchlorate tetraoxidochlorate(1)
HClO
3
h[ClO
2
(OH)] chloric acid hydroxidodioxidochlorine
[ClO
3
]
chlorate trioxidochlorate(1)
HClO
2
h[ClO(OH)] chlorous acid hydroxidooxidochlorine
[ClO
2
]
chlorite dioxidochlorate(1)
HClO h[O(H)Cl] hypochlorous acid chloridohydridooxygen
[OCl]
hypochlorite chloridooxygenate(1-)
HBrO
4
h[BrO
3
(OH)] perbromic acid hydroxidotrioxidobromine
[BrO
4
]
perbromate tetraoxidobromate(1)
HBrO
3
h[BrO
2
(OH)] bromic acid hydroxidodioxidobromine
[BrO
3
]
bromate trioxidobromate(1)
HBrO
2
h[BrO(OH)] bromous acid hydroxidooxidobromine
[BrO
2
]
bromite dioxidobromate(1)
HBrO h[O(H)Br] hypobromous acid bromidohydridooxygen
[OBr]
hypobromite bromidooxygenate(1-)
H
5
IO
6
h[IO(OH)
5
] orthoperiodic acid
a
pentahydroxidooxidoiodine
[IO
6
]
5
orthoperiodate
a
hexaoxidoiodate(5)
HIO
4
h[IO
3
(OH)] periodic acid
a
hydroxidotrioxidoiodine
[IO
4
]
periodate
a
tetraoxidoiodate(1)
HIO
3
h[IO
2
(OH)] iodic acid hydroxidodioxidoiodine
[IO
3
]
iodate trioxidoiodate(1)
HIO
2
h[IO(OH)] iodous acid hydroxidooxidoiodine
[IO
2
]
iodite dioxidoiodate(1)
HIO h[O(H)I] hypoiodous acid hydridoiodidooxygen
[OI]
hypoiodite iodidooxygenate(1)
(continued)
1
3
1
I
N
O
R
G
A
N
I
C
A
C
I
D
S
A
N
D
D
E
R
I
V
A
T
I
V
E
S
I
R
-
8
.
2
a
The prefx 'ortho` has not been used consistently in the past (including in Chapter I-9 of Ref. 2). Here, it has been removed in the cases of boric acid, silicic acid and
phosphoric acid where there is no ambiguity in the names without 'ortho`. The only cases where 'ortho` distinguishes between two different compounds are the telluric
and periodic acids (and corresponding anions).
b
The names fulminic acid and isofulminic acid have been used inconsistently in the past. The compound originally named fulminic acid is HCNO, which is not an
oxoacid, while the esters usually called fulminates in organic chemistry are RONC, corresponding to the oxoacid HONC. The additive names in the right hand column
specify the structures unambiguously. The preferred organic names are formonitrile oxide for HCNO and 2
2
-methylidenehydroxylamine for HONC. (See Section P-61.9
of Ref. 1. See also Table IX under entries CHNO and CNO).
c
The oligomeric series can be continued, e.g. diphosphoric acid, triphosphoric acid, etc.; dithionic acid, trithionic acid, tetrathionic acid, etc.; dithionous, trithionous, etc.
d
The names nitric acidium, sulfuric acidium, etc. for the hydronated acids represent a hybrid of several nomenclatures and are diffcult to translate into certain languages.
They are no longer acceptable.
e
The substitutive name would be azanol. However, for preferred names for certain organic derivatives, NH
2
OH itself is regarded as a parent with the name
hydroxylamine. See Ref. 1, Section P-68.3.
f
These are systematic substitutive names. The traditional names hyponitrous acid and hyponitrite are not acceptable; the systematics otherwise adhered to for use of the
prefx 'hypo` would have prescribed hypodinitrous and hypodinitrite.
g
The name phosphorous acid and the formula H
3
PO
3
have been used in the literature for both [P(OH)
3
] and [PHO(OH)
2
]. The present choice of names for these two
species is in accord with the parent names given in Sections P-42.3 and P-42.4 of Ref. 1.
h
These are substitutive names. No 'acid` names are commonly used for the two isomers of HPO
2
.
i
The names arsoric, arsorous, stiboric and stiborous are included because they are used as parent names in Section P-42.4 of Ref. 1.
j
Caution is needed if using the names sulfonic acid, sulfnic acid, selenonic acid, etc. for these compounds. Substitutive nomenclature prescribes using substitution into
parent hydrides rather than into the acids when naming corresponding functional derivatives, e.g. trisulfanedisulfonic acid (not trisulfanediylK K K), see footnote m;
methaneseleninic acid (not methylK K K); etc. Note that the substituent groups 'sulfonyl`, 'sulfnyl`, etc., are S(O)
2
,S(O), etc., not HS(O)*, HS(O), etc.
k
These are systematic substitutive names. Names based on the traditional names sulfoxylic acid for S(OH)
2
and sulfenic acid for HSOH, and indeed these names
themselves, are no longer acceptable.
l
Systematic use of the prefx 'hypo` would give the names hypodisulfuric acid for dithionic acid and hypodisulfurous acid for dithionous acid.
m
The homologues trithionic acid, tetrathionic acid, etc., may be alternatively named by substitutive nomenclature as sulfanedisulfonic acid, disulfanedisulfonic acid, etc.
n
This common name presents a problem because the unsymmetrical structure is not the structure which would otherwise be associated with the 'diacid` construction
(disulfurous acid would systematically be [HO(O)SOS(O)OH]). The use of an additive name eliminates this potential confusion, but the problem with the use of
disulfurous acid as a parent name persists in the naming of organic derivatives.
o
The formula H
2
SeO
3
has been used in the literature for both selenonic acid and selenous acid. The present choice of names for the two structures shown is in accord with
the parent names given in Sections P-42.1 and P-42.4 of Ref. 1.
1
3
2
I
N
O
R
G
A
N
I
C
A
C
I
D
S
A
N
D
D
E
R
I
V
A
T
I
V
E
S
I
R
-
8
.
2
Vous aimerez peut-être aussi
- Nomenclatura Composti InorganiciDocument4 pagesNomenclatura Composti InorganiciSerena MarrazzoPas encore d'évaluation
- NomenclaturaDocument13 pagesNomenclaturaAleCastelliPas encore d'évaluation
- Chimica Occulta: Indagine nella struttura occulta degli atomiD'EverandChimica Occulta: Indagine nella struttura occulta degli atomiPas encore d'évaluation
- Nomenclatura Di Base Chimica Per IngegneriaDocument13 pagesNomenclatura Di Base Chimica Per IngegneriaVu D TrevorPas encore d'évaluation
- Nomenclatura InorganicaDocument10 pagesNomenclatura InorganicaLucaPas encore d'évaluation
- Le Orchestre Sinfoniche e Cori delle Principali Radio Nazionali dell'Europa OccidentaleD'EverandLe Orchestre Sinfoniche e Cori delle Principali Radio Nazionali dell'Europa OccidentalePas encore d'évaluation
- Lezione Di Chimica N. 4Document5 pagesLezione Di Chimica N. 4the andrix splatterPas encore d'évaluation
- AcidiDocument2 pagesAcidiAlvaro SoleroPas encore d'évaluation
- Esercizi Nomenclatura Inorganica - ScienzaChimicaDocument6 pagesEsercizi Nomenclatura Inorganica - ScienzaChimicaAlessandro PratiPas encore d'évaluation
- NOMENCLATURADocument9 pagesNOMENCLATURAnicolepesce01Pas encore d'évaluation
- Nomenclatura Compuşilor ChimiciDocument9 pagesNomenclatura Compuşilor Chimicicondecuse100% (2)
- Esercizi NomenclaturaDocument10 pagesEsercizi NomenclaturaAlessandro PratiPas encore d'évaluation
- Nomenclatura Chimica: Appunti DiDocument19 pagesNomenclatura Chimica: Appunti Dihaconep181Pas encore d'évaluation
- Lezione1 Stechiometria Nomenclatura ChimicaDocument21 pagesLezione1 Stechiometria Nomenclatura ChimicaLeo Bursese100% (1)
- Composti e ReazioniDocument36 pagesComposti e ReazioniFrancesco TorrettaroPas encore d'évaluation
- Nomenclatura ChimicaDocument63 pagesNomenclatura ChimicaDaniele CaglieroPas encore d'évaluation
- Nomenclatura ChimicaDocument19 pagesNomenclatura Chimicaapi-253266324Pas encore d'évaluation
- Sali PDFDocument2 pagesSali PDFGiorgia SolesPas encore d'évaluation
- 3 Nomenclatura 2021Document14 pages3 Nomenclatura 2021serenaPas encore d'évaluation
- Nomenclatura ZanicchelliDocument28 pagesNomenclatura ZanicchelliAndrea GregoPas encore d'évaluation
- NomenclaturaDocument17 pagesNomenclaturaermelinda memoliPas encore d'évaluation
- Nomenclatura Molecole InorganicheDocument25 pagesNomenclatura Molecole InorganicheLorenzo GregorisPas encore d'évaluation
- Ripasso Nomenclatura TradizionaleDocument3 pagesRipasso Nomenclatura TradizionaleAlessio SargentiniPas encore d'évaluation
- Nomenclatura Composti ChimiciDocument21 pagesNomenclatura Composti ChimiciKnabodinalioPas encore d'évaluation
- La Nomenclatura ChimicaDocument5 pagesLa Nomenclatura ChimicaAlex SeveroniPas encore d'évaluation
- Appunti Di Chimica Inorganica Per Il Liceo ScientificoDocument3 pagesAppunti Di Chimica Inorganica Per Il Liceo ScientificoBelinda AbbruzzesePas encore d'évaluation
- F4 UvoifevgujdxfyvyukcvyukfeqguvkfequykvfecygiqkDocument63 pagesF4 Uvoifevgujdxfyvyukcvyukfeqguvkfequykvfecygiqkjacoponavari2004Pas encore d'évaluation
- Antichi Simboli ChimiciDocument20 pagesAntichi Simboli Chimicigerri74okPas encore d'évaluation
- Nomenclatura Dei Composti BinariDocument4 pagesNomenclatura Dei Composti Binarinicolacaddeo07Pas encore d'évaluation
- Appunti Di Scienze (Classe Seconda)Document47 pagesAppunti Di Scienze (Classe Seconda)Liceo F. Vercelli100% (1)
- Esercizi TotaliDocument19 pagesEsercizi TotaliSARA FERRANTEPas encore d'évaluation
- Elementi Composti NomenclaturaDocument7 pagesElementi Composti NomenclaturaTed SukuboPas encore d'évaluation
- NomenclaturaDocument48 pagesNomenclaturafeklendPas encore d'évaluation
- Nomenclatura (Tradizionale e IUPAC)Document3 pagesNomenclatura (Tradizionale e IUPAC)Luca GhigiPas encore d'évaluation
- Regole Di NomenclaturaDocument7 pagesRegole Di NomenclaturaSKYN3T21100% (1)
- NomenclaturaDocument30 pagesNomenclaturaMatteo Achille CampanelliPas encore d'évaluation
- 2 nomenclaturaIIDocument30 pages2 nomenclaturaIIBiagio CastronovoPas encore d'évaluation
- 4) COMPOSTI INORGANICI EserciziDocument4 pages4) COMPOSTI INORGANICI Esercizicorrado corradiPas encore d'évaluation
- Zanichelli Chimica Intorno Sintesi10Document2 pagesZanichelli Chimica Intorno Sintesi10dmfra08Pas encore d'évaluation
- nuovi_esercizi_nomenclaturaDocument8 pagesnuovi_esercizi_nomenclaturanicolacaddeo07Pas encore d'évaluation
- NomenclaturaDocument3 pagesNomenclaturaCalisthenicsMarcoPas encore d'évaluation
- Biologia 05 - Nomenclatura ChimicaDocument5 pagesBiologia 05 - Nomenclatura ChimicaAnonymous oG0VPL2YPas encore d'évaluation
- Chimica Generale RipassoDocument36 pagesChimica Generale RipassoEster CellucciPas encore d'évaluation
- Lezione 1. Nomenclatura ChimicaDocument57 pagesLezione 1. Nomenclatura ChimicaRagne FranciscoPas encore d'évaluation
- Esercizi ChimDocument6 pagesEsercizi ChimrosagiuliaPas encore d'évaluation
- NomenclaturaDocument12 pagesNomenclaturaFrank VillalvaPas encore d'évaluation
- Esercizi Sui CompostiDocument1 pageEsercizi Sui CompostiFrancesco GentilePas encore d'évaluation
- Acidi TernariDocument2 pagesAcidi TernariVeltro da CorvaiaPas encore d'évaluation
- Nomenclatura Dei Composti OrganiciDocument48 pagesNomenclatura Dei Composti OrganicimarbenzPas encore d'évaluation
- Chimica - OssidoriduzioniDocument2 pagesChimica - OssidoriduzioniPaolo D'AlessandroPas encore d'évaluation
- La Nomenclatura (Chimica)Document9 pagesLa Nomenclatura (Chimica)Federico MazzolaniPas encore d'évaluation
- La Nomenclatura InorganicaDocument5 pagesLa Nomenclatura InorganicaSimona StefanelliPas encore d'évaluation
- Nomenclatura Chimica e TabelleDocument83 pagesNomenclatura Chimica e TabelleElia Lipreri100% (1)
- NOMENCLATURADocument41 pagesNOMENCLATURAcelestePas encore d'évaluation
- Piping Ed02Document53 pagesPiping Ed02Giovanni EsemerePas encore d'évaluation
- Esercizi Chimica Nomenclatura Classificazione 2Document2 pagesEsercizi Chimica Nomenclatura Classificazione 2PauloBarbuPas encore d'évaluation
- Guida AtexDocument48 pagesGuida Atexfrancescocass100% (1)
- 5 Oli EssenzialiDocument45 pages5 Oli EssenzialiDana GoldoniPas encore d'évaluation