Académique Documents
Professionnel Documents
Culture Documents
El Gas Ideal
Transféré par
Yinno BernalDescription originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
El Gas Ideal
Transféré par
Yinno BernalDroits d'auteur :
Formats disponibles
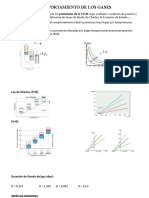
EL GAS IDEAL
1. La Ley de los Gases Ideales :
El gas ideal es un gas cuyas molculas estn separadas que raramente chocan unas con otras. Puesto que este es el caso para cualquier gas real a baja densidad de partculas, todos los gases son ideales a baja densidad. Este hecho fue utilizado en el aparato anterior para definir la temperatura absoluta T en funcin de la presin p de un gas ideal a volumen constante. El resultado es la EC. 8.3 que puede escribirse tambin:
P=
8.6
Esto establece que, a volumen constante, la presin de un gas ideal es la proporcional a la temperatura absoluta..
La dependencia existe entre p y el volumen del gas puede deducirse de la Ec.8.6 en el supuesto de que p, la presin del gas a la temperatura del hielo, sea proporcional a la densidad de particulas, 8.7 Donde b es otra constante independiente de la composiscion quimica del gas. Esta suposicion es razonable poruqe , como veremos en el aparato siguiente laa presin del gas es producida por las molculas del gas al cocar con la pared del recipiente. Cuando se duplica la densidad de particulas, hay el doble de molculas en el recipiente.
Para un gas diluido esto significa que choca con la pared el doble de molculas y de aqu que la presin se vea duplicada. OBSERVACIN: La Ec. 8.7 no es correcta si n es muy grande. En un gas denso, la frecuencia con que una molcula choca con otra una pared se ve afectada por la presencia de las otras molculas .Por un lado despus de chocar contra la pared, una molcula puede rebotar en alguna molcula prxima y chocar contra la pader de una seunda vez. Este efecto tiende a aumentar la presin por encima del valor dado por la Ec. 8.7. Por otro lado, si las molculas del gas se atraen entre si fuertemente, pueden tener cierta tendencia a mantenerse unidas brevemente despus de cada colisin. Este efecto tiende a disminuir la presin por debajo del valor de la Ec. 8.7 Por lo tanto la presin en un gas real puede ser mayor o menor que la presin en un gas ideal (Apart 8.5).
La densidad de partculas est relacionada con el nmero de moles n y con el volumen V del gas por medio de la ec 8.2, de modo que la Ec 8.7 puede escibrise : Pi= As la dependencia existe en p y el volumen se obtien sustituyendo por esta ltima exprsin en la Ec 8.6: 8.8 La magnitud bNa/a es la constante R de los gases. Sus componentes dimensiones son {energa/kelvin}, y su valor es
En funcin de R la Ec 8.8 se convierte en :
que es la ley de los gases ideales.
Definicin : La ley de los gases ideales
8.9
da la relacin entre la presin p, el volumen V y la temperatura T de n moles de u gas ideal. Debe ponerse cuidado y atencin en el uso de la ecuacin porque las magnitudes que aparecen en ella deben estar en la forma apropiada y en las unidades correctas. La presin es la presin absoluta en newtons por metro cuadrado, en volumen en metros cbicos y la temperatura es la temperatura absoluta en kelvins.
Ejemplo 1. Cul es la densidad de masa del oxigeno a temperatura y presin normales (TPN), es decir a 0 C y 1 atm? Se utiliza la ley de los gases ideales a fin de determinar el nmero de moles n de un gas ideal en un volumen V= 1 a una presin de p=1 atm=1.01 * N/ y una temperatura de T=273 K. En primer lugar se despeja n de la Ec 8.9 y despus se aplican en ella estos valores. El resultado es :
n Puesto que la masa de un mol de oxgeno, O2 es 32 g, la masa de 44.5 mole de oxgeno es 44.5 *32 g= 1.425kg Por lo tanto la densidad TPN del oxgeno es 1.43 kg/ que concuerda con el valor dado en la tabla 7.2
Ejemplo 2.supongamos que el neumtico de un automvil se llena con aire a una temperatura de 20 C hasta una presin(manomtrica) de 24lb/ .Despus de recorrer 100 millas por una carretera, la temperatura del neumtico es 50 C.Cul es la presin dek neumtico a esta temperatura? La mejor manera de proceder es, en primer lugar,volver a escribir la Ec. 8.9 de forma tal que las magnitudes que sufren variaciones queden a un lado de la ecuacin y las que permanecn constantes, en el otro. En este caso T y p varan pero no as el volumen V ni, por supuesto, n y R. Por lo tanto la Ec. 8.9 se puede escribir de nuevo en la forma:
A continuacin, las magnitudes dadas deben ponerse en la forma apropiada. Las temperaturas Celsius debenexpresarse en temperaturas absolutas y las presiones manomtricas en presiones absolutas. De la Ec 8.5 se tiene que la temperatura inicial es T 1 =273+20=293 K y la temperatura final de, Tf =273+50=323 K. Suponiendo que la presin atmosferica es 14.7 lb/ , la presin absoluta inicial es Pi=14.7 + 24.0 lb/ =38.7 lb/ . A la temperatura inical, la Ec. 8.10 es :
y la temperatura final es
Por ltimo despejamos de aqu Pf :
= =42.6
La presin manomtrica en el neumtico a la temperatura ms elevada es 42.6-14.7 =27.9 , que resulta ser 3.9 ms alta que la presin manomtrica inicial. OBSERVACIN: En este ltimo ejemplo no se necesita la constante R de los gases porque slo se ha calculado lo que ha variado la presin.Como se han utilizado proporciones para hallar Pf , la presin no ha tenido que ser la convertida a unidaddes SI. En cambio, en el primer ejemplo se necesita R para poder calcular el nmero de moles de un gas en determinadas condiciones.Puesto que el valor R est dado en unidades SI,todas las otras magnitudes haban de darse tambien en unidades SI.A menudo es mas conveniente medir la presin en atmsferas, milmetros de mercurio o libras por pulgada cuadrada y el volumen en litros, cetrmetros cbicos o pies cbicos. En lugar de convertir estas unidaddes en unidades SI, se utiliza el valor de R que corresponde a estas unidades.La tabla 8.1 da los valores de R que de ser empleados en la Ec. 8.9 cuando P y V se miden en otras unidades.
La ley de Dalton de la presin parcial: En una mezcla de gases ideales
cada componente ejerce una presin parcial proporcional a su concentracion molecular,La presin total de la mezcla es igual, por consigueinte, a la suma de las presiones parciales de todos los gases componentes. La ley de Dalton es importante porque los efectos fisiolgicos de cada componete del aire dependen de la presin parcial que ejerce el componete en los pulmones y no de la presintotal, Por ejemplo, la cantidad de nitrgeno que se disuelve en la sangre y en los tejidos del cuerpo es proporcional a la presin parcial del nitrgeno en los pulmones. La presin parcial del nitrgeno se hace pelifrosamente elevada para un buzo a grandes profundidades
TABLA 8.1. Valores de la constante R de los gases para diversas unidades de presin y volumen. La temperatura aparece siempre en kelvins
Volumen 1 litro 1 litro
Presin atm mm Hg atm mm Hg atm
R 8.314 J/K 8.205 x atm-1/K 62.4 mm Hg-1/k 82.05 atm/K 6.24 x m Hg/K 2.90x atm/K 4.26 x lb-K
2. Gases Reales : La presin y el volumen de un gas real estn relacionados por la ley de los gases ideales, Ec. 8.9 slo cuando la densidad de partculas es pequea. Cuando se aumenta la presin de un gas, la disminucin de volumen produce un aumento en la densidad. Por lo tanto, a presin elevada es de esperar que la relacin presin-volumen de un gas real, se desve de la de un gas ideal. Para la mayora de los gases estas observaciones se hacen apreciables a densidades por encima de partculas/ , o sea, alrededor de 1 mol/1. Es decir, a una presin a la cual 1 mol de gas ocupe un volumen de 1 litro o cosa as, no es aplicable la ley de los gases ideales.
Vous aimerez peut-être aussi
- Ingeniería química. Soluciones a los problemas del tomo ID'EverandIngeniería química. Soluciones a los problemas del tomo IPas encore d'évaluation
- Ley de Los GasesDocument7 pagesLey de Los Gasesjulio camposPas encore d'évaluation
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesD'EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesPas encore d'évaluation
- TermodinamicaDocument16 pagesTermodinamicaLUIS HERNANDEZPas encore d'évaluation
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- ExcelDocument16 pagesExcelruben romanPas encore d'évaluation
- Sesion 09 Estado Gaseoso F (Modo de Compatibilidad)Document4 pagesSesion 09 Estado Gaseoso F (Modo de Compatibilidad)Miguel CZPas encore d'évaluation
- Clase10 Teoriagases2013aDocument15 pagesClase10 Teoriagases2013aMauricio RamirezPas encore d'évaluation
- Gases IdealesDocument12 pagesGases IdealesRayulss HernandezPas encore d'évaluation
- TermodinamicaDocument17 pagesTermodinamicaManuel Lucio LópezPas encore d'évaluation
- Term Odin A MicaDocument16 pagesTerm Odin A Micaલિસા એન્ડ્રીયા એન્ડ્રીયાPas encore d'évaluation
- Gases Ideales y RealesDocument28 pagesGases Ideales y RealesLee HansonPas encore d'évaluation
- Folleto Gases y TermodinamicaDocument18 pagesFolleto Gases y TermodinamicaFaco QcoPas encore d'évaluation
- Sesión 4 Gases Ideales y RealesDocument8 pagesSesión 4 Gases Ideales y RealesPaola Stefania Villarreal VeraPas encore d'évaluation
- Term Odin A MicaDocument21 pagesTerm Odin A MicaNel VelaPas encore d'évaluation
- Gases RealesDocument6 pagesGases RealesRenato EspinosaPas encore d'évaluation
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesERIKA LOZADA RUSSELPas encore d'évaluation
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesElsa Marzana SanizoPas encore d'évaluation
- Estado GaseosoDocument7 pagesEstado Gaseosofernando mercadoPas encore d'évaluation
- Gases Química PDFDocument8 pagesGases Química PDFMax ChazzPas encore d'évaluation
- Cuestionario Previo 9 (Ley de Boyle-Mariotte) - 1 - 280Document8 pagesCuestionario Previo 9 (Ley de Boyle-Mariotte) - 1 - 280Alan Alberth OHPas encore d'évaluation
- Ley de Los Gases IdealesDocument4 pagesLey de Los Gases IdealesCArlosPas encore d'évaluation
- Estudio de Los Gases Ideales y Reales - Lab 1Document27 pagesEstudio de Los Gases Ideales y Reales - Lab 1Rosario CcahuanticoPas encore d'évaluation
- Sesion 09 Estado Gaseoso 13 IIDocument25 pagesSesion 09 Estado Gaseoso 13 IIRodriguez Roncal HerbertPas encore d'évaluation
- Ley de Boyle MariotteDocument5 pagesLey de Boyle MariotteKevin MolinaPas encore d'évaluation
- 03 Gases IdealesDocument37 pages03 Gases IdealesFaustoPas encore d'évaluation
- La Ecuación Del Gas Ideal!Document2 pagesLa Ecuación Del Gas Ideal!Erick Rl T MPas encore d'évaluation
- Taller 3 Segunda ParteDocument7 pagesTaller 3 Segunda ParteHydra OrionPas encore d'évaluation
- Gases 2020-1Document10 pagesGases 2020-1Edward GilPas encore d'évaluation
- Quimica 2Document12 pagesQuimica 2Maria Isabel Ángeles Quevedo100% (1)
- Ecuaciones de Estado para Gases RealesDocument25 pagesEcuaciones de Estado para Gases RealesKEVIN ARNOLDO PEREZ RIVASPas encore d'évaluation
- Unidad IVDocument20 pagesUnidad IVYubiri Marcano SuarezPas encore d'évaluation
- Taller de Gases-QuimicaDocument14 pagesTaller de Gases-QuimicaYera CastroPas encore d'évaluation
- Cuestionario de PlantasDocument108 pagesCuestionario de PlantasJuan Silva LopezPas encore d'évaluation
- Clase I, Temperatura y Presion, Ley de Los Gases IdealesDocument17 pagesClase I, Temperatura y Presion, Ley de Los Gases IdealesYetsabel ValenzuelaPas encore d'évaluation
- TEMA #1 Fisicoquimica I - QMC 213Document67 pagesTEMA #1 Fisicoquimica I - QMC 213Anonymous yEGP9hnPas encore d'évaluation
- Primer Parcial Plantas de Conversión TérmicaDocument47 pagesPrimer Parcial Plantas de Conversión TérmicaJuanPazPas encore d'évaluation
- Capítulo 4Document35 pagesCapítulo 4rofdiazPas encore d'évaluation
- Presion y Un Gas PerfectoDocument4 pagesPresion y Un Gas PerfectoFrancis Delgado RPas encore d'évaluation
- GasesDocument13 pagesGasesDianaCalderónOyola100% (1)
- Capitulo 10 GasesDocument17 pagesCapitulo 10 GasesRogelio RodriguezPas encore d'évaluation
- Gases Ideales y RealesDocument13 pagesGases Ideales y RealesLee HansonPas encore d'évaluation
- Teoria de GasesDocument6 pagesTeoria de GasesClaudia Mabel FloresPas encore d'évaluation
- Problemario - Unidad - 5 Quimica AplicadaDocument16 pagesProblemario - Unidad - 5 Quimica AplicadauziePas encore d'évaluation
- Trabajo de FluidosDocument82 pagesTrabajo de FluidosRoberto Martinez100% (1)
- Felix - ReservoriosDocument71 pagesFelix - ReservoriosKEVIN ANDREE MONTERO FERNANDEZPas encore d'évaluation
- Cap 7 Gases Ideales 19 Mayo 2013 PDFDocument14 pagesCap 7 Gases Ideales 19 Mayo 2013 PDFKriiztal GodinezPas encore d'évaluation
- Ley de Los Gases y Propiedades de Los HidrocarburosDocument17 pagesLey de Los Gases y Propiedades de Los HidrocarburosAndrimarCorderoPas encore d'évaluation
- Gases Ideales - BiologiaDocument9 pagesGases Ideales - BiologiaNorella RiveraPas encore d'évaluation
- Gases IdealesDocument13 pagesGases IdealesLissette Marysol QuispePas encore d'évaluation
- Gases Ideales y Sus LeyesDocument7 pagesGases Ideales y Sus LeyesMarlene SotoPas encore d'évaluation
- Practica 1 GasesDocument11 pagesPractica 1 GasesCarlos A Villalobos100% (2)
- TP Gases IdealesDocument5 pagesTP Gases Idealespris.gytPas encore d'évaluation
- Unidad IDocument11 pagesUnidad IEspinoza LuisPas encore d'évaluation
- 3 CalculoscomunesDocument16 pages3 CalculoscomunesAlexander Perez PerezPas encore d'évaluation
- Prop 2Document27 pagesProp 2ThaiPas encore d'évaluation
- Practica 1 ESIME ZACDocument9 pagesPractica 1 ESIME ZACeduardoPas encore d'évaluation
- V. Teoria Cinetica de Los GasesDocument28 pagesV. Teoria Cinetica de Los Gasesanon_580798559Pas encore d'évaluation
- Mezcla de GasesDocument7 pagesMezcla de GasesRicardo GarcíaPas encore d'évaluation
- Capítulo 10Document4 pagesCapítulo 10luis arauzPas encore d'évaluation
- 1223Document10 pages1223Yinno BernalPas encore d'évaluation
- Apuntes Anatomia 2 AngelesDocument41 pagesApuntes Anatomia 2 AngelesManuel Eduardo Bolivar SmithPas encore d'évaluation
- Apuntes Anatomia 2 AngelesDocument41 pagesApuntes Anatomia 2 AngelesManuel Eduardo Bolivar SmithPas encore d'évaluation
- Defectos Cardiacos CongenitosDocument19 pagesDefectos Cardiacos CongenitosYinno BernalPas encore d'évaluation
- Al Calo IdesDocument28 pagesAl Calo IdesYinno BernalPas encore d'évaluation
- HipotermiaDocument4 pagesHipotermiaYinno BernalPas encore d'évaluation
- Word de KokiDocument4 pagesWord de Kokijuan. joel ventura villanuevaPas encore d'évaluation
- Práctica 4. Equilibrió QuímicoDocument2 pagesPráctica 4. Equilibrió QuímicoJaider Hernan Garcia HernandezPas encore d'évaluation
- Equilibrio QuímicoDocument20 pagesEquilibrio QuímicoHugo Ardón AguilarPas encore d'évaluation
- Ondas en El AguaDocument6 pagesOndas en El AguaReinaldo WeltiPas encore d'évaluation
- Cap, 1 Esfuerzo (P)Document11 pagesCap, 1 Esfuerzo (P)Rosmeri DelgadoPas encore d'évaluation
- Las 3 Leyes de NewtonDocument3 pagesLas 3 Leyes de Newtonldguzman886Pas encore d'évaluation
- Solubilidad Informe UnmsmDocument27 pagesSolubilidad Informe Unmsmjudith4greenPas encore d'évaluation
- CinematicaDocument1 pageCinematicaRODRIGO YEBET TARCO HUAMANPas encore d'évaluation
- Reporte de Resultados - Practica Nro 12 Cinética Química 1Document4 pagesReporte de Resultados - Practica Nro 12 Cinética Química 1Michael Legalize StonePas encore d'évaluation
- 03 Equilibrio IDocument25 pages03 Equilibrio IAlexRodríguez100% (1)
- Primer Informe Del Laboratorio de Mecánica de SuelosDocument15 pagesPrimer Informe Del Laboratorio de Mecánica de SuelosJuanma Hernandez AlvarezPas encore d'évaluation
- Proceso de Enfriamiento Del Gas NaturalDocument11 pagesProceso de Enfriamiento Del Gas NaturalCamila LujánPas encore d'évaluation
- Taller ANÁLISIS DE FALLA EN CUÑA DE TALUDES EN ROCADocument19 pagesTaller ANÁLISIS DE FALLA EN CUÑA DE TALUDES EN ROCACatherin Hernandez0% (1)
- Fuerza y Leyes de Newton PDFDocument11 pagesFuerza y Leyes de Newton PDFmarko rattzingerPas encore d'évaluation
- 285 2013 10 08 2013 - 2014 - Grado - Fisica PDFDocument391 pages285 2013 10 08 2013 - 2014 - Grado - Fisica PDFJaneth DurandPas encore d'évaluation
- MCU IES La Magdalena Aviles ASTURIASDocument7 pagesMCU IES La Magdalena Aviles ASTURIASLaurence AVENDANO LOPEZPas encore d'évaluation
- Reglamento Nacional de Edificaciones MaterialesDocument6 pagesReglamento Nacional de Edificaciones MaterialesKelly Villanueva altunaPas encore d'évaluation
- Taller2 CampoEléctricoDocument2 pagesTaller2 CampoEléctricoJuan Sebastian Ducuara GelvesPas encore d'évaluation
- Síntesis y Posterior Morfología y Composición Del Grafeno A Partir de ElectrolisisDocument4 pagesSíntesis y Posterior Morfología y Composición Del Grafeno A Partir de ElectrolisisMaría C. PinillaPas encore d'évaluation
- Tarea15 3ro EnergiaDocument2 pagesTarea15 3ro EnergiaGerardo Piero Gamarra AlarconPas encore d'évaluation
- Examen Parcial Teoria de CamposDocument5 pagesExamen Parcial Teoria de CamposYOSVIN KEVIN GONZALES ANTICONAPas encore d'évaluation
- Examen Final EstructurasDocument30 pagesExamen Final EstructurasChristian saravia sotoPas encore d'évaluation
- Masa 1Document4 pagesMasa 1Alvaro CerPas encore d'évaluation
- Diseno de Una Caja Reductora Con Embrague de Proteccion Con Sobrepotencia.Document265 pagesDiseno de Una Caja Reductora Con Embrague de Proteccion Con Sobrepotencia.B3t1Pas encore d'évaluation
- Secado Por Atomizacion Parte 1Document3 pagesSecado Por Atomizacion Parte 1ArielPas encore d'évaluation
- Operator's Manual ES-1Document82 pagesOperator's Manual ES-1Miguel Angel Santos PintadoPas encore d'évaluation
- Examen Final - Semana 8 PDFDocument2 pagesExamen Final - Semana 8 PDFHhhhCali100% (1)
- Elementos Estructurales BásicosDocument6 pagesElementos Estructurales BásicosElissaPas encore d'évaluation
- Analisis Dinamico Modal EspectralDocument17 pagesAnalisis Dinamico Modal EspectralMario ramires chavesPas encore d'évaluation
- Unidad 3. Sistemas MecanicosDocument15 pagesUnidad 3. Sistemas MecanicosFreedy Martinez MedinaPas encore d'évaluation