Académique Documents
Professionnel Documents
Culture Documents
Inhibición Competitiva
Transféré par
anon_278872808Description originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Inhibición Competitiva
Transféré par
anon_278872808Droits d'auteur :
Formats disponibles
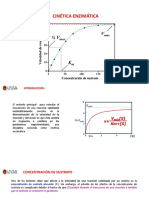
Inhibicin competitiva: el inhibidor puede combinarse con la enzima libre de tal modo que compite con el sustrato normal
para unirse al centro activo. Un inhibidor competitivo reacciona reversiblemente con la enzima para formar un complejo enzima-inhibidor (E-I) anlogo al complejo enzima sustato: E + I EI La vmx de la reaccin catalizada por la enzima no variar en presencia del inhibidor competitivo (lgicamente, cuando la [S] sea muy elevada, apenas habr ocasin de que se una la E con una molcula de I). En cambio la Km aparente del sustrato aumentar en presencia del inhibidor (es decir, ser precisa una [S] superior para alcanzar 1/2 vmx). Por lo tanto, en la cintica se refleja como una disminucin de la afinidad de E por S. Un ejemplo clsico de inhibicin competitiva es la de la succinato deshidrogenasa por el malonato y por otros aniones dicarboxilato.
*Inhibicin acompetitiva: aqu el inhibidor no se combina con la enzima libre. Sin embargo se combina con el complejo enzima-sustrato-inhibidor (E-S-I), el cual no se transforma en el producto habitual de la reaccin: ES + I ESI La presencia del inhibidor hace que disminuya la Km aparente en la misma proporcin que la vmx (como el I se une al complejo ES, su presencia se manifiesta tambin a elevadas [S], por lo que disminuye vmx). La Km aparente disminuye (lo cual quiere decir que la [S] precisa para alcanzar 1/2 vmx ser menor). No es que haya aumentado la afinidad de E por S: en realidad se mantiene igual, pero como la vmx ha disminuido, se precisar menor [S] para alcanzar 1/2 vmx y por eso la Km disminuye -y la afinidad aumenta- "aparentemente". La inhibicin acompetitiva es poco frecuente en las reacciones de un solo sustrato, pero es corriente en las reacciones de dos sustratos.
*Inhibicin no competitiva: el inhibidor no competitivo puede combinarse con la enzima libre (E) o con el complejo enzima sustrato (ES), e interfiere en la accin de ambos: E + I EI ES + I ESI
La presencia del inhibidor hace que decrezca la vmx (es decir, no puede ser compensada su presencia por elevadas [S]) pero la Km aparente no vara (o sea, que a la misma [S] se alcanza la
1/2 vmx correspondiente a la presencia del inhibidor). En realidad la afinidad de E por S s ha disminuido realmente (aunque no "aparentemente"). Algunas enzimas (no todas) que poseen un grupo -SH esencial, son inhibidas no competitivamente por iones de metales pesados (la enzima requiere esos grupos -SH intactos para su actividad normal). El agente quelante EDTA (tetra-acetato de etilen-diamida) se une reversiblemente al Mg2+ y a otros cationes divalentes, e inhibe as de modo no competitivo a algunas enzimas que precisan esos iones para su actividad. http://tertuliadeamigos.webcindario.com/bio2bach8.html
Vous aimerez peut-être aussi
- Curso de Detergentes Iqia SolutionsDocument17 pagesCurso de Detergentes Iqia SolutionsFelix Acebey85% (13)
- Cuestionario Laboratorio 5Document5 pagesCuestionario Laboratorio 5genet2015Pas encore d'évaluation
- Documento Completo de Cinetica EnzimaticaDocument11 pagesDocumento Completo de Cinetica EnzimaticaMonica VegaPas encore d'évaluation
- Inhibiciones de Reacciones QuimicasDocument4 pagesInhibiciones de Reacciones QuimicasJohanna SaavedraPas encore d'évaluation
- Inhibicion EnzimaticaDocument14 pagesInhibicion EnzimaticaFiorella Rosas RuizPas encore d'évaluation
- Factores Externos Que Alteran La Actividad EnzimáticaDocument4 pagesFactores Externos Que Alteran La Actividad EnzimáticaNegrita GuevaraPas encore d'évaluation
- Repaso de Cinética Enzimática e Inhibición Enzimática Fabián Rodríguez 2010Document4 pagesRepaso de Cinética Enzimática e Inhibición Enzimática Fabián Rodríguez 2010luis19401809Pas encore d'évaluation
- Inhibicion EnzimaticaDocument3 pagesInhibicion EnzimaticaMarco OsunaPas encore d'évaluation
- Inhibidores EnzimáticosDocument9 pagesInhibidores EnzimáticosVariedades Y-JPas encore d'évaluation
- Cinética EnzimáticaDocument10 pagesCinética EnzimáticaIbette NorttonPas encore d'évaluation
- Resoluciön Ejercicios de Inhibición-Activación y Efectos de PHDocument2 pagesResoluciön Ejercicios de Inhibición-Activación y Efectos de PHaaron30102023Pas encore d'évaluation
- Enzimas 2Document5 pagesEnzimas 2mpmPas encore d'évaluation
- Inhibicion EnzimaticaDocument5 pagesInhibicion EnzimaticaDeisy Soto CastroPas encore d'évaluation
- Ejercicios de Inhibición-Activación y Efectos de PHDocument3 pagesEjercicios de Inhibición-Activación y Efectos de PHaaron30102023Pas encore d'évaluation
- INHIBICIÓN ENZIMÁTICA La Actividad Enzimática Se Puede InhibirDocument1 pageINHIBICIÓN ENZIMÁTICA La Actividad Enzimática Se Puede InhibirElisa LozanoPas encore d'évaluation
- 000000000000000000000000Document21 pages000000000000000000000000Cristian BenalcázarPas encore d'évaluation
- Inhibidor EnzimáticoDocument18 pagesInhibidor EnzimáticoAdri CruzPas encore d'évaluation
- Tema 11 - Inhibición y Regulación de La Reacción EnzimáticaDocument4 pagesTema 11 - Inhibición y Regulación de La Reacción EnzimáticaLara MaríaPas encore d'évaluation
- Tema 015Document55 pagesTema 015Jeff Willian Rosas QuinaPas encore d'évaluation
- Cuestionario EnzimasDocument7 pagesCuestionario EnzimasJames ChPas encore d'évaluation
- Clase 5 BB - QQDocument21 pagesClase 5 BB - QQMarco AntonioPas encore d'évaluation
- Bioquimica Biologia Celular Yt MolecularDocument89 pagesBioquimica Biologia Celular Yt MolecularGiulli DuránPas encore d'évaluation
- Tema 4Document7 pagesTema 4Andrea Rodriguez MenendezPas encore d'évaluation
- Cinética Enzimática FisicoquimicaDocument23 pagesCinética Enzimática FisicoquimicaKriistian Rene QuintanaPas encore d'évaluation
- Tipos de InhibidoresDocument30 pagesTipos de Inhibidoresrukmari_yukiPas encore d'évaluation
- Ilovepdf - Merged (1) - MergedDocument190 pagesIlovepdf - Merged (1) - MergedMARIA FERNANDA SERVIN ROBLEDOPas encore d'évaluation
- Definiciones QuimicaDocument5 pagesDefiniciones Quimicadenisse floresPas encore d'évaluation
- Inhibidor EnzimáticoDocument16 pagesInhibidor Enzimáticojazmin yoselin jara carhuaricraPas encore d'évaluation
- Inhibidores Enzimáticos de Uso ClínicosDocument5 pagesInhibidores Enzimáticos de Uso ClínicosAngélica RomanPas encore d'évaluation
- Inhibidores ReversiblesDocument14 pagesInhibidores ReversiblesDavid AntonioPas encore d'évaluation
- GlifosatoDocument19 pagesGlifosatocesarPas encore d'évaluation
- Presentacion 6 Cinetica EnzimaticaDocument46 pagesPresentacion 6 Cinetica EnzimaticaE Clinton LMPas encore d'évaluation
- Tema 7 Parte 2 Inhibicion Enzimatica-Reacciones BisustratoDocument34 pagesTema 7 Parte 2 Inhibicion Enzimatica-Reacciones Bisustratoismael.laasikriPas encore d'évaluation
- Inhibidores BrechelDocument6 pagesInhibidores BrechelGrismayling WooPas encore d'évaluation
- Trabajo 3 de CineticaDocument9 pagesTrabajo 3 de Cineticachrismetal 188Pas encore d'évaluation
- INHIBIDORESDocument3 pagesINHIBIDORESLESLIE EVELIN LOMA JIMENEZPas encore d'évaluation
- Qué Es Cinética EnzimáticaDocument21 pagesQué Es Cinética EnzimáticaStefa WupamPas encore d'évaluation
- Accion de Inhibidores Enzimaticos en La Cadena RespiratoriaDocument3 pagesAccion de Inhibidores Enzimaticos en La Cadena Respiratoriachicofinta0km0Pas encore d'évaluation
- Innhibición EnzimáticaDocument4 pagesInnhibición EnzimáticaPatriciaPas encore d'évaluation
- Química CinéticaDocument10 pagesQuímica Cinéticayulyalv02Pas encore d'évaluation
- Roca Deber 1 IiuDocument6 pagesRoca Deber 1 IiuMARIA EMILIA ROCA ROJASPas encore d'évaluation
- Inhibicion Enzimatica PDFDocument55 pagesInhibicion Enzimatica PDFJesús Sánchez G.100% (1)
- Seminario 7-Inhibicion EnzimaticaDocument11 pagesSeminario 7-Inhibicion EnzimaticaAntonio CallejasPas encore d'évaluation
- Constante KM Michaelis-MentenDocument11 pagesConstante KM Michaelis-MentencladeprafirPas encore d'évaluation
- Cinetica EnzimaticaDocument108 pagesCinetica EnzimaticaDerlis Adán Miño LesmePas encore d'évaluation
- 6.3 BioquimicaDocument40 pages6.3 BioquimicaBrenda Soto100% (1)
- Apuntes BioquímicaDocument10 pagesApuntes BioquímicaCarolina AvilaPas encore d'évaluation
- Inhibición EnzimaticaDocument33 pagesInhibición EnzimaticaJessica GuerreroPas encore d'évaluation
- Cinetica de Reacc EnzimaticasDocument9 pagesCinetica de Reacc EnzimaticasMisato Katzuragi RitzukoPas encore d'évaluation
- Tp02 de Bioquímica UNLPDocument11 pagesTp02 de Bioquímica UNLPAlyson GuilhermePas encore d'évaluation
- Disertación Bioquímica (Enzimas)Document4 pagesDisertación Bioquímica (Enzimas)Fabiola Donoso RubilarPas encore d'évaluation
- Inhibicion y SustratoDocument3 pagesInhibicion y SustratoYara HernandezPas encore d'évaluation
- UD 3 Biocatalizadores 2 PBOIDocument60 pagesUD 3 Biocatalizadores 2 PBOIAneudis Javier BritoPas encore d'évaluation
- Regulacion EnzimaticaDocument12 pagesRegulacion EnzimaticaKurtis JuarezPas encore d'évaluation
- Enzimas 3Document13 pagesEnzimas 3el12cirujanoPas encore d'évaluation
- En ZimasDocument3 pagesEn ZimasJóse santiago Díaz giraldoPas encore d'évaluation
- Semana 4. Inhibición Enzimática, Modificación Enzimática de alimentos-CLAVDocument40 pagesSemana 4. Inhibición Enzimática, Modificación Enzimática de alimentos-CLAVCarlos Tafur PortillaPas encore d'évaluation
- Cinetica EnzimatticaalfinDocument12 pagesCinetica EnzimatticaalfinIker MendezPas encore d'évaluation
- Inhibición EnzimáticaDocument2 pagesInhibición Enzimáticaonibur@hotmail..comPas encore d'évaluation
- Diseño de Reactores No Isotérmicos en Estado Estacionario (Final)Document8 pagesDiseño de Reactores No Isotérmicos en Estado Estacionario (Final)María fernanda Sierra muskusPas encore d'évaluation
- Informe 1 Inorganica 1Document20 pagesInforme 1 Inorganica 1kuroiPas encore d'évaluation
- Fuerzas IntermolecularesDocument8 pagesFuerzas IntermolecularesKaterine Leonela Cueva EstradaPas encore d'évaluation
- Physiological Approach To Assessment of Acid-Base Disturbances - En.esDocument12 pagesPhysiological Approach To Assessment of Acid-Base Disturbances - En.esPauurbinaPas encore d'évaluation
- Propiedades Del Trigo de Importancia de TecnológicaDocument3 pagesPropiedades Del Trigo de Importancia de TecnológicaPinto Ramos CandiPas encore d'évaluation
- Carbozinc 858 DOT PDSDocument4 pagesCarbozinc 858 DOT PDSRaymundo Maldonado AlvarezPas encore d'évaluation
- Preguntas de Biologia Imagenes CitologiaDocument7 pagesPreguntas de Biologia Imagenes CitologiaMaría Hidalgo PlataPas encore d'évaluation
- Química 1 - Asuc01117Document3 pagesQuímica 1 - Asuc01117adia ataucuriPas encore d'évaluation
- Tuberías de Un Buque (Trabajo 1)Document12 pagesTuberías de Un Buque (Trabajo 1)Anonymous GyWzu5pHPas encore d'évaluation
- Cotizacion HTT31125 SOLUCIONES LIMPIEZADocument4 pagesCotizacion HTT31125 SOLUCIONES LIMPIEZARamiro Duran ZambranoPas encore d'évaluation
- Equilibrio Líquido-Vapor, Entalpía de VaporizaciónDocument5 pagesEquilibrio Líquido-Vapor, Entalpía de VaporizaciónPablo Ramírez100% (10)
- SOLUCIONESDocument3 pagesSOLUCIONESLuz Angela PerlasPas encore d'évaluation
- Diseño Pavimento Rigido Calle SucreDocument13 pagesDiseño Pavimento Rigido Calle SucreBeel HerreraPas encore d'évaluation
- NOMENCLATURADocument5 pagesNOMENCLATURANatalia Peña CetinaPas encore d'évaluation
- Catalogo SSolarDocument60 pagesCatalogo SSolarGaby InostrozaPas encore d'évaluation
- Examen GmawDocument4 pagesExamen GmawJoana AlmaguerPas encore d'évaluation
- Informe de Laboratorio Ácido AcéticoDocument4 pagesInforme de Laboratorio Ácido AcéticoSharik Paulina Grisales50% (2)
- Nomenclatura Cahn-IngoldDocument3 pagesNomenclatura Cahn-IngoldBujanosPas encore d'évaluation
- 11º Clase - Sedimentadores PrimariosDocument28 pages11º Clase - Sedimentadores PrimariosCarlos SilvaPas encore d'évaluation
- Actividad Número Uno Grupos FuncionalesDocument8 pagesActividad Número Uno Grupos FuncionalesMario Andres Velasquez MolinaPas encore d'évaluation
- Modelo Atómico A Través de La HistoriaDocument2 pagesModelo Atómico A Través de La HistoriaAngela Ruiz100% (1)
- Potabilizacion Del AguaDocument4 pagesPotabilizacion Del AguaarmandoPas encore d'évaluation
- Ga-Fr01 Malla Curricular 2019 Caminar en Secundaria 2019 TerminadoDocument75 pagesGa-Fr01 Malla Curricular 2019 Caminar en Secundaria 2019 TerminadoMyreya Gloria Delgado MartinezPas encore d'évaluation
- TP Ensayos No Destructivos BLANCO VictoriaDocument8 pagesTP Ensayos No Destructivos BLANCO Victoriaagustin biagettiPas encore d'évaluation
- Presentacion Gases Medicinales2Document10 pagesPresentacion Gases Medicinales2javiPas encore d'évaluation
- Fisica TermodinamicaDocument6 pagesFisica TermodinamicaTomas GuerreroPas encore d'évaluation
- Qué Es y en Qué Consiste El Estudio GeotécnicoDocument5 pagesQué Es y en Qué Consiste El Estudio GeotécnicoDavid Meide SalloPas encore d'évaluation
- Napko 412a Cfe p18 PDFDocument2 pagesNapko 412a Cfe p18 PDFNacho Lebb MendozaPas encore d'évaluation