Académique Documents
Professionnel Documents
Culture Documents
Estructura Trabajo Reconocimiento
Transféré par
Jose Caviedes VargasTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Estructura Trabajo Reconocimiento
Transféré par
Jose Caviedes VargasDroits d'auteur :
Formats disponibles
TRABAJO DE RECONOCIMIENTO ACTIVIDAD N 2 FORO RECONOCIMIENTO DEL CURSO ACADEMICO TERMODINAMICA
JOSE LIBARDO CAVIEDES VARGAS 1049611.100 Grupo: 201015_228
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD ESCUELA DE INGENIERIA, INGENIERIA INDUSTRIAL (CEAD TUNJA) 2013
CONTENIDO Pgina INTRODUCCIN .................................................................................................... 3 1. OBJETIVOS ........................................................................................................ 4 1.1 Objetivo General ............................................................................................ 4 1.2 Objetivos Especficos..................................................................................... 4 2. RESUMEN DE LOS CONCEPTOS PRINCIPALES ............................................ 5 CONCLUSIONES................................................................................................ 132 BIBLIOGRAFA ................................................................................................... 143
INTRODUCCIN
La termodinmica se encarga del estudio de la energa y sus transformaciones, en especial, la transformacin del calor en trabajo, el modulo del curso, se divide en dos unidades didcticas, en las cuales, se presenta de forma clara y explicita, las leyes de la termodinmica, los conceptos relacionados, las formulas y ecuaciones necesarias y las actividades de aprendizaje propuestas para el optimo desarrollo del curso.
Durante el estudio del curso, se sigui un proceso basado en el aprendizaje y disciplina autnoma, en la cual se ley concienzudamente en modulo en su totalidad para lograr extraer un resumen del mismo, a partir del cual se desarrollo un mapa conceptual con el contenido temtico resumido anteriormente.
El presente trabajo consta entonces de dos puntos principales en los que se demuestra el reconocimiento del curso, a travs del desarrollo de un resumen y un mapa conceptual sobre el contenido temtico del mismo. En la realizacin del mismo, se pretende hacer un registro y reconocimiento profundo sobre la temtica abordada en el modulo del curso, para familiarizarse con el entorno de estudio y poder desarrollar las actividades de aprendizaje propuestas de la manera mas optima y excelente posible.
1. OBJETIVOS
1.1 Objetivo General Elaborar un resumen acerca de los conceptos principales por cada leccin que tiene el mdulo de termodinmica.
1.2 Objetivos Especficos Elaborar un resumen de ecuaciones por cada leccin que tiene el mdulo de termodinmica. Colocar por cada leccin una ecuacin que se considere como ms importante o representativa.
2. RESUMEN DE LOS CONCEPTOS PRINCIPALES
Unidad 1 Captulo 1 La termodinmica es la ciencia que se ocupa de la transformacin del calor en trabajo. Por lo tanto para el ingeniero brinda las herramientas para el anlisis de las condiciones energticas, y la toma de decisiones correctas en un proceso. Leccin 1: Sistema termodinmico. Es cualquier porcin de materia que se quiera estudiar desde el punto de vista energtico, todo lo que se encuentra fuera del sistema se le denomina ambiente, entorno o alrededores. Se divide en sistema abierto, cerrado y aislado. Leccin 2: Ley cero de la termodinmica. Establece que si dos cuerpos estn en equilibrio trmico con un tercero, los dos se encontraran en equilibrio trmico entre si. Entonces la propiedad de los sistemas en equilibrio es la temperatura. Ecuacin de la leccin 02: T Leccin 3: Calor, Es la energa transferida entre dos sistemas debido a la diferencia de la temperatura, un proceso donde no se presente transferencia de calor se denomina proceso adiabtico, el calor no es una propiedad termodinmica, en un proceso es necesario establecer la forma como se realiza la transferencia, se representa con el smbolo 1Q2. Ecuacin de la leccin 03: Leccin 4: Ecuaciones de estado para gases reales, Los gases reales se apartan del comportamiento ideal por lo que no aplican para la ecuacin del gas ideal, el grado de desviacin de la idealidad se determina por el factor de comprensibilidad Z 5
Ecuacin de Van der Waals. Ecuacin de la leccin 04: Leccin 5: Ecuacin de Redlich, ecuacin mucho mas exacta que la de van der waals y aplicable a un mayor rango de presin y temperaturas. Ecuacin de Redlich Kwong Soave, una mejora de la anterior ya que maneja una constante mas, la cual a su vez es funcin de otra constante conocida como factor acntrico para cada gas. Ecuaciones de estado de virial, se desarrollan en serie donde los coeficientes se determinan experimentalmente a partir de las relaciones PvT. Redlich- Kwong.
( Ecuacin de Redlich - Kwong - Soave ( Captulo 2 Leccin 6: ) [
) }]
Trabajo, para calcularlo en los procesos termodinmicos, es necesario expresarlo en funcin de propiedades que se puedan determinar fcilmente para un sistema particular, no es una propiedad del sistema sino una interaccin entre el sistema y los alrededores. Ecuacin de la leccin 06: Leccin 7: Procesos reversibles e irreversibles, el primero es aquel que una ve efectuada puede invertirse sin ocasionar cambios en el sistema, y el segundo corresponde a aquel que no puede invertirse sin que se generen cambios. Ecuacin de la leccin 07: 6 .
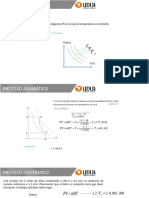
Leccin 8: Diagrama Pv, diagrama de presin contra volumen Diagramas PT, curva de presin de saturacin contra temperatura Diagramas Tv, se construyen determinando para cada temperatura los valores de las correspondientes presiones de saturacin. Diagramas PvT, representaciones tridimensionales de los valores del volumen especfico a diferentes temperaturas y presiones de una sustancia pura. Ecuacin de la leccin 8:
Leccin 9: Propiedades termodinmicas. Intensivas si no dependen de la masa del sistema y extensivas si dependen de la mas o extensin del sistema. La presin y la temperatura son propiedades intensivas, mientras que el volumen o el nmero de moles o masa son extensivos. Ecuacin de la leccin 09:
Leccin 10: Capacidad calorfica, es la cantidad de calor transferida que es capaz de modificar la temperatura en un grado, es la relacin entre el calor transferido a un sistema y la diferencia de temperatura que ocasiona. Ecuacin de la leccin 10:
Captulo 3 Leccin 11: Primera ley de la termodinmica, en sistemas cerrados, la propiedad es la energa acumulada del sistema o simplemente la energa total del sistema, es el valor neto transferido menos el trabajo neto producido es igual al cambio en la energa en el sistema para todo proceso no cclico. 7
Ecuacin de la leccin 11: Leccin 12: Entalpia, se define en funcin de la energa interna, de la presin y del volumen del sistema. Ecuacin de la leccin 12:
Leccin 13: Primera ley y reacciones qumicas. Una reaccin qumica es un proceso termodinmico que es isobrico e isotrmico. Se determina las reacciones de formacin habindose establecidos las entalpias molares para los diferentes elementos, el proceso para hallar el calor normal de formacin como el cambio de entalpia, el calor normal de reaccin y el calor normal de combustin. Ecuacin de la leccin 13:
Leccin 14: Ley de hess: si una reaccin qumica es susceptible de expresarse como una sumatoria de reacciones secuenciales, el cambio de entalpia de la reaccin es igual a la sumatoria de los cambios de entalpia en cada una de las reacciones intermedias. Ecuacin de la leccin 14:
( )
( )
Leccin 15: Calor integral de disolucin, se le denomina al cambio de entalpia cuando un mol de soluto se disuelve en n moles de solvente a una temperatura de 25C y presin de 1 atmosfera. Ecuacin de la leccin 15:
Unidad 2 Captulo 4 Leccin 16: Aplicacin de la primera ley en gases ideales. Energa interna como funcin de la temperatura, experimento de joule: la energa interna U, de un gas ideal, es funcin exclusiva de la temperatura. Ecuacin de la leccin 16: ( )
Leccin 17: Segunda ley de la termodinmica. Enunciado Kelvin Planck, establece que es imposible construir un dispositivo que funcionando en forma cclica su nico efecto sea convertir completamente en trabajo todo el calor procedente de una fuente trmica. Ecuacin de la leccin 17:
Leccin 18: El ciclo de Carnot inverso, el ciclo de Carnot produce trabajo mecnico, el contrario a este es el proceso de refrigeracin en el que sucede exactamente lo contrario, esto es, se toma calor de un foco fro, se le suministra trabajo al sistema y estas dos energas se ceden a un foco caliente. Ecuacin de la leccin 18:
Leccin 19: Entropa. Es la propiedad termodinmica que se encuentra asociada al estado de aleatoriedad de las partculas de un sistema. La Entropa est fundamentada en la necesidad que tenemos de convertir calor en trabajo y como una conclusin es imposible convertir todo el calor absorbido por el sistema en trabajo. no reemplaza 9
a las funciones termodinmicas de entalpa y energa interna anteriormente mencionadas. Ecuacin de la leccin 19: Leccin 20 Calentamiento irreversible de un sistema termodinmico. Expansin libre de un gas ideal, muestra el carcter de irreversibilidad de aquellos procesos en los cuales intervienen diferencias de presiones. Ecuacin de la leccin 20: ( )
Captulo 5 Leccin 21: La mquina de vapor, ciclo de Rankine, es una descripcin de una mquina ideal de vapor; por consiguiente, el rendimiento calculado tiene un valor mximo comparado con las mquinas que se construyen en la industria. Se compone de varios procesos en los que se interacta para calcular el rendimiento mximo de las maquinas. Ecuacin de la leccin 21:
Leccin 22: Motores de cuatro tiempos, ciclo de Otto, fue desarrollado por N.A. Otto, un ingeniero alemn, que en el ltimo tercio del siglo pasado construy la primera mquina con este tipo de motor. Ecuacin de la leccin 22: ( ) Leccin 23: Motores de ignicin por compresin, Ciclo Diesel. Se comprime el aire y en el momento de su mxima compresin se inyecta el combustible para que suceda la combustin y el pistn realice la carrera de trabajo, perfeccionado por R. Diesel, el 10
motor Diesel no tiene carburador y la inyeccin del combustible se realiza por una bomba de inyeccin. Ecuacin de la leccin 23: ( )
Leccin 24: Ciclo de Brayton, Los motores de las turbinas de gas utilizadas en plantas generadoras de corriente elctrica o en la propulsin de aeronaves funcionan mediante el ciclo de Brayton, el cual como en los ciclos estudiados anteriormente. Ecuacin de la leccin 24: ( ( ) ) ( ( ) )
Leccin 25: Maquinas frigorficas. La mquina refrigerante o frigorfica utiliza una fuente de energa externa, generalmente corriente elctrica como en el caso de una nevera o refrigerador comn, para quitar calor de una fuente fra (enfriar) y drselo a una fuente caliente. Ecuacin de la leccin 25: ( ( ) )
Captulo 6 Leccin 26: Anlisis dimensional, sistema de unidades, se utilizara el sistema internacional de unidades para el uso en ciencia y tecnologa. Leccin 27: Conservacin de masa y volumen de control. Un volumen de control es un volumen en el espacio el cual nos interesa para un anlisis y que su tamao y forma son totalmente arbitrarios y estn delimitados de la manera que mejor convenga para el anlisis por efectuar. Ecuacin de la leccin 27: ( ) 11
Leccin 28: Aplicaciones de la termodinmica a procesos de flujo estable. Las propiedades de los intercambiadores de calor, equipos muy utilizados industrialmente, que permiten realizar la transferencia de calor entre fluidos sin que haya mezcla entre ellos. Ecuacin de la leccin 28: ( )
Leccin 29: Bombas, compresores y turbinas. En estos casos el cambio de energa potencial generalmente es muy pequeo y con frecuencia se omite en los clculos. Ecuacin de la leccin 29: ( )
Leccin 30: Aplicacin de las leyes de la termodinmica a procesos de flujo transitorio, en este se presentan cambios en las propiedades del sistema con el tiempo, por otra parte, el proceso de flujo uniforme.
Ecuacin de la leccin 30:
12
CONCLUSIONES
El modulo del curso de Termodinmica se divide en dos unidades didcticas, las cuales se dividen en captulos y lecciones, facilitando el estudio y aprendizaje autnomo del estudiante, la primera hace referencia, a la ley cero, trabajo y primera ley de la Termodinmica, la segunda es sobre la segunda ley y las aplicaciones de la Termodinmica.
La ley cero de la termodinmica establece que, si estn dos cuerpos en equilibrio trmico con un tercero, los dos cuerpos se encontraran en equilibrio trmico entre si.
Para el trabajo en termodinmica, es necesario, expresarlo en funcin de propiedades que se puedan determinar para un sistema particular.
La primera ley de la termodinmica es el valor neto transferido menos el trabajo neto producido igual al cambio en la energa del sistema.
En la segunda ley de la termodinmica, segn el enunciado de Kelvin Planck, es imposible convertir en trabajo todo el calor procedente de una fuente trmica, y se desarrolla el ciclo de carnot.
13
BIBLIOGRAFA
Modulo: Termodinmica. UNAD 2009 Gua de actividades Reconocimiento del curso, Universidad Nacional Abierta y a Distancia. Mnera, R. (2009). Termodinmica. Palmira: Universidad Nacional Abierta y a Distancia.
14
Vous aimerez peut-être aussi
- 17abr Guia 10 Termo IDocument2 pages17abr Guia 10 Termo ITele RrascuachePas encore d'évaluation
- Maquinas Termicas Sesion 9Document9 pagesMaquinas Termicas Sesion 9Pacco Maberick100% (1)
- Gestion Proceso de ExportacionDocument126 pagesGestion Proceso de ExportacionJose Caviedes VargasPas encore d'évaluation
- Gestión DocumentalDocument67 pagesGestión DocumentalViviana CuartasPas encore d'évaluation
- Anexos de La Guia de ActividadesDocument11 pagesAnexos de La Guia de ActividadesalbirojoPas encore d'évaluation
- Deudas FebreroDocument2 pagesDeudas FebreroJose Caviedes VargasPas encore d'évaluation
- Anexos de La Guia de ActividadesDocument11 pagesAnexos de La Guia de ActividadesalbirojoPas encore d'évaluation
- Documento ArchivoDocument20 pagesDocumento ArchivoCharo PalominoPas encore d'évaluation
- Accion Pop Humedal CordobaDocument24 pagesAccion Pop Humedal CordobaJes Rey ParekPas encore d'évaluation
- Matem Ticas Financieras Indicadores PDFDocument1 pageMatem Ticas Financieras Indicadores PDFJose Caviedes VargasPas encore d'évaluation
- Fundición en ArenaDocument9 pagesFundición en ArenaJose Caviedes VargasPas encore d'évaluation
- Conceptos Basicos de Matematica Financiera1Document9 pagesConceptos Basicos de Matematica Financiera1Daniel Alejandro Gutierrez GonzalezPas encore d'évaluation
- Conceptos Basicos de Matematica Financiera1Document9 pagesConceptos Basicos de Matematica Financiera1Daniel Alejandro Gutierrez GonzalezPas encore d'évaluation
- Introduccion A La IngenieriaDocument4 pagesIntroduccion A La IngenieriaJose Caviedes VargasPas encore d'évaluation
- El Uso de Las Tecnicas de Analisis Financiero Como Parte de Las Funciones Del Administrador FinancieroDocument125 pagesEl Uso de Las Tecnicas de Analisis Financiero Como Parte de Las Funciones Del Administrador Financieroclaumidiaz100% (1)
- Competencias GrupalesDocument1 pageCompetencias GrupalesJose Caviedes VargasPas encore d'évaluation
- Copa ColombiaDocument1 pageCopa ColombiaJose Caviedes VargasPas encore d'évaluation
- Anexos de La Guia de ActividadesDocument12 pagesAnexos de La Guia de ActividadesAnonymous LH1JAsePas encore d'évaluation
- Sopa de LetrasDocument1 pageSopa de LetrasJose Caviedes VargasPas encore d'évaluation
- Copa ColombiaDocument1 pageCopa ColombiaJose Caviedes VargasPas encore d'évaluation
- DIEGO Clase Mundial 1Document6 pagesDIEGO Clase Mundial 1Jose Caviedes VargasPas encore d'évaluation
- Pasion y Muerte de JesusDocument8 pagesPasion y Muerte de JesusJose Caviedes VargasPas encore d'évaluation
- ArgumentoDocument1 pageArgumentoJose Caviedes VargasPas encore d'évaluation
- Texto ArgumentativoDocument1 pageTexto ArgumentativoJose Caviedes VargasPas encore d'évaluation
- Diagrama Del ProcesoDocument1 pageDiagrama Del ProcesoJose Caviedes VargasPas encore d'évaluation
- Modalidades de ExportacionDocument7 pagesModalidades de ExportacionJose Caviedes VargasPas encore d'évaluation
- Copa ColombiaDocument1 pageCopa ColombiaJose Caviedes VargasPas encore d'évaluation
- Manual EncuestadorDocument98 pagesManual EncuestadorJose Caviedes VargasPas encore d'évaluation
- EficienciaDocument1 pageEficienciaJose Caviedes VargasPas encore d'évaluation
- Guia 1 Aporte IndividualDocument7 pagesGuia 1 Aporte IndividualJose Caviedes VargasPas encore d'évaluation
- Guia 1 Aporte Individual1Document7 pagesGuia 1 Aporte Individual1Jose Caviedes VargasPas encore d'évaluation
- Evaluacion Por Proyecto - Medicion Del Trabajo - B 2011Document6 pagesEvaluacion Por Proyecto - Medicion Del Trabajo - B 2011Jose Caviedes VargasPas encore d'évaluation
- Segunda Ley TermodinamicaDocument31 pagesSegunda Ley TermodinamicaJosé MiguelPas encore d'évaluation
- Universidad Nacional Del Santa: Facultad de IngenieriaDocument10 pagesUniversidad Nacional Del Santa: Facultad de IngenieriaRoberto BocanegraPas encore d'évaluation
- Ejercicio de RefrigeradoresDocument3 pagesEjercicio de RefrigeradoresYOSVIN KEVIN GONZALES ANTICONAPas encore d'évaluation
- Práctica Segunda ParteDocument8 pagesPráctica Segunda ParteMireyra Belén L.MPas encore d'évaluation
- Ciclo de CarnotDocument3 pagesCiclo de Carnotmikei12Pas encore d'évaluation
- Ejercitario Leyes Termodinamica AgronomíaDocument5 pagesEjercitario Leyes Termodinamica AgronomíaRuth MeaurioPas encore d'évaluation
- Segunda Ley de La TermodinámicaDocument49 pagesSegunda Ley de La Termodinámicayoherr855Pas encore d'évaluation
- Exposicion Ciclos TermodinamicosDocument61 pagesExposicion Ciclos TermodinamicosJimmy Erick Luque MamaniPas encore d'évaluation
- Ciclo de CarnotDocument10 pagesCiclo de CarnotFernando GodoyPas encore d'évaluation
- 2daleydelatermodinamica Cap15Document27 pages2daleydelatermodinamica Cap15david6669999Pas encore d'évaluation
- Práctica 01 de Termodinámica II 2-2017Document4 pagesPráctica 01 de Termodinámica II 2-2017Nadia CondePas encore d'évaluation
- (Grupo - 1) Ciclo de CarnotDocument13 pages(Grupo - 1) Ciclo de CarnotAnggie Olivera NinaPas encore d'évaluation
- Unidad 3 Fisica - CiclosDocument19 pagesUnidad 3 Fisica - CiclosjoeelPas encore d'évaluation
- Cap 6 CompDocument6 pagesCap 6 CompJeff Calugullin100% (1)
- Ciclo de Carnot y AplicacionesDocument1 pageCiclo de Carnot y AplicacionesKiara LopezPas encore d'évaluation
- Guía N 1: Iet Ramón Ignacio AvellaDocument10 pagesGuía N 1: Iet Ramón Ignacio AvellaEdgar Moreno ChaparroPas encore d'évaluation
- Taller Calor 2 SeguimientoDocument23 pagesTaller Calor 2 SeguimientoDanteHelsingPas encore d'évaluation
- Ciclos TermodinamicosDocument29 pagesCiclos TermodinamicosDavid trejo TrejoPas encore d'évaluation
- Centrales Termicas Pedro Fernandez Diez 2Document40 pagesCentrales Termicas Pedro Fernandez Diez 2Daniel ComeglioPas encore d'évaluation
- 6 PDFDocument23 pages6 PDFmicardisPas encore d'évaluation
- Entrop T06Document6 pagesEntrop T06Juan Gonzalo Rose0% (1)
- 1.3 Mapa MentalDocument2 pages1.3 Mapa MentalAlexisPas encore d'évaluation
- 26 de Enero Del 2023Document29 pages26 de Enero Del 2023Ana FortunePas encore d'évaluation
- Asignacion 2 PDocument70 pagesAsignacion 2 PPatricia BalcazarPas encore d'évaluation
- NMX 034 Diagrama SolidosDocument3 pagesNMX 034 Diagrama SolidosEnedinaPas encore d'évaluation
- Dispositivos de IngenieraDocument23 pagesDispositivos de IngenieraMonicaPas encore d'évaluation
- Balotario Termo 3 PDFDocument2 pagesBalotario Termo 3 PDFRonaldo Nuñez CaluaPas encore d'évaluation