Académique Documents
Professionnel Documents
Culture Documents
Balance Térmico y Entropía
Transféré par
Fernando Sierra PinedaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Balance Térmico y Entropía
Transféré par
Fernando Sierra PinedaDroits d'auteur :
Formats disponibles
BALANCE TRMICO Y ENTROPA Universidad de Crdoba - Facultad de Ingenieras - Programa de Ingeniera de Alimentos Fisicoqumica -Berstegui, Crdoba, Colombia.
Docente: Ing. Qumico Ramiro Torres Gallo Domnguez Yina, Llorente Jorge, Rincn Alexander, Sierra Fernando
RESUMEN La entropa es una propiedad termodinmica en la cual se basa la segunda ley de la termodinmica, esta se puede calcular a travs de datos experimentales obtenidos a partir del montaje en un calormetro que contenga una mezcla de agua y nctar donde cada uno de los componentes de esta mezcla se encuentra a distintas temperaturas, para posteriormente obtener la temperatura de equilibrio a la cual se encuentra el sistema, previo a esto es necesaria la calibracin del calormetro para la adquisicin de resultados confiables. Palabras claves: Entropa, temperatura de equilibrio.
ABSTRACT Entropy is a thermodynamic property which is based on the second law of thermodynamics, this can be calculated through the experimental data obtained from the assembly in a calorimeter containing a mixture of water and nectar where each of the components this mixture is at different temperatures, and subsequently obtain the equilibrium temperature at which the system is located, ie prior to the calorimeter calibration required for the acquisition of reliable results. Keywords: Entropy, temperature balance. OBJETIVOS Comprender el concepto de entropa. Relacionar ciertas leyes termodinmicas con sistemas reales. Determinar la variacin de entropa en un proceso reversible. 1
INTRODUCCIN La primera ley permite establecer una relacin entre el calor y el trabajo y definir una importante propiedad termodinmica como es la energa. La determinacin de los cambios de energa en procesos que ocurren en sistemas cerrados ser objeto de estudio en este artculo. El balance energtico en todos los procesos qumicos, biolgicos, ambientales o industriales se fundamenta en la primera ley de la termodinmica. La primera ley de la termodinmica da una definicin precisa del calor, otro concepto de uso corriente. Cuando un sistema se pone en contacto con otro ms fro que l, tiene lugar un proceso de igualacin de las temperaturas de ambos. Para explicar este fenmeno, los cientficos del siglo XVIII conjeturaron que una sustancia que estaba presente en mayor cantidad en el cuerpo de mayor temperatura flua hacia el cuerpo de menor temperatura. Segn se crea, esta sustancia hipottica llamada calrico era un fluido capaz de atravesar los medios materiales. Por el contrario, el primer principio de la termodinmica identifica el calor, como una forma de energa. Se puede convertir en trabajo mecnico y almacenarse, pero no es una sustancia material. Experimentalmente se demostr que el calor y el trabajo o energa, medidos en julios, eran completamente equivalentes. El primer principio es una ley de conservacin de la energa. Afirma que, como la energa no puede crearse ni destruirse la cantidad de energa transferida a un sistema en forma de calor ms la cantidad de energa transferida en forma de trabajo sobre el sistema debe ser igual al aumento de la energa interna del sistema. El calor y el trabajo son mecanismos por los que los sistemas intercambian energa entre s. Otro concepto que clave es la entalpia que se define como la cantidad de energa que un sistema termodinmico puede intercambiar con su entorno. Por ejemplo, en una reaccin qumica a presin constante, el cambio de entalpa del sistema es el calor absorbido o desprendido en la reaccin. En un simple cambio de temperatura, el cambio de entalpa por cada grado de variacin corresponde a la capacidad calorfica del sistema a presin constante. FUNDAMENTO TERICO Atendiendo a la ley cero de la termodinmica si se ponen en contacto dos cuerpos con distinta temperatura, se anticipa que eventualmente el cuerpo caliente se enfriar, y el cuerpo fro se calentar, hasta llegar a un equilibrio trmico, como se nota en la figura 1.
Para este caso la condicin de balance trmico exige que el calor perdido por uno de los cuerpos debe ser igual al calor ganado por el otro as: (1) La primera ley de la termodinmica permite relacionar este intercambio de calor en funcin de entalpa (H) donde la variacin de sta permite expresar la cantidad de calor cedido o recibido durante una transformacin isobrica en un sistema termodinmico, transformacin en el curso de la cual se puede recibir o aportar energa. Es en tal sentido que la entalpa es numricamente igual al calor intercambiado entre los sistema en cuestin. (2) Puesto que la variacin de entalpa se relaciona con el cambio de temperatura, (3), Reemplazando (3) en (2), tenemos: (4) Los cuerpos en cuestin poseen masa, en tanto: (5) En termodinmica, la entropa (simbolizada como S) es una magnitud fsica que permite,
mediante clculo, determinar la parte de la energa que no puede utilizarse para producir trabajo. Es una funcin de estado de carcter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se d de forma natural. Mirado desde otro punto de vista, y para una comprensin y aplicacin ms general del concepto, la entropa se entiende como el grado de desorden de un sistema, 3
Este desorden se grafica en la mayor o menor produccin de energa disponible o no disponible, y sobre esta base, tambin podemos definir la entropa como el ndice de la cantidad de energa no disponible en un sistema termodinmico dado en un momento de su evolucin. Como podemos apreciar, la entropa es el elemento esencial que aporta la termodinmica, ciencia de los procesos irreversibles, es decir orientados en el tiempo.
La segunda ley de la termodinmica. Se puede enunciar de muchas formas, pero una sencilla y precisa es la siguiente: La evolucin espontnea de un sistema aislado se traduce siempre en un aumento de su entropa. Por tanto esta ley se basa en el trmino de entropa el cual fue introducido por el fsico alemn Rudolf J. E. Clausius en 1850 para representar el grado de uniformidad con el que est distribuida la energa, sea sta del tipo que sea. Se aplican las relaciones de eficiencia (ecuacin de Nernst), conceptos de Rudolf J. y E. Clausius para obtener una expresin del tipo:
La cual se puede expresar en funcin de H, para un proceso a presin constante, asi:
Esta ecuacin tiene aplicacin para transiciones de fase como la fusin, sublimacin y vaporizacin, sin embargo para un sistema donde la temperatura del sistema se modifica es conveniente hallar una expresin ms adecuada para S. 4
Usando la relacin
= m Cp T, resulta:
Integrando la expresin: (6)
La variacin de la entropa de sustancias en interaccin es: (7) Para calcular el cambio de entropa. MATERIALES Y REACTIVOS
Calormetro Balanza analtica Agitador Termmetro Beacker Estufa Probeta Nctar Agua destilada PROCEDIMIENTO Seguir los siguientes procesos secuenciales Calibrar el calormetro adicionando en un beacker 100mL de agua destilada, incorporar al calormetro y posteriormente medir la temperatura de esta. Calentar en estufa 100mL de agua destilada, tomar su temperatura y a continuacin verterlos en el beacker que se encuentra dentro del calormetro. 5
Medir la temperatura cada 30 segundos hasta que se equilibre. Pesar 100g de agua destilada, medir la temperatura inicial de esta. Adicionar en el calormetro. Pesar los gramos correspondientes de nctar. Calentar el nctar moderadamente hasta que esta alcance los 80C. Verter el nctar sobre el agua que se encuentra en el calormetro. Agitar continuamente y realizar lecturas de temperatura cada 30 segundos hasta que esta sea constante. CALCULOS 1. Temperatura de equilibrio ( 2. Entropa del nctar ( ) 3. Entropa del agua ( ) 4. Entropa total ( ) ) ( ) ( )
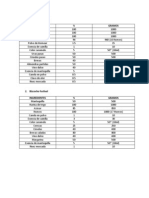
DATOS Temp. del agua Temp. del nctar Temp. de equilibrio
CUESTIONARIO 1. Con el calor especifico del nctar y el agua calcule la entropa de ambas sustancias y la total del sistema. 2. Calcule la temperatura de equilibrio y comprela con la obtenida experimentalmente, calcule el porcentaje de error entre estas, con la temperatura obtenida recalcule porcentaje de error las entropas. A que se deben estas diferencias? 3. Por qu no es posible calcular la entropa mxima de un sistema? 4. Consulte si existe un instrumento para medir la variacin de entropa de un sistema e indique como funciona. 5. Qu aplicaciones tiene la determinacin de la entropa en la ingeniera de alimentos? Existe algn mtodo para calcularla rpidamente o instrumento para hacerlo? S y calcule el
BIBLIOGRAFIA VAN NESS SMITH, Abbot. Introduccin a la termodinmica en la ingeniera qumica. Mxico. Mc Graw Hill, 1997. s3.amazonaws.com/lcp/clasegeo/.../problemas-de-ENTROPIA.doc http://books.google.com.co/books?id=SwFsXNChbmAC&pg=SA14-PA8&lpg=SA14PA8&dq=porque+no+es+posible+calcular+la+%22entropia+maxima%22+de+un+sistema&s ource=bl&ots=cgjNJYmP5z&sig=YhobOMVSGfGwFeGXGJtBtCpcGxA&hl=es&ei=1O3uTLybB oaBlAeK2u3dDA&sa=X&oi=book_result&ct=result&resnum=5&ved=0CC4Q6AEwBA#v=one page&q&f=false Cengel, y; Boles, M.A.(1996) termodinmica, Tomo I segunda edicin. Mc Graw Hill interamericana de Mxico, S.A. de Mxico.
Vous aimerez peut-être aussi
- Laboratori of RutasDocument30 pagesLaboratori of RutasFernando Sierra PinedaPas encore d'évaluation
- Info YogurtDocument20 pagesInfo YogurtFernando Sierra PinedaPas encore d'évaluation
- Iso 22000Document23 pagesIso 22000Fernando Sierra PinedaPas encore d'évaluation
- Iso 22000Document46 pagesIso 22000Fernando Sierra PinedaPas encore d'évaluation
- Transformaciones de La Proteína CárnicaDocument5 pagesTransformaciones de La Proteína CárnicaFernando Sierra PinedaPas encore d'évaluation
- Final No Reviso Mas NadaDocument18 pagesFinal No Reviso Mas NadaFernando Sierra PinedaPas encore d'évaluation
- Intercambiador de PlacasDocument6 pagesIntercambiador de PlacasFernando Sierra PinedaPas encore d'évaluation
- Intercambiador de PlacasDocument6 pagesIntercambiador de PlacasFernando Sierra PinedaPas encore d'évaluation
- Guia de ClacioDocument4 pagesGuia de ClacioFernando Sierra PinedaPas encore d'évaluation
- AntocianinaDocument7 pagesAntocianinaFernando Sierra PinedaPas encore d'évaluation
- Trabajo Riesgos Ergonómicos, Locativos y PsicosocialesDocument16 pagesTrabajo Riesgos Ergonómicos, Locativos y PsicosocialesFernando Sierra PinedaPas encore d'évaluation
- Bases Bioquimicas de NutriciónDocument25 pagesBases Bioquimicas de NutriciónFernando Sierra PinedaPas encore d'évaluation
- Cartas de HeislerDocument4 pagesCartas de HeislerFernando Sierra PinedaPas encore d'évaluation
- BROMATOLOGIA2011Document36 pagesBROMATOLOGIA2011Fernando Sierra PinedaPas encore d'évaluation
- LeitholdDocument1 383 pagesLeitholdsethokiba67% (3)
- .Estudio de La Influencia de La Concentración en La Retención de Vitamina C en Jugo FrescoDocument7 pages.Estudio de La Influencia de La Concentración en La Retención de Vitamina C en Jugo FrescoDarwin PintoPas encore d'évaluation
- Resumen SeminariosDocument21 pagesResumen SeminariosFernando Sierra PinedaPas encore d'évaluation
- Ensayo de Materias PrimasDocument2 pagesEnsayo de Materias PrimasFernando Sierra Pineda100% (1)
- El Sector de Bebidas en ColombiaDocument6 pagesEl Sector de Bebidas en ColombiaFernando Sierra PinedaPas encore d'évaluation
- Aislante de MarmitaDocument12 pagesAislante de MarmitaFernando Sierra PinedaPas encore d'évaluation
- Registro Fotográfico TortasDocument1 pageRegistro Fotográfico TortasFernando Sierra PinedaPas encore d'évaluation
- FundamentosdeMacroeconomia Secc6y7 PabloQuerubin 200510Document4 pagesFundamentosdeMacroeconomia Secc6y7 PabloQuerubin 200510Fernando Sierra PinedaPas encore d'évaluation
- Seminario BebidasssssssssssssssDocument52 pagesSeminario BebidasssssssssssssssFernando Sierra PinedaPas encore d'évaluation
- Alterna RiaDocument1 pageAlterna RiaFernando Sierra PinedaPas encore d'évaluation
- Balance de MateriaDocument22 pagesBalance de MateriaCarlos Sarmiento75% (8)
- Formulaciones y RecetasDocument2 pagesFormulaciones y RecetasFernando Sierra PinedaPas encore d'évaluation
- Info TorTASDocument3 pagesInfo TorTASFernando Sierra PinedaPas encore d'évaluation
- Tecnología de Envasado y Conservación de AlimentosDocument11 pagesTecnología de Envasado y Conservación de AlimentosjlaboratPas encore d'évaluation
- Diapositivas Seminario de CerealesDocument37 pagesDiapositivas Seminario de CerealesFernando Sierra PinedaPas encore d'évaluation
- Analisis Microbiologico de Los Alimentos Vol IDocument175 pagesAnalisis Microbiologico de Los Alimentos Vol ILeonardo P. LuengasPas encore d'évaluation
- Ex 1Document6 pagesEx 1Jose Ayala QuispePas encore d'évaluation
- DISCONTINUIDADES EN LAS INSPECCIONES VISUALES Jhon NestielDocument3 pagesDISCONTINUIDADES EN LAS INSPECCIONES VISUALES Jhon NestielAndres NestielPas encore d'évaluation
- Teoria General de Los SistemaDocument4 pagesTeoria General de Los Sistemadarley paola benitez bertelPas encore d'évaluation
- Guia Bomba MotorDocument14 pagesGuia Bomba MotorJose carlosPas encore d'évaluation
- Valvulas Agua PotableDocument6 pagesValvulas Agua PotableNILDER DIAZ VASQUEZPas encore d'évaluation
- Seminario Bomba vp44Document91 pagesSeminario Bomba vp44Elkin1501Pas encore d'évaluation
- 2019 Manual de Falhas Prematuras Componentes de Motor - Pt.es PDFDocument87 pages2019 Manual de Falhas Prematuras Componentes de Motor - Pt.es PDFJUAN ERNESTO BETANCUR OSORIOPas encore d'évaluation
- Evp CongDocument8 pagesEvp CongEdd CruzPas encore d'évaluation
- Proyecto de MecanicaDocument10 pagesProyecto de MecanicaFidel Jose Muñoz CedeñoPas encore d'évaluation
- Parcial - Escenario 4 Procesos IndustrialesDocument8 pagesParcial - Escenario 4 Procesos Industrialespaula daniela goyeneche gilPas encore d'évaluation
- Comprensor PDFDocument5 pagesComprensor PDFOscar QuinteroPas encore d'évaluation
- Elite Soldadura v4 5 2Document28 pagesElite Soldadura v4 5 2Yovany Diaz RiveraPas encore d'évaluation
- 06 Análisis Exergo-Económico de Una Micro-Turbina de Gas, CIM 2020Document11 pages06 Análisis Exergo-Económico de Una Micro-Turbina de Gas, CIM 2020Helen D. Lugo MéndezPas encore d'évaluation
- El Momento de Una Fuerza para Primero de SecundariaDocument5 pagesEl Momento de Una Fuerza para Primero de SecundariaJean VillafuertePas encore d'évaluation
- Tipos de Roscas - Rosca BSP o Rosca - Gas - Productos - Blog - RMMCIADocument3 pagesTipos de Roscas - Rosca BSP o Rosca - Gas - Productos - Blog - RMMCIAjesusPas encore d'évaluation
- Diapositivas DinámicaDocument75 pagesDiapositivas DinámicaEnriquez IvanPas encore d'évaluation
- Practica de Fisica PDFDocument81 pagesPractica de Fisica PDFAlex Curosaki100% (2)
- Teorias - Capítulo 3 - 2020 FinalDocument31 pagesTeorias - Capítulo 3 - 2020 FinalErison BeltranPas encore d'évaluation
- Teorías y Criterios de Falla Por Cargas EstáticasDocument34 pagesTeorías y Criterios de Falla Por Cargas EstáticasMech JosePas encore d'évaluation
- Practica 5-1 Ley de BoyleDocument3 pagesPractica 5-1 Ley de Boyleulises rhoadsPas encore d'évaluation
- P-3 FundamentosDocument9 pagesP-3 FundamentosMarifer garcia ortizPas encore d'évaluation
- DinámicaDocument7 pagesDinámicaSimon Olivares MorelPas encore d'évaluation
- Infra 302 604Document24 pagesInfra 302 604enrique8herrera-10Pas encore d'évaluation
- Movimiento Curvilineo PDFDocument28 pagesMovimiento Curvilineo PDFSharon GoldsteinPas encore d'évaluation
- Codigo de Colores de Gases MedicinalesDocument6 pagesCodigo de Colores de Gases MedicinalesInge-cap Ltda100% (1)
- Inercia RotacionalDocument5 pagesInercia Rotacionalurrutia9Pas encore d'évaluation
- Cafetera FUTURMAT-MAN-IT4-PEZZI-2009Document21 pagesCafetera FUTURMAT-MAN-IT4-PEZZI-2009cbsomohanoPas encore d'évaluation
- FT - Efi.5 EsDocument4 pagesFT - Efi.5 EsDaniel RoseroPas encore d'évaluation
- Generación de VaporDocument18 pagesGeneración de VaporRicardo Rafael EnsunchoPas encore d'évaluation
- Matus Cortes - Jose Norberto - Proyecto Final Ts Fisica - 507Document19 pagesMatus Cortes - Jose Norberto - Proyecto Final Ts Fisica - 507José YFPas encore d'évaluation