Académique Documents
Professionnel Documents
Culture Documents
Informe I Quimica Soluciones
Transféré par
Cedrick ReyesCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Informe I Quimica Soluciones
Transféré par
Cedrick ReyesDroits d'auteur :
Formats disponibles
AO DEL CENTENARIO DE MACCHUPICHU PARA EL MUNDO
FACULTAD DE INGENIERIA DE MINAS, GEOLOGIA Y METALURGIA
CURSO TEMA DOCENTE ALUMNA
: QUIMICA GENERAL II : SOLUCIONES : Ing. Maguia Valverde : Palomino Tamariz Estefany Fiorela
HUARAZ, 2011
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
SOLUCIONES
I.- OBJETIVO:
1.1. OBJETIVO GENERAL Aprender a preparar soluciones Preparar soluciones de diferentes concentraciones 1.2. OBJETIVOS ESPECIFICOS Requerir a las formulas de molaridad y otros para hallar la cantidad de soluto necesario para la solucin.
III.- FUNDAMENTO TEORICO
Una solucin es un sistema disperso y puede definirse como la mezcla homognea de molculas, tomos o iones de dos o ms sustancias diferentes que dentro de ciertos lmites tiene una composicin que puede variar. A la cantidad de soluto disuelta a una determinada cantidad de disolvente o de solucin se le conoce con el nombre de concentracin. Esta concentracin puede expresarse en diversas formas: FRACCION MOLAR (Xs, Xd): Es la relacin entre el nmero de moles de soluto (o disolvente) y el total de nmero de moles de todos los componentes en la solucin. MOLALIDAD (m): Nmero de moles del soluto disuelto en 1 kilogramo de disolvente. MOLARIDAD (M): Nmero de moles de soluto disuelto en un 1 L de solucin. NORMALIDAD (N): Nmero de equivalentes-gramo de soluto contenidos en 1 litro de solucin. PORCENTAJE EN PESO (%): Es la relacin de la masa del soluto entre la masa total de la solucin expresada en porcentaje o dicho de otro modo es la cantidad de gramos de soluto que hay en 100 gramos de solucin.
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
Para determinar la concentracin de una solucin desconocida se utiliza una segunda solucin de concentracin conocida, que al mezclarse con la primera, experimenta una reaccin qumica especfica y de estequiometria tambin conocida. La solucin de concentracin conocida se llama solucin valorada. El proceso se denomina valoracin o titulacin. En la determinacin de la concentracin desconocida de un acido se utiliza una base de concentracin conocida. En la determinacin de la concentracin desconocida de una base se utiliza un acido de concentracin conocida que se denomina alcalimetra o acidimetra respectivamente. En la reaccin de neutralizacin, los iones hidrogeno provenientes del acido y los iones hidrxido de la base reaccionan formando agua. HCl + NaOH H2O + NaCl H2O(l) + Na+(ac) +Cl-(ac)
H+(ac) + Cl-(ac) +Na+(ac) + OH-(ac)
Los iones del acido y los cationes de la base son iones espectadores, la reaccin neta: H+(ac) + OH-(ac) H2O(l) Cuando se han mezclado cantidades estequiometricamente equivalentes de cido y de base se dice que se llega al punto de equivalencia de la titulacin. En el punto de equivalencia el N de Eq-g de H debe ser igual al N de Eq-g de OH. Una de las formas de determinar cundo se ha llegado al punto de equivalencia de una titulacin acido - base es utilizado un reactivo indicador, que tiene distinto color en solucin acida o en solucin bsica. El cambio de color indica que toda la solucin o problema se ha neutralizado y marca el punto final de la valoracin. Una unidad de concentracin muy til en clculos volumtrico, es la normalidad que empela el concepto de equivalente-gramo. La concentracin normal depende de la reaccin en particular y es necesario especificar dicha reaccin. En el caso de reacciones de neutralizacin como el numero de equivalentes - gramo del acido y la base son iguales se desprende que: NaVa = NbVb .
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
Principales formulas: Frmula % en Volumen: %V =
( )
Frmula partes por milln: PPM = Frmula para la molaridad (M): =
( ( ) )
(
( ) )
Frmula para la normalidad (N): N=Mx
III.- MATERIALES Y REACCTIVOS
Vaso de precipitados Fiola Bagueta Balanza analtica Piscesta cido oxlico ( ) Yoduro de potasio ( KI ) ] Hidrxido de sodio [ Permanganato de potasio[ [ ] [ ] [ ] Esptula Envases Agua destilada
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
IV.- PROCEDIMIENTO Experimento N 1
Preparar una solucin de KI Datos: [ ] = 0.5M
V=250ml , m = 20.75 gr
1. Con los datos sealados hallaremos la cantidad de soluto en gramos que 2. 3. 4. 5.
se requiere para preparar la solucin. Con la ayuda de la esptula cogemos un poco de KI para pesarla. Luego depositarla en un vaso de precipitado. Disolver con agua destilada aproximadamente. Disolver completamente el soluto agitando con la bagueta. Con la ayuda de un embudo trasvasar la solucin a una fiola de 250 ml, lavar repetidas veces el vaso de precipitado con pequeas porciones de agua que se pasan a la fiola. Complete con agua destilada hasta la lnea de aforo de la fiola. Homogenizar, etiquetar y guardar.
6. 7.
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
Experimento N 2
Preparar una solucin de cido Oxlico ( ] = 0.33M Datos: [ , V=250 1. 2. 3. 4. 5. ) , m = 10,395 gr
6. 7.
Con los datos sealados hallaremos la cantidad de soluto en gramos que se requiere para preparar la solucin. Con la ayuda de la esptula cogemos un poco de KI para pesarla. Luego depositarla en un vaso de precipitado. Disolver con agua destilada aproximadamente. Disolver completamente el soluto agitando con la bagueta. Con la ayuda de un embudo trasvasar la solucin a una fiola de 250 ml, lavar repetidas veces el vaso de precipitado con pequeas porciones de agua que se pasan a la fiola. Complete con agua destilada hasta la lnea de aforo de la fiola. Homogenizar, etiquetar y guardar.
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
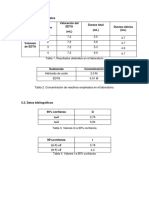
V.- CALCULOS Y/O RESULTADOS
= 1.- [ ] = 1M V= 1 Litro 1 = m = 40 gr 2.- [ ] = 1M V= 1 Litro = m = 35.5 gr 3.- [ ] = 0.5 M V= 250 ml = m = 20.75 gr 4.- [ ] = 0.1 M V= 250 ml = m = 4.1 gr
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
5.- [
] = 0.5 M
V= 250 = m = 19.75 gr
6.- [
] = 0.33 M
V= 250 = m = 10,395 gr
7.- [
] = 6M
V=250 6 = m = 76.5 gr
VI.- CONCLUSIONES
Para preparar una solucin necesitamos saber cuanto de soluto en peso se debe utilizar en dicha solucin.
VII.- RECOMENDACIONES Se recomienda devolver a su lugar los reactivos utilizados en la prctica.
Los instrumentos utilizados devolverlos limpios.
VIII.- BIBLIOGRAFIA
Manual de laboratorio (Qumica General) cuarta edicin http//: WWW. Wikipedia/soluciones.com
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
ANEXOS
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
QUIMICA GENERAL II
UNIVERSIDAD NACIONAL SANTIAGO ANTUNEZ DE MAYOLO
QUIMICA GENERAL II
Vous aimerez peut-être aussi
- Catalogo Camión MineroDocument24 pagesCatalogo Camión MineroCedrick ReyesPas encore d'évaluation
- Taludes en RocaDocument8 pagesTaludes en RocaMerymoon05Pas encore d'évaluation
- VARIOGRAMADocument99 pagesVARIOGRAMARoii Royy100% (2)
- CartografiaDocument12 pagesCartografiaCedrick ReyesPas encore d'évaluation
- EIADocument41 pagesEIACedrick ReyesPas encore d'évaluation
- Calculo de VolumenesDocument20 pagesCalculo de VolumenesTheodore JonesPas encore d'évaluation
- Conceptos de GeodesiaDocument9 pagesConceptos de GeodesiaAmeli Barrenechea VargasPas encore d'évaluation
- CovarianzaDocument11 pagesCovarianzaCedrick ReyesPas encore d'évaluation
- Geologia de Minas - Examenes 2007 - IIDocument23 pagesGeologia de Minas - Examenes 2007 - IIleon chavez orlando yoberPas encore d'évaluation
- DISEÑO DE UNA MALLA DE PERFORACIÓN EN MINERÍA SUBTERRÁNEA - Parte 2Document119 pagesDISEÑO DE UNA MALLA DE PERFORACIÓN EN MINERÍA SUBTERRÁNEA - Parte 2Javier Rodriguez86% (7)
- GeotecniaDocument2 pagesGeotecniaCedrick ReyesPas encore d'évaluation
- Cogars PigarsDocument49 pagesCogars PigarsCedrick ReyesPas encore d'évaluation
- Diseño de Una Malla de Perforación en Minería SubterraneaDocument26 pagesDiseño de Una Malla de Perforación en Minería SubterraneaCedrick Reyes85% (13)
- Sondeos Geotecnicos Calicatas PDFDocument8 pagesSondeos Geotecnicos Calicatas PDFDanny SullcaccoriPas encore d'évaluation
- Sondeo GeotécnicoDocument2 pagesSondeo GeotécnicoCedrick ReyesPas encore d'évaluation
- Optimizacion Deventilacion Minera RauraDocument28 pagesOptimizacion Deventilacion Minera RauraCastillo PercyPas encore d'évaluation
- VentilacionDocument4 pagesVentilacionCedrick ReyesPas encore d'évaluation
- El SolDocument8 pagesEl SolCedrick ReyesPas encore d'évaluation
- Manual Ventsim Español Ver. 3.0 PDFDocument287 pagesManual Ventsim Español Ver. 3.0 PDFDaniel Lagos HernandezPas encore d'évaluation
- Informe de Pruebas MetalúrgicasDocument15 pagesInforme de Pruebas MetalúrgicasCedrick Reyes100% (1)
- Muestre Por PuntosDocument4 pagesMuestre Por PuntosCedrick ReyesPas encore d'évaluation
- Manual Ventsim Español Ver. 3.0 PDFDocument287 pagesManual Ventsim Español Ver. 3.0 PDFDaniel Lagos HernandezPas encore d'évaluation
- Minería Ilegal en Perú 2.Document3 pagesMinería Ilegal en Perú 2.Cedrick ReyesPas encore d'évaluation
- Cambio Climatic oDocument38 pagesCambio Climatic oAracely MAPas encore d'évaluation
- Minería en SuperficieDocument1 pageMinería en SuperficieCedrick ReyesPas encore d'évaluation
- Glosario de Terminos MinerosDocument3 pagesGlosario de Terminos MinerosCedrick ReyesPas encore d'évaluation
- Terminos en MineriaDocument7 pagesTerminos en MineriaCedrick ReyesPas encore d'évaluation
- Diccionario MineroDocument168 pagesDiccionario MineroIsaac NaviaPas encore d'évaluation
- EstadisticaDocument10 pagesEstadisticaCedrick ReyesPas encore d'évaluation
- Mina SubterráneaDocument2 pagesMina SubterráneaCedrick ReyesPas encore d'évaluation
- Rodamientos y ChumacerasDocument47 pagesRodamientos y ChumacerasLu ZugherPas encore d'évaluation
- Fallas y Soluciones en Albañilería ConfinadaDocument2 pagesFallas y Soluciones en Albañilería ConfinadaBenjamin100% (4)
- Instalacion de TinasDocument19 pagesInstalacion de TinasJohn Rodrigo Oscco PomaPas encore d'évaluation
- Diagrama de Fases para Mezclas de Líquidos Parcialmente MisciblesDocument5 pagesDiagrama de Fases para Mezclas de Líquidos Parcialmente MisciblesDavidPas encore d'évaluation
- Ejercicios GrooverDocument7 pagesEjercicios GrooverAldair DoriaPas encore d'évaluation
- Hoek BrownDocument8 pagesHoek BrownrafaelbernaolaPas encore d'évaluation
- FisicaNet - Problema N° 2 de Trabajo, Energía y Potencia. TP04 (Física)Document1 pageFisicaNet - Problema N° 2 de Trabajo, Energía y Potencia. TP04 (Física)Moises Francisco Rengel AcevedoPas encore d'évaluation
- Mecanica de Suelos Aplicada: Ensayo C.B.RDocument18 pagesMecanica de Suelos Aplicada: Ensayo C.B.RJorge Luis Huaman ParionaPas encore d'évaluation
- FundacionesDocument10 pagesFundacionesnicoroma02Pas encore d'évaluation
- Separación ElectrostáticaDocument19 pagesSeparación ElectrostáticaJr ColmenaresPas encore d'évaluation
- Fuerza EstáticaDocument27 pagesFuerza EstáticaRaul Victor Velasquez JaquePas encore d'évaluation
- TamizadoDocument17 pagesTamizadoRichard LennonPas encore d'évaluation
- Cargas Directas Y Remotas: Ilustración 2. Sección TransversalDocument2 pagesCargas Directas Y Remotas: Ilustración 2. Sección TransversalJuan Pablo Jaramillo MesaPas encore d'évaluation
- Diagrama de InteraccionDocument21 pagesDiagrama de InteraccionLuis Vazquez100% (1)
- Tesis Perfiles Conformados Frio EurocodigoDocument164 pagesTesis Perfiles Conformados Frio EurocodigoRaul Bedoya HerediaPas encore d'évaluation
- Estructuras Metalicas Tp2Document12 pagesEstructuras Metalicas Tp2Pablo Gabriel MartinezPas encore d'évaluation
- Practica de SulfatoDocument6 pagesPractica de SulfatoFernando GarciaPas encore d'évaluation
- LAB N°3 Principio de Arquimedes - F3 2019 Ciclo 1 MarzoDocument9 pagesLAB N°3 Principio de Arquimedes - F3 2019 Ciclo 1 MarzoeduardoPas encore d'évaluation
- Actividad 1, Mapa ConceptualDocument1 pageActividad 1, Mapa ConceptualBryhan DharioPas encore d'évaluation
- Curso de Fibra de Vidrio Plásticos y ResinasDocument28 pagesCurso de Fibra de Vidrio Plásticos y ResinasVictor Pasion100% (3)
- Impermeabilización de CubiertasDocument1 pageImpermeabilización de CubiertasMarina Prieto CastielloPas encore d'évaluation
- 4555Document7 pages4555Jhonn Willians Huamani CatañedaPas encore d'évaluation
- Determinación de La Dureza Del AguaDocument9 pagesDeterminación de La Dureza Del AguaAnonymous 28dbytPas encore d'évaluation
- 2 Conservacion de La Energia (Problemas de Prã Ctica)Document1 page2 Conservacion de La Energia (Problemas de Prã Ctica)Alexis Omar Manzanilla TajerPas encore d'évaluation
- Concentraciones QuímicasDocument8 pagesConcentraciones QuímicasJoss RblesPas encore d'évaluation
- Libro-Clínico-Implantes NeO - MAILDocument116 pagesLibro-Clínico-Implantes NeO - MAILDiana Carvajal ManriquePas encore d'évaluation
- Manual AgitadoresDocument26 pagesManual Agitadoressanti100% (3)
- Ejercicios Resueltos QuímicaDocument7 pagesEjercicios Resueltos QuímicaRoberto Alfonso Diaz PerezPas encore d'évaluation
- Lab 08Document20 pagesLab 08Gean CarlosPas encore d'évaluation
- Demarcacion de PavimentoDocument11 pagesDemarcacion de PavimentoJonathan JimenezPas encore d'évaluation