Académique Documents
Professionnel Documents
Culture Documents
Termodinamica Aplicada
Transféré par
Maria SoaresDescription originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Termodinamica Aplicada
Transféré par
Maria SoaresDroits d'auteur :
Formats disponibles
Termodinmica Aplicada a EQ I
Prof. Dr. Marlus Rolemberg
Departamento de Tecnologia Qumica
Centro de cincia Exatas e Tecnologia
Universidade Federal do Maranho
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 2
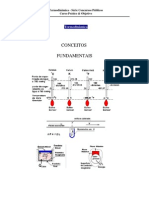
Conceitos preliminares (1)
Universo
Sistema (aberto, fechado)
Vizinhana
Fronteira
Propriedades de estado: caraterizam um sistema. Extensivas ou
intensivas
Estado termodinmico de um sistema:
condio termodinmicas do sistema em determinado momento
(propriedades intensivas)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 3
Conceitos preliminares (2)
Processo
Mudana ocorrida em um sistema que vai de um estado
termodinmico a outro. Algumas propriedades variam
Processos adiabticos, isotrmico, isobrico, isocrico
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 4
Conceitos preliminares (3)
Funes de estado
Propriedades que no dependem do processo (temperatura,
presso, entalpia, energia interna)
Funes de caminho
Grandezas que dependem do `caminho` durante o processo
(calor, trabalho)
Fases de um sistema
Caracterizada por uma estrutura fsica e composio uniforme
No caraterstica de apenas um estado fsico (lquido, slido,
gs) ou de uma substncia simples
Fora de atrao entre molculas caracteriza o estado fsico
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 5
Conceitos preliminares (4)
Fases de um sistema (cont.)
Slido cristalino: arranjo espacial peridico (Diamante x grafite)
Duas substncias podem formar mais de uma fase
Fases separadas por uma fronteira de fases
Mais de uma fase existe Equilbrio de fases
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 6
Conceitos preliminares (5)
Escalas de volume utilizadas nas abordagens
Macroscpica: sistemas/propriedades observadas no cotidiano
Microscpica: elemento diferencial de volume (no visvel a olho
nu`)
Propriedades permanecem uniforme nas escalas acima
Molecular: tomo e molculas
Sistemas de unidades utilizado: SI
Cuidado nas tranformaes e anlise dimensional dos problemas !!
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 7
Propriedades mensurveis (1)
Volume (extensivo ou intensivo)
Relacionado com tamanho do sistema
Propriedade torna-se intensiva dividindo-se pelo nmero total de
moles do sistema ou pela massa
Se a quantidade variar ao longo do sistema (sistema aberto)
definir volume de controle (balano microscpico):
n
V
v =
1
= =
m
V
v
|
.
|
\
|
=
n
V
v
V V '
lim
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 8
Propriedades mensurveis (2)
Temperatura
Grau de aquecimentodo sistema
Calor: energia em trnsito. Energia transferida do mais quente
para o mais frio at o equilbrio
Dois corpos em contato sem fluxo de calor: mesma T (lei zeroda
termodinmica
Dois corpos com mesmo grau de aquecimento que um terceiro
corpo: Todos esto na emsma T (princpio para medida de
temperatura
Nvel molecular: temperatura proporcional energia cintica
mdia das molculas (e no slido???)
Zero absoluto: sem energia cintica molecular
molecular
k
e V m T = ~
2
2
1
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 9
Propriedades mensurveis (3)
Temperatura (cont.)
Lquido-vapor: escape das molculas com maior energia cintica
Fluxo de calor: transferncia da energia cintica (ex: dois slidos
em contato)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 10
Propriedades mensurveis (4)
Temperatura (cont.)
Escalas de temperatura
| | ( ) | | K T R T 5 9 =
| | | | 15 , 273 + = C T K T
| | | | 67 , 495 + = F T R T
| | ( ) | | 32 5 9 + = C T F T
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 11
Propriedades mensurveis (5)
Presso
Fora por unidade de rea que exercida na fronteira do sistema
Resultado da variao do momento das molculaq que atingem
fronteira
( )
=
(
=
N
i
z
dt
V m d
A
P
1
1
Existe relao entre T e P?
Existe relao entre P e quantidade
da substncia?
Princpio da refrigerao
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 12
Propriedades mensurveis (6)
Equilbrio
Condio na qual o estado termodinmico no muda com o tempo
nem apresenta tendncia a uma mudana espontnea
Fora motrizes (?) esto equilibradas
Existe equilbrio na natureza?
Estado estacionrio x equilbrio
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 13
Propriedades mensurveis (7)
Condies de equilbrio
Equilbrio mecnico
Equilbrio trmico
Equilbrio qumico (?)
Equilbrio de fases
As condies nas fases devem ser as mesmas. Ex: lquido-vapor
Como o lquido vaporiza?
O processo reacional no nvel molecular nunca est
verdadeiramente em equilbrio
viz sis
P P =
viz sis
T T =
v l
P P =
v l
T T =
v l
=
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 14
Propriedades mensurveis (8)
Propriedades dependentes e independentes
Postulado: Duas propriedades intensivas definem o estado
termodinmico de um sistema com uma substncia pura
Definidas duas variveis, as demais podem ser determinadas
utilizando relaes termodinmicas (cap. 5)
Propriedades utilizadas para fixar o estado termodinmico:
variveis independentes (T, P)
Demais propriedades calculadas partir das variveis
independentes: variveis dependentes (v)
Determinao de variveis extensivas: deve-se considerar a
quantidade de matria
( ) P T v v , =
( ) n P T V V , , =
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 15
Propriedades mensurveis (9)
Regra das fases de Gibbs
Nmero de propriedades intensivas independentes necessrias
para definir as demais propriedades intensivas de uma
determinada fase (graus de liberdade)
Quantas propriedades so necessrias para definir um sistema de
uma substncia pura em uma fase ?
Caso particular: Equilbrio lquido-vapor de um substncia pura
necessita de uma propriedade intensiva para determinar as
propriedades intensivas de cada fase
Para definir o estado do sistema multifsico necessrio
conhecer a quantidade de matria em casa fase (ex. No ELV de
substncia pura pode-se definir a qualifdade)
2 + = t m
l v
v
n n
n
x
+
=
v l
xv v x v + = ) 1 (
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 16
Propriedades mensurveis (10)
Superfcie PvT
Trs principais propriedades intensivas (mensurveis) no so
independentes
Podem ser representadas por diagramas (envelopes) PvT
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 17
Propriedades mensurveis (11)
Superfcie PvT
Substncia que existe nas trs fases: Ponto triplo (zero grau de
liberdade)
Diagrama Pv: regio bifsica. Linha tripla (volume do sistema
varia na regio de equilbrio de fases)
Diagrama PT: Pontos triplo
Ponto crtico:fronteira entre lquido-gs no definida.
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 18
Propriedades mensurveis (12)
Anlise de processos com diagrama de fases (isobrico)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 19
Propriedades mensurveis (13)
Presso de saturao x Presso de vapor
Presso de saturao: presso na qual uma substncia pura ferve
a uma determinada T (contribuio total na P do sistema)
Presso de vapor: contribuio da presso de saturao em uma
mistura de gases, na P do sistema.
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 20
Propriedades mensurveis (13)
Presso de saturao x Presso de vapor
Presso de saturao: presso na qual uma substncia pura ferve
a uma determinada T (contribuio total na P do sistema)
Presso de vapor: contribuio da presso de saturao em uma
mistura de gases, na P do sistema.
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 21
Propriedades mensurveis (13)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 22
Propriedades mensurveis (13)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 23
Propriedades mensurveis (13)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 24
Propriedades mensurveis (13)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 25
1a. Lei da Termodinmica (1)
A energia pode mudar de uma forma para outra
A energia do universo no varia
Estudo termodimico realizado em um sistema pertencente ao
universo (sistema + vizinhana)
Variao de energia no sistema deve ser igual a energia transferida
pelas fronteiras
Transferncia de energia ocorre na forma de calor e trabalho
Energia no grandeza absoluta. definida em relao a um estado
de referncia
0
univ
= AE
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 26
1a. Lei da Termodinmica (2)
Tipos de energia (observao macroscpica)
Energia cintica: associada ao movimento do sistema
Energia potencial: associada a posio do sistema em um campo
gravitacional
Energia Interna (U): energia sssociada ao movimento, posio e
configurao de ligaes qumica nas molculas do sistema
Ex. 2.1
Se uma pedra cai de um penhasco de 10 m de altura, qual a sua
velocidade quando atinge o solo?
2
2
1
V m E
K
=
mgz E
P
=
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 27
1a. Lei da Termodinmica (2)
Energia interna (nvel molecular): engloba todas as forma de energia
molecular, inclusive cintica e potencial
Variao de energia interna pode ser observada macroscopicamente:
Mudana em T do sistema
Mudana de fase
Mudana de estrutura qumica (reao)
Energia interna pode ser representada pela:
Energia cintica molecular: translacional, vibracional (fnons) e
rotacional
Energia potencial molecular: intermolecular ou intramolecular
Quais destas formas de energia tem maior peso em cada estado da
matria (slido, lquido e gs)?
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 28
1a. Lei da Termodinmica (3)
Gases ideais: U=f(T) (somente T)
Gases reais: U=f(T,P) ou U=f(T,v)
- Trabalho e calor
Energia em trnsito (sistema no possui calor ou trabalho)
Calor (Q): dissipao de energia devido a gradiente trmico (AT)
Trabalho (W): responsvel por todas as outras formas da
transferncia de energia no proveniente de um gradiente trmico
Mecnico (expanso/compresso; eixo)
Eltrico
Magntico
Termodinmica da Eng. Qumica: trabalho de expanso/compresso
o mais comum
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 29
1a. Lei da Termodinmica (3)
Trabalho de expanso/compresso: integral de linha
Trabalho positivo: transferido da vizinhana para o sistema
(compresso)
} }
= = dv P dx F w
E E
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 30
1a. Lei da Termodinmica (4)
Trabalho Pv: transferncia de momento das molculas
Ex. 2.3
Sistema inicialmente com 1 mol de gs A, P = 2 bar e V = 1L. Ocorre processo de
expanso at a presso ficar igual a presso da vizinhana. O volume final de 15,2 L.
Calcule o trabalho realizado.
Trabalho de eixo: transferncia de energia do sistema para vizinhana
(expanso e resfriamento do fluido). Transferncia de energia
mecnica, eltrica ou magntica.
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 31
1a. Lei da Termodinmica (5)
Calor: transferncia de energia entre sistema e vizinhaa por
gradiente trmico.
Processo adiabtico: no h transferncia de calor
Fenmeno observado:
Aquecimento
Mudana de fase
Modos de transferncia de calor:
Conduo
Conveco
Radiao
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 32
1a. Lei da Termodinmica (6)
- Construo de caminhos hipotticos
Energia interna: depende apenas do estado inicial e final do sistema
(funo de estado)
Pode-se escolher qualquer caminhopara ir do estado inicial ao final
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 33
1a. Lei da Termodinmica (7)
- Processos reversveis e irreversveis
Processo reversvel:
o sistema pode voltar ao seu estado inicial aps ocorrer o
processo. Perturbao infinitesimal. Caso ideal.
A direo do processo em qualquer ponto.
Sem atrito
Processo irreversvel: processo real
Exemplo: Determinar o trabalho de compresso e expanso por 4
`caminhos`
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 34
1a. Lei da Termodinmica (8)
( )
} }
= =
2
1
2
1
exp
v
v
atm
v
v
E
dv P dv P w
Processo A (Expanso)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 35
1a. Lei da Termodinmica (9)
Processo B (Compresso)
} }
|
.
|
\
|
+ = =
1
2
1
2
comp
v
v
atm
v
v
E
dv
A
mg
P dv P w
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 36
1a. Lei da Termodinmica (10)
Processo C e D (Compresso e expanso)
(
(
(
(
|
.
|
\
|
+ +
|
|
|
|
.
|
\
|
+ = =
} } }
1
int
int
2
1
2
2
comp
v
v
atm
v
v
atm
v
v
E
dv
A
mg
P dv
A
g
m
P dv P w
(
(
(
(
+
|
|
|
|
.
|
\
|
+ = =
} } }
2
int
int
1
2
1
2
exp
v
v
atm
v
v
atm
v
v
E
dv P dv
A
g
m
P dv P w
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 37
1a. Lei da Termodinmica (11)
Processo E e F(Compresso e expanso)
|
|
.
|
\
|
= = = =
|
|
.
|
\
|
= = = =
=
} } }
} } }
2
1
1 1
1 1
comp
1
2
1 1
1 1
exp
ln
ln
1
2
1
2
2
1
2
1
2
1
2
1
v
v
v P dv
v
v P
Pdv dv P w
v
v
v P dv
v
v P
Pdv dv P w
P P
v
v
v
v
v
v
E
v
v
v
v
v
v
E
E
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 38
1a. Lei da Termodinmica (12)
Eficincia do processo: relao entre processo real e ideal
irrev
rev
comp
rev
irrev
exp
w
w
w
w
=
=
q
q
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 39
- 1a. Lei aplicada a sistemas fechados
No h transferncia de massa entre as fronteiras do sistema
Transferncia de energia entre sistema e vizinhana ocorre atravs de
calor e trabalho.
Quantidade de material pode ser expressa atravs da massa ou de
mol (cuidado com sistemas reativos variao do nmero de moles)
Variao de energia no sistema (depende apenas do estado inicial e
final) igual a energia transferida das vizinhanas para o sistema
(depende do caminho do processo)
Considerando a composio constante (sem reao), dividindo pela
massa do sistema
1a. Lei da Termodinmica (13)
W Q E E U
P K
+ = A + A + A
w q w e u
P K
+ = A + A + A
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 40
1a. Lei da Termodinmica (14)
Nos processo qumicos pode-se desprezar a variao de energia
cintica e potencial (porque?)
W Q U + = A
w q u + = A
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 41
Balano diferencial: variao infinitesimal
Considerando a diferenciao em relao ao tempo (taxa de
transferncia de energia calor ou trabalho: J/s ou W)
1a. Lei da Termodinmica (14)
W Q dE dE dU
P K
o o + = + +
w q dw de du
P K
o o + = + +
W Q
dt
dE
dt
dE
dt
dU
P K
+ = + +
w q
dt
de
dt
de
dt
du
P K
+ = + +
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 42
- 1a. Lei aplicada a sistemas abertos
H transferncia de massa entre as fronteiras do sistema
ESCREVERRRRR
1a. Lei da Termodinmica (15)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 43
- Capacidade Calorfica Cv e Cp
Clculo de U e H independem do caminho. Pode-se especificar duas
propriedades intensivas para determinar o estado sistema (quais? T, P
e/ou V)
1a. Lei da Termodinmica (15)
Etapa 1: U varia com T
(capacidade calorfica a V
constante)
Dados de capacidade
calorfica so muito
importantes para o clculo
das propriedades termodi-
nmicas U e H
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 44
Clculo de Cv e Cp com base em dados experimentais.
1a. Lei da Termodinmica (16)
Cv: Calor adicionada ao
sistema sem variao de
volume (no existe
trabalho pv). Toda energia
acumulada em U.
Cp: Calor adicionada ao
sistema e existe trabalho
de expanso. Est
relacionada a variao de U
e trabalho pv (entalpia).
q u = A
v
v
T
u
c
|
.
|
\
|
c
c
v p q w q u A = + = A
q h v p u = A = A + A
P
p
T
h
c
|
.
|
\
|
c
c
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 45
Dados de Cv e Cp so aproximadamente iguais para lquidos (qual o
motivo?).
Para gases ideais:
Dados de capacidade calorfica podem ser ajustados por expresso
polinomial. Constantes so tabeladas
1a. Lei da Termodinmica (17)
3 2 2
) (
ET DT CT Bt a c
p v
+ + + + =
R
T
u
T
RT u
T
pv u
T
h
c
P P P P
p
+
|
.
|
\
|
c
c
=
|
.
|
\
|
c
+ c
=
|
.
|
\
|
c
+ c
=
|
.
|
\
|
c
c
) ( ) (
| |
} }
+ + + + = = A
2
1
2
1
3 2 2
T
T
T
T
v
dT ET DT CT Bt a dT c u
| |
} }
+ + + + = = A
2
1
2
1
3 2 2
T
T
T
T
P
dT ET DT CT Bt a dT c h
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 46
Capacidade calorfica mdia: mdia do Cp em um intervalo de
temperatura (T
ref
at T). Tref adotado geralmente de 25 C.
Pode-se calcular a variao de entalpia utilizando o Cp mdio,
considerado cosntante naquele intervalo de temperatura
Ex 2.6 Considere o aquecimento de 2 moles de vapor a 200 C e 1
Mpa at 500 C e 1 Mpa. Calcule a entrada de calor necessria usando
os dados a seguir: (a) Capacidade Calorfica; (b) Tabelas de vapor
1a. Lei da Termodinmica (18)
) (
ref P
T T c h = A
) (
ref
T
T
P
P
T T
dt c
c
ref
=
}
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 47
- Calor latente
Calor associado a mudana de fase. No ocorre variao de T durante
a mudana de fase (por qu?)
Entalpia de mudana de fase: diferena entre a entalpia de cada fase
na mesma T. Ex: Enplaria de vaporizao, de fuso, de sublimao, de
condensao, de cristalizao.
1a. Lei da Termodinmica (19)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 48
Calor latentes variam com T (valor depende das condies em que
ocorreu a mudana de fase - P e T.
Em geral, entalpia de variao so obtidas a 1 bar. Se desejarmos em
outra condio de P ou T? Ciclo termodinmico.
1a. Lei da Termodinmica (19)
} }
+ A + = A
T
T
v
P T vap
T
T
l
P T vap
b
b
b
dT c h dT c h
, ,
}
A + A = A
T
T
vl
P T vap T vap
b
b
dT c h h
, ,
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 49
Exerc. 2.8 Considere a gua fervendo em uma chaleira de ch.
Digamos que a gua leve em torno de 10 minutos para fazer com que
1L de gua sada da torneira a 25 C comece a ferver, Qual o calor
total de entrada, Q? Qual a taxa de entrada de calor?
Exerc. 2.12 Em seu laboratrio, que est a 21 C, existe um bloco de
alumnio de 5 kg. Voc deseja aumentar a temperatura do bloco at
50 C. Quanto de calor (J) deve ser fornecido?
1a. Lei da Termodinmica (20)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 50
um postulado (no se pode provar, mas observada na natureza)
Exemplifica a direcionalidade/espontaneidade dos processos.
2a. Lei da Termodinmica (1)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 51
Anlise de processos e relao com a direcionalidade.
Processo I: Processos mecnico
2a. Lei da Termodinmica (2)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 52
Anlise de processos e relao com a direcionalidade.
Processo II: Mquina Trmica
2a. Lei da Termodinmica (3)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 53
2a. Lei da Termodinmica (4)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 54
Entropia: propriedade termodinmica que indica a direcionalidade e
espontaneidade dos processos.
uma funo de estado
Definio estabelecida em momentos histricos diferente
Rudolph clausius (1865) Maximizao de eficincia de processos
cclicos: Relaciona a entropia com a transferncia de calor
reversvel (termodinmica clssica)
Ludwing Boltzmann (1877) Entropia em termos do
comportamento molecular (mecnica estatstica): Maior nmero
de configuraes moleculares so mais provveis de ocorrer e
possuem maior entropia
Claude Shannon (1948): analogia a Boltzmann relacionando a
entropia na teoria da informao (medida da incerteza do
verdadeiro contedo)
Energia em forma de trabalho: no h variao de entropia.
Fluxo de calor: energia migrando de forma desordenada.
2a. Lei da Termodinmica (5)
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 55
Entropia de acordo com a termodinmica clssica:
Por ser funo de estado, a variao independe do caminho escolhido
(reversvel ou irreversvel)
A entropia nos permite avaliar quantitativamente a direcionalidade e
reversibilidade (trabaho mnimo ou mximo processos reversveis)
Avalia-se a variao de entropia do universo nos processos (variao
do sistema + variao da vizinhana)
2a. Lei da Termodinmica (6)
T
q
ds
rev
o
}
= A
final
inicial
rev
T
q
s
o
TermodinmicaAplicada a EQ II Prof. Marlus Rolemberg 56
Estudo de casos: Expanso/Compresso adiabtica
2a. Lei da Termodinmica (7)
Vous aimerez peut-être aussi
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteD'EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambientePas encore d'évaluation
- Análise das tensões em estruturas de concreto devido a variações de temperatura entre os anos de 2009 e 2018D'EverandAnálise das tensões em estruturas de concreto devido a variações de temperatura entre os anos de 2009 e 2018Pas encore d'évaluation
- Aula 1 - Introdução À Termodinâmica PDFDocument15 pagesAula 1 - Introdução À Termodinâmica PDFLouise KurozawaPas encore d'évaluation
- TermodinamicaDocument41 pagesTermodinamicamettzcastroPas encore d'évaluation
- Termodinâmica IDocument49 pagesTermodinâmica IBruno TaveiraPas encore d'évaluation
- 1a Lei Da TermodinâmicaDocument95 pages1a Lei Da TermodinâmicaItallo AugustoPas encore d'évaluation
- Aula 6-Balanço de Energia-1a LeiDocument23 pagesAula 6-Balanço de Energia-1a LeiAntonioMoraesPas encore d'évaluation
- Maq-Term-01 29 02 12Document122 pagesMaq-Term-01 29 02 12Rayane LopesPas encore d'évaluation
- Tema1 Conceitos FundamentaisDocument29 pagesTema1 Conceitos FundamentaisSuzana Correia RibeiroPas encore d'évaluation
- Aula 01Document60 pagesAula 01VictóriaPas encore d'évaluation
- (Slide 1) TermodinâmicaDocument25 pages(Slide 1) TermodinâmicaMarina SartoriPas encore d'évaluation
- 1 Termodinamica 1Document27 pages1 Termodinamica 1Eliziane LeonPas encore d'évaluation
- Qmc5405 Termodinamica Intro 1Document37 pagesQmc5405 Termodinamica Intro 1Aldayr MeloPas encore d'évaluation
- Aula 1a Lei Da TermodinmicaDocument39 pagesAula 1a Lei Da Termodinmicaizaque NatanaelPas encore d'évaluation
- Apostila Termodinamica Difusao Osmose e Tonicidade Das SoluçoesDocument16 pagesApostila Termodinamica Difusao Osmose e Tonicidade Das SoluçoesMaria De Fátima MaltaPas encore d'évaluation
- Resumo de TermodinâmicaDocument10 pagesResumo de TermodinâmicaEduardo Gricio HomemPas encore d'évaluation
- Termodinamica - SlidesDocument190 pagesTermodinamica - SlidesrodrigopeddrosaPas encore d'évaluation
- Resumo Do Livro - MoranShapiroDocument23 pagesResumo Do Livro - MoranShapiroDiegoLuísIzidoroSilvaPas encore d'évaluation
- TermodinamicaDocument48 pagesTermodinamicaAlcivone ColetPas encore d'évaluation
- Termodinamica Q Geral-Parte1aDocument48 pagesTermodinamica Q Geral-Parte1avito xxxPas encore d'évaluation
- Estudo Dirigido Atividade IDocument19 pagesEstudo Dirigido Atividade IMarcio TexPas encore d'évaluation
- Tema 3 1ra Lei de TermodinamicaDocument43 pagesTema 3 1ra Lei de TermodinamicaAntonio Paulo Vasco sementePas encore d'évaluation
- Caderno de BiofísicaDocument17 pagesCaderno de BiofísicaGIOVANNA ASSONI RODRIGUES SOARESPas encore d'évaluation
- Term Odin  MicaDocument175 pagesTerm Odin  MicaFernando RochaPas encore d'évaluation
- Capitulo 2 - TERMODINAMICADocument62 pagesCapitulo 2 - TERMODINAMICAgilbabuPas encore d'évaluation
- Aula 01 02Document20 pagesAula 01 02Wellington de MattosPas encore d'évaluation
- Aula 1Document39 pagesAula 1Ana Claudia RibeiroPas encore d'évaluation
- Apostila - 01-UNIP Termodinâmica BásicaDocument49 pagesApostila - 01-UNIP Termodinâmica BásicaGian Remundini100% (5)
- Azdoc - Tips Termodinamica 1Document10 pagesAzdoc - Tips Termodinamica 1Abraz BamoPas encore d'évaluation
- TermodinâmicaDocument146 pagesTermodinâmicavlimaverdePas encore d'évaluation
- Segunda Lei Da TermodinâmicaDocument20 pagesSegunda Lei Da TermodinâmicaEduardo DeringPas encore d'évaluation
- Aula5 TMF T 2009Document5 pagesAula5 TMF T 2009Gip CongPas encore d'évaluation
- Aula 01 - Termodinâmica BásicaDocument24 pagesAula 01 - Termodinâmica Básicarafael matosPas encore d'évaluation
- Introdução À TermoquímicaDocument6 pagesIntrodução À TermoquímicaJoanna de Paoli100% (1)
- Introduo A Balano de EnergiaDocument26 pagesIntroduo A Balano de EnergiaLaura FernandesPas encore d'évaluation
- Termodinâmica Aplicada Modulo 01Document57 pagesTermodinâmica Aplicada Modulo 01Carlos Balilla FilhoPas encore d'évaluation
- Slides Aula Gases IdeaisDocument51 pagesSlides Aula Gases IdeaisGabriela Tivo da SilvaPas encore d'évaluation
- Gases & Termodinâmica: Modelo Do Gás Ideal Foi Fundamental NoDocument26 pagesGases & Termodinâmica: Modelo Do Gás Ideal Foi Fundamental NoDaniloPas encore d'évaluation
- Cap01 - Conceitos Fundamentais de TermodinâmicaDocument76 pagesCap01 - Conceitos Fundamentais de Termodinâmicacicero.limaPas encore d'évaluation
- Primeira Lei Da TermodinamicaDocument53 pagesPrimeira Lei Da TermodinamicaSidnei RodriguesPas encore d'évaluation
- Apostila Termodinamica PDFDocument75 pagesApostila Termodinamica PDF_danilofarah100% (4)
- 1 - Conceitos e DefiniçõesDocument24 pages1 - Conceitos e DefiniçõesNathan Vergilio Da CostaPas encore d'évaluation
- 1 - Sistemas TermodinâmicosDocument13 pages1 - Sistemas TermodinâmicosRaquel_Daniela100% (1)
- AULA 00 TermodinamicaDocument9 pagesAULA 00 TermodinamicaNilton MachailaPas encore d'évaluation
- Primeira Lei Da Termodinâmica PDFDocument92 pagesPrimeira Lei Da Termodinâmica PDFWalleria SantanaPas encore d'évaluation
- Aula 01 - Transcal 08 01Document34 pagesAula 01 - Transcal 08 01Anderson NascimentoPas encore d'évaluation
- Aula 1 Introdução À TermodinâmicaDocument27 pagesAula 1 Introdução À TermodinâmicaKadSantos100% (1)
- Apostila BME3Document15 pagesApostila BME3Stéfanni Gasparini100% (1)
- 1 Lei Da TermodinâmicaDocument33 pages1 Lei Da TermodinâmicaVitor Chemello100% (1)
- A Segunda Lei Da TermodinâmicaDocument20 pagesA Segunda Lei Da TermodinâmicaGuilherme AntunesPas encore d'évaluation
- Aula 9 - Leis Da TermodinmicaDocument38 pagesAula 9 - Leis Da TermodinmicaGuilherme CauãPas encore d'évaluation
- Aprendendo a mecânica quântica: equação de Schrödinger em 1DD'EverandAprendendo a mecânica quântica: equação de Schrödinger em 1DPas encore d'évaluation
- Controle DigitalD'EverandControle DigitalPas encore d'évaluation
- Modelagem e Simulacao de Biorreator Operando Com FungosDocument91 pagesModelagem e Simulacao de Biorreator Operando Com FungosMaria SoaresPas encore d'évaluation
- Adsorção de Azul de MetilenoDocument2 pagesAdsorção de Azul de MetilenoMaria SoaresPas encore d'évaluation
- Ebo BmeDocument14 pagesEbo BmeMaria SoaresPas encore d'évaluation
- Apostila Básica - Ciclo de RecuperaçãoDocument40 pagesApostila Básica - Ciclo de RecuperaçãoIshellJR75% (4)
- MonitoramentoDocument50 pagesMonitoramentoOrenço JumaPas encore d'évaluation
- Relatório Lei de CharlesDocument7 pagesRelatório Lei de CharlesJerusaFreitasPas encore d'évaluation
- Lista de TermodinamicaDocument5 pagesLista de TermodinamicaBruna GarciaPas encore d'évaluation
- Qmc5405 Termodinamica Intro 1Document37 pagesQmc5405 Termodinamica Intro 1Aldayr MeloPas encore d'évaluation
- Grupo Isometrias GeometriaEuclidianaDocument4 pagesGrupo Isometrias GeometriaEuclidianamarlon mathPas encore d'évaluation
- 2023 01 23 NA MecEstDocument39 pages2023 01 23 NA MecEstEduardo EmanuelPas encore d'évaluation
- Termodinamica 1 Sem 2022Document164 pagesTermodinamica 1 Sem 2022Fernando AdamPas encore d'évaluation
- Exercícios Resolvidos e Comentados - Leis TermodinamicaDocument2 pagesExercícios Resolvidos e Comentados - Leis TermodinamicaJose Luis Manrique Murillo100% (2)
- 1 Lei TermodinamicaDocument3 pages1 Lei TermodinamicaGerson QueirozPas encore d'évaluation
- Termo 17Document32 pagesTermo 17Ju LianaPas encore d'évaluation
- Primeira Lei TermodinâmicaDocument2 pagesPrimeira Lei TermodinâmicaMarcelo Kayser de CamposPas encore d'évaluation
- Termometria - CalorimetriaDocument20 pagesTermometria - CalorimetriaFrancisco SilvaPas encore d'évaluation
- Termodinc 3 A 2 MicaDocument23 pagesTermodinc 3 A 2 MicaWindson MeloPas encore d'évaluation
- 2 Lei Da Termodinâmica, A Teoria Cinética Dos Gases e Noções de Mecânica Estatística.Document17 pages2 Lei Da Termodinâmica, A Teoria Cinética Dos Gases e Noções de Mecânica Estatística.Débora A. AlmeidaPas encore d'évaluation
- Exercicios Propostos Resolvidos Aletas Nao VerificadoDocument15 pagesExercicios Propostos Resolvidos Aletas Nao VerificadoElimar Russi Filho0% (1)
- 3.1 (SALVA) SUMÁRIO DE Calorimetria Calor Sensível (E DEIXA O LIKE)Document3 pages3.1 (SALVA) SUMÁRIO DE Calorimetria Calor Sensível (E DEIXA O LIKE)CRISTIAN ARROYO ESPINOZAPas encore d'évaluation
- Aula 1 Inicial e Introdução FenômenosDocument3 pagesAula 1 Inicial e Introdução FenômenosJaqueline SoaresPas encore d'évaluation
- Mec - Analítica - PARTE 2Document105 pagesMec - Analítica - PARTE 2Paulo Franco100% (1)
- Transferencia de Calor e MassaDocument33 pagesTransferencia de Calor e Massalsouza88Pas encore d'évaluation
- Termoquimica 04Document1 pageTermoquimica 04PaulCumbassPas encore d'évaluation
- Fisica TermodinamicaDocument6 pagesFisica TermodinamicaDaniela SirqueiraPas encore d'évaluation
- 531675Document2 pages531675Carlos Ramon Andrade de OliveiraPas encore d'évaluation
- APOSTILA FEN DE TRANSPORTE Radiação MA LLLLLLLME - 2010 - E20Document9 pagesAPOSTILA FEN DE TRANSPORTE Radiação MA LLLLLLLME - 2010 - E20Jmassaneiro13Pas encore d'évaluation
- AULA 2 - 1 Lei Da TermodinamicaDocument41 pagesAULA 2 - 1 Lei Da TermodinamicaMiécio MelquiadesPas encore d'évaluation
- 2021-2 - Termodinâmica - A - Cap 4.2 - AnotadoDocument40 pages2021-2 - Termodinâmica - A - Cap 4.2 - AnotadoTobias BobakPas encore d'évaluation
- Lista de ExercíciosDocument5 pagesLista de ExercíciosAfonso Dias0% (1)
- INTRODUÇÃODocument23 pagesINTRODUÇÃOVisitantePas encore d'évaluation
- Aulas - IEM001T 1 102Document102 pagesAulas - IEM001T 1 102Lucas JordanPas encore d'évaluation
- Experimento II - CalorímetroDocument7 pagesExperimento II - CalorímetroAna Paula CostaPas encore d'évaluation