Académique Documents
Professionnel Documents
Culture Documents
Apresentação Mod 05 QO
Transféré par
Maria ClaraTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Apresentação Mod 05 QO
Transféré par
Maria ClaraDroits d'auteur :
Formats disponibles
Curso de Qumica
Prof. Alexandre Oliveira
www.alexquimica.com.br
Curso de Qumica Prof. Alexandre Oliveira
Especfico para Medicina
Apresentao Mdulo 05 Qumica Orgnica - Isomeria Cis-trans Gabarito Mdulo 04 Qumica Geral Ligaes intermoleculares
www.alexquimica.com.br
O Curso de Qumica do Cear!
Especfico para Medicina!
Curso de Qumica
Prof. Alexandre Oliveira
www.alexquimica.com.br
QUMICA ORGNICA
Br Cl C H C CH3
Isomeria E-Z
Regras de Seqncia: A Classificao E,Z
Br C H C
CH3 Cl
Captulo 05 Isomeria ciscis-trans
Qual ismero o cis e qual o trans?
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira Prof. Alexandre Oliveira
Isomeria E-Z
Regras de Seqncia: A Classificao E,Z Regra de seqncia 1:
menor prioridade C maior prioridade C maior prioridade maior prioridade menor prioridade menor prioridade C C menor prioridade maior prioridade
Isomeria E-Z
Regras de Seqncia: A Classificao E,Z
maior prioridade Br C H C CH3 ismero Z
maior prioridade Br C H C Cl ismero E
ismero Z
ismero E
Cl
CH3
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
Isomeria E-Z
HOCH2 C HC C C CH2CH3 HC C CH CH2 HOCH2 C C CH CH2
Isomeria E-Z
Regras de Seqncia: A Classificao E,Z
CH2CH3
Regra de seqncia 4: No caso de istopos (tomos com o mesmo nmero atmico, mas diferente nmero de massa), o nmero de massa usado para determinar a prioridade relativa.
CH3 H C D C CH ismero Z CH2 CHCH3 H C D C CHCH3 CH3 ismero E CH CH2
ismero Z
ismero E
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
O Curso de Qumica do Cear!
Especfico para Medicina!
Curso de Qumica
Prof. Alexandre Oliveira
www.alexquimica.com.br
Isomeria E-Z
Regras de Seqncia: A Classificao E,Z
H C ClCH2 H C C C H H CH2CH3 H C ClCH2 C C H C CH2CH3 H H
Estabilidade dos alcenos
Estabilidade dos Alquenos
A maioria dos alcenos tm calores de hidrogenao prximos de -120 kJ mol-1.
(2Z,4Z)-1-cloro-2,4-heptadieno ClCH2 H C C CH2CH3 H C C H H (2E,4Z)-1-cloro-2,4-heptadieno
Prof. Alexandre Oliveira
(2Z,4E)-1-cloro-2,4-heptadieno ClCH2 H C C H H C C H CH2CH3 (2E,4E)-1-cloro-2,4-heptadieno
Prof. Alexandre Oliveira
Estabilidade dos alcenos
Estabilidade dos Alquenos O calor de hidrogenao pode ser usado para medir a estabilidade relativa dos alcenos:
Estabilidade dos alcenos
Estabilidade dos Alquenos Estabilidade relativa dos ismeros cis e trans:
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
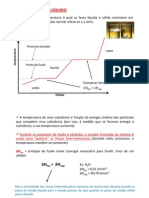
Estabilidade dos alcenos
Estabilidade dos Alquenos Diagrama de energia para os trs ismeros do buteno:
Estabilidade dos alcenos
Estabilidade dos Alquenos
Estabilidade para os trs ismeros do buteno:
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
O Curso de Qumica do Cear!
Especfico para Medicina!
Curso de Qumica
Prof. Alexandre Oliveira
www.alexquimica.com.br
Estabilidade dos alcenos
Estabilidade dos Alquenos
Estabilidade dos alcenos
Estabilidade relativa dos alcenos pelos calores de combusto: Quando a hidrogenao dos alcenos isomricos no leva ao mesmo alcano, os calores de combusto podem ser usados para medir as estabilidades relativas:
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
Estabilidade dos alcenos
Estabilidade relativa dos alcenos pelos calores de combusto:
Estabilidade dos alcenos
Estabilidade relativa dos alcenos pelos calores de combusto:
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
Estabilidade dos alcenos
Estabilidade dos Alquenos
Estabilidade relativa dos alcenos:
Fim Isomeria ciscis-trans
Prof. Alexandre Oliveira
Prof. Alexandre Oliveira
O Curso de Qumica do Cear!
Especfico para Medicina!
Curso de Qumica
Prof. Alexandre Oliveira
www.alexquimica.com.br
Resoluo Mdulo 05 Qumica Geral Foras Intermoleculares, Estrutura dos Lquidos e Slidos
01) (a) Slido < lquido < gs (b) gs < lquido < slido 02) Nos estados lquido e slido as partculas esto se tocando e existe muito pouco espao vazio, logo os volumes ocupados por uma unidade de massa so muito similares e as densidades tambm. Na fase gasosa as molculas esto afastadas, de forma que uma massa unitria ocupa um volume muito maior do que no lquido ou no slido, e a densidade da fase gasosa muito menor. 03) igual a questo 08 04) (a) Foras de disperso de London (b) foras dipolodipolo (c) foras dipolodipolo e em determinados casos ligao de hidrognio 05) (a) Molcula covalente apolar; apenas foras de disperso de London (b) molcula covalente polar com ligaes OH; ligao de hidrognio, foras dipolodipolo e foras de disperso de London (c) molcula covalente polar; foras dipolodipolo e foras de disperso de London (mas no ligao de hidrognio) 06) (a) A polarizabilidade a facilidade com a qual a distribuio de carga em uma molcula pode ser distorcida para produzir um dipolo temporrio. (b) Te o mais polarizvel porque seus eltrons de valncia esto mais afastados do ncleo e mantidos menos fortemente. (c) Em ordem crescente de polarizabilidade: CH4 < SiH4 < SiCl4 < GeCl4 < GeBr4 (d) A ordem de grandeza das foras de disperso de London e portanto os pontos de ebulio das molculas aumentam medida que a polarizabilidade aumenta. A ordem crescente dos pontos de ebulio a ordem crescente de polarizabilidade dada no item (c). 07) (a) H2S (b) CO2 (c) CCl4 08) Tanto molculas de butano na forma de tubos como molculas esfricas de 2-metilpropano sofrem foras de disperso. A maior superfcie de contato entre as molculas de butano produzem maior ponto de ebulio. 09) CH3NH2 e CH3OH. As molculas com ligaes NH, OH e FH formam ligaes de hidrognio com molculas semelhantes. 10) (a) HF tem o maior ponto de ebulio porque as ligaes de hidrognio so mais fortes do que as foras de dipolodipolo. (b) CHBr3 tem o maior ponto de ebulio porque tem a maior massa molar, indicando maior polarizabilidade e foras de disperso mais fortes. (c) ICl tem o maior ponto de ebulio porque as molculas tm massas molares similares (conseqentemente foras de disperso similares), mas ICl polar, fornecendo-lhe foras de dipolodipolo que esto ausentes na molcula apolar de Br2. 11) Tenso superficial, alto ponto de ebulio e alto calor especfico. 12) (a) Tanto as viscosidades quanto as tenses superficiais de lquidos aumentam medida que as foras intermoleculares tornam-se mais fortes. (b) A tenso superficial e a viscosidade diminuem conforme a temperatura e a energia cintica mdia das molculas aumentam. 13) (a) CHBr3 tem massa molar mais alta, mais polarizvel e tem foras de disperso mais fortes, logo a tenso superficial maior. (b) medida que a temperatura aumenta, a viscosidade do leo diminui porque as energias cinticas mdias das molculas aumentam. (c) As foras adesivas entre a gua polar e a cera de carro apolar so fracas; assim, a grande tenso superficial da gua puxa o lquido para a forma com a menor rea superficial, uma esfera. 14) Endotrmica: fuso, vaporizao, sublimao; exotrmica: condensao, congelamento, deposio. 15) A fuso no requer a separao das molculas, de forma que a exigncia de energia menor do que para a vaporizao, onde as molculas devem ser separadas. 16) (a) A presso crtica a presso necessria para provocar a liquefao a temperatura crtica. (b) medida que a fora de atrao entre as molculas aumenta, a temperatura crtica do composto aumenta. (c) Todos os gases da Tabela 11.5 podem ser liquefeitos temperatura do nitrognio lquido, dada presso suficiente. 17) (a) Nenhum efeito (b) Nenhum efeito (c) A presso de vapor diminui com o aumento das foras intermoleculares atrativas porque menos molculas tm energia cintica suficiente para
O Curso de Qumica do Cear!
Especfico para Medicina!
Curso de Qumica
Prof. Alexandre Oliveira
www.alexquimica.com.br
superar as foras atrativas e escapar para a fase de vapor. (d) A presso de vapor aumenta com o aumento da temperatura porque as energias cinticas mdias das molculas aumentam. 18) CBr4 < CHBr3<CH2Br2<CH2Cl2<CH3Cl < CH4. A tendncia dominada pelas foras de disperso mesmo quatro das molculas sendo polares. A ordem crescente de volatilidade a ordem crescente da presso de vapor, a ordem decrescente da massa molar e a ordem decrescente de intensidade das foras de disperso. 19) (a) A temperatura da gua nas duas panelas a mesma. (b) A presso de vapor no depende nem do volume nem da rea superficial do lquido. mesma temperatura, as presses de vapor da gua nos dois recipientes so as mesmas. 20) A linha lquido gs de um diagrama de fases termina no ponto crtico, a temperatura e presso depois dos quais no se pode distinguir entre as fases lquida e gasosa. 21) Em slido cristalino, as partculas componentes esto arranjadas em padro respetitivo ordenado. Em um slido amorfo, no existe estrutura ordenada. 22) A clula unitria a unidade fundamental da rede cristalina. Quando repetida em trs dimenses, ela produz a rede cristalina. um paraleleppedo com distncias e ngulos caractersticos. As clulas unitrias podem ser primitivas ou centradas. 23) A grande diferena nos pontos de fuso deve-se s foras muito diferentes impondo ordem atmica no estado slido. Muito mais energia cintica necessria para romper as ligaes metlicas deslocalizadas no ouro do que para vencer as foras de disperso de London relativamente fracas em Xe. 24) (a) r = 1,355 (b) densidade = 22,67 g/cm3 25) Massa atmica = 55,8 g/mol 26) (a) 12 (b) 6 (c) 8 27) a = 6,13 28) (a) Ligao de hidrognio, foras dipolodipolo, foras de disperso de London (b) ligaes qumicas covalentes (c) ligaes inicas (d) ligaes metlicas 29) Nos slidos moleculares, foras intermoleculares relativamente fracas unem as molculas na rede, necessitando, assim, de relativamente pouca energia para romper essas foras. Nos slidos covalentes, as ligaes covalentes unem os tomos em uma rede extensa. A fuso ou a deformao de um slido covalente significa a quebra de ligaes covalentes, que necessitam de grande quantidade de energia. 30) Por causa do seu ponto de fuso relativamente alto e das propriedades como soluo condutora, o slido deve ser inico. 31) (a) B, rede covalente como C(s), versus as foras de disperso fracas em BF3 (b) NaCl, inico versus ligao metlica (c) TiO2, maior carga em O2 do que em Cl (d) MgF2, maior carga em Mg2+ do que em Na+
O Curso de Qumica do Cear!
Especfico para Medicina!
Vous aimerez peut-être aussi
- Refrigeração ResidencialDocument51 pagesRefrigeração ResidencialLucas Lima73% (11)
- Manual de Hidraulica Basica PDFDocument312 pagesManual de Hidraulica Basica PDFJuliano Carvalho100% (5)
- CaldeiraDocument80 pagesCaldeiraCláudia Zanetti100% (2)
- Dimensionamento de Uma Turbina A Gás para Geração de Energia Eléctrica DomésticaDocument19 pagesDimensionamento de Uma Turbina A Gás para Geração de Energia Eléctrica DomésticaThiago ValentePas encore d'évaluation
- Apostila de EvaporaçãoDocument9 pagesApostila de EvaporaçãoNilsonPas encore d'évaluation
- Gases IndustriaisDocument26 pagesGases IndustriaisAlcinda Da v. JeremiasPas encore d'évaluation
- Compostos BiciclicosDocument2 pagesCompostos BiciclicosMaria ClaraPas encore d'évaluation
- Reações Com Aldeídos e CetonasDocument10 pagesReações Com Aldeídos e CetonasMaria ClaraPas encore d'évaluation
- ALCANOSDocument5 pagesALCANOSMaria ClaraPas encore d'évaluation
- Química Geral - Ligações Químicas - Ligação Metálica - AprofundamentoDocument14 pagesQuímica Geral - Ligações Químicas - Ligação Metálica - AprofundamentoMaria ClaraPas encore d'évaluation
- Química Geral - Ligações Intermoleculares CompletoDocument28 pagesQuímica Geral - Ligações Intermoleculares CompletoMaria ClaraPas encore d'évaluation
- Revisão - Uece 2 - Master 2006Document2 pagesRevisão - Uece 2 - Master 2006Maria ClaraPas encore d'évaluation
- Estereoisomeria - Química Orgânica - Ari - PB - 2013Document66 pagesEstereoisomeria - Química Orgânica - Ari - PB - 2013Maria ClaraPas encore d'évaluation
- Específica Master - Aula 3 - Sala e Casa 2006Document7 pagesEspecífica Master - Aula 3 - Sala e Casa 2006Maria ClaraPas encore d'évaluation
- rEVISÃO - UECE 1 - MASTER 2006Document2 pagesrEVISÃO - UECE 1 - MASTER 2006Maria Clara100% (1)
- rEVISÃO - UECE 1 - MASTER 2006Document2 pagesrEVISÃO - UECE 1 - MASTER 2006Maria Clara100% (1)
- QuiDocument10 pagesQuiMaria ClaraPas encore d'évaluation
- Relatorio 5 FenomenosDocument6 pagesRelatorio 5 FenomenosSérgio FernandesPas encore d'évaluation
- O Estudo Dos Gases PDFDocument8 pagesO Estudo Dos Gases PDFAlex Conceição BritoPas encore d'évaluation
- Detalhe Da UFCD: 4576 - Mecânica Dos FluídosDocument2 pagesDetalhe Da UFCD: 4576 - Mecânica Dos FluídosJoão Tao Portugal100% (1)
- Lista de Exercícios GasesDocument2 pagesLista de Exercícios GasesalvaroPas encore d'évaluation
- Aula 01 - Comando Simples Direto e IndiretoDocument4 pagesAula 01 - Comando Simples Direto e IndiretoIsabela FornasierePas encore d'évaluation
- Anexos nr13Document9 pagesAnexos nr13adr123deoliveira4100% (1)
- Formulário MECFLUDocument2 pagesFormulário MECFLUVitor CarvalhoPas encore d'évaluation
- (20170417004446) FT Conteúdo 8 Pré Aula Lei de Torricelli Efeito Venturi Tubo de Pitot e Efeito MagnumDocument6 pages(20170417004446) FT Conteúdo 8 Pré Aula Lei de Torricelli Efeito Venturi Tubo de Pitot e Efeito MagnumRaphael LopesPas encore d'évaluation
- Resumo de BiofísicaDocument2 pagesResumo de BiofísicaLourivalFerreiraPas encore d'évaluation
- Portaria 142-2019 InmetroDocument7 pagesPortaria 142-2019 InmetroRicardo RicoPas encore d'évaluation
- Gasometro Umido para Afericao de Medidores de Volume de GasesDocument9 pagesGasometro Umido para Afericao de Medidores de Volume de GasesGrazi RuasPas encore d'évaluation
- Expto 3 - Purificação Por SublimaçãoDocument3 pagesExpto 3 - Purificação Por SublimaçãoBruno Henrique Morais Cardoso100% (2)
- Relatório 2 QUI150Document21 pagesRelatório 2 QUI150Nathalia ZuccolottoPas encore d'évaluation
- Fiedler Catalogo PreviewDocument9 pagesFiedler Catalogo PreviewAdriano PantarotoPas encore d'évaluation
- Lista Do Atividades 2 Ano BPDocument7 pagesLista Do Atividades 2 Ano BPSophia VelamePas encore d'évaluation
- Oa Rosa Damascena - Harmonie AromaterapiaDocument1 pageOa Rosa Damascena - Harmonie AromaterapiaFabio SimãoPas encore d'évaluation
- Prova Exp 2Document5 pagesProva Exp 2eloisaconsensoPas encore d'évaluation
- PROSTARDocument12 pagesPROSTARRafael PaivaPas encore d'évaluation
- Quimica 18Document29 pagesQuimica 18ascatanho100% (1)
- Lista 2 MecfluidosDocument3 pagesLista 2 MecfluidosSamuel Venancio da SilvaPas encore d'évaluation
- Aula 4 HIDRAÚLICA HidrodinâmicaDocument18 pagesAula 4 HIDRAÚLICA HidrodinâmicaAndreza FrarePas encore d'évaluation
- 02 Lista TermodinamicaDocument4 pages02 Lista TermodinamicaWashington DCPas encore d'évaluation
- Capilari DadeDocument2 pagesCapilari DadeAllison RafaelPas encore d'évaluation
- Tarde Prova 13 Engenheiro de Processamento J NiorDocument17 pagesTarde Prova 13 Engenheiro de Processamento J NiorTamires OishiPas encore d'évaluation