Académique Documents
Professionnel Documents
Culture Documents
Destilación Fraccionada
Transféré par
Santiago Alexander Borges HernandezTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Destilación Fraccionada
Transféré par
Santiago Alexander Borges HernandezDroits d'auteur :
Formats disponibles
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
1 1 1
Prof. Jorge Uzctegui Nava
DESTILACIN FRACCIONADA. INTRODUCCIN. La destilacin fraccionada es simplemente una tcnica para realizar una serie completa de pequeas destilaciones simples, en una sola operacin sencilla y continua. Esto se logra insertando entre el baln de destilacin y el cabezal, una columna de fraccionamiento tal como se muestra en el aparato de la figura 1.
Figura1. Aparato para la destilacin fraccionada En principio, una columna de destilacin fraccionada proporciona una gran superficie para el intercambio de calor, en las condiciones de equilibrio, entre el vapor ascendente y el condensado descendente. Esto posibilita una serie completa de evaporaciones y condensaciones parciales a lo largo de la columna. La columna de fraccionamiento hace posible que una mezcla binaria de l quidos miscibles, por e!emplo, benceno y tolueno, est su!eta continuamente a muchos ciclos de vaporizacin " condensacin, a medida que el material se mueve hacia arriba en la columna. #on cada ciclo, dentro de la columna, la composicin del vapor se enriquece progresivamente en el componente de menor punto de ebullicin. $inalmente, benceno puro %p.eb. &',' (#) emerge del tope de la columna, condensa y pasa al recipiente colector como la primera fraccin. La destilacin, debe efectuarse lentamente para asegurar la formacin de los numerosos ciclos de vaporizacin " evaporacin.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
2 2 2
#uando casi todo el benceno ha destilado, la temperatura comienza a aumentar y por lo tanto, se recoge una pequea fraccin de la segunda fraccin que contiene algo de benceno y tolueno. #uando la temperatura alcanza los 11' (#, punto de ebullicin del tolueno puro, el vapor se condensa y se colecta la tercera fraccin de tolueno puro, en un nuevo recipiente colector. *n gr+fico de punto de ebullicin en funcin del volumen de destilado, refle!a el proceso y se representa en la figura ,. -e nota claramente que la separacin es mucho me!or que en la destilacin simple.
Figura 2.
Representacin grfica de temperatura de ebullicin en funcin del volumen de destilado para la destilacin fraccionada de una mezcla de benceno y tolueno.
En los estudios de la destilacin fraccionada es me!or construir un diagrama que correlacione los puntos de ebullicin en funcin de la composicin de la fase l quida y la fase de vapor a presin constante que se muestra en la figura ., en lugar del diagrama presin de vapor como una funcin de la composicin a temperatura constante que se muestra en la figura /. #omo es m+s pr+ctico hacer variar la temperatura y mantener constante la presin que modificar esta 0ltima y hacer que sea constante la primera, las destilaciones fraccionadas se realizan a presin constante. 1 una presin e2terna dada, cualquier solucin de composicin definida ebullir+ a una temperatura a la que su presin total de vapor se hace igual a la presin e2terna. 3uesto que, de acuerdo con la Ley de 4aoult, las diferentes concentraciones de una solucin dan como resultado diferentes presiones de vapor, soluciones de concentraciones diferentes ebullir+n a temperaturas diferentes. Las soluciones cuyos componentes tengan ba!as presiones de vapor ebullir+n a temperaturas m+s altas que las que tengan componentes con presiones de vapor elevadas. Esto se debe a que las
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
3 3 3
soluciones con presiones de vapor m+s altas pueden alcanzar la presin e2terna a temperaturas relativamente menores y, por tanto, comienzan a ebullir a una temperatura m+s ba!a. #omo se mencion anteriormente, la figura . muestra el diagrama del punto de ebullicin para una solucin binaria ideal a una presin e2terna constante de 1 atm. 1l comparar el diagrama de la figura . con la figura /, observamos que la curva de l quido est+ por deba!o de la del vapor en la figura ., mientras que en la figura / se encuentran invertidas, es decir que, las dos curvas son similares en tipo con la e2cepcin de que est+n invertidas. Esto se comprende con facilidad, ya que, a presin constante, el estado de vapor e2iste a temperaturas m+s altas. En la figura /, el componente 1 puro posee un punto de ebullicin m+s ba!o que el componente 5 puro, o sea 61 7 65 , porque tiene una mayor presin de vapor que el componente 5. En el diagrama de punto de ebullicin en funcin de la composicin de la figura ., se obtienen dos curvas, una que da la composicin del l quido y la otra que da la composicin del vapor con el cual est+ en equilibrio al punto de ebullicin. La fase de vapor es m+s rica en el componente de menor punto de ebullicin y la fase l quida en el componente de mayor punto de ebullicin. Las l neas horizontales y verticales que se muestran en la figura ., representan los procesos que se realizan durante una destilacin fraccionada. #ada una de las l neas horizontales %L 181 9 L,8, 9 etc.), representan una etapa de vaporizacin de un determinado ciclo de vaporizacin " condensacin e indica la composicin del vapor en equilibrio con el l quido a una temperatura dada. 3or e!emplo, a :. (# un l quido con composicin de ;' < de 1 %L . en el diagrama), producir+ vapor en equilibrio de composicin &' < de 1 %8 . en el diagrama). El vapor resulta m+s rico en el componente de menor punto de ebullicin, 1, que en el l quido inicial. #ada una de las l neas verticales %8 1 L, 9 8, L. , etc), representa la etapa de condensacin para un ciclo dado de vaporizacin " condensacin. La composicin no cambia a medida que la temperatura disminuye en el proceso de condensacin. El vapor en el punto 8 . , por e!emplo, condensa para producir l quido L/ , de composicin &' < de 1, con una ca da de la temperatura desde :. (# hasta los ;. (#.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
4 4 4
Figura 3. Diagrama de fases de temperatura de ebullicin en funcin de la composicin para la destilacin fraccionada de una mezcla binaria ideal a presin constante.
Figura .! Diagrama de fases de presin de vapor en funcin de la composicin para una destilacin fraccionada de una solucin binaria ideal" a temperatura constante
1hora consideremos el diagrama de fases, para una solucin cuyo contenido inicial es de ; < de 1. La solucin de composicin ; < de 1 y =; < de 5, se calienta siguiendo el aumento de temperatura de la l nea punteada, hasta que se observa su ebullicin a los &> (# %punto L 1). El vapor tiene una composicin 81 de ,' < en 1 y &' < en 5. El vapor es m+s rico en 1 que en l quido original, pero ba!o ning0n concepto es 1 puro. En una destilacin simple, el l quido condensar a y pasar a al recipiente colector en estado altamente impuro. -in embargo, con una columna de fraccionamiento, el vapor condensar+ en la columna para dar l quido %L,), de composicin ,' < en 1 y &' < en 5. Este l quido %L,), se revaporiza %punto de ebullicin >& (#), para producir vapor, 8 , , de composicin ;' < en 1, que condensa para dar l quido de composicin L . %;' < en 1). El l quido L . %punto de ebullicin :. (#), es revaporizado para dar vapor de composicin 8 . , &' < en 1, el cual condensa para dar l quido L/ , &' < en 1 y ,' < en 5. 1l mismo tiempo, el l quido L / , es revaporizado %punto de ebullicin ;. (#), para generar vapor de composicin 8/ , =; < en 1 y ; < en 5, que se condensa para producir l quido de composicin L ; , =; < de 1 y ; < en 5. $inalmente, el l quido L;, %punto de ebullicin ;1 (#), se vaporiza una vez m+s, para dar vapor 8 ; , que es 1 esencialmente puro. El l quido 1 puro, emerge desde la columna y se condensa, pasando
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
5 5 5
al recipiente colector. ?ientras tanto, el componente 5, se ha concentrado en el baln de destilacin y puede ahora destilar como un componente puro. 1 todo lo largo de la columna e2iste un gradiente de temperaturas desde el punto de ebullicin de 1 hasta el punto de ebullicin de 5.
Figura #. $roceso de vaporizacin !condensacin en una columna de fraccionamiento Este gradiente representa una serie completa de equilibrios entre el l quido y el vapor en los que la concentracin de 1 aumenta progresivamente desde el e2tremo inferior al superior de la columna. El proceso descrito se esquematiza en la figura ;. EFICIENCIA DE UNA COLUMNA DE FRACCIONAMIENTO. *na medida de la eficiencia de una columna de fraccionamiento esta dada por el n0mero de platos tericos. *na columna tendr+ un plato terico, si el primer destilado %vapor condensado), tiene una
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
6 6 6
composicin localizada en %2 %,' < de 1), cuando se comienza con un l quido de composicin %1 %; < de 1), tal como se muestra en la figura anterior. Este proceso corresponde a una destilacin simple, es decir a un ciclo de vaporizacin " condensacin. *na columna tendr+ , platos tericos, si el destilado %vapor), tiene la composicin %3 %;' < de 1), comenzando con una mezcla de composicin %1 %; < de 1). La columna de dos platos tericos, realiza esencialmente @ dos destilaciones simples @, correspondientes a las l neas %1&1 %2 y %2&2 %3 , en el diagrama de fases anterior. 3or lo tanto, ser+n necesarios cinco platos tericos, para separar 1 casi puro %l neas %1&1 %2 ' %2&2 %3 ' %3&3 % ' % & %# y %#&#). E2perimentalmente, el primer plato terico, corresponde a la vaporizacin inicial desde el baln de destilacin, obtenindose los restantes cuatro platos de los ciclos de condensacin " evaporacin en la columna. La mayor a de las columnas no permiten que la destilacin se efect0e en etapas discretas, como se indica en el diagrama de fases. En su lugar, el proceso es continuo, permitiendo que los vapores estn continuamente en contacto con el l quido de composicin variable, a medida que este pasa a largo de la columna. La relacin entre el n0mero de platos tericos necesarios para separar una mezcla ideal de dos componentes y la diferencia entre los puntos de ebullicin de los componentes se da en la tabla AB 1. TABLA N 1. PLATOS TERICOS REQUERIDOS PARA SEPARAR MEZCLAS,
BASADOS EN LA DIFERENCIA DE PUNTO DE EBULLICIN DE SUS COMPONENTES. DIFERENCIA EN EL PUNTO EBULLICION 1'& >, ;/ /. .: DE NUMERO DE PLATOS TEORICOS 1 , . / ; DIFERENCIA EN EL NUMERO PUNTO EBULLICION ,' 1' > / , DE PLATOS TEORICOS 1' ,' .' ;' 1'' DE
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
7 7 7
Los valores se han calculado asumiendo que la columna opera en condiciones de equilibrio y un punto de ebullicin promedio de 1;' (# para cada mezcla. 3uesto que, las columnas raras veces funcionan en condiciones de equilibrio, puede ser necesario usar mayor n0mero de platos tericos, que los calculados, para lograr la separacin completa. 3or e!emplo, puede ser necesario, usar una columna con tres o cuatro platos, en lugar de los dos mencionados, para separar una mezcla con una diferencia de >, (#. La tabla, sin embargo, es todav a 0til, para suministrar un n0mero apro2imado de platos tericos, necesarios para separar mezclas de dos componentes. 3or e!emplo, se puede separar un compuesto 1, de punto de ebullicin 1'' (#, de un compuesto 5 de punto de ebullicin ,'' (#, por destilacin simple, ya que se requiere en forma apro2imada un slo plato terico. *na destilacin fraccionada, con una columna de apro2imadamente ; platos tericos, ser+ necesaria, para separar una mezcla de un compuesto de punto de ebullicin 1.' (# de otro de punto de ebullicin 1:: (#. 3ara que una separacin resulte adecuada, la eficiencia %n0mero de platos tericos) de la columna debe aumentar, a medida que las diferencias de puntos de ebullicin, entre los componentes disminuye. TIPOS DE COLUMNAS DE FRACCIONAMIENTOS. 1 travs de los aos se han desarrollado numerosos tipos de columnas de fraccionamiento para realizar separaciones de mezclas l quidas. Entre estas tenemos, la de relleno, la 8igreu2, tubo de Coung y la de platos, las cuales, se muestran en la figura :.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
8 8 8
c) Figura (. )ipos de columnas de fraccionamiento.
En una columna de relleno sencilla%a), %el relleno !uede consistir en una gran $ariedad de materiales inertes con una gran su!er%icie& como '(lices de $idrio& '(lices de metal& trocitos de carborundo o !orcelana& etc), e2iste un intercambio continuo de calor en la superficie del relleno entre el condensado descendente m+s fr o y el vapor ascendente m+s caliente. #uando el condensado, en alg0n punto de la columna toma calor del vapor, parte se evapora de nuevo y el vapor formado es m+s rico en el componente m+s vol+til que el condensado. 1l mismo tiempo, cuando el vapor cede calor al condensado, parte del mismo se condensa, siendo este condensado m+s rico que el vapor con el que esta en equilibrio en el componente de punto de ebullicin m+s elevado. De esta forma, el vapor que llega y es eliminado en la cabeza de la columna es componente de punto de ebullicin ba!o en estado puro9 el residuo del matraz es componente de punto de ebullicin elevado. La columna de 8igreu2 %b), tiene una serie de incrustaciones de vidrio en +ngulo de /; (#, las que se encuentran en pares en lados opuestos a lo largo del interior de la columna, para aumentar la superficie. #on este tipo de columna, se puede destilar l quidos en forma r+pida, pero con el inconveniente, que la eficiencia no es muy alta. 3or e!emplo, una columna de ,' cm, puede tener ,,; platos tericos y separar a materiales con una diferencia m+2ima de punto de ebullicin de :' (#. En cambio, el uso de las columnas de relleno permite separar mezclas cuya diferencia de puntos de ebullicin es menor, tal como se muestra en la tabla A (,. Las columnas 8igreu2, se usan con frecuencia en destilaciones en pequea escala, debido a su menor volumen de retencin, es decir, el volumen de l quido retenido por la columna al final de una destilacin. TABLA N 2. TIPO DE COLUMNA !2" #$ %& '()*+ X 1 #$ %&
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
COMPARACIN ENTRE LA COLUMNA DE VIGREUX NUMERO DE PLATOS TERICOS DIFERENCIAS DE PUNTO DE EBULLICIN
DOS TIPOS
DE COLUMNAS DE RELLENO. VOLUMEN DE RETENCIN !$',
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
9 9 9
1 / >
%-.$&/)+, 8igreu2 4ellena %hlices de vidrio) 4ellena %hlices de metal)
,,; ; 1.
:' .: 1>
La columna rellena de hlices de vidrio, tiene la venta!a que no reacciona con los compuestos org+nicos, mientras que las rellenas con hlices de metal, pueden reaccionar con compuestos org+nicos tales como los haluros de alquilo. El tubo de Coung %c), posee una espiral de vidrio enrollada en una varilla vertical, tambin de vidrio. El espiral debe fi!arse e2actamente dentro de las dimensiones de la columna, de modo que el espacio entre la pared interna de la columna y el espiral sea m nima, para prevenir de esta manera, el escape de cualquier cantidad apreciable de vapor, entre las paredes de la columna y el espiral. La columna de platos %d), est+ provista de pequeos estrechamientos en los que se recoge l quido condensado a intervalos regulares. En estas columnas, la mayor parte del condensado en el refrigerante, se devuelve de nuevo a la columna, recogindose en el colector slo una pequea fraccin. La relacin entre el condensado que se devuelve a la columna y el que se recoge recibe el nombre de relacin de reflujo. La eficacia del fraccionamiento aumenta al aumentar la relacin de reflu!o. Ca que como se muestra en la tabla ., los diferentes empaquetamientos de columna difieren ampliamente en eficiencia, es deseable, definir un par+metro que nos permita comparar, en forma cuantitativa su efectividad para la separacin de mezclas. 1ntes de definir la eficiencia de una columna de fraccionamiento, consideremos, el factor de enriquecimiento, , el cual se e2presa como el cociente de la relacin de las fracciones molares de los componentes de la mezcla en la fase de vapor y la relacin de las fracciones molares en la fase l quida para una destilacin simpleE
XA XB (vapor ) = factor de enriquecimiento XA XB (lquido)
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
10 10 10
El valor calculado para el factor de enriquecimiento, , dado por esta ecuacin, corresponde a un slo plato terico. El n0mero de platos tericos, n, en una columna, puede considerarse como el n0mero de veces que debe redestilarse la primera fraccin de destilado de una mezcla, obtenida por destilacin simple, de manera que se obtengan los mismos resultados que se logran aplicando una destilacin a travs de una columna, y se calculan por la e2presin E n*1
XA XA (lquido) = ( vapor en el tope de la columna ) XB XB
El e2ponente de es n F 1, en lugar de n, ya que el enriquecimiento en el vapor dentro del baln de destilacin corresponde a un plato terico por definicin. 1dicionalmente, si se divide la longitud en cm de la seccin de relleno de la columna de fraccionamiento por el n0mero de platos tericos se obtiene un par+metro denominado @ altura equivalente de plato terico +.,.).$. , de la columna, y que corresponde a la longitud de columna empaquetada requerida para realizar la separacin de un plato terico. Es decir +,)$ -
l (longitud de la columna empaquetada ) n (n merode platos teri cos)
3or e!emplo, una columna 8igreu2 recubierta de /' cm de longitud, tiene cuatro platos tericos, por tanto, su GE36, es de 1' cm H plato. ?uchos tipos de columnas de relleno que se calientan e2teriormente son considerablemente m+s eficaces, alcanzando valores de GE36 menores de 1 cm. Este n0mero puede ser 0til cuando se comparan las eficiencias relativas de varias columnas. ?ientras menor sea el valor de GE63, m+s eficiente ser+ la columna. 10n cuando, el valor e2acto de GE63 para un empaque dado, depende de las condiciones de operacin %di+metro de la columna, densidad del material de empaque, velocidad de destilacin, etc.), es 0til para obtener estimados apro2imados de valores relativos. La tabla ., registra valores representativos de GE63 para algunos materiales de empaque, medidos ba!o condiciones normales de traba!o en aparatos de destilacin de uso estudiantil, para la separacin de una mezcla de benceno y tolueno. )abla 3.! &alores de +,$)" para algunos materiales comunes.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
10
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
11 11 11
material de empa.ue carborundo lecho de vidrio hlices de vidrio hlices de metal
+,)$ /cm0 : &"= /"; &"=
3ara determinar el n0mero de platos tericos requeridos para obtener una separacin determinada, se puede hacer uso de la siguiente consideracinE -e define primero un patrn de separacin como la destilacin de una mezcla ideal ;' E ;' molar donde el primer /' < del material destilado tiene una pureza promedio del =; < en el componente de menor punto de ebullicin.
En estas condiciones, podemos aplicar la ecuacinE n /para la separacin estndar0 -
1,53 , la log10
cual e2presa que a medida que la volatilidad relativa, " se apro2ima a la unidad el n0mero de platos tericos para alcanzar el =; < de pureza aumenta abruptamente. 3or otra parte, para una solucin ideal de dos componentes de puntos de ebullicin )A y )1 , el n0mero de platos tericos, n, que se requieren para lograr una separacin est+ndar podr a calcularse por la siguiente ecuacinE n /para la separacin estndar0 -
250 , la cual significa TB TA
que a medida que la diferencia en los puntos de ebullicin, entre los componentes de la mezcla ideal es menor, el valor requerido de n para la separacin est+ndar aumentar+ r+pidamente. Esta relacin, es m+s 0til, pero tambin m+s apro2imada que la anterior. Itro mtodo para calcular el n0mero de platos tericos, consiste en aplicar el mtodo de ?c#abe " 6hiele, el que hace uso de la figura que se representa a continuacin.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
11
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
12 12 12
Figura 2.
34todo de 3c5abe ! )6iele para determinar el n7mero de platos tericos en una columna de fraccionamiento
*na vez que la columna ha funcionado, se analiza la composicin de la mezcla l quida del recipiente y el destilado que se condens en la parte superior de la columna. #omo se indica en la figura >, se traza una gr+fica de la fraccin molar del componente 1 en el vapor, en funcin de su fraccin molar en el l quido. Las cantidades del componente 1 en el recipiente y el destilado las dan los puntos a y f, respectivamente. Luego se traza una l nea de /; (, a lo largo de la cual J 1 K C1 en todos los puntos. La tarea consiste en determinar el n0mero de destilaciones que se producen entre a y f. El l quido en el punto a se vaporiza por completo %a lo largo de la l nea vertical aaL), para dar un valor en aL cuya composicin es la misma que la de la solucin original. Esto por supuesto, se encuentra en la l neas de /; ( en la que J 1a K J1aL . 1 continuacin, se condensa completamente el vapor con la composicin C1a %a lo largo de la l nea horizontal aLb), para obtener un l quido con una composicin de J 1b . -e repite este procedimiento hasta llegar al punto e2perimental f. El n0mero de pasos horizontales da el n0mero de destilaciones tericas simples que se llevaron a cabo. El n0mero de platos tericos en la columna es una unidad inferior al n0mero de pasos, ya que se considera que el recipiente es un plato terico. 3or tanto en la figura >, e2istir+n %; " 1), o sea / platos tericos.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
12
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
13 13 13
SOLUCIONES NO IDEALES DE DOS LQUIDOS VOLTILES. La mayor a de las soluciones obedecen la teor a de las soluciones ideales slo en un intervalo reducido de concentraciones de soluto9 la solucin ideal analizada con el e!emplo de la mezcla de benceno " tolueno, es bastante rara. Esto quiere decir que la mayor a de las soluciones son no ideales. La pregunta que queda por contestar es qu tipo de desviaciones de la teor a de soluciones ideales cabe esperar. Los e!emplos m+s notables de no idealidad en el caso de l quidos son los azetropos y otras mezclas que hierven a temperatura constante. -us desviaciones de la idealidad se deben a interacciones moleculares. -in embargo, como el n0mero de molculas que interact0a en un l quido es tan grande, no e2iste actualmente ninguna teor a que pueda e2plicar apropiadamente tales desviaciones. -e forma una solucin no ideal cuando el proceso de mezcla de sus componentes va acompaado de liberacin o absorcin de calor. Las soluciones no ideales no obedecen la Ley de 4aoult y la dependencia de sus presiones de vapor respecto a la concentracin puede ser bastante complicada. La liberacin de calor que se produce al mezclar dos l quidos indica que los componentes han encontrado en la solucin una situacin de energ a menor que en sus estados puros. Este comportamiento se presenta cuando la estructura molecular de los componentes es tal que las fuerzas de atraccin entre molculas diferentes son m+s intensas que las que hay entre molculas del mismo tipo. *n e!emplo espec fico de un par de molculas de esta clase son el cloroformo, #G#l., y la acetona, #G. " #I " #G..
5l 5l 5l 5 + 8 5
5+3
5+3
interaccin por puente de 6idrgeno entre cloroformo y acetona
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
13
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
14 14 14
#uando las molculas de cloroformo y acetona se apro2iman, el +tomo aislado de G de la molcula de cloroformo es atra do fuertemente hacia el +tomo de o2 geno de la molcula de acetona, formando un enlace por puente de hidrgeno, tal como se muestra en la figura. El enlace de hidrgeno no ocurre en #G#l . puro o en la acetona pura, porque no hay +tomos de o2 geno en el cloroformo, y los +tomos de G de la acetona no poseen las caracter sticas elctricas apropiadas para formar enlaces por puente de hidrgeno fuertes. Dado que la liberacin de calor indica que las molculas de la solucin est+n en una situacin de energ a ba!a, no es sorprendente que la presin de vapor de cada componente sea menor que la predicha por la Ley de 4aoult. En la figura &, se muestran las presiones de vapor en funcin de la concentracin de mezclas de cloroformo " acetona.
Figura 9. $resin de vapor en funcin de la composicin para soluciones de acetona ! cloroformo. Las l neas discontinuas indican las predicciones de la Ley de 4aoult. -e dice que una solucin de esta clase muestra desviaciones negativas de la Ley de Raoult , pues a cada concentracin, la presin de vapor de cada componente es menor que la predicha por la Ley de 4aoult. -in embargo, obsrvese que en ambos e2tremos de la escala de concentraciones, el componente que est+ en e2ceso se desv a de la Ley de 4aoult slo muy ligeramente. #omo el componente que
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
14
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
15 15 15
est+ en e2ceso se considera siempre que es el disolvente, se puede afirmar, con apro2imacin aceptable, que en una solucin diluida el disolvente obedece la Ley de 4aoult. La absorcin de calor durante la mezcla indica que las molculas de los componentes tienen en la solucin m+s energ a que en sus estados puros. En otras palabras, las fuerzas atractivas entre molculas diferentes son m+s dbiles que las e2istentes entre molculas del mismo tipo. #omo en una solucin de este tipo las molculas se encuentran en una condicin de energ a mayor, no es sorprendente que tengan mayor tendencia a escapar de la solucin y que la presin de vapor de cada componente sea mayor que la predicha por la Ley de 4aoult. Las soluciones que muestran estas desviaciones positivas de la Ley de Raoult son con frecuencia el resultado de mezclar un l quido formado por molculas polares con otro formado por molculas no polares. En solucin, la atraccin fuerte entre dos molculas polares se reemplaza por la atraccin m+s dbil que hay entre molculas polares y no polares, una situacin que es energticamente desfavorable. Entre los e!emplos de pares de l quidos que presentan desviaciones positivas de la idealidad, tenemos E ter et lico " acetona, disulfuro de carbono " acetona, tetracloruro de carbono " metanol y ciclohe2ano " benceno. En la figura =, se presenta una gr+fica del sistema ter " acetona, a .' (#. Las l neas discontinuas indican el comportamiento esperado si las soluciones fueran ideales. Es decir, que el disolvente obedece la Ley de 4aoult, cuando su fraccin molar se acerca a uno.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
15
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
16 16 16
Figura :. $resin de vapor en funcin de la composicin para soluciones acetona ! 4ter et;lico. ?uchos pares de l quidos no obedecen la Ley de 4aoult, como consecuencia de este hecho tendremos la formacin de soluciones de una composicin espec fica, que presentan puntos de ebullicin que son menores o mayores que los puntos de ebullicin de los componentes individuales de las mezclas, a estas soluciones se les denomina < mezclas azeotrpicas < AZETROPOS. *na mezcla de punto de ebullicin constante recibe el nombre de azetropo o mezcla azeotrpica %del griego que hierve sin alteracin). La composicin, como asimismo el punto de ebullicin, de una mezcla de este tipo, son constantes y no pueden ser alterados por destilacin simple o fraccionada. 3or lo tanto, un azetropo, act0a como si fuera un compuesto puro. E2isten dos tipos de azetropos, aquellos que poseen un punto de ebullicin menor que cualquiera de sus componentes %azetropo de punto de ebullicin mnimo) y aquellos que presentan un punto de ebullicin que es mayor que cualquiera de sus componentes % azetropo de punto de ebullicin mximo). De acuerdo con la discusin precedente, los azetropos de punto de ebullicin m nimo, ocurren cuando se mezclan molculas de muy diferente polaridad %por e!emplo9 etanol y heptano o acetona "
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
16
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
17 17 17
disulfuro de carbono). Los azeotrpos de alto punto de ebullicin, surgen cuando las fuerzas de atraccin entre las molculas del soluto y el solvente son mucho m+s grandes que las fuerzas de atraccin entre solamente las molculas del soluto. #omo se mencion, una mezcla l quida que muestre un comportamiento azetropico %punto de ebullicin muy definido a una composicin tambin muy definida), no puede separarse por el uso de la destilacin simple o fraccionada. 1lgunas veces, las mezclas azeotrpicas e2isten solamente en un intervalo espec fico de presiones, por lo tanto la separacin de componentes puros, puede lograrse por destilacin a una presin diferente. En general, los mtodos m+s pr+cticos para lograr la separacin de azetropos incluyen E cromatograf a, e2traccin o mediante alguna transformacin qu mica de uno o ambos componentes, seguida de un proceso de destilacin. 1lgunos slidos org+nicos se adhieren fuertemente al agua y son frecuentemente dif ciles de secar por mtodos convencionales. La disolucin de un slido de este tipo en benceno seguido por destilacin del azetropo benceno " agua que se forma, configura un mtodo bastante efectivo para destruir un azetropo. El benceno remanente, se puede eliminar por evaporacin asistida por un rota"evaporador. $recuentemente se pueden separar los dos componentes en estado puro que conforman una mezcla azetropica mediante la adicin de un tercer componente que altera la relacin de la presin de vapor del azetropo inicial y que conduce a la formacin de un nuevo azetropo ternario que se separa por destilacin, de!ando alguno de los componentes libre, para obtenerlo en forma pura. DIAGRAMAS TEMPERATURA - COMPOSICIN DE SISTEMAS NO IDEALES. (.AZETROPOS DE PUNTO DE EBULLICIN MNIMO. Es de esperar, que las soluciones cuyas curvas de presin de vapor muestren una desviacin de la idealidad, tengan tambin curvas de punto de ebullicin que difieran de las que muestran las soluciones ideales. Las curvas de presin de vapor que presentan un m+2imo, o sea aquellas en las que los componentes poseen una desviacin positiva de la idealidad, tienen diagramas de puntos de ebullicin que pasan por un m nimo, como se ilustra en la figura 1'. Las curvas que relacionan los puntos de ebullicin con la composicin de estos sistemas, se interpretan simplemente como si consistiesen de dos sistemas separados. 3or e!emplo, la figura &,
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
17
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
18 18 18
muestra un diagrama t pico temperatura composicin de un sistema de dos componentes 1 y 2, que forman una mezcla de punto de ebullicin m nimo, representado por )c . -i tenemos una solucin cuya concentracin est+ entre =2 - > y =2 - =25 , como se ve en la figura, los 0nicos componentes que se pueden separar mediante la destilacin fraccionada son el componente 1 puro y el azetropo con una composicin =25 . -i se calienta una solucin de composicin =2a , ebullir+ a la temperatura )a , que representa el punto a en el diagrama. El vapor en equilibrio con esta solucin, a )a " lo da el punto a? y tiene una composicin dada por @2a . 3uesto que @2a A =2a , el vapor ser+ m+s rico en el componente 2 %componente de menor punto de ebullicin), que el l quido residual. 1l continuar la ebullicin, la temperatura del l quido aumenta, ya que es m+s rico en el componente 1" menos vol+til.
Figura 1>. Diagrama temperatura ! composicin para un sistema .ue forma una mezcla de punto de ebullicin m;nimo. 1s eventualmente, la destilacin continua del residuo l quido dar+ el componente 1 puro, de punto de ebullicin m+s elevado, en el residuo, y la mezcla azeotrpica de punto de ebullicin m nimo en
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
18
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
19 19 19
el punto c, en el destilado. 3or tanto, la mezcla l quida de composicin =25 ebullir+ completamente a la temperatura constante )c " sin cambios en la composicin. 1s pues, los azetropos act0an como si fueran componentes puros, puesto que ebullen a una temperatura dada con una composicin definida9 sin embargo, tanto la composicin como los puntos de ebullicin de los azetropos var an con la presin, lo cual indica que no son compuestos definidos. 3or otra parte, si la concentracin de una solucin se encuentra entre =2 - =25 y =2 - 1, los 0nicos componentes que se podr+n obtener mediante la destilacin fraccionada son el componente 2 puro y una mezcla azeotrpica de composicin =25 . -i se calienta a la temperatura )b una solucin de composicin =2b, esta ebullir+ en el punto b, y estar+ en equilibrio con el vapor en el punto b?" que tiene una concentracin @2b. 3uesto que @2b B =2b , el vapor ser+ m+s pobre en el componente 2 que en el residuo l quido. 1l proseguir la ebullicin, el l quido se har+ cada vez m+s rico en el componente 2 de punto de ebullicin m+s elevado, mientras que el vapor dar+ la mezcla azeotrpica =25 , con el punto de ebullicin m+s ba!o. El azetropo de punto de ebullicin m nimo m+s com0n es una mezcla de etanol " agua, cuyo diagrama se muestra en la figura 11. El azetropo &3 , en la figura, tiene una composicin de apro2imadamente =: < de etanol y / < de agua y un punto de ebullicin de >&,1 (#.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
19
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
20 20 20
Figura 11. Diagrama de fases para el azetropo de punto de ebullicin m;nimo etanol ! agua. Este punto de ebullicin no es mucho menor que el punto de ebullicin del etanol puro %>&,. (#). -in embargo, esta pequea diferencia significa que tan slo se puede obtener una mezcla de composicin =: < en etanol y / < en agua, al someterla a una destilacin simple o fraccionada. 10n con la me!or columna de fraccionamiento, no se puede obtener etanol al 1'' <. Esto se puede lograr, removiendo el / < de agua presente en el azetropo, aadiendo benceno y removiendo el nuevo azetropo ternario %agua " etanol " benceno), que se forma de punto de ebullicin :; (#. *na vez que el agua sea eliminada, el e2ceso de benceno se remueve como un azetropo formado por etanol " benceno de punto de ebullicin :& (#. El material resultante que permanece estar+ libre de agua y es denominado alcohol absoluto. El comportamiento de una mezcla de etanol " agua en un proceso de destilacin fraccionada de composicin C" en la figura =" se describe de la siguiente manera E La mezcla se calienta %l nea =%1), hasta que se observa su ebullicin en el punto %1. El vapor &1 ser+ m+s rico en el componente de menor punto de ebullicin, etanol, que en la mezcla original. El condensado %2 se vaporiza para dar &2. El proceso continua, siguiendo la l nea &2%3 hasta que se obtenga el azetropo en &3 .
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
20
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
21 21 21
El destilado no es etanol puro, sino una mezcla de composicin apro2imada de =: < en etanol y / < en agua. El contenido del recipiente colector llega a ser progresivamente m+s rico en el componente de mayor punto de ebullicin, agua, a medida que transcurre la destilacin. #uando todo el alcohol se remueve como el azetropo, permanecer+ agua pura en el baln de destilacin que destilar+ a 1'' (#. *na solucin que contiene =: < de etanol y / < de agua, act0a como si fuera un l quido puro, ebullendo a >&,1 (#, sin cambio en la composicin del vapor. 1lgunos azetropos comunes de punto de ebullicin m nimo se dan en la tabla /. )abla . 5omposicin de azetropos comunes de punto de ebullicin m;nimo
583$8EF5F8G AD,8)R8$8 Etanol " agua 5enceno " agua 5enceno " agua " etanol ?etanol " tetracloruro carbono Etanol " benceno ?etanol " tolueno ?etanol " benceno #iclohe2ano " etanol , " propanol " agua 1cetato de butilo " agua $enol " agua /porcentaHe en peso0 =;,: < etanol 9 /,/ < agua =1,1 < benceno 9 &,= < agua >/,1 < benceno 9 >,/ < agua 9 1&,; < etanol de ,',: < metanol 9 >=, / < tetracloruro de carbono .,,/ < etanol 9 :>,: < benceno >,,/ <metanol 9 ,>,: < tolueno .=,; < metanol 9 :',; < benceno :=,; < ciclohe2ano 9 .',; < etanol &>,& < , " propanol 9 1,,, < agua >,,= < acetato de butilo " ,>,1 < agua =,, < fenol 9 =',& < agua $IG)8 D, ,1I%%F5F8G /J50 >&,1> :=,/ :/,= ;;,> :>,& :.,> ;&,. :/,= &',/ =',> ==,;
0.-
AZETROPOS DE PUNTO DE EBULLICIN MXIMO.
Las curvas de presin de vapor que muestran un m nimo, o sea aquellas en las que los componentes tienen una desviacin negativa de la idealidad en la presin de vapor, tienen diagramas de punto de ebullicin que pasan por un m+2imo, como se ilustra en la figura 1,.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
21
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
22 22 22
Figura 12. Diagrama temperatura ! composicin para un sistema .ue forma una mezcla de punto de ebullicin mCimo. 3or medio de un razonamiento an+logo al caso anterior, se pueden obtener ya sea el azetropo en el punto c y el componente 1 o el azetropo y el componente puro 2 mediante la destilacin fraccionada, dependiendo de si la concentracin de un componente de la mezcla l quida es menor o mayor que la de la mezcla azeotrpica. 3or e!emplo, si consideramos una mezcla l quida que tiene una composicin de ,' < en 1 y &' < en 5, la destilacin fraccionada resultar+ en el componente 5 puro, de menor punto de ebullicin, con un azetropo de mayor punto de ebullicin. En este caso nunca se podr+ obtener el componente 1 en estado puro. -i en cambio, la composicin inicial de la mezcla l quida es &' < en 1 y ,' < en 5, no se podr+ obtener nunca el componente 5 puro. La figura 1. muestra esquem+ticamente el razonamiento anterior.
Figura 13. Azetropo de punto de ebullicin mCimo. En la tabla ; se enumeran algunos azetropos de punto de ebullicin m+2imo con sus composiciones en porcenta!e en peso y sus respectivos puntos de ebullicin.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
22
UNIVERSIDAD DE LOS ANDES FACULTAD DE CIENCIAS DEPARTAMENTO DE QUIMICA COORDINACIN LABORATORIOS QUMICA ORGNICA LABORATORIO DE QUMICA ORGNICA I - A
23 23 23
)abla #. Azetropos de punto de ebullicin mCimo. 583$8EF5F8G AD,8)R8$8 1cetona " cloroformo #loroformo " , " butanona 1cido clorh drico 1cido actico " dio2ano 5enzaldeh do " fenol ,',' /porcentaHe en peso0 < acetona 9 &',' < $IG)8 D, ,1I%%F5F8G /J50 :/,> >=,= 1'&,: 11=,; 1&;,:
cloroformo 1>,' < cloroformo 9 &.,' < , " butanona ,',, < 9 >=,& < agua >>,' < +cido actico 9 ,.,' < dio2ano /=,' benzaldeh do 9 ;1,' fenol
1F1%F8KRAFFA 1. Fntroduction to 8rganic %aboratory )ec6ni.ues. 1 #ontemporary 1pproach, -econd Edition., 3avia, Lampman y Mriz 2. 5urso $rctico de Lu;mica 8rgnica , 6ercera Edicin, 5reNster, 8anderNerf, ?cENen .. Lu;mica 8rgnica" Fundamentos tericos M prcticos para el %aboratorio. Ouinta Edicin. " Lydia PalagovsQy Murman, ?anuales Eudeba, 5uenos 1ires, 1==;. /. Lu;mica 8rgnica ,Cperimental. 3rimera Edicin Espaola., G. D. Durst y P. R. PoQel, Editorial 4evert -.1., 5arcelona, 1=&; . ;. A )eCt 1ooN of $ractical 8rganic 56emistry" 6hird Edition., 1. S. 8ogel., Riley., AeN CorQ., 1=>,. :. ,Cperimentos de Lu;mica 8rgnica. L. $. $ieser., Editorial 4evert -.1., ?adrid., 1=:>.
Laboratorio de Qumica Orgnica I- A. Prctica N 5. Destilacin im!le " #raccionada
23
Vous aimerez peut-être aussi
- Balance de materia orientado a procesosD'EverandBalance de materia orientado a procesosPas encore d'évaluation
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Calculo Del Numero de Platos de Una Torre de Destilacion PDFDocument35 pagesCalculo Del Numero de Platos de Una Torre de Destilacion PDFyoly10100% (1)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesD'EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesPas encore d'évaluation
- Velocidad CalentamientoDocument11 pagesVelocidad CalentamientoyojanPas encore d'évaluation
- Objetivos de La PrácticaDocument12 pagesObjetivos de La PrácticaSoraya Sanchez MohedanoPas encore d'évaluation
- 7-Tipos de DestilaciónDocument11 pages7-Tipos de DestilaciónesmeraldaPas encore d'évaluation
- Destilación FraccionadaDocument18 pagesDestilación FraccionadaLorena VivasPas encore d'évaluation
- Ponchon SavaritDocument21 pagesPonchon SavaritJorge RomoPas encore d'évaluation
- Laboratorio ArrastreDocument10 pagesLaboratorio ArrastreMarlox-kPas encore d'évaluation
- Destilacion en Corriente de VaporDocument15 pagesDestilacion en Corriente de VaporluisPas encore d'évaluation
- Destilación Simple y FraccionadaDocument6 pagesDestilación Simple y FraccionadaLu AscencioPas encore d'évaluation
- P DestilacionDocument27 pagesP Destilacionhigienequimica5041100% (3)
- Guía 7-DestilaciónDocument9 pagesGuía 7-DestilaciónkatherinePas encore d'évaluation
- Destilacion Fraccionada FinalDocument5 pagesDestilacion Fraccionada FinalLuisis321Pas encore d'évaluation
- Destilación Simple Informe 4Document8 pagesDestilación Simple Informe 4Andres OrtizPas encore d'évaluation
- Destilación FraccioanadaDocument10 pagesDestilación Fraccioanadacamila B.Pas encore d'évaluation
- Procesos de SeparaciónDocument116 pagesProcesos de SeparaciónLaura Castaño GarridoPas encore d'évaluation
- Tecnicas Comunes de LaboratorioDocument9 pagesTecnicas Comunes de LaboratorioHanns GomezPas encore d'évaluation
- DestilaciónDocument5 pagesDestilaciónDavid Montaño PozoPas encore d'évaluation
- Destilacion Ing 3Document14 pagesDestilacion Ing 3winnyPas encore d'évaluation
- Preguntas LaboratorioDocument7 pagesPreguntas LaboratorioMonica OramasPas encore d'évaluation
- Destilacion de Un Solvente Volatil EtanolDocument20 pagesDestilacion de Un Solvente Volatil Etanollmrc101Pas encore d'évaluation
- Destilacion - TeoriaDocument32 pagesDestilacion - TeoriaGracielaProiettiPas encore d'évaluation
- Laboratorio Destilacion Fraccionada para ImprimirDocument5 pagesLaboratorio Destilacion Fraccionada para ImprimirNatyCalderónCabreraPas encore d'évaluation
- Reacción 6lk5bvolátilDocument34 pagesReacción 6lk5bvolátilXimena GutierrezPas encore d'évaluation
- Laboratorio Integral IiDocument5 pagesLaboratorio Integral IiEdeleryPas encore d'évaluation
- Tema 5. Curso de DestilaciónDocument50 pagesTema 5. Curso de DestilaciónCarlos OlivellaPas encore d'évaluation
- Glosario de TérminosDocument8 pagesGlosario de TérminosJesusito Manuel RojasPas encore d'évaluation
- Destilación Simple y Fraccionada Punto de EbulliciónDocument9 pagesDestilación Simple y Fraccionada Punto de Ebullición.:("*"BLacK BuLLeT"*"):.80% (5)
- P 10 Destilacion Bach Con RectificacionDocument24 pagesP 10 Destilacion Bach Con RectificacionChris QCPas encore d'évaluation
- Destilacion Batch - CompletoDocument26 pagesDestilacion Batch - CompletoAnaFabiolaBaptistaMatheusPas encore d'évaluation
- Destilacion FraccionadaDocument26 pagesDestilacion FraccionadaLuis Antonio VazquezPas encore d'évaluation
- Los Puntos de Ebullición de Los Alcoholes También Son Influenciados Por La Polaridad Delcompuesto y La Cantidad de Puentes de HidrógenoDocument3 pagesLos Puntos de Ebullición de Los Alcoholes También Son Influenciados Por La Polaridad Delcompuesto y La Cantidad de Puentes de HidrógenoHenrry ParedesPas encore d'évaluation
- Tema 5 Separaciones Tc3a9rmicasDocument80 pagesTema 5 Separaciones Tc3a9rmicasquimmaseda1144Pas encore d'évaluation
- Columnas de Rectificacion 23Document25 pagesColumnas de Rectificacion 23Rodrigo Salinas HuamancondorPas encore d'évaluation
- DESTILACION 2da ParteDocument51 pagesDESTILACION 2da ParteIvan Carlos Cerquera PerezPas encore d'évaluation
- Destilación Normal de Una MezclaDocument9 pagesDestilación Normal de Una MezclaJuan Carlos Sullca CasasPas encore d'évaluation
- 8502-15 Laboratorio de Quimica OrganicaDocument59 pages8502-15 Laboratorio de Quimica OrganicaVictor Javier Coaquira MamaniPas encore d'évaluation
- DESTILACIÓNDocument16 pagesDESTILACIÓNJuan Julio BadaracoPas encore d'évaluation
- Destilacion Bach Con Rectificacion (Pract 11) ImprimirDocument30 pagesDestilacion Bach Con Rectificacion (Pract 11) ImprimirLuis TelloPas encore d'évaluation
- EvaporadoresDocument8 pagesEvaporadoreszirkan_mrPas encore d'évaluation
- DestilacionDocument5 pagesDestilacionJhovani FrancoPas encore d'évaluation
- Práctica de DestilaciónDocument18 pagesPráctica de DestilaciónMuny ZAPas encore d'évaluation
- Arrastre Por VaporDocument10 pagesArrastre Por VaporXime VeGaPas encore d'évaluation
- Arequipe - EvaporacionDocument4 pagesArequipe - EvaporacionLoReena MoRaPas encore d'évaluation
- Arrastre Con VaporDocument17 pagesArrastre Con VaporSantiago Alexander Borges Hernandez0% (1)
- Practica 4. Destilacion Simple y FraccionadaDocument3 pagesPractica 4. Destilacion Simple y FraccionadaSara Ventura67% (3)
- Columna de FraccionamientoDocument9 pagesColumna de FraccionamientoMarcelo Andres Serrano AlconPas encore d'évaluation
- YaDocument7 pagesYaGISELLA SOFIA LEAL PERTUZPas encore d'évaluation
- Destilacion Por Carga (URU)Document29 pagesDestilacion Por Carga (URU)JoseRicardoNogueraPas encore d'évaluation
- La Destilacion PDFDocument17 pagesLa Destilacion PDFMarco Antonio Fernandez LuisPas encore d'évaluation
- DestilaciónDocument28 pagesDestilaciónAlfonsoGomezCastroPas encore d'évaluation
- Laboratorio de Destilación Con Columna EmpacadaDocument10 pagesLaboratorio de Destilación Con Columna Empacadaomat567Pas encore d'évaluation
- Unidad1 FraccionamientDocument9 pagesUnidad1 FraccionamientRenso linaresPas encore d'évaluation
- Unidad 2 Destilación PDFDocument13 pagesUnidad 2 Destilación PDFNicandroGonzalesPas encore d'évaluation
- Psicometría. Principios básicos y protocolos experimentales diversosD'EverandPsicometría. Principios básicos y protocolos experimentales diversosPas encore d'évaluation
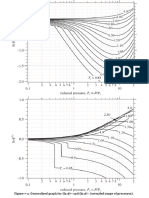
- Gráficas Generalizadas de Coeficientes de FugacidadDocument1 pageGráficas Generalizadas de Coeficientes de FugacidadSantiago Alexander Borges HernandezPas encore d'évaluation
- Gráficas Generalizadas de Z (Método de Lee-Kesler)Document1 pageGráficas Generalizadas de Z (Método de Lee-Kesler)Santiago Alexander Borges HernandezPas encore d'évaluation
- Identificación de Cationes de Los Grupos 0 Al V y de AnionesDocument8 pagesIdentificación de Cationes de Los Grupos 0 Al V y de AnionesSantiago Alexander Borges HernandezPas encore d'évaluation
- Constantes de Viscosidad CinemáticaDocument2 pagesConstantes de Viscosidad CinemáticaSantiago Alexander Borges HernandezPas encore d'évaluation
- Guia Problemas Resueltos ELV TermoDocument21 pagesGuia Problemas Resueltos ELV TermoMauricio Andrés Gutiérrez BravoPas encore d'évaluation
- Capítulos 4 y 5 - BalzhiserDocument43 pagesCapítulos 4 y 5 - BalzhiserSantiago Alexander Borges HernandezPas encore d'évaluation
- Diagrama de Mollier SolkaneDocument11 pagesDiagrama de Mollier SolkaneCesar Orlando Barria VeraPas encore d'évaluation
- Mc3b3dulo 9 Sobre Programacic3b3n Matlab2 PDFDocument32 pagesMc3b3dulo 9 Sobre Programacic3b3n Matlab2 PDFHector Arizaga IdrovoPas encore d'évaluation
- Nomogramas de Presión de Vapor para Hidrocarburos Livianos A Altas y Bajas TemperaturasDocument2 pagesNomogramas de Presión de Vapor para Hidrocarburos Livianos A Altas y Bajas TemperaturasSantiago Alexander Borges Hernandez0% (1)
- Método Del Árbol de SíntesisDocument68 pagesMétodo Del Árbol de SíntesisSantiago Alexander Borges HernandezPas encore d'évaluation
- La Química de Los Alimentos - Deanna MarcanoDocument356 pagesLa Química de Los Alimentos - Deanna MarcanoSantiago Alexander Borges Hernandez100% (4)
- Arrastre Con VaporDocument17 pagesArrastre Con VaporSantiago Alexander Borges Hernandez0% (1)
- Ejemplo de Difusión Crank-NicolsonDocument4 pagesEjemplo de Difusión Crank-NicolsonSantiago Alexander Borges HernandezPas encore d'évaluation
- Práctica #4. Extracción de La Cafeína Del TéDocument13 pagesPráctica #4. Extracción de La Cafeína Del TéSantiago Alexander Borges Hernandez50% (2)
- Átomos PolielectrónicosDocument3 pagesÁtomos PolielectrónicosNadia AlvaradoPas encore d'évaluation
- Reserva Nacional de MatsésDocument2 pagesReserva Nacional de MatsésMelPas encore d'évaluation
- EXAMENES PASADOS 2020 y 2021 SEGUNDO PARCIAL FQB-102Document4 pagesEXAMENES PASADOS 2020 y 2021 SEGUNDO PARCIAL FQB-102Natalia CarreraPas encore d'évaluation
- Juego OCA ODSDocument4 pagesJuego OCA ODSBlanksillasPas encore d'évaluation
- Resalto Hidraulico (Folleto Digitalizado) 1ersemestre2020Document9 pagesResalto Hidraulico (Folleto Digitalizado) 1ersemestre2020Alberto Flores KlussmannPas encore d'évaluation
- Practica 2Document8 pagesPractica 2Miriam CuinPas encore d'évaluation
- Tema 2 - Química OrgánicaDocument8 pagesTema 2 - Química OrgánicaDexPas encore d'évaluation
- P Solar M C Perc HC Artm144 450w 24vDocument10 pagesP Solar M C Perc HC Artm144 450w 24vCarlos Cortina MartinezPas encore d'évaluation
- Reproducción Asexual y SexualDocument3 pagesReproducción Asexual y SexualDíaz Zumaeta Ariana MichellePas encore d'évaluation
- LuminolDocument9 pagesLuminolEdwin Giovanny Herrera BucheliPas encore d'évaluation
- PCC Primero Fisica 2019-2020Document12 pagesPCC Primero Fisica 2019-2020byit s5100% (1)
- Conexion de Pantallas Sist Subt AT 115kV CFEDocument12 pagesConexion de Pantallas Sist Subt AT 115kV CFEBoris Miranda100% (1)
- Actividad 3Document3 pagesActividad 3D1360:)Pas encore d'évaluation
- ESCORRENTIADocument16 pagesESCORRENTIAMarcelo Cuentas MercadoPas encore d'évaluation
- Procedimiento Constructivo de Una Losa DeportivaDocument7 pagesProcedimiento Constructivo de Una Losa DeportivaAnthony M. IpmedPas encore d'évaluation
- Fase 1 Texto ParaleloDocument17 pagesFase 1 Texto ParaleloCLAUDIA GABRIELA HERNÃ�NDEZ QUIÑONEZPas encore d'évaluation
- Arqueología Colombiana. Ciencia, Pasado y ExclusiónDocument240 pagesArqueología Colombiana. Ciencia, Pasado y ExclusiónGabriel CatañoPas encore d'évaluation
- La Materia y La Energia para Sexto de PrimariaDocument4 pagesLa Materia y La Energia para Sexto de PrimariarosaPas encore d'évaluation
- MODULO 1 - Magnitudes y Errores.Document15 pagesMODULO 1 - Magnitudes y Errores.Emely ReyesPas encore d'évaluation
- Catalogo Eastech SolarDocument15 pagesCatalogo Eastech SolarManuel Sabaté LópezPas encore d'évaluation
- Electrostática para Quinto Grado de SecundariaDocument7 pagesElectrostática para Quinto Grado de SecundariaSmith DAPas encore d'évaluation
- Ciclo RankineDocument3 pagesCiclo RankineGarcia PerezPas encore d'évaluation
- Tarea Control de La ErosiónDocument7 pagesTarea Control de La ErosiónCesarManuelCastilloCamachoPas encore d'évaluation
- MDP - 05 - e - 04 (Procedimiento de Diseño para Intercambiadores de Doble Tubo)Document27 pagesMDP - 05 - e - 04 (Procedimiento de Diseño para Intercambiadores de Doble Tubo)Noah RuizPas encore d'évaluation
- La Utopía de Reconstrucción.Document4 pagesLa Utopía de Reconstrucción.InmitrosPas encore d'évaluation
- Flotación de Sulfuros de Plomo - Diseñor TrifactorialDocument36 pagesFlotación de Sulfuros de Plomo - Diseñor TrifactorialPedro RodriguezPas encore d'évaluation
- Practica Final de Quimica IDocument31 pagesPractica Final de Quimica IRobert Colon ReyesPas encore d'évaluation
- NTP - 198 Botellas Gas ComprimidoDocument12 pagesNTP - 198 Botellas Gas ComprimidoFernando SaavedraPas encore d'évaluation
- Secado SolarDocument33 pagesSecado SolarPercy Huauya PabloPas encore d'évaluation
- Sesión 4Document30 pagesSesión 4Carc Pamam ccsPas encore d'évaluation