Académique Documents
Professionnel Documents
Culture Documents
Cap 11-Conservación de La Energía, 1ra Ley de La Termodinámica
Transféré par
Richard Payano Yale0 évaluation0% ont trouvé ce document utile (0 vote)
63 vues6 pagesTitre original
Cap 11-Conservación de la energía, 1ra Ley de la Termodinámica
Copyright
© Attribution Non-Commercial (BY-NC)
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Attribution Non-Commercial (BY-NC)
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
63 vues6 pagesCap 11-Conservación de La Energía, 1ra Ley de La Termodinámica
Transféré par
Richard Payano YaleDroits d'auteur :
Attribution Non-Commercial (BY-NC)
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 6
Cuaderno de Actividades: Fsica I
Mg. Percy Vctor Caote Fajardo
256
11) Conservacin de la energa,
1
ra
Ley de la Termodinmica
Cuaderno de Actividades: Fsica I
Mg. Percy Vctor Caote Fajardo
257
6) Conservacin de la energa, 1ra Ley de la
Termodinmica
Experimentaremos como en un sistema fsico se pueden producir diversas
transformaciones de energa que involucren calor, energa trmica, energa
interna, energa mecnica o, como es posible virtud al calor, bajo
determinadas condiciones, hacer que un sistema realice trabajo, esto es, como
un sistema es capaz de hacer trabajo. En todos los casos es posible plantear
la conservacin de la energa, que en termodinmica constituye su 1
ra
Ley.
6.1) Calor y Energa trmica en sistemas termodinmicos
Un sistema termodinmico ser un sistema fsico que podr especificarse
usando ciertas variables macro o microscpicas, usaremos en general, las
variables macroscpicas (p, V, T, U) para describir el estado de estos
sistemas.
En el contexto energtico, las energas asociadas a los sistemas
termodinmicos son,
i) Energa interna, es la energa propia del sistema asumido estacionario.
ii) Energa trmica, parte de la energa interna que depende de la T.
iii) Calor, energa trmica transferida por diferencia de T
s
.
En cuanto a que en diversos procesos se ha observado conversin de E
M
en Q
(energa trmica), es adecuado contar con una relacin adecuada que permita
hacer la conversin, esa expresin la obtuvo James Joule con su notable
experimento, hall lo que actualmente se conoce como equivalente mecnico
de la calora,
1 4,186 cal J
? Represente en un sistema gaseoso poco denso las diversas formas de
energa.
? Describa el experimento de James Joule.
6.2) Trabajo y Calor en procesos termodinmicos.
Especificar el estado de los sistemas termodinmicos puede depender de
diversas consideraciones, por ejemplo, de la naturaleza del sistema. Usaremos
mayoritariamente un sistema gas constituido por un solo tipo de molcula (gas
ideal), que adems se encuentre en equilibrio trmico interno, es decir, que
cada punto del sistema se encuentre a los mismos valores de p y T.
Un proceso termodinmico es una secuencia continua de estados, por
los que atraviesa el sistema, para transformarse de un estado inicial a
otro final.
Cuaderno de Actividades: Fsica I
Mg. Percy Vctor Caote Fajardo
258
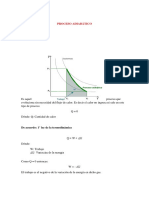
i) Trabajo, W
Supongamos un gas contenido en un cilindro con mbolo mvil, en equilibrio,
con valores de presin y volumen, p y V, respectivamente. Si se aade calor al
gas de tal manera que se expanda lentamente, esto es, cuasiestticamente,
para garantizar el equilibrio termodinmico del gas, entonces, el trabajo
efectuado por el gas sobre el mbolo ser,
( )
, A: Area del embolo
, : Cambio de V debido a la expansin
g g
f
i
v
v
dW
Adx dV
p p V
Fdx F dx F pA
dW p p dV Adx dV
W pdV
}
Por lo tanto, para calcular el W hecho por el gas (qu ser asumido +) se
deber conocer ( ) p p V . Una grafica p-V nos muestra al W hecho por el gas
mediante el rea bajo la curva,
GAS
T
1 (p
1
,V
1
,T
1
)
Proceso
V
p 2(p
2
, V
2
, T
2
)
A
F
g
F
e
x x
Cuaderno de Actividades: Fsica I
Mg. Percy Vctor Caote Fajardo
259
Ahora, un detalle importante en cuanto a la realizacin del W hecho por el gas,
es que este depende solo del proceso, mas no de los estados i f. Se muestra
a continuacin 2 curvas p-V entre los estados i-f que corroboran este hecho,
ii) Calor, Q
El calor, forma de energa trmica, puede darse o extraerse de diversas
formas para que el sistema evolucione del estado inicial al final, esto es, una
vez ms, esta CFE no es una funcin de los estados i-f, si no, del camino
(proceso) para pasar de if.
Por ejemplo, un gas ideal puede expandirse desde un Vi hasta un V
f
, a
T cte , absorbiendo calor, pero, se puede lograr lo mismo con un gas ideal
haciendo que su energa interna cambie sin recibir Q.
p
i
p
i
p
f
f
W
V
v
i
v
f
p p
p
i
i p
i
i
f p
f
w
2
f
p
f
w
i
v
i
v
f
V v
i
v
f
V
Cuaderno de Actividades: Fsica I
Mg. Percy Vctor Caote Fajardo
260
6.3) 1
ra
Ley de la Termodinmica, Conservacin de la Energa.
Segn lo observado para W y Q, cada una de ellas dependen de la forma
como se realice la transformacin del sistema entre los estados i f; la
cantidad de calor (energa trmica) que se agrega a un sistema se puede
transformar en trabajo hecho por el sistema y cambios en su energa interna,
de igual modo ocurre con el trabajo realizado por (o sobre) el sistema. Esto es,
si se considerara la energa Q-W sobre un sistema, de observaran 2 hechos
importantsimos,
j) Slo dependen de los estados inicial-final del sistema.
jj) Provocan cambios de la energa interna del sistema, AU, haciendo que U
slo dependa de los estados i-f.
De tal manera que, de acuerdo a la conservacin de la energa.,
Q W U o Q U W A A +
En esta ecuacin, como ya se indic, la energa U esta vinculada al estado del
sistema, esto es, podra usarse para caracterizarlo. U es una propiedad del
sistema, lo define; ms an, no es tanto U si no AU la cantidad energtica
importante. U es por lo tanto una funcin de estado.
6.4) Procesos trmicos importantes.
Describimos como un sistema termodinmico especial (gas ideal) se
transforma del estado inicial al estado final, mediante la 1
ra
Ley de la
termodinmica.
i) PT con sistema aislado
Q 0 y W 0 AU 0 U
i
U
f
o
ii) PT cclico
Estado i Estado f: AU 0 Q W |
iii) PT Adiabtico
Q 0 AU -W
Caso especial: Expansin libre adiabtica, W 0.
Cuaderno de Actividades: Fsica I
Mg. Percy Vctor Caote Fajardo
261
? Aplicaciones tecnolgicas de los PT adiabticos.
iv) PT Isotrmico
T constante : AU 0 Q W nRTln
f
i
V
V
`
)
|expansin| c
Gas ideal : pV nRT
v) PT isobtico
p constante : W pAV, AV V
f
- V
i
|
vi) PT isovolumtrico o isocoro
V constante: W 0 Q AU
Observaciones:
j) Los Ws sern +s si los realiza el sistema sobre los exteriores y los Qs sern
+s cuando se entregan al sistema. Por consiguiente, cuando W es hecho
sobre el sistema o Q sale del sistema se habrn de considerar s.
jj) Las ecuaciones y hacen indistinguibles a Q y W!
Esto es, nunca se podr distinguir microscpicamente si AU fue producida
por Q o W.
Vous aimerez peut-être aussi
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesD'EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesPas encore d'évaluation
- UntecsDocument6 pagesUntecsandryuntecsPas encore d'évaluation
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaD'EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaPas encore d'évaluation
- Cap 11-1ra LT-MEJORADODocument10 pagesCap 11-1ra LT-MEJORADOFreemanPas encore d'évaluation
- 1 Era LTDocument10 pages1 Era LTGonzalo Salvador GuevaraPas encore d'évaluation
- Cap 5Document47 pagesCap 5Carlos Javier Cotrina SaavedraPas encore d'évaluation
- Aputes de SolidifaciónDocument37 pagesAputes de SolidifaciónCaballero RrzPas encore d'évaluation
- GUIA Primera Ley de La TermodinamicaDocument5 pagesGUIA Primera Ley de La TermodinamicaMatiasJoseIgnacioCabreraHerreraPas encore d'évaluation
- U3 S6 Fluidos LecturaDocument18 pagesU3 S6 Fluidos LecturaEddy Ipanaque PerezPas encore d'évaluation
- Cap 9-FluidosDocument18 pagesCap 9-FluidosArusa SanchezPas encore d'évaluation
- Temperatura y Calor 1 PDFDocument14 pagesTemperatura y Calor 1 PDFJorge Rivas RojasPas encore d'évaluation
- PrimeraleyDocument34 pagesPrimeraleyEdward TacePas encore d'évaluation
- 1 LeyTermodinámica 201810Document10 pages1 LeyTermodinámica 201810Juan David Castro :3Pas encore d'évaluation
- Fis102 LMC5 2021Document21 pagesFis102 LMC5 2021Juan Mamani NinaPas encore d'évaluation
- 1era Ley TermoDocument18 pages1era Ley TermoEnrique Diaz RubioPas encore d'évaluation
- 04 ElectocalorDocument31 pages04 ElectocalorJhoany GómezPas encore d'évaluation
- Fluidos Cap.4 PDFDocument20 pagesFluidos Cap.4 PDFGerman TicliahuancaPas encore d'évaluation
- Cap 9-FluidosDocument21 pagesCap 9-FluidosJose Enrique Lopez DionicioPas encore d'évaluation
- Primera Ley TermodinamicaDocument8 pagesPrimera Ley Termodinamicaescorp3627Pas encore d'évaluation
- Leyesdelatermodinmica 100805145529 Phpapp02Document26 pagesLeyesdelatermodinmica 100805145529 Phpapp02Pablo TapiaPas encore d'évaluation
- Sintitul 15Document13 pagesSintitul 15Luis Miguel Angel Lizarraga MattoPas encore d'évaluation
- Semana 1ADocument14 pagesSemana 1AElor TorrotoPas encore d'évaluation
- Sintitul 15Document13 pagesSintitul 15Jeanpiere MedinaPas encore d'évaluation
- Primera Ley de La Termodinamica PDFDocument7 pagesPrimera Ley de La Termodinamica PDFCarlos Pupuche RodriguezPas encore d'évaluation
- Primera Ley de La TermodinámicaDocument7 pagesPrimera Ley de La TermodinámicaJhon PazosPas encore d'évaluation
- SsssssDocument18 pagesSsssssHel Helen Flor BellaPas encore d'évaluation
- T05-Primera Ley IIDocument46 pagesT05-Primera Ley IIYohana DominguezPas encore d'évaluation
- Tema 4Document10 pagesTema 4Zakaria El KhoumsiPas encore d'évaluation
- Cap 9 FluidosDocument20 pagesCap 9 FluidosFidel GutierrezPas encore d'évaluation
- SEMANA 6 PRIMERA LEY DE LA TERMODINAMICA CP ALIMENTOS ULCB SEMANA 6Document49 pagesSEMANA 6 PRIMERA LEY DE LA TERMODINAMICA CP ALIMENTOS ULCB SEMANA 6gustavo_castro_17Pas encore d'évaluation
- 1 Clase 1y2 Ley DelatermodinamicaDocument45 pages1 Clase 1y2 Ley DelatermodinamicaVictor Hugo SepulvedaPas encore d'évaluation
- 7403-19 FÍSICA Comportamiento de Los GasesDocument18 pages7403-19 FÍSICA Comportamiento de Los GasesIsabel Cristina AndradePas encore d'évaluation
- 2A - 3 - 4 - Primera Ley de La TermodinamicaDocument9 pages2A - 3 - 4 - Primera Ley de La TermodinamicaElizeth Colin HerreraPas encore d'évaluation
- PCFU309-2 EjerciciosDocument5 pagesPCFU309-2 EjerciciosMarisol PinoPas encore d'évaluation
- Primera Ley de La TermodinamicaDocument35 pagesPrimera Ley de La Termodinamicaclientes KonePas encore d'évaluation
- Proceso AdiabáticoDocument5 pagesProceso AdiabáticoAlfredo Pucho LeonPas encore d'évaluation
- Complemento 2Document7 pagesComplemento 2Renzo EspinozaPas encore d'évaluation
- Práctica #06 Transformaciones Termodinámicas HVDocument15 pagesPráctica #06 Transformaciones Termodinámicas HVHeriber Vega SifuentesPas encore d'évaluation
- ProcesosDocument20 pagesProcesosShirley VergaraPas encore d'évaluation
- Primera Ley de Termodinamica Sistemas Cerrados y AbiertosDocument42 pagesPrimera Ley de Termodinamica Sistemas Cerrados y AbiertosJavier FuentesPas encore d'évaluation
- Cuadernillo Cap 4 Fluidos Mejorado Sa0111141809Document20 pagesCuadernillo Cap 4 Fluidos Mejorado Sa0111141809RudyJesusCapaIlizarbePas encore d'évaluation
- Cap 4 FluidosDocument20 pagesCap 4 FluidosCarlos CarbajalPas encore d'évaluation
- 1eray2daleydelatermodinamica1 130224174100 Phpapp02Document44 pages1eray2daleydelatermodinamica1 130224174100 Phpapp02Rodrigo Ruiz DíazPas encore d'évaluation
- Folleto de Termo Cooregido Firme 2Document102 pagesFolleto de Termo Cooregido Firme 2antoni100% (2)
- 7407-16 FISICA Comportamiento de Los GasesDocument30 pages7407-16 FISICA Comportamiento de Los GasesHs AcotaPas encore d'évaluation
- TermodinámicaDocument18 pagesTermodinámicaNolberto Bustamante VasquezPas encore d'évaluation
- CálculoDocument4 pagesCálculoeduardoe19861082Pas encore d'évaluation
- Semana 03 - Procesos Termodinamicos 2018-1Document45 pagesSemana 03 - Procesos Termodinamicos 2018-1Mario Enrique Martinez ArismendiPas encore d'évaluation
- Tema 2 - Primer PrincipioDocument10 pagesTema 2 - Primer PrincipioDaniel SilvaPas encore d'évaluation
- Termodinámica 2º BachilleratoDocument34 pagesTermodinámica 2º Bachilleratoismael15Pas encore d'évaluation
- Problemas Primer PrincipioDocument8 pagesProblemas Primer PrincipioDani FPPas encore d'évaluation
- Tema 6 TermoquimicaDocument51 pagesTema 6 TermoquimicaJose Luis Gutierrez GonzalezPas encore d'évaluation
- Termo 6Document45 pagesTermo 6Lesly PerezPas encore d'évaluation
- Termo 6Document46 pagesTermo 6yessicaPas encore d'évaluation
- Informe #7 Determinacion de Gamma Del AireDocument11 pagesInforme #7 Determinacion de Gamma Del AireCristian Joaquin Zegarra100% (1)
- Primera Ley de La TermodinámicaDocument27 pagesPrimera Ley de La TermodinámicaQuito NeiraPas encore d'évaluation
- Primera Ley de La TermodinmicaDocument46 pagesPrimera Ley de La TermodinmicaJosué Vake100% (1)
- Cap-12-2da Ley de TermodinámicaDocument6 pagesCap-12-2da Ley de TermodinámicaFelipe CarrascoPas encore d'évaluation
- Cap-12 - 2da Ley de La Termodinámica. Entropía.Document5 pagesCap-12 - 2da Ley de La Termodinámica. Entropía.Richard Payano YalePas encore d'évaluation
- Separata N°7Document5 pagesSeparata N°7Richard Payano YalePas encore d'évaluation
- Cap 11 - Conservación de La Energía, 1ra Ley de La TermodinámicaDocument13 pagesCap 11 - Conservación de La Energía, 1ra Ley de La TermodinámicaRichard Payano YalePas encore d'évaluation
- Separata N°8Document10 pagesSeparata N°8Richard Payano YalePas encore d'évaluation
- Cap-12-2da Ley de TermodinámicaDocument6 pagesCap-12-2da Ley de TermodinámicaFelipe CarrascoPas encore d'évaluation
- CAP 10 - Temperatura y CalorDocument13 pagesCAP 10 - Temperatura y CalorRichard Payano YalePas encore d'évaluation
- Cap 9 - FluidosDocument17 pagesCap 9 - FluidosRichard Payano YalePas encore d'évaluation
- Separata N°4 - Dinámica de Un Sistema de PartículasDocument9 pagesSeparata N°4 - Dinámica de Un Sistema de PartículasRichard Payano YalePas encore d'évaluation
- Separata N°3 - Trabajo y EnergíaDocument14 pagesSeparata N°3 - Trabajo y EnergíaRichard Payano YalePas encore d'évaluation
- Separata N°6 - Elasticidad, MAS, OndasDocument11 pagesSeparata N°6 - Elasticidad, MAS, OndasRichard Payano YalePas encore d'évaluation
- Separata N°5 - Mecánica Del Cuerpo RígidoDocument11 pagesSeparata N°5 - Mecánica Del Cuerpo RígidoRichard Payano YalePas encore d'évaluation
- Separata N°1 - Cinemática de Una PartículaDocument11 pagesSeparata N°1 - Cinemática de Una PartículaRichard Payano YalePas encore d'évaluation
- Separata N°2 - Dinámica de Una PartículaDocument9 pagesSeparata N°2 - Dinámica de Una PartículaRichard Payano YalePas encore d'évaluation
- Trabajo y EnergíaDocument17 pagesTrabajo y EnergíaRichard Payano YalePas encore d'évaluation
- Cap 8-Ondas 205-225Document21 pagesCap 8-Ondas 205-225Hiroshi Yukihiro HanazawaPas encore d'évaluation
- MasDocument23 pagesMasRichard Payano YalePas encore d'évaluation
- Mecánica Del Cuerpo RígidoDocument12 pagesMecánica Del Cuerpo RígidoRichard Payano YalePas encore d'évaluation
- Examen FinalDocument7 pagesExamen FinalRichard Payano YalePas encore d'évaluation
- ElasticidadDocument19 pagesElasticidadRichard Payano YalePas encore d'évaluation
- Dinámica de Un Sistema de PartículasDocument25 pagesDinámica de Un Sistema de PartículasRichard Payano YalePas encore d'évaluation
- Dinámica de Una PartículaDocument23 pagesDinámica de Una PartículaRichard Payano YalePas encore d'évaluation
- Solucionario 2013 1Document5 pagesSolucionario 2013 1Justin BlackPas encore d'évaluation
- Solucionario 2013 1Document5 pagesSolucionario 2013 1Richard Payano YalePas encore d'évaluation
- Texto 1Document22 pagesTexto 1Miguel AngelPas encore d'évaluation
- TP 3 Termoquímica - Calor, Trabajo y EnergíaDocument6 pagesTP 3 Termoquímica - Calor, Trabajo y EnergíaMicaela Natalia Arequipa garciaPas encore d'évaluation
- U03 Termoquímica PROB+CUEST 23.24Document4 pagesU03 Termoquímica PROB+CUEST 23.24Jimi 887Pas encore d'évaluation
- Termo 2021 Notas de ClaseDocument97 pagesTermo 2021 Notas de ClaseAndres BurgosPas encore d'évaluation
- Calculo AcondicionamientoDocument72 pagesCalculo AcondicionamientocornoliaPas encore d'évaluation
- 2da-3ra LEY TERMODINADocument48 pages2da-3ra LEY TERMODINACARLOS JESUS ESPIRITU SILVESTREPas encore d'évaluation
- Temperatura y Medidores de TemperaturaDocument18 pagesTemperatura y Medidores de TemperaturaRonald Jhonn Condori FloresPas encore d'évaluation
- Diseño Curricular Implementacion de Redes y Servicios de TelecoDocument69 pagesDiseño Curricular Implementacion de Redes y Servicios de Telecojuan david tavaresPas encore d'évaluation
- Banegas - Oscar - Guía Práctica No 11Document8 pagesBanegas - Oscar - Guía Práctica No 11VICTORIA GISSEL FERNANDEZ MARTINEZPas encore d'évaluation
- Conceptos TermodinamicaDocument39 pagesConceptos TermodinamicaJuan ChoquePas encore d'évaluation
- Sistema de RefrigeracionDocument39 pagesSistema de RefrigeracionJhon UZPas encore d'évaluation
- Copia de EQUILIBRIO IONICODocument20 pagesCopia de EQUILIBRIO IONICODayane CarolinePas encore d'évaluation
- LIBbacarsDocument274 pagesLIBbacarsMayte SalazarPas encore d'évaluation
- ParesDocument8 pagesParesMarco Antonio RamosPas encore d'évaluation
- Actividad 1, Unidad 1, Reporte de InvestigacionDocument3 pagesActividad 1, Unidad 1, Reporte de InvestigacionAdrian PeraltaPas encore d'évaluation
- Solucion TP2 C MT 1Document4 pagesSolucion TP2 C MT 1Paola ReynaldiPas encore d'évaluation
- Formulario de Equilibrio QuímicoDocument7 pagesFormulario de Equilibrio QuímicoHansSmithPas encore d'évaluation
- Ejercc. en Openboard de Ope II Gestion 2 - 2021Document1 pageEjercc. en Openboard de Ope II Gestion 2 - 2021Sergio GutierrezPas encore d'évaluation
- Ejercicios para ResolverDocument3 pagesEjercicios para ResolverANGIE ARLETTE HIDALGO APAZA0% (1)
- A42010 Catálogo Profesional Koolnova - Koolair 2022 - 2023 - Es Sin PreciosDocument24 pagesA42010 Catálogo Profesional Koolnova - Koolair 2022 - 2023 - Es Sin Preciosrbarrosocela77Pas encore d'évaluation
- Marco TeoricoDocument4 pagesMarco TeoricoEdward HerreraPas encore d'évaluation
- CalculosDocument13 pagesCalculosNery Limon OrtizPas encore d'évaluation
- Laboratorio Presion de Vapor - Fernando EcheverriaDocument7 pagesLaboratorio Presion de Vapor - Fernando Echeverriafernando2697Pas encore d'évaluation
- Temario Ciencias Naturales Grado NovenoDocument3 pagesTemario Ciencias Naturales Grado NovenoAlonsoPas encore d'évaluation
- Trabajo Fin de Master - Estudio ACS e HidrotermiaDocument97 pagesTrabajo Fin de Master - Estudio ACS e HidrotermiachipulinoPas encore d'évaluation
- Quimica 3 y 4Document233 pagesQuimica 3 y 4Junco FuertePas encore d'évaluation
- Compresor de Pistón LiquidoDocument11 pagesCompresor de Pistón LiquidoHolleey100% (1)
- Laboratorio 4 Calor EspecíficoDocument13 pagesLaboratorio 4 Calor EspecíficoGabriela Jimenez CastrePas encore d'évaluation
- Opf Olimpiada Peruana de Fisica Examen de Seleccion 08 de Junio 2013Document17 pagesOpf Olimpiada Peruana de Fisica Examen de Seleccion 08 de Junio 2013Arquimedes ArquimedesPas encore d'évaluation
- Portafolio Termodinamica (II Parcial)Document22 pagesPortafolio Termodinamica (II Parcial)Roger ChavezPas encore d'évaluation