Académique Documents
Professionnel Documents
Culture Documents
Índice de La Unidad 3
Transféré par
Soledad ChiroqueTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Índice de La Unidad 3
Transféré par
Soledad ChiroqueDroits d'auteur :
Formats disponibles
1
Universidad Nacional de Trujillo
ndice de la Unidad 3
3.1. Introduccin y objetivos: 3.1.1. CinticaQumica (aspecto cintico) 3.1.2. Aspecto termodinmico 3.2. Equilibrio Qumico CONTENIDOS a) Concepto de equilibrio qumico. 1.1. Caractersticas. reacciones qumicas. Aspecto dinmico de las
2.Ley de accin de masas. La constante de equilibrio KC. 3.3.1. 4.4.1. 5.6.6.1. Grado de disociacin a. Relacin KC con el grado de disociacin. KP. Relacin con KC . Magnitud de las constantes de equilibrio. Cociente de reaccin. Modificaciones del equilibrio. Concentracin en reactivos y productos.
6.2. Efecto de los cambios de presin, volumen y temperatura.
INGENIERIA INDUSTRIAL CICLO II
Universidad Nacional de Trujillo
6.3.
Principio de Le Chatelier.
3.3. Dependencia de K con la temperatura 3.4. Equilibrio molecular 3.5. Clculos una vez alcanzado el equilibrio 3.6. Equilibrio inico 3.6.1. Teoras cido - base 3.6.2. Fortaleza de cidos 3.6.3. Fortaleza de bases 3.6.4. Auto ionizacin del agua y escala de pH 3.6.5. Clculos con cidos y bases dbiles 3.6.6. Hidrlisis de sales 3.6.7. Efecto del in comn 3.6.8. Soluciones buffer o amortiguadoras
6.4.
Importancia en procesos industriales.
7.Equilibrios solubilidad
heterogneos.
Producto
de
INGENIERIA INDUSTRIAL
CICLO II
Universidad Nacional de Trujillo
3.1 Introduccin Cintica qumica La cintica qumica es un rea que se encarga del estudio de la rapidez de reaccin, cmo cambia la rapidez de reaccin bajo condiciones variables y qu eventos moleculares se efectan mediante la reaccin general (Difusin, ciencia de superficies, catlisis). La cintica qumica es un estudio puramente emprico y experimental; el rea qumica que permite indagar en las mecnicas de reaccin se conoce como dinmica qumica. Cintica qumica La termodinmica nos permite saber si una reaccin es espontnea o no segn factores termodinmicos como entalpa, entropa y energa libre, pero no informa acerca de la rapidez con que se produce el cambio qumico. La Cintica Qumica determinar si una reaccin es lenta o rpida al estudiar los factores que determinan la velocidad y el mecanismo, es decir, la etapa o serie de etapas en las que ocurre el cambio. La velocidad de reaccin corresponder a la rapidez con que tiene lugar una reaccin; durante el cambio, la concentracin de los reactantes disminuir, mientras que la concentracin de los productos aumentar. La velocidad media, entonces, se medir a travs del cambio de concentracin en un periodo determinado de tiempo. A partir de una reaccin A B, donde A est representado por las esferas rojas y B por las esferas azules, en la figura se ilustra cmo cambian las concentraciones a medida que transcurre el tiempo.
En el tiempo cero, en el primer tiesto de capacidad de un litro, se considera que hay un mol de A. Transcurridos 20 segundos, la cantidad de moles de A disminuy a 0,54 y la cantidad de moles formada de B es 0,46. A los 40 segundos, la cantidad de moles de A es 0,3 y los moles de B son 0,7. La siguiente tabla lustra las concentraciones de A y B en INGENIERIA INDUSTRIAL CICLO II
Universidad Nacional de Trujillo
diferentes tiempos.
Este grfico ilustra el cambio de la concentracin de A.
Este grfico ilustra el cambio de la concentracin de B.
La velocidad de consumo de A:
En el primer periodo de tiempo: VA = - (0,54 1,0) / (20 0) VA = 0,023 M / s INGENIERIA INDUSTRIAL CICLO II
Universidad Nacional de Trujillo
En el segundo periodo de tiempo: VA = - (0,3 0,54) / (40 20) VA = 0,012 M / s Es posible determinar que la velocidad de consumo de A disminuye, pues disminuye la concentracin de A a medida que transcurre el tiempo. El signo menos (-) alude a la disminucin de la concentracin de A por unidad de tiempo y se debe multiplicar por (-1), ya que las velocidades son positivas. La velocidad de formacin de B:
En el primer periodo de tiempo: VB = - (0,46 0) / (20 0) VB = 0,023 M / s En el segundo periodo de tiempo: VB = - (0,7 0,46) / (40 20) VB = 0,012 M / s La velocidad de formacin de B disminuye a medida que transcurre el tiempo. Para esta reaccin: VA = VB Expresin general de la velocidad de reaccin en funcin de reactantes y productos y la relacin entre ellos: Para la reaccin: aA + b Bc C + d D Se puede expresar la velocidad en funcin de los reactantes y/o de los productos y la relacin entre ellas de la siguiente manera:
Ejercicio: Se realiz experimentalmente la reaccin 2 ICl(g) + H2(g) I2(g) + 2 HCl(g) y se obtuvieron los siguientes valores:
INGENIERIA INDUSTRIAL
CICLO II
Universidad Nacional de Trujillo
a. Determina la velocidad en tres espacios de tiempo en funcin de cada uno de los reactantes. b. Compara para cada uno de esos intervalos de tiempo la velocidad en funcin del ICl y en funcin de H2. Las teoras que permiten explicar la cintica de una reaccin son las siguientes: Teora de las colisiones efectivas Segn esta teora, para que ocurra una reaccin qumica es necesario que existan choques entre las molculas de reactantes. Las colisiones, en tanto, deben cumplir con dos condiciones: Las molculas de reactantes deben poseer la energa suficiente para que pueda ocurrir el rompimiento de enlaces, reordenamiento de los tomos y posteriormente la formacin de los productos. Si no se dispone de la energa suficiente, las molculas rebotan sin formar los productos. Los choques entre las molculas deben efectuarse con la debida orientacin. Si el choque entre las molculas cumple con estas condiciones, se dice que las colisiones son efectivas y ocurre la reaccin entre los reactantes.
Teora del complejo activado Segn esta teora, al aproximarse los reactantes se produce la formacin de un estado intermedio de alta energa y corta duracin que se denomina complejo activado. La energa de activacin es la energa que se necesita suministrar a los reactantes para que se forme el complejo activado. Cuanto mayor sea la energa de activacin, en general, menor ser la velocidad de la reaccin. De acuerdo al cambio neto de energa, es decir, la diferencia entre la energa de los productos y de los reactantes, las reacciones se clasifican en endergnicassi se requiere energa, y exergnicas si se libera. Cuando la energa se manifiesta como calor, las reacciones se denominarn endotrmicas y exotrmicasrespectivamente.
INGENIERIA INDUSTRIAL
CICLO II
Universidad Nacional de Trujillo
Diagrama de energa para reacciones con energa de activacin Reaccin exotrmica con energa de activacin:
E<0 La energa liberada corresponde a la diferencia de energa entre los productos y los reactantes. Como la energa de los productos es menor a la energa de los reactantes, se libera energa en el proceso. Reaccin endotrmica con energa de activacin:
E>0 La energa necesaria para que ocurra el cambio corresponde a la diferencia de energa entre los productos y los reactantes. Como la energa de los productos es mayor a la energa de los reactantes, se requiere energa para el proceso. Relacin entre la velocidad de la reaccin y la concentracin de los reactantes INGENIERIA INDUSTRIAL CICLO II
Universidad Nacional de Trujillo
Una forma de estudiar el efecto de la concentracin en la velocidad de reaccin es determinando experimentalmente la velocidad con distintas concentraciones iniciales de reactantes. Segn la siguiente reaccin hipottica: A + B C, se obtienen los siguientes valores de velocidad, con distintas concentraciones iniciales de A y de B. [A] 0,1 0,1 0,2 0,2 [B] 0,1 0,2 0,1 0,2 velocidad 1 x 10-3 4 x 10-3 2 x 10-3 8 x 10-3
Se puede observar que: Al duplicar la concentracin de A, manteniendo constante la concentracin de B, la velocidad se duplica, por tanto existe una proporcionalidad directa entre la velocidad y la concentracin de A. El orden respecto a A en este caso es 1. Al duplicar la concentracin de B, manteniendo constante la concentracin de A, la velocidad se cuadruplica, por tanto existe una proporcionalidad directa entre la velocidad y la concentracin de B. El orden respecto a A es 2. En el caso de A el orden coincide con el coeficiente estequiomtrico; en cambio, respecto a B, el orden y el coeficiente estequiomtrico son diferentes. El orden total de la reaccin es 3.
La ecuacin de velocidad tiene la siguiente expresin: V = k [A] [B]2 El orden de reaccin respecto a un reactivo es el exponente al cual se eleva la concentracin en la ecuacin de velocidad. El orden total de la reaccin corresponde a la sumatoria de los rdenes parciales
. Factores que influyen en la velocidad de reaccin
Dentro de los factores que alteran la cintica de reaccin estn: Temperatura. Concentracin. Naturaleza de los reactantes. Estado fsico en que se encuentran los reactantes. El grado de disgregacin, cuando los reactantes son slidos. Los catalizadores e inhibidores.
Efecto de la temperatura en la velocidad de reaccin Al incrementar la temperatura la velocidad de la reaccin aumenta. Este hecho encuentra explicacin en las dos teoras revisadas, dado que un aumento de la INGENIERIA INDUSTRIAL CICLO II
Universidad Nacional de Trujillo
temperatura favorece los choques efectivos entre las molculas, habiendo, adems, ms molculas de reactantes que poseen la energa suficiente para formar el complejo activado. En general, un aumento de temperatura de 10C se traduce en un aumento de la velocidad cercana al doble de su valor original.
Efecto de la concentracin de los reactantes Al aumentar la concentracin de los reactantes, aumenta la probabilidad de choques efectivos entre las molculas, y adems existen ms molculas que tienen la energa necesaria para formar el complejo activado. A mayor concentracin, mayor es la velocidad de reaccin.
Naturaleza de los reactantes Cuando la reaccin implica el rompimiento de enlaces covalentes ser, generalmente, ms lenta que cuando ocurre entre partculas que se encuentran como iones.
Estado fsico de los reactantes Las reacciones homogneas entre gases o entre sustancias disueltas suceden generalmente con mayor rapidez que si estuvieran en estado slido. En el primer caso es mayor el nmero de choques entre las molculas, lo que favorece la velocidad de reaccin. El grado de divisin de los slidos influye en la cintica de la reaccin, ya que cuando aumenta la superficie efectiva de contacto entre los reactantes, mayor es la probabilidad de que tenga lugar el choque de las molculas. Cuando el slido est como un trozo, la reaccin se produce con las molculas de la superficie.
Catalizadores e inhibidores
INGENIERIA INDUSTRIAL
CICLO II
10
Universidad Nacional de Trujillo
Un catalizador es una sustancia que, estando presente en una reaccin qumica, produce una variacin de su velocidad sin ser consumida ni formada durante el transcurso de la reaccin.
Los catalizadores pueden ser catalizadores positivos o catalizadores negativos. Los primeros son las sustancias que aumentan la velocidad de la reaccin, pero que no se consumen ni se forman, pues su papel es disminuir la energa de activacin. En cambio, los catalizadores negativos o inhibidores, aumentan la energa de activacin, y por lo tanto, disminuyen la velocidad de la reaccin. Un catalizador es una sustancia que, estando presente en una reaccin qumica, produce una variacin de su velocidad sin ser consumida ni formada durante el transcurso de la reaccin. Los catalizadores pueden ser catalizadores positivos o catalizadores negativos. Los primeros son las sustancias que aumentan la velocidad de la reaccin, pero que no se consumen ni se forman, pues su papel es disminuir la energa de activacin. En cambio, los catalizadores negativos o inhibidores, aumentan la energa de activacin, y por lo tanto, disminuyen la velocidad de la reaccin.
EQUILIBRIO QUIMICO
Cmo se alcanza el equilibrio? El equilibrio qumico se alcanza en una reaccin reversible, cuando las velocidades de las reacciones directa e inversa se igualan (por un simple acuerdo se llamar reaccin directa la formacin de los productos y reaccin inversa a la otra en que los productos se recombinan para producir los reactantes originales) y las concentraciones netas de reactivos y productos permanecen constantes. La mayor parte de las reacciones qumicas son reversibles y su representacin es mediante una doble flecha. A+B C+D
Si las condiciones en que se desarrolla el equilibrio permanecen invariables, las velocidades con que progresan las dos reacciones opuestas llegan a igualarse en un instante dado. En ese momento se dice que el sistema se encuentra en estado de equilibrio, esto es, las dos reacciones opuestas continan producindose y las concentraciones de los reactantes y de los productos permanecern constantes. Representacin grfica de la variacin de las velocidades de los reaccionantes y de los productos. En cualquier instante, la velocidad es proporcional a la concentracin de las sustancias. A partir de un cierto momento ("tiempo de equilibrio", te) las dos velocidades se hacen iguales y se ha llegado al equilibrio qumico.
INGENIERIA INDUSTRIAL
CICLO II
11
Universidad Nacional de Trujillo
Representacin grfica de la concentracin de los reaccionantes y de los productos. Al iniciarse la reaccin de formacin de C o D, la concentracin de A o B disminuye en forma gradual y se produce C o D cuya concentracin aumenta de 0 a un valor constante. As mismo, la concentracin de A o B va decreciendo hasta llegar a un valor constante. Al llegar ambos reactantes y productos a la concentracin constante el sistema alcanza su equilibrio qumico.
Ley del equilibrio qumico Para una reaccin qumica que ocurre a una temperatura y presin determinada, tenemos el equilibrio aA + bB cC + dD Un catalizador es una sustancia que, estando presente en una reaccin qumica, produce una variacin de su velocidad sin ser consumida ni formada durante el transcurso de la reaccin. Los catalizadores pueden ser catalizadores positivos o catalizadores negativos. Los primeros son las sustancias que aumentan la velocidad de la reaccin, pero que no se consumen ni se forman, pues su papel es disminuir la energa de activacin. En cambio, los catalizadores negativos o inhibidores, aumentan la energa de activacin, y por lo tanto, disminuyen la velocidad de la reaccin.
INGENIERIA INDUSTRIAL
CICLO II
12
Universidad Nacional de Trujillo
Las expresiones de velocidad directa e inversa para la reaccin: V1 = K1 [A]a [B]b V2 = K2 [C]c [D]d En el equilibrio deben igualarse las dos velocidades. En ese momento los coeficientes estequiomtricos coinciden con el orden de la reaccin, de esta manera: Si V1 = V2 K1 [A]a [B]b = K2 [C]c [D]d K1 [C]c [D]d ---- = ------------- = Keq K2 [A]a [B]b La Ley de accin de masas o ley de Gulberg y Waage se define como: En un proceso elemental, el producto de las concentraciones en el equilibrio de los productos elevadas a sus respectivos coeficientes estequiomtricos, dividido por el producto de las concentraciones de los reactivos en el equilibrio elevadas a sus respectivos coeficientes estequiomtricos, es una constante para cada temperatura llamada constante de equilibrio Keq o simplemente K. Las concentraciones de las sustancias slidas y del agua cuando esta ltima se disocia, no se consideran para establecer la ley del equilibrio, ya que es muy pequea la cantidad disociada y su valor, por lo tanto, no cambia considerablemente. La constante de equilibrio K, nos permite establecer el grado en que se produce una reaccin, as: - Cuando K > 1 indica que en el equilibrio la mayora de los reactivos se convierten en productos.
- Cuando K < 1, indica que cuando se establece el equilibrio, la mayora de los reactivos quedan sin reaccionar, formndose solo pequeas cantidades de productos.
- Si K = 1, significa que en el equilibrio no hay predominio ni de los productos ni de los reactantes. A+B Factores que afectan el equilibrio qumico Existen diversos factores capaces de modificar el estado de equilibrio de un proceso qumico como son la temperatura, la presin y el efecto de las concentraciones. Estos factores estn relacionados con el principio de Le Chatelier-Braund, Si en un sistema en equilibrio se modifica alguno de los factores que influyen en el mismo (temperatura, presin o concentracin), el sistema evoluciona de forma que se desplaza en el sentido que tienda a contrarrestar dicha variacin. C+D
INGENIERIA INDUSTRIAL
CICLO II
13
Universidad Nacional de Trujillo
Efecto de la temperatura En los procesos endotrmicos el aumento de temperatura favorece el proceso porque necesita aporte de energa. En las reacciones exotrmicas el aumento de temperatura entorpece la reaccin. En general la reaccin se desplaza en el sentido que absorba calor, es decir, que sea endotrmica. Para una reaccin endotrmica: A + B + calor C + D
Un aumento de la temperatura provocar un desplazamiento del equilibrio hacia el lado que contrarresta, o sea hacia la derecha. Para una reaccin exotrmica: A + B C + D + calor
Un aumento de la temperatura provocar el desplazamiento hacia la izquierda. Efecto de la presin Una variacin de presin en un equilibrio qumico influye solamente cuando en el mismo intervienen gases y hay variacin del nmero de moles. Si aumenta la presin, el sistema se desplazar hacia donde existan menor nmero de moles (porque ocupan menos espacio) para as contrarrestar el efecto de disminucin de V, y viceversa.El efecto de un cambio de presin depende de los cambios de volumen que tengan lugar durante la reaccin. Si aquella se produce sin cambio de volumen, todo cambio de presin que se le aplique no la modifica. Efecto de las concentraciones La variacin de la concentracin de cualquiera de las especies que intervienen en el equilibrio no afecto en absoluto al valor de la constante de equilibrio; no obstante el valor de las concentraciones de las restantes especies en equilibrio s se modifica. As: Un aumento de la concentracin de cualquier sustancia desplaza el equilibrio en direccin contraria a la formacin de esa sustancia. Una disminucin de la concentracin de cualquier sustancia desplaza el equilibrio hacia la formacin de esa sustancia. El objeto de la cintica qumica es medir las velocidades de las reacciones qumicas y encontrar ecuaciones que relacionen la velocidad de una reaccin con variables experimentales. Se encuentra experimentalmente que la velocidad de una reaccin depende mayormente de la temperatura y las concentraciones de las especies involucradas en la reaccin. En las reacciones simples, slo la concentracin de los reactivos afecta la velocidad de reaccin junto con la temperatura, pero en reacciones ms complejas la velocidad tambin puede depender de la concentracin de uno o ms productos. La presencia de un catalizador tambin afecta la velocidad de reaccin; en este caso puede aumentar su velocidad. Del estudio de la velocidad de una reaccin y su dependencia con todos estos factores se puede saber mucho acerca de los pasos en detalle para ir de reactivos a productos. Esto ltimo es el mecanismo de reaccin. Las reacciones se pueden clasificar cinticamente en homogneas y heterogneas. La primera ocurre en una fase y la segunda en ms de una fase. La reaccin heterognea depende del rea de una superficie ya sea la de las paredes del vaso o de un catalizador slido. En este captulo se discuten reacciones homogneas. INGENIERIA INDUSTRIAL CICLO II
14
Universidad Nacional de Trujillo
Unidad
3:
Qu ocurre cuando se consumen los reactivos de una reaccin qumica?, quiere decir que sta ha terminado?, que ya no hay ms transformaciones a nivel molecular? Podramos estar equivocados!! Conforme transcurre el tiempo despus de iniciada la reaccin, se va incrementado la cantidad de molculas de productos, los choques entre stas se vuelven ms probables y en consecuencia, puede ocurrir una reaccin en el sentido inverso, donde nuevamente se forman los reactivos originales. Cuando la mezcla de reaccin deja de cambiar, lo que sucede es que la transformacin de reactivos a productos tiene en ese momento la misma velocidad que la transformacin de productos a reactivos, entonces podemos afirmar que se ha alcanzado el equilibrio qumico. En ciertas reacciones qumicas se observa claramente que los reactivos no llegan a consumirse totalmente, que se detienen antes de completarse. Tales reacciones son reversibles, es decir, los reactivos originales forman productos, pero entonces los productos reaccionan nuevamente con ellos mismos para dar los reactivos originales. Ocurren dos reacciones opuestas a igual velocidad: se ha alcanzado el equilibrio qumico. El resultado eventual, es una mezcla de reactivos y productos en concentraciones definidas, ms que una simple mezcla de productos.
Observacin Podemos afirmar entonces que el equilibrio qumico se caracteriza en que dos procesos opuestos se llevan a cabo simultneamente y con la misma velocidad.
El equilibrio qumico es un proceso dinmico, en el que microscpicamente hay un cambio (los reactivos se transforman en productos a la misma velocidad que los productos se transforman en reactivos) que macroscpicamente es indetectable (las concentraciones de las especies en la mezcla de reaccin no varan). Para alcanzar el equilibrio, ni los reactivos ni los productos escapan del sistema.
INGENIERIA INDUSTRIAL
CICLO II
15
Universidad Nacional de Trujillo
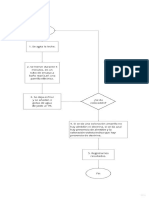
Clasificacin del equilibrio qumico:
INGENIERIA INDUSTRIAL
CICLO II
16
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
17
Universidad Nacional de Trujillo
Principio de Le Chatelier. Variaciones en el equilibrio. Un cambio o perturbacin en cualquiera de las variables que determinan el estado de equilibrio qumico produce un desplazamiento del equilibrio en el sentido de contrarrestar o minimizar el efecto causado por la perturbacin. D[reactivos] > 0 D[reactivos] < 0 D[productos] > 0 D[productos] < 0 DT > 0 (exotrmicas) DT > 0 (endotrmicas) DT < 0 (exotrmicas) DT < 0 (endotrmicas) Dp> 0 Dp < 0 Hacia donde menos n moles de gases Hacia donde ms n moles de gases.
Importancia en procesos industriales.
El saber qu condiciones favorecen el desplazamiento de un equilibrio hacia la formacin de un producto es de suma importancia en la industria, pues se conseguir un mayor rendimiento, en dicho proceso . Un ejemplo tpico es la sntesis de Haber en la formacin de amoniaco a partir de la reaccin N2(g) + 3 H2(g) 2 NH3(g), exotrmica. La formacin de amoniaco est favorecida por altas presiones (menos moles gaseosos de productos que de reactivos) y por una baja temperatura. Por ello esta reaccin se lleva a cabo a altsima presin y a una temperatura relativamente baja, aunque no puede ser muy baja para que la reaccin no sea muy lenta. Hay que mantener un equilibrio entre rendimiento y tiempo de reaccin.
INGENIERIA INDUSTRIAL
CICLO II
18
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
19
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
20
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
21
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
22
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
23
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
24
Universidad Nacional de Trujillo
LEY DE ACCIN DE MASAS. CONSTANTE DE EQUILIBRIO (KC) Para una reaccin cualquiera (a A + b B+ .... c C + d D + ...) se define la constante de equilibrio (KC) de la siguiente manera:
siendo las concentraciones medidas en el equilibrio (no confundir con las concentraciones iniciales de reactivos y productos). Se denomina constante de equilibrio, porque se observa que dicho valor es constante (dentro un mismo equilibrio) si se parte de cualquier concentracin inicial de reactivo o producto. En la reaccin anterior: H2 (g)+ I2 (g) 2 HI (g)
El valor de KC, dada su expresin, depende de cmo se ajuste la reaccin. Es decir, si la reaccin anterior la hubiramos ajustado como: H2(g) + I2(g) HI (g), la constante valdra la raz cuadrada de la anterior. La constante KC cambia con la temperatura. ATENCIN!: Slo se incluyen las especies gaseosas y/o en disolucin. Las especies en estado slido o lquido tienen concentracin constante, y por tanto, se integran en la constante de equilibrio. Ejemplo: Tengamos el equilibrio: 2SO2 (g) + O2 (g) 2 SO3 (g). Se hacen cinco experimentos en los que se introducen diferentes concentraciones iniciales de ambos reactivos (SO2 y O2). Se produce la reaccin y una vez alcanzado el equilibrio se miden las concentraciones tanto de reactivos como de productos observndose los siguientes datos: Concentr. iniciales (mol/l) [SO2] Exp 1 Exp 2 Exp 3 Exp 4 0,200 0,150 [O2] 0,200 0,400 [SO3] 0,200 0,700 Concentr. equilibrio (mol/l) [SO2] 0,030 0,014 0,053 0,132 [O2] 0,115 0,332 0,026 0,066 [SO3] 0,170 0,135 0,143 0,568 Kc 279,2 280,1 280,0 280,5
INGENIERIA INDUSTRIAL
CICLO II
25
Universidad Nacional de Trujillo
0,150 0,400 0,250 0,037 0,343 0,363 280,6
Exp 5
Kc se obtiene aplicando la expresin:
y como se ve es prcticamente constante. Ejercicio A: Escribir las expresiones de KC para los siguientes equilibrios qumicos: a) N2O4 (g) 2 NO2 (g); b) 2 NO (g) + Cl2 (g) 2NOCl(g); c) CaCO3(s) CaO(s) + CO2(g); d) 2 NaHCO3(s) Na2CO3(s) + H2O(g) + CO2(g). Significado del valor de Kc
Ejemplo: En un recipiente de 10 litros se introduce una mezcla de 4 moles de N2(g) y 12 moles de H2(g); a) escribir la reaccin de equilibrio; b) si establecido ste se observa que hay 0,92 moles de NH3(g), determinar las concentraciones de N2 e H2 en el equilibrio y la constante Kc. a) Equilibrio: N2 (g) + 3 H2 (g) 2 NH3(g) 0 0,92 0,092
b) Moles inic.: 4 Moles equil. 4 0,46 = 3,54 conc. eq(mol/l) 0,354
12 12 1,38 = 10,62 1,062
INGENIERIA INDUSTRIAL
CICLO II
26
Universidad Nacional de Trujillo
Ejercicio B: En un recipiente de 250 ml se introducen 3 g de PCl5, establecindose el equilibrio: PCl5 (g) PCl3 (g) + Cl2 (g). Sabiendo que la KC a la temperatura del experimento es 0,48, determinar la composicin molar del equilibrio. CONSTANTE DE EQUILIBRIO (KP). RELACIN CON (KC). En las reacciones en que intervengan gases es ms sencillo medir presiones parciales que concentraciones. As en una reaccin tipo: a A + b B c C + d D, se observa la constancia de Kp viene definida por:
En la reaccin: 2 SO2 (g) + O2 (g) 2 SO3 (g)
De la ecuacin general de los gases:
se obtiene:
Vemos, pues, que KP puede depender de la temperatura siempre que haya un cambio en el n de moles de gases
Donde Dn = incremento en n de moles de gases (nproductos nreactivos) Ejemplo: Calcular la constante Kp a 1000 K en la reaccin de formacin del amoniaco vista anteriormente. (KC = 1,996 102 M2) N2(g) + 3 H2(g) 2 NH3(g) Dn = nproductos nreactivos = 2 (1 + 3) = 2 INGENIERIA INDUSTRIAL CICLO II
27
Universidad Nacional de Trujillo
KP = Kc x (RT) Dn =1,996 x 10-2 mol-2l2 (0,082 atmxl xmol-1xK-1 x1000 K) -2
Ejercicio c) La constante de equilibrio de la reaccin: N2O4 2 NO2 vale 0,671 a 45C. Calcule la presin total en el equilibrio en un recipiente que se ha llenado con N2O4 a 10 atmsferas y a dicha temperatura. Datos: R = 0,082 atmlmol-1K-1. MAGNITUD DE KC Y KP. El valor de ambas constantes puede variar entre lmites bastante grandes: Ejemplos: H2 (g) + Cl2 (g) 2 HCl(g) ; Kc (298 K) = 2,5 x 1033 La reaccin est muy desplazada a la derecha (en realidad se puede sustituir el smbolo por ). H2 (g) + I2 (g)2 HI (g); Kc (698 K) = 55,0 Se trata de un verdadero equilibrio (hay concentraciones apreciables de reactivos y productos). N2 (g) + O2 (g) 2 NO (g); Kc (298 K) = 5,3 x 1031 La reaccin est muy desplazada a la izquierda, es decir, apenas se forman productos. GRADO DE DISOCIACIN (a). Se utiliza en aquellas reacciones en las que existe un nico reactivo que se disocia en dos o ms molculas ms pequeas. Es la fraccin de un mol que se disocia (tanto por 1). En consecuencia, el % de sustancia disociada es igual a 100a. Ejemplo: En un matraz de 5 litros se introducen 2 moles de PCl5(g) y 1 mol de PCl3(g) y se establece el siguiente equilibrio: PCl5(g) PCl3(g) + Cl2(g). Sabiendo que Kc (250 C) = 0,042; a) cules son las concentraciones de cada sustancia en el equilibrio?; b) cul es el grado de disociacin? a) Equilibrio: PCl5 (g) PCl3 (g) + Cl2 (g) Moles inic.: 2 1 0 Moles equil. 2 x 1+x x conc. eq(mol/l)(2 x)/5 (1 + x)/5 x/5
INGENIERIA INDUSTRIAL
CICLO II
28
Universidad Nacional de Trujillo
Resolviendo la ecuacin de segundo grado, se deduce que x = 0,28 moles
b) Si de 2 moles de PCl5 se disocian 0,28 moles en PCl3 y Cl2, de cada mol de PCl5 se disociarn 0,14. Por tanto, a = 0,14, lo que viene a decir que el PCl5 se ha disociado en un 14 %. RELACIN ENTRE KC Y a. Sea una reaccin A B + C. Si llamamos c = [A]inicial y suponemos que en principio slo existe sustancia A, tendremos que: Equilibrio: A Conc. Inic. (mol/l): c conc. eq(mol/l) c(1 a) B 0 ca + C 0 ca
En el caso de que la sustancia est poco disociada (KC muy pequea): a <<1 y KC = c a2, con lo que se tiene a de manera inmediata. En caso de duda, puedes despreciar, y si ves que a < 0,02, puedes dejar el resultado, mientras que si a > 0,02 conviene que no desprecies y resuelvas la ecuacin de segundo grado. Ejemplo: Utilizar la expresin de la constante en funcin de a en el ejemplo anterior: En un matraz de 5 litros se introducen 2 moles de PCl5(g) y 1 mol de PCl3(g) y se establece el siguiente equilibrio: PCl5(g) PCl3(g) + Cl2(g). Sabiendo que Kc (250 C) = 0,042, cul es el grado de disociacin?. Equilibrio: PCl5 (g) PCl3 (g) + Cl2 (g) Conc. inic.: 2/5 1/5 0 conc. eq(mol/l) 0,4(1a) 0,2+0,4 a 0,4 a
INGENIERIA INDUSTRIAL
CICLO II
29
Universidad Nacional de Trujillo
En este caso y dado el valor de la constante no debe despreciarse a frente a 1, por lo que deberamos resolver la ecuacin de segundo grado: a = 0,14
Ejercicio D: En el equilibrio anterior (Kc = 0,042): PCl5 (g) PCl3 (g) + Cl2(g) cul sera el grado de disociacin y el nmero de moles en el equilibrio de las tres sustancias si pusiramos nicamente 2 moles de PCl5(g) en los 5 litros del matraz? Ejercicio E: A 450 C y 10 atm de presin el NH3 (g) est disociado en un 95,7 % segn la reaccin: 2 NH3 (g) N2 (g) + 3 H2 (g). Calcular KC y KP a dicha temperatura. COCIENTE DE REACCIN (Q) En una reaccin cualquiera: aA + b B c C + d D se llama cociente de reaccin a: Tiene la misma frmula que la KC pero a diferencia de sta, las concentraciones no tienen porqu ser las del equilibrio. Si Q = Kc entonces el sistema est en equilibrio.
Si Q < Kc el sistema evolucionar hacia la derecha, es decir, aumentarn las concentraciones de los productos y disminuirn las de los reactivos hasta que Q se iguale con KC. Si Q > Kc el sistema evolucionar hacia la izquierda, es decir, aumentarn las concentraciones de los reactivos y disminuirn las de los productos hasta que Q se iguale con KC. Ejemplo: En un recipiente de 3 litros se introducen 0,6 moles de HI, 0,3 moles de H2 y 0,3 moles de I2 a 490C. Si Kc = 0,022 a 490C para 2HI (g) H2 (g) + I2(g) a) se encuentra en equilibrio?; b) Caso de no encontrarse, cuantos moles de HI, H2 e I2 habr en el equilibrio? INGENIERIA INDUSTRIAL CICLO II
30
Universidad Nacional de Trujillo
a) Como Q > Kc el sistema no se encuentra en equilibrio y la reaccin se desplazar hacia la izquierda. b) Equilibrio: Moles inic.: Moles equil. 2 HI (g) 0,6 0,6 + 2x I2 (g) + H2 (g) 0,3 0,3 0,3 x 0,3 x
Resolviendo la ecuacin se obtiene que: x = 0,163 moles Equil: Moleq: 2 HI (g) 0,6+2x0, 163 I2 (g) + H2 (g) 0,30,163 0,30,163
n(HI) = 0,93 mol ; n(I2) = 0,14 mol ; n(H2) = 0,14 mol MODIFICACIONES DEL EQUILIBRIO. Si un sistema se encuentra en equilibrio (Q = Kc) y se produce una perturbacin: Cambio en la concentracin de alguno de los reactivos o productos. Cambio en la presin (o volumen). Cambio en la temperatura.
El sistema deja de estar en equilibrio y trata de volver a l. Cambio en la concentracin de alguno de los reactivos o productos. Si una vez establecido un equilibrio se vara la concentracin algn reactivo o producto el equilibrio desaparece y se tiende hacia un nuevo equilibrio. Las concentraciones iniciales de este nuevo equilibrio son las del equilibrio anterior con las variaciones que se hayan introducido. Lgicamente la constante del nuevo equilibrio es la misma, por lo que si aumenta la concentracin de algn reactivo, crecera el denominador en Q, y la manera de volver a igualarse a KCsera que disminuyera la concentracin de reactivos (en cantidades estequiomtricas) y, en consecuencia, que aumentasen las
INGENIERIA INDUSTRIAL
CICLO II
31
Universidad Nacional de Trujillo
concentraciones de productos, con lo que el equilibrio se desplazara hacia la derecha, es decir, se obtiene ms producto que en condiciones iniciales. De la manera, en caso de que disminuyera la concentracin de algn reactivo: disminuira el denominador en Q, y la manera de volver a igualarse a KC sera que aumentase la concentracin de reactivos (en cantidades estequiomtricas) y, en consecuencia, que disminuyesen las concentraciones de productos, con lo que el equilibrio se desplazara hacia la izquierda, es decir, se obtiene menos producto que en condiciones iniciales. Anlogamente, podra argumentarse que, si aumentase la concentracin de algn producto, el equilibrio se desplazara a la izquierda, mientras que si disminuyese, se desplazara hacia la derecha. Ejemplo: En el equilibrio anterior: PCl5 (g) PCl3 (g) + Cl2 (g) ya sabemos que, partiendo de 2 moles de PCl5 (g) en un volumen de 5 litros, el equilibrio se consegua con 1,45 moles de PCl5, 0,55 moles de PCl3 y 0,55 moles de Cl2 cuntos moles habr en el nuevo equilibrio si una vez alcanzado el primero aadimos 1 mol de Cl2 al matraz? (Kc = 0,042) Equilibrio: Moles inic.: Moles equil. PCl5 (g) 1,45 1,45 + x PCl3 (g) + 0,55 0,55 x Cl2 (g) 0,55 + 1 1,55 x
Resolviendo la ecuacin se obtiene que: x = 0,268 Equilibrio: neq (mol) conc (mol/l) PCl5 (g) 1,45+0,268 1,718 0,3436 PCl3 (g) + Cl2 (g) 0,550,268 1,550,268 0,282 1,282 0,0564 0,2564
El equilibrio se ha desplazado a la izquierda. Se puede comprobar como:
INGENIERIA INDUSTRIAL
CICLO II
32
Universidad Nacional de Trujillo
Cambio en la presin (o volumen): En cualquier equilibrio en el que haya un cambio en el nmero de moles en sustancias gaseosas entre reactivos y productos, como por ejemplo en reacciones de disociacin del tipo: AB + C, ya se vio que KC=c x 2 Al aumentar p (o disminuir el volumen) aumenta la concentracin y eso lleva consigo una menor a, es decir, el equilibrio se desplaza hacia la izquierda que es donde menos moles hay. Este desplazamiento del equilibrio al aumentar la presin, hacia donde menos moles de sustancias gaseosas, es vlido y generalizable para cualquier equilibrio en el que intervengan gases. Lgicamente, si la presin disminuye, el efecto es el contrario. Si el nmero de moles gaseosos total de reactivos es igual al de productos se pueden eliminar todos los volmenes en la expresin de KC, con lo que ste no afecta al equilibrio (y por tanto, tampoco la presin). CUIDADO!: El cambio de presin apenas afecta a sustancias lquidas (incluyendo disoluciones) o slidas, por lo que si en una reaccin no interviene ningn gas, estos cambios no afectarn al equilibrio. Ejemplo Selectividad. Madrid Junio 1998: Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrgeno y 2,5 de yodo, se calienta a 400C con lo que al alcanzar el equilibrio se obtienen 4.5 moles de HI, siendo el volumen del recipiente de reaccin de 10 litros. Calcule: a) El valor de las constantes de equilibrio Kc y Kp; b) La concentracin de los compuestos si el volumen se reduce a la mitad manteniendo constante la temperatura a 400C. a) Equilibrio: Moles inic.: Moles equil: conc. eq(mol/l) H2 (g) + 3,5 1,25 0,125 I2 (g) 2 HI (g) 2,5 0 0,25 4,5 0,025 0,45
b) En este caso, el volumen no influye en el equilibrio, pues al haber el mismo n de moles de reactivos y productos, se eliminan todas las V en la expresin de KC. Por tanto, las concentraciones de reactivos y productos, simplemente se duplican:
INGENIERIA INDUSTRIAL
CICLO II
33
Universidad Nacional de Trujillo
Se puede comprobar como:
Cambio en la temperatura. Se observa que, al aumentar T, el sistema se desplaza hacia donde se consuma calor, es decir, hacia la izquierda en las reacciones exotrmicas y hacia la derecha en las endotrmicas. Si disminuye T el sistema se desplaza hacia donde se desprenda calor (derecha en las exotrmicas e izquierda en las endotrmicas). Ejemplo: Hacia dnde se desplazar el equilibrio al: a) disminuir la presin? b) aumentar la temperatura H2O (g) + C(s) CO (g) + H2(g) (DH > 0) Hay que tener en cuenta que las concentraciones de los slidos ya estn incluidas en la KC por ser constantes.
a) Al bajar "p" el equilibrio se desplaza hacia la derecha (donde ms moles de gases hay: 1 de CO + 1 de H2 frente a 1 slo de H2O) b) Al subir "T" el equilibrio tambin se desplaza hacia la derecha (donde se consume calor por ser la reaccin endotrmica). Dependencia de k con la temperatura:
A partir de nuestros conocimientos de Termodinmica podemos recordar que:
G = RT lnK G = H TS Los valores de H y S no varan en ciertos rangos de temperatura. El valor de la constante de equilibrio de la temperatura de reaccin.
Podemos plantear las expresiones para dos temperaturas diferentes: G = RT1lnK1 = H T1S INGENIERIA INDUSTRIAL CICLO II
34
Universidad Nacional de Trujillo
G = RT2lnK2 = H T2S Dependencia Buscamos una relacin que nos indique la dependencia del valor de la constante de equilibrio con la temperatura:
Restamos (2) (1):
Finalmente, obtenemos la ecuacin de Van'tHoff, expresin que nos indica la dependencia de la constante de equilibrio, K, y la temperatura, T:
como H tiene unidades de energa Por ejemplo, para el sistema:
Se tiene:
T(k) kp
298 O,1124
398 3,8010
393 29,000
408 84,98
423 111,000
Podemos observar que conforme se incrementa la temperatura, el valor de K se hace cada vez ms grande, es decir, se favorece el sentido directo de la reaccin, adems, podemos deducir que la reaccin es endotrmica. Lo comprobamos con los valores a 75 C y 120 C:
INGENIERIA INDUSTRIAL
CICLO II
35
Universidad Nacional de Trujillo
De donde obtenemos que H = 51345,19 J = 51,35 kJ > 0 endotrmica.
la reaccin es
El equilibrio molecular es aquel en el que todas las sustancias participantes son moleculares. stepuede ser de dos tipos, homogneo y heterogneo.
Equilibrio Homogneo El trmino se aplica a las reacciones en las que todas las especies participantes (reactivos y productos) se encuentran en la misma fase, como:
Por ejemplo:
Equilibrio Heterogneo Una reaccin reversible en la que intervienen reactivos y productos en distintas fases conduce a unequilibrio heterogneo, por ejemplo:
INGENIERIA INDUSTRIAL
CICLO II
36
Universidad Nacional de Trujillo
Donde los dos slidos y el gas constituyen fases distintas a una misma temperatura. Debemos recordar: Estado de la materia gases slidos puros lquidos puros disoluciones Actividad, a presin parcial, p 1 1 molaridad, M, (mol/L)
Como sabemos, K se define en trminos de actividades, a, que sonmagnitudes adimensionales, en consecuencia, para la reaccin dada, su constante de equilibrio ser:
El valor de K no depende de las cantidades de CaCO3(s) y CaO(s) presentes, siempre y cuando algo de cada uno de ellos se encuentren presentes en el equilibrio:
Importante
INGENIERIA INDUSTRIAL
CICLO II
37
Universidad Nacional de Trujillo
A pesar que los slidos y lquidos puros no aparecen en la expresin de la constante de equilibrio, K, estos deben estar presentes para que se establezca el equilibrio.
A determinada temperatura, se colocan 5 kg de CaCO3(s) en un recipiente hermticamente cerrado y se deja alcanzar el equilibrio. Se sabe que a dicha temperatura, el valor de Kp es 4,21. Determina la masa de CaCO3(s) que permanece sin reaccionar una vez alcanzado el equilibrio.
n = 4,033 mol de CO2 formadas El CO2(g) se form por los moles de CaCO3(s) que se descompusieron, que ser estequiomtricamente igual a las moles de CO2(g) formadas, por lo que primero calculamos las moles iniciales de CaCO3(s):
luego calculamos las moles de CaCO3(s) que permanecen en el equilibrio: i nsin reaccionar = 50 4,033 = 45,97 mol de CaCO3 y finalmente la masa de CaCO3(s) que permanece en el equilibrio:
INGENIERIA INDUSTRIAL
CICLO II
38
Universidad Nacional de Trujillo
Conocida la constante de equilibrio, K, a determinada temperatura, para una reaccin especfica, se pueden calcular las concentraciones de los componentes de la mezcla en equilibrio, a partir de las concentraciones iniciales, como lo veremos en los siguientes ejercicios.
Ejercicio 1: Se sabe que a 750 C, el valor de Kc es 0,771 para la siguiente reaccin:
Si colocamos 0,0100 moles de H2 y 0,0150 moles de CO2 en un recipiente de 2 L a 750 C, podemos calcular las concentraciones de cada una de las especies en el equilibrio:
Determinamos
las concentraciones iniciales:
Hacemos un anlisis estequiomtrico:
Escribimos la expresin de Kc:
INGENIERIA INDUSTRIAL
CICLO II
39
Universidad Nacional de Trujillo
Reemplazamos las [ ]eq en la expresin de Kc:
Determinamos el valor de x: (0,0000375 - 0,0125 x + x2) 0,771 = x2
0,229 x2 + 0,0096375 x - 0,0000289 = 0 x1 = 0,002811 M ; x2 = 0,04490 M
Elegimos el valor positivo de x, que a su vez es menor que cualquiera de las concentraciones iniciales. Descartamos el valor negativo de x porque la cantidad que reacciona no puede ser negativa.
Determinamos las concentraciones en el equilibrio:
[H2]eq = 0,0050 x = 0,0022 M [CO2]eq = 0,0075 x = 0,0047 M [H2O]eq = [CO]eq = x = 0,002811 M
Finalmente podemos determinar el grado de reaccin, de cada uno de los reactantes:
la reaccin se produjo en un 56,0 % respecto al H2
la reaccin se produjo en un 37,5 % respecto al CO2
INGENIERIA INDUSTRIAL
CICLO II
40
Universidad Nacional de Trujillo
Ejercicio 2 Para la reaccin mostrada, se sabe que a 450 C, el valor de KP = 4,51 x 10-5:
La mezcla inicial contena 81 atm de H2(g) y 215 atm de N2(g). Una vez alcanzado el equilibrio se determin que la mezcla consista en 26 atm de NH3(g), 42 atm de H2(g) y 202 atm de N2(g).
p0 preacciona pforma peq de los datos:
215 x 215 -x 202 atm
81 3x 81 -3 x
2x 2x
42 atm
26
A partir de la informacin proporcionada, podemos deducir que x = 13 atm Determinemos el grado de reaccin, , y el porcentaje que ha reaccionado, 100 , de cada uno de los reactivos:
Respecto al N2:
ha reaccionado el 6,05 % del N2
Respecto al H2:
ha reaccionado el 48,12 % del H2
Observaciones Para determinar las concentraciones en el equilibrio debemos tener en cuenta los INGENIERIA INDUSTRIAL CICLO II
41
Universidad Nacional de Trujillo
siguientes pasos:
Determinar
las concentraciones
iniciales.
Hacer el anlisis estequiomtrico: expresar las concentraciones de equilibriode todas las especies en trminos de las concentraciones iniciales y una sola variable x que representa el cambio de concentracin. Escribir la expresin de la constante de equilibrio en trminos de las concentraciones de equilibrio. Si se conoce el valor de la constante de equilibrio, despejar y obtener el valor de x. Calcular las concentraciones de equilibrio.
El grado de reaccin, , indica en qu proporcin se convirti en producto un determinado reactivo:
que tambin puede expresarse en trminos de porcentaje de reaccin: 100
Importante
Ten en cuenta que:
Con frecuencia se llega a expresiones cuadrticas para x: Si uno de valores de x es negativo, se descarta Si los dos son positivos, se debe elegir el que es menor que las concentraciones iniciales.
Si el valor de K es del orden de 10-5 o menor que este, se puede aproximar el valor de ( [ ]0 x ) como [ ]0
INGENIERIA INDUSTRIAL
CICLO II
42
Universidad Nacional de Trujillo
3.6. Equilibrio Inico Unidad 3: Equilibrio qumico El equilibrio inico se diferencia del equilibrio molecular por el tipo de partculas presentes en la mezcla en equilibrio, as:
En el equilibrio molecular tenemos la presencia nicamente de molculas, es decir, tanto los reactivos como los productos se encuentran en estado molecular. En el equilibrio inico tenemos la presencia tanto de molculas como de partculas inicas en la mezcla en equilibrio.
En esta seccin vamos a estudiar la participacin de las siguientes sustancias:
cidos y bases en solucin acuosa el agua sales en solucin acuosa
La importancia de los cidos, las bases y las sales (producto de la reaccin de un cido y una base) es amplia:
Sin cidos y bases no se podra fabricar una multitud de sustancias entre las quefiguran fertilizantes, pigmentos, sales, productos del petrleo, fibras sintticas, vidrio, etc. Los cidos, las bases y las sales son indispensables en la agricultura, pues muchas plantas requieren un medio ligeramente cido para crecer. La acidez y la basicidad desempean un papel fundamental en el comportamiento de ciertos sistemas qumicos, biolgicos y geolgicos. Algunos medicamentos, como el cido ascrbico y la penicilina, son estables en medios cidos, pero no en medios bsicos.
Algunos ejemplos de este tipo de sustancias que encontramos y usamos en nuestra vida diaria son:
INGENIERIA INDUSTRIAL
CICLO II
43
Universidad Nacional de Trujillo
cidos
vinagre ctricos cerveza
bases
jabones
anticido detergentes
sales
Sal
anticido
Urea
Teoras cido - base En este captulo analizaremos dos de las definiciones de los cidos y bases, teniendo en cuenta su comportamiento al disolverlos en agua pura. INGENIERIA INDUSTRIAL CICLO II
44
Universidad Nacional de Trujillo
Teora de Arrhenius
Un cido es una sustancia que cuando se disuelve en agua libera iones hidrgeno, H+. Una base es una sustancia que al disolverse en agua, libera iones hidroxilo, OH.
Por ejemplo, cuando el cloruro de hidrgeno gaseoso, HCl, se disuelve en agua, se disocia en iones hidrgeno, H+, e iones cloruro, Cl:
Esta solucin es lo que conocemos como cido clorhdrico, el cual es el responsable de la digestin en el estmago.
Los cidos orgnicos contienen el grupo carboxilo, -COOH, el cual libera el ion hidrgeno, H+. Por ejemplo, para el cido actico, CH3COOH, (componente principal del vinagre):
Cuando el hidrxido de sodio, NaOH, se disuelve en agua, se disocia en iones sodio, Na+ y iones hidroxilo, OH:
Teora de Brnsted Lowry
Un cido es una sustancia (molcula o ion) que puede transferir un protn, H+, a otra sustancia. Una base es una sustancia que puede aceptar un protn.
Segn esta teora, cuando el cido actico, CH3COOH, se disuelve en agua, algunas de sus molculas se disocian transfirindole un protn, H+, convirtindose en el in acetato, CH3COO-. Por su parte, el agua, H2O, se comporta como base al aceptar el protn, H+, convirtindose en el ion hidronio, H3O+: INGENIERIA INDUSTRIAL CICLO II
45
Universidad Nacional de Trujillo
La teora de Brnsted Lowry permite ampliar el rango de sustancias que pueden clasificarse comobases, por ejemplo el amonaco, NH3:
A una base y un cido que difieren slo en la presencia o ausencia de un protn, se les conoce comopar conjugado cido-base:
base conjugada es la porcin que queda de la molcula del cido, despus que transfiere el protn. cido conjugado se forma cuando el protn se transfiere a la base.
INGENIERIA INDUSTRIAL
CICLO II
46
Universidad Nacional de Trujillo
Como se puede observar, el agua puede comportarse como cido en algunos casos y en otros como base, por eso se dice que es un anftero. Fuerza de Bases Los hidrxidos metlicos contienen iones OH en sus redes cristalinas, luego todos son bases potencialmente fuertes. La fuerza de los hidrxidos est determinada por la concentracin de iones OH en la disolucin. Las bases fuertes estn conformadas por los hidrxidos de los metales de las familias 1A y 2A de la tabla peridica (excepto Be y Mg):
1 Bases fuertes 2
LiOH, NaOH, KOH, RbOH, CsOH, FrOH
Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2
El hidrxido de sodio, NaOH, es una base fuerte, en cambio el hidrxido de magnesio, Mg(OH)2, es dbil:
Base fuerte:
Base dbil:
INGENIERIA INDUSTRIAL
CICLO II
47
Universidad Nacional de Trujillo
Como observamos, las bases dbiles tambin forman un sistema en equilibrio cuando se disuelven en agua:
[ ]0 [ ]reacciona [ ]forma [ ]eq
[ ]0 x [ ]0 -x
x x
x x
La expresin de la constante de equilibrio, en trminos de concentraciones, se denomina Kb, constante de disociacin bsica:
Al observar la expresin de Kb podemos concluir que conforme se incrementa la [OH ], aumentar el valor de Kb y el del grado de ionizacin, . Cuanto mayor es el valor de , la base ser menos dbil, y en consecuencia, mayor es el valor de Kb.
Ciertas bases son mejores aceptoras de protones que otras. Cuanto ms fuerte es una base, ms dbil es su cido conjugado.
A mayor valor de Kb menos dbil o relativamente ms fuerte es la base. Los trminos fuerte y dbil se usan en el mismo sentido tanto para bases como para cidos. fuerte = disociacin completa (ion hidrxido aadido a una solucin), como en: NaOH(s) Na+(ac) + OH(ac)
dbil
= muy pequea disociacin (o reaccin con el agua), como por ejemplo en:
INGENIERIA INDUSTRIAL
CICLO II
48
Universidad Nacional de Trujillo
cido Nombre Frmula Estructura Kb conjugado
Etilamina
C2H5NH2
5,6 x 10-4
C2H5NH3+
Metilamina
CH3NH2
4,4 x 10-4
CH3NH3+
Cafena
C8H10N4O2
4,1 x 10-4
C8H11N4O2+
Amonaco
NH3
1,8 x 10-5
NH4+
Piridina
C 5 H5 N
1,7 x 10-9
C5H5NH+
Anilina
C6H5NH2
3,8 x 10-10
C6H5NH3+
INGENIERIA INDUSTRIAL
CICLO II
49
Universidad Nacional de Trujillo
cido
Nombre
Frmula
Estructura
Kb conjugado
Urea
H2NCONH2
1,5 x 10-14
H2NCONH3+
Los trminos fuerte y dbil se usan en el mismo sentido tanto para bases como para cidos. fuerte = disociacin completa (ion hidrxido aadido a una solucin), como en: NaOH(s) Na+ (ac) + OH(ac)
dbil = muy pequea disociacin (o reaccin con el agua), como por ejemplo en:
En este caso, la constante en trminos de concentraciones, se denomina Kw, constante del producto inico del agua:
Kw = [H3O+] [OH-] De la ecuacin de equilibrio de la autoionizacin del agua podemos deducir que, en el agua pura la[H3O+] es igual a la [OH-]:
Cuando al agua se le aade un cido, la concentracin de iones H3O+ se incrementa, a la vez que la concentracin de los iones OH disminuye, de manera que el producto [H3O+] [OH-] se mantenga constante. Esto provoca que dominen las propiedades cidas, o sea que la concentracin de H3O+ sea mayor que la de los iones OH.
INGENIERIA INDUSTRIAL
CICLO II
50
Universidad Nacional de Trujillo
Por el contrario, si se aade una base al agua, es la concentracin de iones OH la que aumenta, mientras que la de los iones H3O+ disminuye, tornndose la solucin en bsica, donde la concentracin de iones H3O+ es menor que la de los iones OH, de manera que el producto [H3O+] [OH-] se mantiene constante.
A 25 C, Kw = 1 x 1014, por lo tanto en el agua pura: [OH-] = 1 x 107 M
H30=
[H3O+] = [OH-]
agua pura y soluciones neutras soluciones cidas soluciones bsicas
[H3O+] > [OH-] [H3O+] < [OH-]
La escala de pH Expresar la concentracin de los iones H3O+ y OH en nmeros tan pequeos resulta engorroso, por lo que en 1909 se defini la escala de pH, del francs pouvoir hidrogene, poder del hidrgeno. La definicin matemtica de pH es: pH = log [H3O+] Y se acostumbra definir tambin: Y anlogamente: pKa = log Ka pKb = log Kb pOH = log [OH] pKw = log Kw
Como la [H3O+] se relaciona con la [OH], a travs de Kw, se cumple que: pH + pOH = pKw INGENIERIA INDUSTRIAL CICLO II
51
Universidad Nacional de Trujillo
y a 25 C: pH + pOH = 14
Como la escala de pH es logartmica, una diferencia de una unidad implica un cambio en la acidez de 10 veces. El pH indica la acidez de una disolucin, mientras que la fuerza del cido est caracterizada por su porcentaje de disociacin. Cuando el pH se incrementa, el pOH disminuye. Clculos con cidos y bases dbiles Resolucin de problemas de equilibrio de cidos y bases dbiles Los clculos en el equilibrio inico, en particular con cidos y bases dbiles, es similar al empleado en el equilibrio molecular, solo que como trabajamos con partculas inicas en disoluciones acuosas, debemos trabajar con concentraciones, en trminos de molaridad, M.
Identifica las especies principales presentes en la solucin. Selecciona la especie que puede producir iones H+ o iones OH, segn sea el caso y escribe la reaccin de ionizacin. Escribe la expresin de la constante de equilibrio. Tabula las concentraciones iniciales y en el equilibrio. Escribe las concentraciones en el equilibrio en trminos de x. Sustituye en la expresin de equilibrio, las concentraciones en equilibrio, en trminos de x. Resuelve para x, recuerda que puedes aplicar la forma aproximada. Calcula [H+] o [OH] segn corresponda, el grado de ionizacin y el pH. Recuerda que:
Ejercicio El cido lctico, CH3CHOHCOOH (HLac), recibe su nombre de la leche agria, de la cual se aisl por primera vez en 1780. A 25 C el Ka para el HLac es 8,4 x 104. Si INGENIERIA INDUSTRIAL CICLO II
52
Universidad Nacional de Trujillo
tenemos 500 mL de una solucin de leche agria que contiene 0,050 moles de HLac, como componente cido:
determinamos la concentracin inicial de HLac:
podemos escribir la ecuacin de equilibrio y hacer el balance:
[ ]0 []reacciona [ ]forma [ ]eq
0,10 x
x x
x x
0,10 x escribimos la expresin de Ka:
reemplazamos las concentraciones en el equilibrio y determinamos x:
x2 + 8,4 x104x 8,4 x105 = 0
INGENIERIA INDUSTRIAL
CICLO II
53
Universidad Nacional de Trujillo
x1 = 8,75 x103
x2 = 9,59 x103
dado que el valor de x2 es negativo y x1 es menor que [HLac]0, elegimos el valor dex1 = 8,75 x103 la concentracin de iones H+ en el equilibrio ser: [H+] = x = 8,75 x103 M el grado de ionizacin del cido lctico ser:
el porcentaje de ionizacin ser:
finalmente determinamos el pH de la solucin: pH = log [H+] = log (8,75 x103) = 2,06
hemos determinado que el pH de la leche agria es 2,06, es decir se trata de una solucin cida.
. Hidrlisis de sales
Como resultado de una reaccin de neutralizacin entre un cido y una base, se obtiene una sal, segn la reaccin general: cido + base
sal
agua
Una sal es un compuesto inico que contiene un catin que no es H+ y un anin que no es OH: (catin de la base)(anin del cido) HCl + NaOH
NaCl + H2O
Cuando las sales se disuelven en agua se disocian completamente en sus iones, podramos esperar que las disoluciones obtenidas fueran neutras, es decir con pH 7, sin embargo esto no siempre es cierto!!
INGENIERIA INDUSTRIAL
CICLO II
54
Universidad Nacional de Trujillo
Hemos visto que haydos tipos de cidos y dos tipos de bases, los fuertes y los dbiles, por consiguiente, las neutralizaciones cido base van a conducir a cuatro tipos diferentes de sales. Sales Provenientes de cidos y Bases Fuertes El HCl es un cido fuerte y el NaOH es una base fuerte que al reaccionar forman el cloruro de sodio, NaCl: HCl + NaOH NaCl + H2O
Neutralizacin cido-base cido base sal agua
La disolucin de este tipo de sales produce soluciones neutras: NaCl(s) + H2O Na+(ac) + Cl(ac)
ionizacin de la sal
La disolucin de una sal de este tipo no altera el equilibrio de disociacin del agua, por lo tanto la solucin es neutra: [H+] = [OH-]
Cuando las sales no provienen de cidos fuertes y bases fuertes, los iones formados reaccionan con el agua, esta reaccin se denomina hidrlisis. El trmino hidrlisis proviene de las palabras griegashidro, que significa agua y lisis que significa ruptura. La hidrlisis de estas sales produce reacciones de equilibrio, cuya constante en trminos de concentraciones, se denomina constante de hidrlisis, Kh.
Sales Provenientes de cidos Dbiles y Bases Fuertes El HCN es un cido dbil y el NaOH es una base fuerte que al reaccionar forman el NaCN: HCN(ac) + cido-base NaCN(s) + NaOH(ac) H2O NaCN(s) Na+(ac) + + H2O neutralizacin
CN(ac)
ionizacin de la sal
INGENIERIA INDUSTRIAL
CICLO II
55
Universidad Nacional de Trujillo
Este tipo de sales se hidrolizan produciendo disoluciones bsicas:
hidrlisis de la sal
El anin de la sal acepta un protn del agua, formando el cido dbil (del que proviene la sal), liberando iones hidroxilo, OH, en consecuencia: [OH] > [H3O+] pH > 7 Sales Provenientes de cidos Fuertes y Bases Dbiles El HCl es un cido fuerte y el NH3 es una base dbil que al reaccionar forman el NH4Cl: HCl(ac) + NH3(ac) NH4Cl(ac) + Cl(ac) neutralizacin cido-base ionizacin de la sal
NH4Cl(ac)
NH4+(ac)
Este tipo de sales se hidrolizan produciendo disoluciones cidas:
hidrlisis de la sal
El catin de la sal cede un protn al agua, formando la base dbil (de la que proviene la sal), liberando iones hidronio, H3O+, en consecuencia: [H3O+] > [OH]
INGENIERIA INDUSTRIAL
CICLO II
56
Universidad Nacional de Trujillo
pH < 7
Clculos en la hidrlisis
Un preservante alimenticio es una sustancia que, sin alterar el sabor de los alimentos, impide el crecimiento de los microorganismos que los descomponen. Tal es el caso del benzoato de sodio, C6H5COONa, empleado en bebidas no alcohlicas como jugos, en margarinas y jaleas. La etiqueta de un envase de jugo de fruta indica que el contenido de benzoato de sodio es 0,015 M. Si sabemos que a 25 C el Ka del cido benzoico, C6H5COOH, es 6,3 x 105:
Podemos plantear el equilibrio para la hidrlisis de la sal:
Expresamos la constante de equilibrio:
Determinamos las concentraciones en el equilibrio:
x = 1,587
106
[C6H5COO] = 0,015 - x = 0,014998 M [C6H5COOH] = [OH] = x = 1,587
x
106 M
Calculamos el pH del jugo:
pOH = log [OH] = log (1,587 x 106) = 5,81 pH = 14 pOH = 8,19
Determinamos el grado de hidrlisis (grado de reaccin):
INGENIERIA INDUSTRIAL
CICLO II
57
Universidad Nacional de Trujillo
Podemos afirmar que la sal se ha hidrolizado en 0,01058 %
3.6.7. Efecto del ion comn
Unidad 3: Equilibrio qumico
En los tres procesos de disociacin que hemos visto (de cidos, bases y sales) hemos considerado un solo soluto cada vez. Analizaremos ahora el caso de disoluciones donde estn presentes dos solutos que contienen un mismo ion (catin o anin), denominado ion comn. Los indicadores cido-base son sustancias, generalmente coloreadas, que se disocian parcialmente. Sus iones presentan una coloracin distinta a la de la especie sin disociar, de modo que, segn el sentido que est favorecido en el equilibrio, la disolucin puede presentar uno u otro color de manera preferente. Conforme vara el pH de una solucin, los indicadores varan su color, indicando de forma cualitativa, si la solucin es cida o bsica.
Si a 100 mL de solucin 0,10 M de un cido dbil, HA, se le aade el indicador anaranjado de metilo, ste presenta su color cido, rojo: HA + H2O A + H3O+ color del indicador: rojo
Si a esta solucin se le aaden 0,015 moles de una sal de HA, por ejemplo NaA, el color cambia a amarillo: HA + H2O amarillo A + H3O+ color del indicador:
Esta observacin experimental se puede explicar en base al Principio de Le Chatelier: la adicin del in A, desplaza el equilibrio hacia la izquierda, y en consecuencia disminuye la concentracin de los iones hidronio, H3O+, disminuyendo por lo tanto, el grado de disociacin, alfa. Dado que el cido dbil, HA, y su sal, NaA, tienen en comn el ion A:
INGENIERIA INDUSTRIAL
CICLO II
58
Universidad Nacional de Trujillo
(ac)
HA(ac)
H2O(l)
H3O
+ (ac)
NaA(ac)
H2O(l)
A(ac)
Na+(ac)
Este fenmeno se denomina efecto del ion comn.
El efecto que puede ejercer la presencia de un ion comn sobre un sistema en equilibrio, se basa en el Principio de Le Chatelier.
Si analizamos el pH y el grado de disociacin de 100 mL de una solucin 0,10 M de cido actico, CH3COOH, tendremos: CH3COOH(ac) [ ]0 [ ]reacciona [ ]forma [ ]eq 0,10 x 0,10 -x + H2O(l) CH3COO(ac) x x + H3O+(ac) X X
x = 1,34 x103 = [H3O+]
pH = 2,87
Si a esta solucin de CH3COOH le aadimos 0,015 moles de acetato de sodio, CH3COONa, determinaremos la nueva concentracin de los iones H3O+:
La concentracin de los iones acetato en la mezcla ser:
INGENIERIA INDUSTRIAL
CICLO II
59
Universidad Nacional de Trujillo
Dado que ion CH3COO es uno de los productos de la disociacin del CH3COOH, el equilibrio de ste se desplaza en el sentido inverso. Como vemos, ser muy poco lo que se haya disociado del cido actico, de modo que podemos considerar que la concentracin inicial de ste sigue siendo 0,10 M. De igual manera, ser muy poca la cantidad del ion acetato que se haya podido hidrolizar, por lo que consideraremos que su concentracin sigue siendo 0,15 M. Al realizar el balance estequiomtrico para el nuevo estado de equilibrio tendremos: CH3COOH(ac) + H2O(l) CH3COO(ac) 0,15 x 0,15 + x + H3O+(ac) x x
[ ]0 [ ]reac. [ ]forma [ ]eq
0,10 x 0,10 -x
Como el Ka del cido actico es 1,8 x 105, podemos determinar la nueva concentracin de iones H3O+:
x = 1,2 x105 = [H3O+]
El grado de ionizacin ser:
Finalmente el pH de la disolucin ser:
pH = - log [H3O+] = 4,92
INGENIERIA INDUSTRIAL
CICLO II
60
Universidad Nacional de Trujillo
Hemos comprobado que al aadir el ion acetato disminuye la [H3O+], y por consiguiente, aumenta el pH de la solucin, adems disminuye el valor de alfa y en consecuencia, el grado de reaccin.
3.6.8. Soluciones Buffer o Amortiguadoras
Unidad 3: Equilibrio qumico
Algunas veces es necesario preparar y guardar una solucin con un pH constante. La preservacin de dicha solucin es an ms difcil que su preparacin:
si la solucin entra en contacto con el aire, absorber dixido de carbono, CO2, y se volver ms cida. si la solucin se guarda en un recipiente de vidrio, las impurezas alcalinas "desprendidas" del vidrio pueden alterar el pH.
Las soluciones buffer o amortiguadoras son capaces de mantener su pH en valores aproximadamente constantes, aun cuando se agreguen pequeas cantidades de cido o base, o se diluya la solucin.
Una disolucin buffer o amortiguadora se caracteriza por contener simultneamente una especie dbil y su par conjugado:
un cido dbil y la sal de su par conjugado HA + H2O A + H3O+
una base dbil y la sal de su par conjugado + H2O BH+ + OH
La disolucin buffer debe contener una concentracin relativamente grande de cada uno de losintegrantes del par conjugado, de modo que:
la especie cida del sistema buffer pueda reaccionar con los iones OH que se le aadan
INGENIERIA INDUSTRIAL
CICLO II
61
Universidad Nacional de Trujillo
la especie bsica del sistema buffer pueda reaccionar con la cantidad de iones H+ que se aadan
La presencia del par conjugado hace que la especie dbil se disocie en menor proporcin:
HA
H2O
H3O+
H2O
BH+
OH
La presencia de la especie dbil hace que el par conjugado se hidrolice menos:
H2O
HA
OH
BH+
H2O B +
H3O+
INGENIERIA INDUSTRIAL
CICLO II
62
Universidad Nacional de Trujillo
El uso de las disoluciones buffer es importante en muchos procesos industriales, as por ejemplo en el electro platinado, la elaboracin del cuero, de materiales fotogrficos y de tintes.
En la investigacin bacteriolgica, generalmente se debe mantener el pH de los medios de cultivo para el crecimiento de las bacterias en estudio.
En el cuerpo humano los valores del pH varan mucho de un fluido a otro, sin embargo estos valores son fundamentales para el funcionamiento adecuado de las enzimas y el balance de la presin osmtica y se mantienen gracias a las disoluciones buffer.
Cmo calcular el pH en soluciones buffer
INGENIERIA INDUSTRIAL
CICLO II
63
Universidad Nacional de Trujillo
Equilibrios de solubilidad. Constante del producto de solubilidad, Kps. Criterios para la precipitacin o disolucin. Precipitacin de Sulfuros. Efecto de la formacin de complejos. Anfoterismo. Aplicaciones y ejercicios
Equilibrio de solubilidad
La aparicin de precipitados en una disolucin, introduce peculiaridades propias en el tratamiento matemtico del equilibrio. Al producirse la precipitacin, los balances de masas de las especies implicadas en la misma, dejan de cumplirse pues parte de la masa que antes haba en la disolucin a pasado al precipitado. Por contra, la disolucin permanece saturada en las especies que forman el precipitado, de forma que se cumple el producto de solubilidad: aA + b B < = > Aa Bb Ks = [A] a [B] b
(1)
Esta expresin tambin se cumple, justo al inicio de la precipitacin, cuando todava no hay precipitado, pero la disolucin ya se encuentra saturada de A y B. Un problema comn en equilibrios de precipitacin es la determinacin de la solubilidad, s, de un precipitado en diversas condiciones experimentales. La solubilidad se define como la concentracin del precipitado que se haya en disolucin. En el caso anterior, si el precipitado Aa Bb se aade en agua destilada, la solubilidad ser: s = concentracin de Aa Bb disuelta = [A] / a = [B] / b por lo que: (2) (3) Ks = (a s)a (b s)b s = (Ks / ( aa bb)) 1/(a+b)
La solubilidad puede disminuirse aadiendo a la disolucin, alguno de los componentes del precipitado. Por ejemplo, si se aade una concentracin C de A: (4) Ks = (C + a s)a (b s)b en general C >> s, por lo que: INGENIERIA INDUSTRIAL CICLO II
64
Universidad Nacional de Trujillo
(5) Ks = Ca (b s)b
Problema.- Determinar la solubilidad del sulfato de bario en agua destilada y en una disolucin 0,1 M de Na2SO4.
En este caso: Ba2+ + SO42- < = > BaSO4 Ks = [Ba2+] [SO42- ] = s . s = 10 -9,97 s = 10 -4,985 M Si la disolucin es adems 0,1 M en Na2SO4: Ks = [Ba2+][SO42-] = s . (C + s) ~ s . C = 10 -9,97 s = 10 -8,97 M Vemos como la solubilidad ha disminuido considerablemente por efecto del ion comn.
Equilibrios laterales Los equilibrios laterales aumentan la solubilidad de los precipitados. Esto se manifiesta en un aumento del valor de la constante de solubilidad condicional: (6) Ks' = [A'] a [B'] b = [A]a [B] b
a b A B
Problema 4.13.- Una disolucin amortiguada a pH = 2 que es 1 M en EDTA y 0.01 M en Pb2+ se satura en H2S precipitar el PbS? La concentracin de una disolucin saturada de H2S es 0,1 M. En primer lugar plantearemos los equilibrios: Pb2+ + S2- < = > PbS pKs = 26,6
Pb2+ + Y4- < = > PbY2-
log KPbY = 18,0
Los equilibrios laterales son provocados por H+y OH-, y afectan al Pb2+, al S2-, al Y4- y al PbY2-. Las constantes sern: Pb2+ / OHINGENIERIA INDUSTRIAL log = 6,2; 10,3 y 14,0 CICLO II
65
Universidad Nacional de Trujillo
S2- / H+
log K = 12,9 y 7,05
Y4- / H+
log K = 11,0; 6,3; 2,5 y 1,9
PbY2- / H+
log KH = 2,8
De donde:
Pb
= 1,000
= 1015,95
= 1014,03
PbY
= 7,31
Por lo que las constantes condicionales sern: Ks' = Ks KPbY' = KPbY
Pb PbY S
= 10-10,65
Pb Y)
/(
= 10-4,83
Para saber si precipitar el PbS, evaluaremos la concentracin de Pb2+ libre que quedara en equilibrio con el EDTA: [Pb2+] = 0,01 / (1 + KPbY' [Y']) Como [Y'] >> [Pb2+], podemos poner [Y'] = 1 M y por lo tanto: [Pb2+] = 1,48 10-7 M Como estamos a pH=2, nos encontramos claramente en la zona de predominio del H2S, podemos poner [S '] = 0,1 y evaluar el producto inico del precipitado: [Pb2+] [S ' ] = 1,48 10-7 0,1 = 1,48 10-8 > Ks' = 2,24 10-11 M por lo tanto el PbS precipitar.
INGENIERIA INDUSTRIAL
CICLO II
66
Universidad Nacional de Trujillo
Si queremos conocer la solubilidad del PbS en las condiciones del problema, tendremos que obtener la concentracin de Pb2+ en equilibrio con el precipitado: [Pb2+] = Ks / [S ' ] = 2,24 10-10 M
La solubilidad ser:s = [Pb2+] + [PbY']y la concentracin condicional de complejo PbY'] = KPbY' [Pb2+] [Y'] = 1,515 10-5 y por lo tanto s = 1,515 10-5 M
Problema 4.15.- Se tiene una suspensin de AgCl y Ag2CrO4, que contiene 0,001 moles de cada sal en un litro de agua A qu valor de pH mximo debe ajustarse la suspensin para disolver el cromato de plata? En este caso tenemos dos precipitados, por lo tanto, se cumplirn dos productos de solubilidad: KAgCl = [Ag+] [Cl-] = 10-9,75 KAg2CrO4 = [Ag+]2 [CrO42-] = 10-11,95 Al disminuir el pH, el cromato se protonar induciendo la solubilizacin del cromato de plata. A partir de los diagramas de predominio vemos que el HCrO4- inicia su predominio a pH < 6,5. Por otra parte, los complejos hidroxilados de la plata empiezan a predominar a partir de pH >11,7. Por ello no los tendremos en cuenta. Las nicas reacciones laterales a considerar sern las del cromato con los protones. Justo a el pH mximo en que todo el cromato de plata se haya disuelto, la disolucin estar saturada y an podr ser aplicado el producto de solubilidad, pero a ese pH: [CrO4'] = 0,001 M = [CrO42-] CrO4(H) [Ag+] = 0,002 + sAgCl Donde sAgCl es la solubilidad del cloruro de plata: [Ag+] [Cl-] = (0,002 + sAgCl) sAgCl = 10-9,75 De donde sAgCl = 8,89 10-8 M, por ello podemos poner [Ag+] = 0,002 M. Con estos datos, se puede obtener la concentracin de cromato libre: [CrO42-] = 10-11,95 / [Ag+]2 = 10-11,95 / 0,0022 = 2,805 10-7 M y el coeficiente de reaccin lateral:
CrO4 (H)
= [CrO4`] / [CrO42-] = 0,001 / 2,805 10-7 = 3565 CICLO II
INGENIERIA INDUSTRIAL
67
Universidad Nacional de Trujillo
Si slo consideramos la primera protonacin del cromato:
CrO42- + H+
< = > HCrO4Tendremos:
log Ks = 6,5
CrO4 (H)
= 1 + K h = 1 + 106,5 h = 3565
De donde h = 1,127 10-3 M y pH = 2,95. Con este valor de pH, las concentraciones de HCrO4-, H2CrO4 y de Cr2O72- sern: [HCrO4-] = 10-4 M; [H2CrO4] = 2 10-7 M y [Cr2O72-] = 3,2 10-5M. Que confirma el predominio de HCrO4-. Si queremos resolver el problema de forma ms exacta, tendremos tambin que consider el resto de las especies del sistema cromato. Los clculos seran: [CrO4'] = [CrO42- ] + [HCrO4-] + [H2CrO4 ] + 2 [Cr2O72-] Por lo tanto: [CrO4'] = [CrO42- ] + [HCrO4-] + [H2CrO4 ] + 2 KD [HCrO4- ]2 Y en funcin de la concentracin de protones: [CrO4'] = [CrO42- ] (1 + 1 h + 2 h2 + 2 KD12[CrO4 2- ] h2 )
Asi pues:
CrO4 (H)
= 1 + 1 h + (1 + 2 KD12[CrO4 2- ] ) h2
Sustituyendo los valores de las constantes: 107,95h2 +106,5 h - 3564 = 0 de donde h = 1,093 10-3 M, y el pH = 2,961 .
INGENIERIA INDUSTRIAL
CICLO II
68
Universidad Nacional de Trujillo
En los temas anteriores has visto casi exclusivamente sistemas gaseosos en equilibrio, en los que todas las sustancias se encontraban en estado gaseoso a la temperatura de trabajo, como era el caso de la sntesis del amoniaco. En la unidad siguiente vers las reacciones entre cidos y bases, con todas las sustancias en disolucin acuosa. Si todos los reactivos y productos estn en el mismo estado fsico, el equilibrio eshomogneo, pero si uno o ms reactivos o productos estn en una fase diferente, el equilibrio es heterogneo. Son ejemplos de este ltimo tipo los equilibrios entre sustancias slidas y gaseosas: C (s) + O2 (g) CO2 (g) o entre una disolucin saturada y su precipitado: BaSO4 (s) Ba2+ (aq) + SO42- (aq) ste es el caso que vas a ver en este tema, en el que analizars la solubilidad de compuestos inicos poco solubles, por un lado, y la formacin de precipitados de compuestos inicos poco solubles, por otro. En la imagen puedes ver precipitados de colores caractersticos en tubos de ensayo: blancos, grises, azules, negros o rojizos. Estos colores permiten identificar los iones que haba en disolucin; por ejemplo, el precipitado azulado del tubo 4 ser muy probablemente hidrxido de cobre (II), que tiene ese color. Los equilibrios de solubilidad tienen gran importancia en Qumica. Permiten resolver problemas como la recuperacin de sustancias muy caras que estn en disolucin, como el ion Ag+, o la deteccin y eliminacin de las disoluciones de iones txicos para los organismos. Otros procesos relacionados con equilibrios de solubilidad son la formacin de cavernas de piedra caliza, el ablandamiento del agua dura, la formacin de clculos renales o las caries dentales, como vers en este tema.
INGENIERIA INDUSTRIAL
CICLO II
69
Universidad Nacional de Trujillo
Antes de comenzar a trata el tema de la constante del producto de solubilidad, es til y necesario recordar los conceptos de sales solubles y poco solubles. El AgNO3 por INGENIERIA INDUSTRIAL CICLO II
70
Universidad Nacional de Trujillo
ejemplo, es una sal soluble, en cambio el CH3COOAg, es una sal poco soluble. Esto puede comprobarse fcilmente cuando se intenta disolver una cantidad igual de una sal u otra en un volumen igual de agua. Si mantenemos la temperatura constante , y aadimos a un vaso o un matraz un poco de sal comn, ( NaCl), observaremos que la disolucin ser completa en pocos segundos. Si repetimos varias veces dicha operacin, se ver que la disolucin del slido se produce cada vez de manera ms lenta, hasta llegar al punto en el cual ya no se disuelva ms sal. Se dice entonces, que la disolucin se encuentra saturada en NaCl, y se conoce como solubilidad a la concentracin de soluto disuelto en la disolucin que se encuentra saturada. La cantidad de sal que consigue ser admitida por una disolucin hasta que se satura suele ser muy grande, pues la sal comn es bastante soluble en agua. En cambio, otra serie de compuestos son poco solubles, y basta con disolver una muy pequea cantidad de ellos para conseguir una disolucin saturada. Por lo general, se suele considerar que una sal es de tipo soluble cuando se pueden preparar disoluciones de concentraciones superiores a valores de 0.01M, en cambio, aquellas sales con solubilidades bastante inferiores a 0.01M, se suelen considerar sales insolubles.
Otro ejemplo es el cloruro de plata, AgCl, el cual es una sal ms bien poco soluble en agua. Cuando esta se disuelve en agua, de manera rpida se consigue una saturacin y se establece un equilibrio entre el cloruro de plata , el cual es slido, y sus iones, llegando a dar lugar a lo que se conoce como un equilibrio inico en disolucin acuosa, tal y como representa la siguiente ecuacin: AgCl (s) Ag^+ (ac) + Cl^- (ac) Como ste equilibrio es de tipo heterogneo, la expresin de la constante de equilibrio ser el producto de las concentraciones de iones en la disolucin que se encuentra saturada, pues la concentracin de AgCl, es constante debido al hecho de ser un slido: Kps = [Ag^+][Cl^-] La constante de equilibrio conocida como Kps, se le llama constante del producto de solubilidad y, al igual que cualquier constante de equilibrio, el valor depende de la temperatura. As, la expresin de la constante del producto de solubilidad de un compuesto de tipo inico que sea poco soluble, ser el producto de las concentraciones de los iones que lo compongan en cada caso, encontrndose stos elevados, cada uno a un exponente que se tratar del nmero de iones que contenga el compuesto en cuestin. Cuando se conoce el valor de la constante del producto de solubilidad para un compuesto inico que sea poco soluble, se puede calcular bien su solubilidad. Es bastante ms frecuente encontrar informacin los valores de las constantes Kps, que sobre las solubilidades en s. La constante del producto de solubilidad, tambin tiene otra aplicacin, pues permite conocer si se formar un precipitado al mezclar distintas disoluciones que contengan iones que componen una sal que sea poco soluble. INGENIERIA INDUSTRIAL CICLO II
71
Universidad Nacional de Trujillo
Si ponemos como ejemplo dos disoluciones, una 2.10^-1 M, de Pb (NO3)2, y otra 2.10^-2 M de Na2SO4, la primera disolucin contiene iones Pb^2+ y tambin iones NO3^-, en cambio, la segunda disolucin contiene iones Na^+ e iones SO4^2-. El sulfato de plomo II, es una sal de tipo poco soluble, siendo posible la formacin de una pequea cantidad de PbSO4 (s) Pb^2+ (ac) + 2 NO3^- (ac) 2Na^+ (ac) + SO4^2- (ac) , ambas reacciones tienen como producto el PbSO4(s). Pero para poder saber con certeza si se producir el precipitado de PbSO4, es decir, para saber si se formar una fase slida cuando mezclamos las disoluciones, se necesita considerar el siguiente equilibrio de tipo heterogneo: PbSO4 (s) Pb^2+ (ac) + SO4^2- (ac) As, podemos calcular el valor del cociente de reaccin Q, partiendo de las concentraciones de los iones inicialmente. El cociente de reaccin para el proceso, obtiene la forma de la expresin de la constante de producto de solubilidad, dndosele el nombre de producto inico: Q= [Pb^2+][SO4^2-] Si comparamos el valor de Q, con el valor de la constante Kps, se dan tres posibles opciones: Q< Kps en este caso no se ver formado ningn precipitado. Q= Kps la disolucin es saturada. Q>Kps en este caso s se formar un precipitado.
INGENIERIA INDUSTRIAL
CICLO II
72
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
73
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
74
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
75
Universidad Nacional de Trujillo
La sal precipita cuando a la disolucin saturada se aade algunos de Sus iones. Entonces, segn el principio de Lechatelier, el equilibrio se desplaza hacia la derecha, formndose el precipitado del solido inico (efecto ion comn) Sal (s) Catin (ac) + anin (ac) Para analizar cmo evoluciona una reaccin en funcin de las concentraciones hay que calcular el cociente de reaccin .Aadiendo producto el slido se precipita y sustrayendo se disuelve ms slido. Si Qps > Kps precipita, disolucin sobresaturada Si Qps = Kps disolucin en saturada. Si Qps < Kps se puede aadir sal sin precipitacin, disolucin no saturada saturada. Precipitacin fraccionada La precipitacin fraccionada es un proceso en el que dos o ms aniones en disolucin se separan mediante un reactivo que permite su precipitacin. Ese reactivo forma una sal con cada una de los iones con distintos productos de solubilidad. Primero precipita el de menor producto de solubilidad. Cuando se agote, la adicin de ms reactivos precipita una sal del segundo.
Equilibrio de solubilidad-precipitacin
SOLUBILIDAD Y CONSTANTE DEL PRODUCTO DE SOLUBILIDAD. La solubilidad es una medida de la capacidad de una determinada sustancia para disolverse en otra. Se expresa en moles o gramos de soluto por litro. Los equilibrios de solubilidad precipitacin son equilibrios heterogneos que se establecen en sales poco disueltas entre el soluto no disuelto y sus iones en disolucin acuosa. En estos equilibrios se define una nueva constante de equilibrio llamada "producto de solubilidad, Ksp. Ejemplo: AI(OH) 3+ (aq) + 3 OH- Ksp= Al3+?. OH-? 3(s) = Al
INGENIERIA INDUSTRIAL
CICLO II
76
Universidad Nacional de Trujillo
EFECTO DEL IN COMUN. El efecto del in comn establece que para disminuir la solubilidad de una sal se agrega uno de los iones. Al aumentar la concentracin de uno de los iones que forman el precipitado, la concentracin del otro debe disminuir, para que Kps permanezca constante, a una temperatura determinada. Este efecto es el que permite reducir la solubilidad de muchos precipitados, o para precipitar cuantitativamente un ion, usando exceso de agente precipitante.
LAS LIMITACIONES DEL CONCEPTO DE Ksp Las limitaciones del concepto de Ksp son: El efecto salino que hace referencia a la presencia de iones no comunes a los implicados en el equilibrio de solubilidad aumentando la solubilidad. Debido a ello el valor de Ksp vara en funcin de la cantidad de iones. Los equilibrios simultneos que tienen lugar en una disolucin dan lugar a que el valor de ksp pueda ser errneo. La disociacin incompleta de soluto en iones y el hecho de que algunos iones de la disolucin se unan formando pares de iones da lugar a que el valor de Ksp sea mayor al esperado debido a la reduccin de iones disociados.
CRITERIOS PARA LA PRECIPITACIN Y RECIPITACIN TOTAL. El producto inico es el producto de las concentraciones molares (de equilibrio) de los iones constituyentes, cada una elevada a la potencia del coeficiente estequiomtrico en la ecuacin de equilibrio. CmAn? m Cn+ + n AmQsp = Cn+?m Am-?n
INGENIERIA INDUSTRIAL
CICLO II
77
Universidad Nacional de Trujillo
Los criterios para que una sal se disuelva, no se disuelva o permanezca en equilibrio son: Si Ksp > Qsp la sal no precipita tratndose de una disolucin no saturada. Si Ksp = Qsp se establece un equilibrio. La precipitacin fraccionada consiste en la separacin de iones que tienen la propiedad de precipitar con la misma especie, dando precipitados con solubilidades suficientemente diferentes. SOLUBILIDAD Y PH. Si tenemos una sal poco soluble con un anin de propiedades bsicas y un catin de propiedades cidas, nos encontramos en una situacin en la que la sal se ver afectada por el pH del medio, ya que la presencia de iones H facilitara la reaccin con los cationes que se quieren en solucin. EQUILIBRIO DE IONES COMPLEJOS. Un in complejo es un anin o un catin poli atmico compuesto por un in metlico central al que se unen otros grupos denominados ligando. Los complejos de coordinacin son sustancias que contienen a los iones complejos.
INGENIERIA INDUSTRIAL
CICLO II
78
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
79
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
80
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
81
Universidad Nacional de Trujillo
Anfteros
En Qumica, una sustancia anftera es aquella que puede reaccionar ya sea como un cido o como una base. La palabra deriva del prefijo griego ampho- (u-) que significa "ambos". Muchos metales (tales como zinc, estao, plomo, aluminio, y berilio) y la mayora de los metaloides tienen xidos o hidrxidos anfteros. Otra clase de sustancias anfteras son lasmolculasanfiprticas que pueden donar o aceptar un protn. Algunos ejemplos son los aminocidos y las protenas, que tienen grupos aminos y cido carboxlico, y tambin los compuestos auto ionizables como el agua y el amonaco. De acuerdo con la teora de Brnsted-Lowry de cidos y bases: los cidos son donadores de protones y las bases son aceptores de protones. Una molcula o in anfiprtico puede donar o aceptar un protn, actuando ya sea como un cido o una base. El agua, los aminocidos, los iones hidrogenocarbonato y los iones hidrogenosulfato son ejemplos comunes de especies anfiprticas. Ya que pueden donar un protn,todas las sustancias anfiprticas contienen tomos de hidrgeno. Adems, puesto que pueden actuar como un cido o una base, son anfteros.
Ejemplos Un ejemplo comn de una sustancia anfiprtica es el in hidrogenocarbonato (o bicarbonato), que puede actuar como una base: HCO3- + H2O H2CO3 + OH-
O como un cido: HCO3- + H2O CO32- + H3O+
Por lo tanto, puede aceptar o donar un protn. El agua es el ejemplo ms comn, actuando como una base al reaccionar con un cido como el cido clorhdrico: H2O + HCl H3O+ + Cl-,
______--__::::
y actuando como un cido cuando reacciona con una base tal como el amoniaco: H2O + NH3 NH4+ + OH-
Las sustancias clasificadas como anfteras tienen la particularidad de que la carga elctrica INGENIERIA INDUSTRIAL CICLO II
82
Universidad Nacional de Trujillo
de la parte hidroflica cambia en funcin del pH del medio. Actan como bases en medios
INGENIERIA INDUSTRIAL
CICLO II
83
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
84
Universidad Nacional de Trujillo
INGENIERIA INDUSTRIAL
CICLO II
Vous aimerez peut-être aussi
- Modelamiento y casos especiales de la cinética química heterogéneaD'EverandModelamiento y casos especiales de la cinética química heterogéneaÉvaluation : 3 sur 5 étoiles3/5 (1)
- Cinetica QuimicaDocument10 pagesCinetica QuimicaAnghi BCPas encore d'évaluation
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaD'EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaÉvaluation : 3 sur 5 étoiles3/5 (2)
- Guía de Cinética QuimicaDocument13 pagesGuía de Cinética Quimicafelipe jaraPas encore d'évaluation
- Taller 10 IIIDocument6 pagesTaller 10 IIIJhoanna SernäPas encore d'évaluation
- Operaciones unitarias y proceso químico. QUIE0108: Operaciones básicas en planta químicaD'EverandOperaciones unitarias y proceso químico. QUIE0108: Operaciones básicas en planta químicaPas encore d'évaluation
- CINETICA QUIMICA DefinitivaDocument31 pagesCINETICA QUIMICA DefinitivaJioriver VallejoPas encore d'évaluation
- Semana 11Document10 pagesSemana 11zeppelinIVPas encore d'évaluation
- Apuntes Sobre Cinética QuímicaDocument14 pagesApuntes Sobre Cinética QuímicaLaboratoriodeciencias Altazor100% (2)
- CineticaDocument14 pagesCineticacristianPas encore d'évaluation
- Captura de Pantalla 2023-08-30 A La(s) 12.28.37Document22 pagesCaptura de Pantalla 2023-08-30 A La(s) 12.28.37Julia Abigail Domínguez CisnerosPas encore d'évaluation
- Teoria FisicoquimicaDocument19 pagesTeoria Fisicoquimicaed caronte elricPas encore d'évaluation
- Guía Cuarto Medio Química Cinetica y EquilibrioDocument7 pagesGuía Cuarto Medio Química Cinetica y EquilibrioTamara GuzmanPas encore d'évaluation
- Trabajo de Cinetica (Fisicoquimica)Document23 pagesTrabajo de Cinetica (Fisicoquimica)Andres FelipePas encore d'évaluation
- 3 Cinetica QuimicaDocument28 pages3 Cinetica QuimicaAlfredo Gonzalez MateoPas encore d'évaluation
- Tema 4. Velocidad de Las Reacciones Químicas PDFDocument11 pagesTema 4. Velocidad de Las Reacciones Químicas PDFsefogomezPas encore d'évaluation
- Velocidad DE ReacciónDocument23 pagesVelocidad DE ReacciónBrianna “Brianna” graellPas encore d'évaluation
- Cinetica y EquilibrioDocument13 pagesCinetica y EquilibrioIgnacio AcuñaPas encore d'évaluation
- Cinética de Las Reacciones QuimicasDocument33 pagesCinética de Las Reacciones QuimicasElizabeth ChirinosPas encore d'évaluation
- Cinetica Quimica Universidad Del ValleDocument19 pagesCinetica Quimica Universidad Del Valletamariz colque bustosPas encore d'évaluation
- 3 Cinetica QuimicaDocument29 pages3 Cinetica QuimicaDamián Alexander100% (1)
- EXPERIENCIA 6 - Eq. Qco. y Cte. de Eq.Document20 pagesEXPERIENCIA 6 - Eq. Qco. y Cte. de Eq.JacCke MeDinaPas encore d'évaluation
- Cinética Química. - TeoríaDocument14 pagesCinética Química. - TeoríaFacundo zarachoPas encore d'évaluation
- Practica 4 Energia CineticaDocument12 pagesPractica 4 Energia CineticaGerrard Cardenas AlonsoPas encore d'évaluation
- Practica de CatalisisDocument15 pagesPractica de CatalisisHugo RamírezPas encore d'évaluation
- Re-10-Lab-399 Cinetica Quimica I v2Document12 pagesRe-10-Lab-399 Cinetica Quimica I v2Iker BolívarPas encore d'évaluation
- CINÉTICA QUÍMICA-ChangDocument105 pagesCINÉTICA QUÍMICA-ChangRoman Angel Hernandez50% (2)
- 1.guía Práctica Electivo Cinética Química I Velocidad de Reacción PDFDocument8 pages1.guía Práctica Electivo Cinética Química I Velocidad de Reacción PDFFelipe Echeverría100% (4)
- PRQ 3208 - Lab Nº2Document11 pagesPRQ 3208 - Lab Nº2Leidy CanquiPas encore d'évaluation
- Manual Practica 3 QUÍMICA II - AdrianDocument20 pagesManual Practica 3 QUÍMICA II - Adrianvictor emanuelPas encore d'évaluation
- Cinetica QuimicaDocument11 pagesCinetica QuimicaAnonymous 1Id7AcPas encore d'évaluation
- Trabajo RevisarDocument6 pagesTrabajo RevisarGisell TabordaPas encore d'évaluation
- Cuadernillo de Analitica T y TPDocument71 pagesCuadernillo de Analitica T y TPJor-gePas encore d'évaluation
- Reacción Homogenea BatchDocument15 pagesReacción Homogenea BatchCastPas encore d'évaluation
- Tema 3 Cinética y Equilibrio QuímicoDocument11 pagesTema 3 Cinética y Equilibrio Químicocarlos_btr3413Pas encore d'évaluation
- 1.-Objetivo: A+B Productos ..... ........ ..Document3 pages1.-Objetivo: A+B Productos ..... ........ ..Gabriel Sanchez18Pas encore d'évaluation
- Cinetica QuimicaDocument10 pagesCinetica QuimicacristhandartPas encore d'évaluation
- Velociad de DescomposicionDocument26 pagesVelociad de DescomposicionJuanLopezTrujilloPas encore d'évaluation
- Cinética QuímicaDocument13 pagesCinética QuímicaChase Alvarez SalvadorPas encore d'évaluation
- Velocidad de ReacciónDocument29 pagesVelocidad de ReacciónalexPas encore d'évaluation
- 3 Cinetica Quimica PDFDocument30 pages3 Cinetica Quimica PDFMarilyn RuizPas encore d'évaluation
- Cinetica QuimicaDocument16 pagesCinetica Quimica.:("*"BLacK BuLLeT"*"):.90% (10)
- La Cinética QuímicaDocument12 pagesLa Cinética QuímicaNicholas GarzaPas encore d'évaluation
- Guia Estudio Cinetica Quim 2018Document3 pagesGuia Estudio Cinetica Quim 2018Makarena Jaqueline Herrera DuartePas encore d'évaluation
- Guía 2 - Equilibrio QuímicoDocument4 pagesGuía 2 - Equilibrio QuímicoMauricio ahumadaPas encore d'évaluation
- FísicoqxDocument11 pagesFísicoqxBlanca AmayaPas encore d'évaluation
- TERCER PARCIAL QuímicaDocument85 pagesTERCER PARCIAL QuímicaPetronila MedHerrPas encore d'évaluation
- Constante de Velocidad de Una ReacciónDocument5 pagesConstante de Velocidad de Una ReacciónMisol Enalliby Saldaña ArámbulaPas encore d'évaluation
- Laboratorio N° 8Document31 pagesLaboratorio N° 8Lizeth Mamani GutierrezPas encore d'évaluation
- Laboratorio de Fisicoquimica II - Cinetica QuimicaDocument12 pagesLaboratorio de Fisicoquimica II - Cinetica QuimicaElizabethPas encore d'évaluation
- Laboratorio Nº8 CINETICADocument22 pagesLaboratorio Nº8 CINETICAMarcos Jhoel Condori SotoPas encore d'évaluation
- Unidad 2 Cinética de Las ReaccionesDocument17 pagesUnidad 2 Cinética de Las ReaccionesJoseXochihuaJuanPas encore d'évaluation
- Lab Compresión IIDocument13 pagesLab Compresión IIjloayza.negocios.21Pas encore d'évaluation
- Capitulo 3Document52 pagesCapitulo 3EldaPas encore d'évaluation
- Tema 5 - EquilibrioDocument30 pagesTema 5 - Equilibrioandres guerreroPas encore d'évaluation
- Ley de Acción de MasasDocument6 pagesLey de Acción de MasasC Ronie SandiPas encore d'évaluation
- Informe N4Document27 pagesInforme N4Angel rojas sotoPas encore d'évaluation
- CINÉTICA QUÍMICaDocument5 pagesCINÉTICA QUÍMICaconstanza.salas.1Pas encore d'évaluation
- Contrato de Prestación de Servicios MusicalesDocument1 pageContrato de Prestación de Servicios MusicalesSoledad ChiroquePas encore d'évaluation
- Con Amor de Un Admirador para La Señorita Stefanie Su Nombre Es de Renombre Más Dulce y Suave Que El Néctar de Una Flor Fragante y FlorecienteDocument2 pagesCon Amor de Un Admirador para La Señorita Stefanie Su Nombre Es de Renombre Más Dulce y Suave Que El Néctar de Una Flor Fragante y FlorecienteSoledad ChiroquePas encore d'évaluation
- Consecuencias de La DrogadicciónDocument2 pagesConsecuencias de La DrogadicciónSoledad ChiroquePas encore d'évaluation
- Balance EconómicoDocument1 pageBalance EconómicoSoledad Chiroque100% (2)
- Gisella 2019Document6 pagesGisella 2019Soledad ChiroquePas encore d'évaluation
- Proyecto de Feria de Ciencias y Tecnología2Document5 pagesProyecto de Feria de Ciencias y Tecnología2Soledad Chiroque100% (1)
- Gisella 2019Document6 pagesGisella 2019Soledad ChiroquePas encore d'évaluation
- Sesion - Proceso Historico de La Doctrina Social de La Iglesia 5° Año EvvDocument3 pagesSesion - Proceso Historico de La Doctrina Social de La Iglesia 5° Año EvvSoledad Chiroque100% (1)
- Sesión de Clase 1Document7 pagesSesión de Clase 1Soledad ChiroquePas encore d'évaluation
- Sesion Historia de La Salvacion Patriarcas Jueces Reyes - 1° Año EvvDocument3 pagesSesion Historia de La Salvacion Patriarcas Jueces Reyes - 1° Año EvvSoledad Chiroque80% (5)
- Sesion Religiosidad Popular Santa Rosa de Lima 2 ° Año RaimondiDocument3 pagesSesion Religiosidad Popular Santa Rosa de Lima 2 ° Año RaimondiSoledad Chiroque50% (2)
- Sesion La Iglesia en La Edad Media - 3° Año EvvDocument3 pagesSesion La Iglesia en La Edad Media - 3° Año EvvSoledad Chiroque100% (4)
- Trastornos AlimenticiosDocument1 pageTrastornos AlimenticiosSoledad ChiroquePas encore d'évaluation
- Fábula de La Lechera para Los NiñosDocument1 pageFábula de La Lechera para Los NiñosSoledad Chiroque50% (2)
- Monografia Redes SocialesDocument14 pagesMonografia Redes SocialesSoledad ChiroquePas encore d'évaluation
- Certificado DomiciliarioDocument1 pageCertificado DomiciliarioSoledad Chiroque0% (1)
- Monografia Redes SocialesDocument14 pagesMonografia Redes SocialesSoledad ChiroquePas encore d'évaluation
- Conmoción en China Al Enfermar 500 Niños de Una Escuela Por Contaminación Del SueloDocument4 pagesConmoción en China Al Enfermar 500 Niños de Una Escuela Por Contaminación Del SueloSoledad ChiroquePas encore d'évaluation
- Fisioterapia en Actividad F Sica y DeporteDocument3 pagesFisioterapia en Actividad F Sica y DeporteSoledad ChiroquePas encore d'évaluation
- Otorgamiento de PoderDocument1 pageOtorgamiento de PoderSoledad ChiroquePas encore d'évaluation
- Impacto de La Revolución FrancesaDocument5 pagesImpacto de La Revolución FrancesaSoledad ChiroquePas encore d'évaluation
- Funciones de Los Elementos en La PlantaDocument2 pagesFunciones de Los Elementos en La PlantaVigilancia StarseedsPas encore d'évaluation
- Laboratorio de Quimica.Document11 pagesLaboratorio de Quimica.Carlos MuñozPas encore d'évaluation
- Deber 2 EjerciciosDocument15 pagesDeber 2 EjerciciosRonald CañarPas encore d'évaluation
- Examen Recuperación Tecnologia C° - VacacionalDocument2 pagesExamen Recuperación Tecnologia C° - VacacionalEver CóndorPas encore d'évaluation
- Sobre Las Instalaciones Industriales-Instalaciones de Agua-CDocument49 pagesSobre Las Instalaciones Industriales-Instalaciones de Agua-CLucho GutierrezPas encore d'évaluation
- Cloro GasDocument6 pagesCloro GasDave CPas encore d'évaluation
- Técnicas de GranulaciónDocument9 pagesTécnicas de GranulaciónNancy Nava100% (1)
- Enzimas DigestivasDocument9 pagesEnzimas DigestivasJaime MeridaPas encore d'évaluation
- Presentación SolventesDocument11 pagesPresentación Solventesnattasha15Pas encore d'évaluation
- La Gelatina. Propiedades y Usos.Document3 pagesLa Gelatina. Propiedades y Usos.AgroindustriahumanaPas encore d'évaluation
- Lavador CiclónicoDocument5 pagesLavador CiclónicoAlberto CalzadoPas encore d'évaluation
- Agua Fria Vs Agua Caliente ComparaciónDocument3 pagesAgua Fria Vs Agua Caliente ComparaciónMH Limber0% (1)
- Molibdeno MonografiaDocument25 pagesMolibdeno MonografiasandhjPas encore d'évaluation
- DNP FT AkronHydraulicL 270513Document2 pagesDNP FT AkronHydraulicL 270513Patricia MenaPas encore d'évaluation
- Diapositivas de Explicacion de Tema 1 Tem-100.Document20 pagesDiapositivas de Explicacion de Tema 1 Tem-100.Franklin Luna CuarityPas encore d'évaluation
- Nton 05 007-98Document11 pagesNton 05 007-98Mary Ch100% (2)
- Cuestionario ColumnasDocument1 pageCuestionario ColumnasGarrido Furlong MarcoPas encore d'évaluation
- Eficiencia Maquinas de VaporDocument10 pagesEficiencia Maquinas de Vaporangel ruizPas encore d'évaluation
- Modelo SistematizaciónDocument54 pagesModelo SistematizaciónMiguel Angel Zilvetty TorricoPas encore d'évaluation
- Benemérita Universidad Autónoma de PueblaDocument4 pagesBenemérita Universidad Autónoma de PueblaHeriberto GómezPas encore d'évaluation
- Copia de Mazda Sistema de Carga Lunes 13Document12 pagesCopia de Mazda Sistema de Carga Lunes 13cesar zapata zuñigaPas encore d'évaluation
- Herbicidas - FAODocument39 pagesHerbicidas - FAOanon_30755738950% (2)
- Definiciones de Densidad Del Aire, Humedad en El Aire, Presion Atmosferica y TemperaturaDocument3 pagesDefiniciones de Densidad Del Aire, Humedad en El Aire, Presion Atmosferica y TemperaturaMariano Martin100% (2)
- Transporte de La MenbranaDocument6 pagesTransporte de La MenbranaMarycel ContrerasPas encore d'évaluation
- Gases Refrigerantes Los Mas ComunesDocument6 pagesGases Refrigerantes Los Mas ComunesYadira AnastacioPas encore d'évaluation
- Procedimiento de Aplicacion de Soldaduras v2Document12 pagesProcedimiento de Aplicacion de Soldaduras v2Marlon Humberto Navarro AltamarPas encore d'évaluation
- Ingeniería de ReactoresDocument3 pagesIngeniería de ReactoresClaudia Fernandez'HdzPas encore d'évaluation
- Aerosol WikiDocument8 pagesAerosol WikiJuanBarasPas encore d'évaluation
- T-2 Diagramas de Flujo de Pruebas de Plataforma en LecheDocument6 pagesT-2 Diagramas de Flujo de Pruebas de Plataforma en LecheOLAN BARBOSA JESUS ARTUROPas encore d'évaluation
- Manual de Química Análitica EstDocument36 pagesManual de Química Análitica EstEduardo VegaPas encore d'évaluation