Académique Documents
Professionnel Documents
Culture Documents
Experimento N 4
Transféré par
Mary Rosmery Ticona ApazaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Experimento N 4
Transféré par
Mary Rosmery Ticona ApazaDroits d'auteur :
Formats disponibles
EXPERIMENTO N 4 CONSERVACION DE LA ENERGIA COLORIFICA Y CALOR ESPEICIFO
i.
OBJETIVOS Determinacin de la energa calorfica se conservada en el procedimiento de calentamiento y enfriamiento de un sistema. Determinacin de calor especifico de aluminio, cobre y el tungsteno.
ii.
MARCO TERICO
Calor o Energa Trmica.- Es la suma de energa cintica de todas las molecular, cuyo resultado es la ganancia o prdida de energa interna; el calor es simplemente otra forma de energa que puede medirse solo en funcin del efecto que produce. Existen 2 unidades para medir el calor: a) Calora (cal).- Es el calor necesario para aumentar la temperatura de un gramo de agua en un grado Celsius. b) Unidad Tcnica Britnica (BTU).- Es la cantidad de calor necesario para elevar en un frado Fahrenheit la temperatura de una libra de agua.
Capacidad Calorfica.- Es la relacin existente entre la cantidad de calor de una sustancia y su correspondiente elevacin de temperatura.
La capacidad calorfica de una sustancia tiene un valor mayor si se lleva a cabo la presin constante, que si se realiza a volumen constante, ya que al aplicar presin constante a una sustancia, sta sufre un aumento de su volumen, lo que provoca una disminucin a su temperatura y en consecuencia, necesitar ms calor para elevarla. A volumen constante, todo el calor suministrado a la sustancia pasa a aumentar la energa cintica de las moleculas, por tanto, la temperatura se incrementa con mayor facilidad. Calor Especfico (Ce).- De una sustancia es igual a la capacidad calorfica de dicha sustancia entre su masa:
Y como:
Sustituyendo:
Por lo tanto:
En trminos prcticos el Ce de una sustancia se define como la cantidad de calor necesaria para elevar en un grado la temperatura de una masa unitaria de la sustancia. Calormetro.- Es un recipiente que permite medir las cantidades de calor que interactan cuando se mezclan sustancias a diferentes temperaturas stas tienden a alcanzar el equilibrio trmico, es decir, mientras una pierde calor la otra gana, por ello se realiza un balance de energa en el calormetro y se cumple que: En cualquier intercambio de calor efectuado, el calor cedido es igual al absorbido: Q2 = Q1 ( ) ( )
iii.
EQUIPOS Y MATERIALES Calormetro Termmetro Agua caliente y fra Muestra de aluminio, cobre, tungsteno Balanza Hilo
iv.
PARTE EXPERIMENTAL
En este experimento, combinaremos el agua caliente y fra de temperatura y masa conocida usando la definicin de calora, podremos hallar la cantidad de energa calorfica que se transfiere al llevar el agua fri y caliente a su temperatura final comn y por consguete determinar si la energa calorfica se conserva en este proceso.
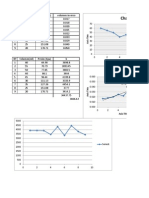
PROCEDIMIENTO 1. Determinar la masa del calormetro vaco . registre este en la tabla 1.1 2. Llene los calormetro acerca de 1/3 de agua fra. Mida la masa del calometro y el agua junto para determinar .registre su resultado 3. Llene w segundo calormetro aproximadamente 1/3 de agua caliente. El agua debe ser ms de 20 C de temperatura de la habitacin , pase el calormetro y el agua junto para determinar y registre los resultados 4. Medir las temperatura del agua fra y caliente y regstralo en la tabla 5. Inmediatamente despus de medir las temperaturas, aadir el agua caliente al agua fra combinndolo inmediatamente con el termmetro medir hasta que temperatura se establece registre la temperatura final de la mezcla 6. Medir la la masa final del calormetro y mezcla de agua 7. Repita el experimento dos veces con diferentes masas de agua y diferentes temperaturas RECOLECCIN DE DATOS Tabla 1.1 Datos Prueba N1 25.8 127.6 188 15.5 77 50 285.5 Prueba N2 25.8 92.8 101.4 16.9 59.5 36.51 165.9 Prueba N3 25.8 285.5 82.4 47.5 64.9 48.3 340
ANALISIS DE DATOS. De sus datos, haga los clculos necesarios para determinar a masa fra y calientes ( ) y tambin los cambios de temperatura experimentados por cada uno ( ) .Registrar sus resultados en la Tabla 1.2 2. Usando las ecuaciones mostrados debajo, calcula a EL CALOR GNADO POR EL agua fra y caliente, respectivamente. Introduzca sus resultados en la tabla. ( ( )( )( )( ) )( ) y
Tabla 1.2 clculos Prueba N1 101.8 162.2 34.5 27 890.1 2748.6 Prueba N2 67 101.4 19.61 22.99 505.938 1540.33 Prueba N3 259.7 82.4 0.8 16.6 20.64 4311.02
ACTIVIDAD 2 calor especfico
CUIDADO: Este experimento implica el uso de agua hirviendo y el anejo de objetos CALIENTES del materia. Trabaje cuidadosamente PROCEDIMIENTO
La medida , de la masa del calormetro que usted usar (debera estar vacos y seco) . Registre sus resultados en la tabla 2.1 Mida las masas del aluminio, el cobre y muestra del tungsteno. Registre estas masas en la Tabla 2.1 en la fila designada Pega un hilo para cada uno de las muestras de metal y suspenda cada uno de las muestras en agua hirviendo. Espere unos minutos para que se calienten bien. Llene el calormetro aproximadamente la agua fra utilizar el agua suficiente para cubrir la totalidad de cualquiera de las muestras de natal. La medida es la temperatura del agua fra. Registre su medida en la tabla
Inmediatamente despus de la medicin de la temperatura, remueva un de los metales del agua hirviendo, rpidamente squelo con un pao, entonces suspndalo en el agua fra en el calormetro de muestra debe estar completamente cubierta, pero no debe tocar la parte inferior del calormetro. Agite el agua y registre la temperatura ms alta alcanzada por el agua entra en equilibrio trmico con la muestra del metal Inmediatamente despus de tomar la temperatura, mida y registre la calormetro, el agua , y el metal de muestra. la masa total del
RECOLECCIN DE DATOS
Prueba N1 25.8 47.4 16.15 18.3 227.4 154.2
Prueba N2
Prueba N3
ANALISIS DE DATOS Para cada metal probado, use las ecuaciones mostradas abajo para determinar a la masa de agua usada , el cambio de temperatura del agua cuando entra en contacto en la muestra de metal cambio de temperatura de la muestra del metal cuando est dentro en contacto con el agua . Registre sus resultados en la tabla 2.1 ( )
De la ley de conservacin de energa, el calor perdido de la muestra de metal debe igualar al calor ganado por el agua: El calor perdido por la muestra = El calor ganado por el agua Etc ( )( )( ) ( )( )( )
es el calor especfico del agua, lo cual es
Utilice la ecuacin anterior, y los datos recogidos, para resolver los calores especficos de aluminio registrados en la tabla 2.1
Vous aimerez peut-être aussi
- Practica 4 Efectos Termicos 3 Calor de Fusion Del HieloDocument4 pagesPractica 4 Efectos Termicos 3 Calor de Fusion Del HieloEduardo Lara MagañaPas encore d'évaluation
- Práctica No. 2 CALOR DE NEUTRALIZACIÓNDocument9 pagesPráctica No. 2 CALOR DE NEUTRALIZACIÓNAlejandro SánchezPas encore d'évaluation
- 3ra PRACTICA AULA VIRTUALDocument4 pages3ra PRACTICA AULA VIRTUALWilbert Rendón SalvadorPas encore d'évaluation
- Reporte 07 7Document7 pagesReporte 07 7Samantha ValdiviaPas encore d'évaluation
- LabFIQUI-I-"VISCOSIDAD DE LIQUIDOS"CDocument14 pagesLabFIQUI-I-"VISCOSIDAD DE LIQUIDOS"Ccefiqt100% (4)
- Calorimetría: Determinar calor específico metalDocument4 pagesCalorimetría: Determinar calor específico metalNicolas DamianPas encore d'évaluation
- El Diagrama de StüveDocument4 pagesEl Diagrama de Stüveesther0% (1)
- Informe Equilibrio L VDocument6 pagesInforme Equilibrio L Vjuan carlosPas encore d'évaluation
- Determinación de peso molecular y densidad de una sustancia volátilDocument26 pagesDeterminación de peso molecular y densidad de una sustancia volátilSandra AndradePas encore d'évaluation
- Práctica #6. Leyes de Los Gases.Document16 pagesPráctica #6. Leyes de Los Gases.antonio mujicaPas encore d'évaluation
- Calor de mezcla de KNO3 en aguaDocument4 pagesCalor de mezcla de KNO3 en aguaJonatan DavidPas encore d'évaluation
- Practica 4444Document14 pagesPractica 4444abelPas encore d'évaluation
- Informe Termo QuímicaDocument15 pagesInforme Termo QuímicaDiego RuedaPas encore d'évaluation
- Informe Nº1 FICODocument15 pagesInforme Nº1 FICOsantiago sales100% (1)
- Practica 5 de ElectroquimicaDocument13 pagesPractica 5 de ElectroquimicaMiguel SuarezPas encore d'évaluation
- INFORME #3 TermodinamicaDocument7 pagesINFORME #3 TermodinamicaPAMELA JULIETH CAMACHO PERAFANPas encore d'évaluation
- Calorimetría: determinación experimental de caloresDocument21 pagesCalorimetría: determinación experimental de caloresLuis Angel ChuraPas encore d'évaluation
- Gravedad APIDocument4 pagesGravedad APICristian VallejoPas encore d'évaluation
- Practica 7 Lab de FisicoquimicaDocument19 pagesPractica 7 Lab de FisicoquimicaWendy Guaman MendozaPas encore d'évaluation
- Termoquimica2 Laboratorio de Fisicoquimica UNMSMDocument19 pagesTermoquimica2 Laboratorio de Fisicoquimica UNMSMwaldir marcelinoPas encore d'évaluation
- Viscosidad de StockDocument10 pagesViscosidad de StockEdward SaavedraPas encore d'évaluation
- CALORIMETRIA (Cuestionario) - Mamani Halcon Alexis SebastianDocument7 pagesCALORIMETRIA (Cuestionario) - Mamani Halcon Alexis SebastianAlexis Sebastián Mamani HalconPas encore d'évaluation
- Calorimetria-Objetivos y Analisis de ResultadosDocument1 pageCalorimetria-Objetivos y Analisis de ResultadosClaudia Sedano IbañezPas encore d'évaluation
- Segunda Serie Del Curso de Transferencia de MasaDocument3 pagesSegunda Serie Del Curso de Transferencia de MasaRodolfo ChabléPas encore d'évaluation
- Cambio de EntropiaDocument5 pagesCambio de EntropiaMaena AnzolaPas encore d'évaluation
- Calor de Combustion13Document19 pagesCalor de Combustion13Jorge TrejoPas encore d'évaluation
- Laboratorio Equivalente Eléctrico de Calor (Simulación)Document7 pagesLaboratorio Equivalente Eléctrico de Calor (Simulación)Yeimmy Londoño GaitanPas encore d'évaluation
- Informe de Lab - Fisica Calor Especifico UtpDocument16 pagesInforme de Lab - Fisica Calor Especifico UtpLiliana BejaranoPas encore d'évaluation
- Calor y Dilatacic3b3n TermicaDocument17 pagesCalor y Dilatacic3b3n Termicasergio menco arizaPas encore d'évaluation
- Informe #4 - Leyes de La TermodinámicaDocument27 pagesInforme #4 - Leyes de La TermodinámicaRicardo Milla AlegrePas encore d'évaluation
- Laboratorio de Física II Ley de Charles y Gay-LussacDocument5 pagesLaboratorio de Física II Ley de Charles y Gay-LussacJuan Felipe GiraldoPas encore d'évaluation
- Problemas de FasesDocument7 pagesProblemas de FasesIván0% (1)
- Estado Gaseoso IDocument18 pagesEstado Gaseoso IRosmery Ramos ManriquePas encore d'évaluation
- Guia n0 2Document1 pageGuia n0 2Gaston Larama AnzaPas encore d'évaluation
- Practica 9 Regla Palanca 2012Document22 pagesPractica 9 Regla Palanca 2012ivan lopezPas encore d'évaluation
- Calorimetría_determina_temperatura_equilibrio_sistemasDocument18 pagesCalorimetría_determina_temperatura_equilibrio_sistemasMelany Freire100% (1)
- Equilibrio QuimicoDocument6 pagesEquilibrio QuimicoLeonardo SashaPas encore d'évaluation
- Examenes Lab Fisicoquimica 2016Document5 pagesExamenes Lab Fisicoquimica 2016Alvaro Israel Olorio Illanes100% (1)
- Inf. 8 de FisicoquimicaDocument8 pagesInf. 8 de FisicoquimicaLucía Molina RamírezPas encore d'évaluation
- Práctica # 1 Cuestionario Obtención NitrobencenoDocument1 pagePráctica # 1 Cuestionario Obtención NitrobencenoPaul Angel Soliz MamaniPas encore d'évaluation
- E. Efusión Isotérmica de Un Gas IdealDocument2 pagesE. Efusión Isotérmica de Un Gas IdealLeonardo VarasPas encore d'évaluation
- MEDICIÓN DE RESISTENCIADocument25 pagesMEDICIÓN DE RESISTENCIARoger inturiasPas encore d'évaluation
- Semana N°3Document26 pagesSemana N°3Cristhian Gonzales SalinasPas encore d'évaluation
- Equivalente Mecanico Del CalorDocument9 pagesEquivalente Mecanico Del CalorJosecarlos JairPas encore d'évaluation
- Explique en Qué Consiste La Técnica Llamada CalorimetríaDocument1 pageExplique en Qué Consiste La Técnica Llamada CalorimetríaRoberto Gabriel Chochoca YarlequePas encore d'évaluation
- Ley de BoyleDocument4 pagesLey de BoyleJUAN PABLO VEJARANO CARMONAPas encore d'évaluation
- Ejercicios de fisicoquímica 2 sobre soluciones ideales y no idealesDocument2 pagesEjercicios de fisicoquímica 2 sobre soluciones ideales y no idealesbraulio moises gutierrez mozombite0% (2)
- Informe de Laboratorio VirtualDocument4 pagesInforme de Laboratorio VirtualMARIA CHAVARROPas encore d'évaluation
- Entalpía combustión hidrocarburo 1000KDocument2 pagesEntalpía combustión hidrocarburo 1000KGary Ridmar Alcaraz CamposPas encore d'évaluation
- Lab. Arquimedes y BourdonDocument40 pagesLab. Arquimedes y BourdonChristian CuervoPas encore d'évaluation
- Manula Termodinamica - Cristal Lopez Hernandez U2Document10 pagesManula Termodinamica - Cristal Lopez Hernandez U2Paola MontufarPas encore d'évaluation
- Peso Molecular Del EtanolDocument8 pagesPeso Molecular Del EtanolLinda CastroPas encore d'évaluation
- Incertidumbre - Fisica Mecanica UFPSDocument7 pagesIncertidumbre - Fisica Mecanica UFPSLuisAlbertoM̶e̶n̶d̶o̶z̶a̶̶c̶e̶lisMfcPas encore d'évaluation
- Informe Carga ElectricaDocument16 pagesInforme Carga ElectricaRoger inturiasPas encore d'évaluation
- Laboratorio de Fisicoquímica #4Document15 pagesLaboratorio de Fisicoquímica #4Sergio Arturo Garabito Villegas100% (2)
- Laboratorio Calor Específico de Un SólidoDocument4 pagesLaboratorio Calor Específico de Un SólidoYeimmy Londoño GaitanPas encore d'évaluation
- Reporte de La Practica #4 "Calorimetria"Document16 pagesReporte de La Practica #4 "Calorimetria"Carlos Juárez Hernández77% (22)
- Calor EspecificoDocument11 pagesCalor Especificoroyler lazaroPas encore d'évaluation
- Articulo Quimica IIDocument10 pagesArticulo Quimica IIAnthoni MansillaPas encore d'évaluation
- 002-12 - PRE - SEVIGESAC. - GarantíasDocument3 pages002-12 - PRE - SEVIGESAC. - GarantíastintayaPas encore d'évaluation
- Elementos ToxicosDocument47 pagesElementos Toxicosalexander_poma330Pas encore d'évaluation
- Examen de Razonamiento Verbal 3roDocument2 pagesExamen de Razonamiento Verbal 3roMary Rosmery Ticona ApazaPas encore d'évaluation
- Examen de Tercer Trimestre 1gradoDocument7 pagesExamen de Tercer Trimestre 1gradoClaudio TiconaPas encore d'évaluation
- Calor DatosDocument1 pageCalor DatosMary Rosmery Ticona ApazaPas encore d'évaluation
- Examen de Razonamiento Verbal 3roDocument2 pagesExamen de Razonamiento Verbal 3roMary Rosmery Ticona ApazaPas encore d'évaluation
- Inteligencia - Emocional. DIAPOSITIVASDocument32 pagesInteligencia - Emocional. DIAPOSITIVASMary Rosmery Ticona ApazaPas encore d'évaluation
- CocientesDocument6 pagesCocientesMary Rosmery Ticona ApazaPas encore d'évaluation
- TrabajoDocument3 pagesTrabajoMary Rosmery Ticona ApazaPas encore d'évaluation
- APLICACIONESDocument1 pageAPLICACIONESMary Rosmery Ticona ApazaPas encore d'évaluation
- SINÓNIMOSDocument10 pagesSINÓNIMOSClaudio TiconaPas encore d'évaluation
- APLICACIONESDocument1 pageAPLICACIONESMary Rosmery Ticona ApazaPas encore d'évaluation
- Trabajo Encargado Fisica IIDocument6 pagesTrabajo Encargado Fisica IIMary Rosmery Ticona ApazaPas encore d'évaluation
- Transporte Camas BajasDocument19 pagesTransporte Camas BajasMary Rosmery Ticona ApazaPas encore d'évaluation
- T Espel 0742Document96 pagesT Espel 0742Mary Rosmery Ticona ApazaPas encore d'évaluation
- Harvard MiniaturaDocument2 pagesHarvard MiniaturaMary Rosmery Ticona ApazaPas encore d'évaluation
- Ensayo de Corte DirectoDocument6 pagesEnsayo de Corte DirectoKristina SuttonPas encore d'évaluation
- Gentilicios del PerúDocument2 pagesGentilicios del PerúClaudio TiconaPas encore d'évaluation
- Al Tensar UDocument4 pagesAl Tensar UMary Rosmery Ticona ApazaPas encore d'évaluation
- Determinación Del Límite Líquido de Un SueloDocument3 pagesDeterminación Del Límite Líquido de Un SueloMary Rosmery Ticona ApazaPas encore d'évaluation
- Laboratorio de FisicaDocument11 pagesLaboratorio de FisicaMary Rosmery Ticona ApazaPas encore d'évaluation
- Determinación Del Límite Líquido de Un SueloDocument3 pagesDeterminación Del Límite Líquido de Un SueloMary Rosmery Ticona ApazaPas encore d'évaluation
- Energia PotencialDocument18 pagesEnergia PotencialMary Rosmery Ticona ApazaPas encore d'évaluation
- Mometo de Inercia Basado Sobre El Periodo de OsilacionDocument7 pagesMometo de Inercia Basado Sobre El Periodo de OsilacionMary Rosmery Ticona ApazaPas encore d'évaluation
- Experimento 3Document6 pagesExperimento 3Mary Rosmery Ticona ApazaPas encore d'évaluation
- Definición CBRDocument2 pagesDefinición CBRhilkrePas encore d'évaluation
- Kirchof 1Document9 pagesKirchof 1Mary Rosmery Ticona ApazaPas encore d'évaluation
- Calor DatosDocument1 pageCalor DatosMary Rosmery Ticona ApazaPas encore d'évaluation
- Libro 1Document2 pagesLibro 1Mary Rosmery Ticona ApazaPas encore d'évaluation
- Informe 6Document15 pagesInforme 6Laura SánchezPas encore d'évaluation
- OXILAB-5-IT-001 Determinación de Ph.Document7 pagesOXILAB-5-IT-001 Determinación de Ph.Ysrrael centenoPas encore d'évaluation
- Soluciones buffer, pH y pOH en bioquímica clínicaDocument1 pageSoluciones buffer, pH y pOH en bioquímica clínicadinaPas encore d'évaluation
- Tema 06Document30 pagesTema 06Fernando ModregoPas encore d'évaluation
- Calorimetría SoluciónDocument18 pagesCalorimetría SoluciónJosé MendozaPas encore d'évaluation
- Calorimetría y TermodinámicaDocument5 pagesCalorimetría y TermodinámicaMaria Del RosarioPas encore d'évaluation
- Calor y TemperaturaDocument13 pagesCalor y TemperaturaYesmin FloresPas encore d'évaluation
- Transferencia de CalorDocument8 pagesTransferencia de CalorMaría Claudia Cáceres ObadaPas encore d'évaluation
- Ejercicio PenmanDocument33 pagesEjercicio Penmanluisabanto1995Pas encore d'évaluation
- Fase 2 - Grupo 8 - Ley de FourierDocument15 pagesFase 2 - Grupo 8 - Ley de FourierMery RamirezPas encore d'évaluation
- Fuerza ácidos basesDocument7 pagesFuerza ácidos basesAngely Castro BayueloPas encore d'évaluation
- Ejercicios EVAU Equilibrio-CinéticaDocument6 pagesEjercicios EVAU Equilibrio-CinéticaElRegresoDeXD 01Pas encore d'évaluation
- Método de BellDocument10 pagesMétodo de BellAmandaPas encore d'évaluation
- Es 0.230. 10 en Estado Estacionario. .: Universidad Nacional de JujuyDocument2 pagesEs 0.230. 10 en Estado Estacionario. .: Universidad Nacional de JujuySergio JulianPas encore d'évaluation
- Practica 5 - Conductividad TermicaDocument16 pagesPractica 5 - Conductividad TermicaMiguel Angel C. Greer80% (5)
- Reporte No 1 Determinacion de La Constante de Equilibrio de Un Acido DebilDocument28 pagesReporte No 1 Determinacion de La Constante de Equilibrio de Un Acido DebilErnesto GarcíaPas encore d'évaluation
- Tarea 4 - Equilibrio - Carolyn Goncalves - FinalDocument32 pagesTarea 4 - Equilibrio - Carolyn Goncalves - FinalCarlos Gil GarcíaPas encore d'évaluation
- Calor Latente: A. Competencia: B. IntroducciónDocument5 pagesCalor Latente: A. Competencia: B. IntroducciónFrancisco Gallegos BallónPas encore d'évaluation
- PDF Cambios de Fase Del Agua - CompressDocument22 pagesPDF Cambios de Fase Del Agua - CompressTania YankurPas encore d'évaluation
- Calor y temperatura: problemas resueltos de transferencia de calorDocument5 pagesCalor y temperatura: problemas resueltos de transferencia de calorElard Cesar Estofanero JaraPas encore d'évaluation
- Equilibrio Termico CalorimetriaDocument6 pagesEquilibrio Termico CalorimetriaAndrea MedeloPas encore d'évaluation
- Ficha de Evaluacion de Fenomenos Termicos y TermodinamicaDocument2 pagesFicha de Evaluacion de Fenomenos Termicos y TermodinamicaSANSIMON1968Pas encore d'évaluation
- Informe #6Document15 pagesInforme #6ErwinPas encore d'évaluation
- Unidad 2. Termodinámica IIDocument57 pagesUnidad 2. Termodinámica IIJorge GallardoPas encore d'évaluation
- Lab. 3 Calor Especifico Liq FQDocument8 pagesLab. 3 Calor Especifico Liq FQCharl GrymPas encore d'évaluation
- S A Practica10Document8 pagesS A Practica10Alex ContrerasPas encore d'évaluation
- Dilatacion TermicaDocument77 pagesDilatacion TermicaGERMAN LOPEZ ANDRADEPas encore d'évaluation
- Examen parcial de Fenómenos de transporte II sobre transferencia de calorDocument3 pagesExamen parcial de Fenómenos de transporte II sobre transferencia de calorLina Maria Ospina NuñezPas encore d'évaluation
- Cálculo de La Temperatura en La Fase GaseosaDocument7 pagesCálculo de La Temperatura en La Fase GaseosasaraPas encore d'évaluation
- Prueba de Entrada Fenomenos de Transferencia (06092020) Villca Calcina PDFDocument2 pagesPrueba de Entrada Fenomenos de Transferencia (06092020) Villca Calcina PDFALVARO JESUS VILLCA CALCINAPas encore d'évaluation