Académique Documents
Professionnel Documents
Culture Documents
C 00 XP 1 C
Transféré par
Mihnea GamanTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
C 00 XP 1 C
Transféré par
Mihnea GamanDroits d'auteur :
Formats disponibles
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
PROPOSITION DE CORRIGE POLYTECHNIQUE-ESPCI CHIMIE FILIERE PC AN 2000
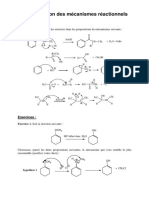
I. Synthse biomimtique dun prcurseur de la progestrone 1.a) La raction est une ctalisation qui rsulte dune addition nuclophile suivie dune limination.
CH3 O OC2H5
D
O O
Le mcanisme propos est le suivant : (en se limitant la partie ragissante de la molcule C)
O H3C S O O H H3C O S O O
+ H
H O
H O
H HO H O O HO H O O
H O HO O HO O O H
H2O
H O
D
O
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
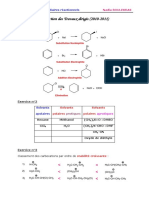
b) D et E sont des isomres de position.
Ha O CH3b OC2H5 O Ha' Ha' CH3b' OC2H5
D
O Hc O
E
O O
Ha : singulet dintgration 1, vers 5,2 6 ppm Hb : singulet dintgration 3, vers 1 ppm Hc : triplet dintgration 1, vers 2,6 ppm c)
Ha : doublet dintgration 2 vers 2 ppm Hb : singulet dintgration 3 vers 1,6 2,1 ppm Pas de signal vers 2,6 ppm
(carbocation tertiaire)
H O CH3 OC2H5 O H H CH3 OC2H5
+
O H O
H
O H O
provenant de l'APTS
H O
CH3 OC2H5
+
O O
Le systme conjugu 2.a)
de E est plus stable que le systme non conjugu de D.
CH3 O
F
O
CH2OH
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
b)
Ha O O CH3b
F'
CH2OH
G
CH2c
Pour G, spectre I.R. : 1680 cm-1 : C=O conjugu rien au del de 3000cm-1 confirme la disparition du groupe OH, mais thylniques ? spectre RMN Ha : 5,9 ppm, intgration : 1 Hb : 2,1 ppm, intgration : 3 Hc : 5,4 ppm, intgration : 2 Le mcanisme de formation de F est celui donn la question I.1.a) en sens inverse
O O H
quid des C-H
+ H
C H2 O H C H2
H2O
O O H H O
H +
CH2 CH2 CH2
c) LiAlH4 rduit trs facilement le groupe ctone, do sa ncessaire protection. 3.a) Les groupes CO2C2H5 exerant des effets lectroniques attracteurs polarisent les liaisons C-H selon :
C
De plus, et cest essentiel, lanion obtenu par dpart de H est stabilis par msomrie :
O O O O O O O
O O O O
La prsence du systme conjugu
accrot encore cette stabilisation.
Na , Le compos H est :
O
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
b)
O O O
CH2
CH2
CH2
H3CO2C
CO2CH3 O
CO2CH3 CO2CH3
HO
c)
O O O CO2CH3
+
CH2 O
O O
CO2CH3 H O H
O H O H
O H
HO +
4.a)
HO
+ I
o
5 4 3
2 1 2 * 3 + 2 * 3 = 12 3 doubles 3 groupes liaison mthyles 4
Nombre dlectrons :
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
La H.O. est la n6 ; la B.V. est la n 7. b) Vis vis dun nuclophile, le compos se comporte comme un lectrophile, il faut donc considrer sa B.V. qui est surtout dveloppe en C6 (plus fort coefficient en valeur absolue). Cest donc sur ce carbone (C6) que laddition nuclophile a lieu (dans linterprtation du modle des orbitales frontires). c) I est bien le produit majoritaire attendu. La moindre gne strique sur cet atome de carbone peut aussi faciliter la formation de ce produit. 5.a) Saponification :
O CH3 CO2
I + 2 HO
CO2
+ 2 CH3OH
Acidification :
O CH3 CO2H
CO2H
Dcarboxylation :
O CH3 CO2H O CH3
+ CO2(g)
CO2H
CO2H
Le gaz dgag est du dioxyde de carbone. Estrification :
O CH3
+ CH3OH
H
O CH3
+ H2O
K Ici aussi, le mcanisme est crit avec la partie ragissante de la molcule. Il sagit dun transfert circulaire concert six centres
H O C HO CH CH2 O C O HO O C CH O CH2 H O O
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
H O O
H O
+H
6.a)
Ha S CH3b
O CH3 O
Ha na pas de voisin ; les trois protons Hb sont quivalents et nont dautres voisins que eux-mmes, do les singulets obtenus. Le rapport dintgration est en accord avec le nombre de protons 3 : 1. Ha sort 5,6 ppm or 5,2 < 5,6 < 6,0. Les Hb sortent 1,7 ppm or 1,6 < 1,7 < 2,1 b)
F B F F
B, Z = 5 F, Z = 9
1s2 2s2 2p1 1s2 2s2 2p5
BF3 est de type AX3, il a donc une gomtrie plane trigonale. BF3, possdant une lacune lectronique, est un acide de Lewis, il peut donc ragir avec une base de Lewis telle que lthoxythane :
Et Et F3B Et O Et
F3B
c) Il sagit dune activation lectrophile par lacide BF3, qui, en rgissant avec loxygne du carbonyle accrot llectrophilie du carbone fonctionnel. d)
H O CH3
L'
O CH3 O
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
7.a) Le prfixe (R) est li une convention de nomenclature selon Cahn, Ingold et Prelog base sur les numros atomiques et des rgles squentielles. Le prfixe (+) a une signification exprimentale. La substance tudie est dextrogyre.
NH2
H3C
H C6H5
b)
H S CH3
*
O
OH
M a un atome de carbone asymtrique not C*. C compos nest pas optiquement pur car le carbone asymtrique est form en 3.b) partir dune structure plane, donc il existe sous deux configurations. c) N est un compos ionique, temprature de fusion leve, donc, il est possible de lobtenir cristallis dans un solvant organique tel que lactate dthyle.
H S CH3 H3N CH3 H C6H5
S CO2
H Dune part, une purification est ncessaire car, lors de toute prcipitation, il y a pigeage de molcules trangres (ractifs, par exemple) dans le solide. Dautre part, et cest le point le plus important ici, le sel obtenu est un mlange de deux diastroisomres (S,R et R,R). Les solubilits diffrentes de ces deux stroisomres dans un solvant bien choisi permet de les sparer et, dans le cas tudi, de recueillir le seul diastroisomre solide (R,R). d) Par rsolution du racmique ou sparation nantiomrique, un obtient quun seul stroisomre :
H S CH3
S CO2H
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
H S CH3 S
H CH3
S CH2OH
Q
H H S CH3 S
S CH2OTs
H H CH3
S I H
S C H2
P(C6H5) I H
b) En ne sintressant qu la partie ractive de la molcule :
O C H2 OH O CH3 C H2 O H S O Cl CH3
+ Cl
S O
Cl
O
Q +
H N
C H2
O H
S O
CH3
H2 C
SN2
O Ts
H2 C
+ TsO
R c) Il sagit dune substitution nuclophile bimolculaire sur un atome de carbone primaire ; I- est un bon nuclofuge et 3P est un bon nuclophile. 9. On obtient le mlange T et T par une raction de Wittig.
S + C6H5Li
LiI + C6H6 +
H C H2
H2 C C H
P3
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
H2 C H C H2 C H
P3
C H H C H2
H2 C C H C H
Le produit T obtenu scrit :
CH3
S H
10.a) Lalcool A est :
HO
CH3
La protonation de latome doxygne du groupe alcool, suivie dune limination deau conduit au carbocation :
CH3
CH3
H O H H
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
OH
CH3
CH3
H +
tautomrie cto-nol, acido catalyse
CH3
6 B
CH3
2
H
5 4
H
b) Au cours de cette tape six atomes de carbone asymtriques sont cres et contrls. Dans la reprsentation prcdente, ils sont numrots de 1 6. c) En partant de M, on aurait un mlange de deux diastroisomres qui diffrent par un atome de carbone asymtrique :
CH3 O CH3 O
6 B
CH3
6 et
CH3
2
H
5 4
H
2
H
5 4
H
C* diffrent de B
10
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
II Dosages par spectrophotomtrie UV visible.
Premire partie : gnralits
1. A = log(Io/I) loi de Beer Lambert : A = lc 2 = 2,0.10-3 mol-1.L.cm-1 A 2 c 10-3 mol.L-1 On ne peut tudier que des solutions dilues. 3. A = Ai = l (ici) Dans le cas de deux composs : A = l (1c1 + 2c2)
ci = ni n = x i tot = x i c o V V
A = lco [1x1 + 2(1-x1)]
4. L'absorption UV-visible correspond une transition lectronique d'un niveau occup un niveau vacant (la transition doit tre permise), niveaux d'nergie tels que E = h, frquence de l'onde lectromagntique, situe dans l'UV ou le visible ici. Les composs aromatiques possdent de nombreux niveaux et *, et absorbent gnralement dans l'UV. La multiplication du nombre d'lectrons conjugus abaisse gnralement l'cart d'nergie E, l'absorption se fait alors dans le visible, ces composs sont colors.
Deuxime partie : dosage d'un acide faible
1. Deux raisons la faible amplitude du saut de pH : le pKa lev (acide faible) : le pH la demi-quivalence est de l'ordre de pKa la faible concentration de l'acide : au double de l'quivalence, la solution obtenue est sensiblement une solution de soude de concentration co, de pH de l'ordre de 14 + logco. Le saut de pH est plus faible si pKa est lev et co plus faible. 2. pH = pKa la demi-quivalence si [HA] = [A-] (vrifi sur la simulation) ; cela suppose la raction de dosage quantitative (les courbes de % sont ici quasiment des droites, la condition est remplie), et les ractions de HA et A- avec l'eau ainsi que l'autoprotolyse de l'eau ngligeables devant celle du dosage. La dtermination du pKa par cette mthode ncessite une lecture de la valeur du pH la demiquivalence, donc ncessite de reprer l'quivalence avec prcision, ce qui n'est pas le cas ici. Pour 0 x 1,
dpH = 1,74 dx x = 0,5 pH = pK a + log x 1 x dpH 1 = dx 2,3.x.(1 x )
x = 0,05 )pH = 0,087
d'o
pKa 0,1
3. pH = 6 (pKa-1), l'absorption 390 nm est faible, elle augmente avec le pH. C'est la forme basique qui absorbe cette longueur d'onde. La forme acide absorbe 310 nm (absorption d'autant plus importante que le pH est faible).
forme acide
O2 N OH
forme basique
O2 N
O-
4.Le point isobestique est le point dintersection des courbes daprs I.3. A = lc0 [BH(1-) + B] (cf. notation du II.5.) tant le coefficient de dissociation de l'acide (BH) Pour = iso 330 nm, BH = B d'o A = BHlco 5.
xBH donc
pH.
(a) A1 = lco[1,BH(1-) + 1,B] (b) A2 = lco[2,BH(1-) + 2,B] (a)2,BH (b)1,BH (a') A1.2,BH A2.1,BH = lco(1,B.2,BH - 2,B.1,BH) (a)2,B (b)1,B (b') A1.2,B A2.1,B = lco(1-)(1,BH.2,B - 2,BH.1,B) (a') - (b') A1(2,B - 2,BH) = A2(1,B - 1,BH) lco(1,B.2,BH - 2,B.1,BH) La courbe A1 = f(A2) doit tre une droite, ce qui est vrifi par les donnes exprimentales. 11
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
6. d'aprs (a) : A1 - lco1,BH = lco(1,B - 1,BH) A1 - lco1,B = lco(-1,B + 1,BH)(1-) (a")/(b") d'o
A 1 lc o 1, BH Ka [B] = = = + 1 lc o 1, B A 1 [BH] [H ] A 1 lc o 1, BH lc o 1,B A 1 = pH pK a
(a") (b")
log
La courbe reprsentant f en fonction du pH est une droite, coupant l'axe des abscisses en pH = pKa. La lecture graphique fournit pKa 7,05. Cette mthode permet a priori d'esprer une bonne prcision (intersection de deux droites de pentes nettement diffrentes). Cependant, la taille du graphe fourni ainsi que l'chelle choisie permettent-ils de faire mieux que 0,1 unit de pKa, prcision estime au II.2. ? Nous guetterons avec intrt le compterendu du jury de TP, pour voir si on ne reproche pas aux candidats le choix d'chelles inadaptes pour rendre compte de leurs mesures ! Troisime partie : application au dosage d'un acide faible
HO H3C CH3 NH+ H3C HOH2C HO CH3 N H3C HOH2C
-
CH3 N
formes notes respectivement :
BH2, BH et B pH
par la suite.
1.
HOH2C
pK1
pK2
10
2.a Au point de dpart, la solution ne contient que deux espces : , dcroissante entre 0 et 0,1 mL) environ 80% de la forme BH2 (courbe , croissante de 0 0,1 mL, puis dcroissante) environ 20% de la forme BH (courbe 2.b. La premire acidit n'est pas trs faible (pK1 5), et les deux acidits assez nettement diffrentes ()pK 5), l'amplitude du premier saut sera de l'ordre de 5 units pH (pH de l'ordre de 5 la premire demi-quivalence, de l'ordre de 10 la deuxime demi-quivalence). En revanche, la deuxime acidit est plus faible que celle tudie dans la seconde partie, avec la mme concentration en acide : 10-4 mol.L-1). L'tude prcdente permet de conclure l'absence d'un deuxime saut de pH voir II.1). 2.c. Les courbes % BH2 et % BH d'une part, % BH et % B d'autre part, ne se coupent pas aux points de demi-quivalence, d'o pH pKa aux demi-quivalences (0,05 et 0,15 mL) 3. La dtermination des pKi par lecture du pH aux demi-quivalence est videmment impossible ici ! 4. L'existence d'un point isobestique suppose qu'il existe une longueur d'onde 8iso pour laquelle on observe simultanment BH2 = BH = B, ce qui est a priori peu probable, et non ralis ici. 5. La branche de gauche de la figure 6 correspond des valeurs croissantes simultanment pour A3 et A4. D'aprs le tableau I, ces mesures correspondent aux valeurs de pH les plus faibles ; les deux formes prpondrantes sont alors les formes BH2 et BH. La branche de droite (A4 dcroissante et A3 croissante et suprieure ou gale 0,35) correspond aux valeurs de pH les plus leves, elle est imputable au couple BH/B. 6. Les courbes de la figure 5 montrent que la premire partie du dosage ne fait intervenir que le couple BH2/BH (% B = 0 pour V 0,1 mL), et la seconde (V 0,1 mL) uniquement le couple BH/B (% BH2 = 0). Sur chaque partie du dosage, on est donc dans le mme cas que celui tudi au II.6. Des calculs analogues permettent d'tablir les relations : pour V 0,1 mL, f1 = pH-pK1 pour V 0,1 mL, f2 = pH-pK2 Le trac des courbes correspondantes fournit les pKi, de mme qu'au II.6. : 12
X-ESPCI 2000
Corrig n3
Guy CLERVAL Luc MARTEL
(voir courbes fin du corrig) pK1 5,25 pK2 9,8 Mme discussion que plus haut pour la prcision sur les pKi. Quatrime partie : tude cintique de la diffusion membranaire Remarque prliminaire : l'introduction voque la diffusion des principes actifs de l'intrieur de la vsicule vers l'extrieur, alors que le problme tudie la diffusion des protons de l'extrieur vers l'intrieur, sans mme l'crire explicitement ! 1. Le pH-mtre permet de mesurer le pH de la solution extrieure. Le pH l'intrieur des vsicules est suivi par absorptiomtrie grce la sonde indicatrice (cf. parties prcdentes). Les valeurs obtenues seront diffrentes tant que dure la diffusion. Le volume de la solution extrieure tant beaucoup plus important que le volume intrieur des vsicules, on peut admettre que le pH extrieur ne variera quasiment pas, alors que le pH intrieur variera au cours du temps. Les variations d'absorbance permettent donc de suivre l'volution du pH l'intrieur des vsicules, donc la vitesse de diffusion des protons travers la membrane. 2. Les calculs du II.6. ont permis d'tablir :
A lc o B [H + ] / c o h / c o = = = h lc o BH A Ka Ka
tant ici une constante (et non le coefficient de l'acide utilis comme sonde de pH).
= 1 K aco
co = 1 mol.L-1 est la concentration de rfrence ; elle a t explicitement crite ici pour viter les problmes de dimension (cf. question 4.)
3. La concentration h varie linairement en fonction du temps ! 4. g = h = At + B Vitesse d'augmentation de la concentration des protons :
v= dh A = = K a co = 10 6 mol.L1.s 1 dt
Une augmentation de 10-4 mol.L-1 de h durera 100 s, soit 1 min 40 s. Courbes du III.6., avec une prcision approchant celle des graphes de l'nonc !
0.791
f1
Fonc Fonc
0.791
f2
Fonc Fonc
0.571
0.456
0.351
0.121
pH
0.130
-0.215
pH 0
-0.0898 -0.550
-0.310 5.00
|
5.20 5,25 5.40 5.60 5.80 6.00
-0.885 9.00
|
9.26 9.52 9.78 9,8 10.0 10.3
13
Vous aimerez peut-être aussi
- Al CoolsDocument13 pagesAl Coolsbmm2Pas encore d'évaluation
- 0 C 40 F 13 A 769 Aef 3 Ca 505Document4 pages0 C 40 F 13 A 769 Aef 3 Ca 505api-497754935Pas encore d'évaluation
- SMC4 Examen Juin 2013Document5 pagesSMC4 Examen Juin 2013Yc YacinePas encore d'évaluation
- HEI Chimie-Organique 2002 CHIMIEDocument3 pagesHEI Chimie-Organique 2002 CHIMIESalma SellamiPas encore d'évaluation
- HEI Chimie-Organique 2008 CHIMIEDocument2 pagesHEI Chimie-Organique 2008 CHIMIENawal ZakriPas encore d'évaluation
- Chap 4Document13 pagesChap 4Chihab GhlalaPas encore d'évaluation
- EXAMEN 1 CORRIGéDocument3 pagesEXAMEN 1 CORRIGéSOUFYANE MUSTAPAPas encore d'évaluation
- Exercices de Chimie OrganiqueDocument7 pagesExercices de Chimie OrganiqueAy ManPas encore d'évaluation
- A 3 CompetitionDocument3 pagesA 3 CompetitionEmilie BoubinetPas encore d'évaluation
- Chimie Organique Fonctionnelle TD Corr 01Document2 pagesChimie Organique Fonctionnelle TD Corr 01123456789Pas encore d'évaluation
- Chap2 Aldéhydes Et CétonesDocument34 pagesChap2 Aldéhydes Et CétonesEssemlali Abde SamadPas encore d'évaluation
- Série 5Document1 pageSérie 5simo GriPas encore d'évaluation
- Chimie OrganiqueDocument35 pagesChimie Organiquemahad0% (1)
- Nova CHIMIE Tle CDE CORRIGÉ PDFDocument75 pagesNova CHIMIE Tle CDE CORRIGÉ PDFgeorgeskouwadan437100% (1)
- Examen Corrigé Hydro Smc4 by - Chimist ChimistDocument5 pagesExamen Corrigé Hydro Smc4 by - Chimist ChimistYc YacinePas encore d'évaluation
- TD Chap 1-2Document8 pagesTD Chap 1-2Aris MpomePas encore d'évaluation
- RevisionDocument10 pagesRevisionChimiste ChimistePas encore d'évaluation
- Solvants en Chimie OrganiqueDocument3 pagesSolvants en Chimie OrganiqueMvone100% (2)
- Serie 3 PDFDocument2 pagesSerie 3 PDFElbahi Djaalab0% (2)
- 2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFDocument19 pages2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFAbdessamed GherbaouiPas encore d'évaluation
- UntitledDocument3 pagesUntitledAbdeldjalil MayachePas encore d'évaluation
- TD Nomenclature Corrigé12goodprepa PDFDocument3 pagesTD Nomenclature Corrigé12goodprepa PDFNour EddinePas encore d'évaluation
- Orga - 23 SN1 ET SN2Document7 pagesOrga - 23 SN1 ET SN2زيد بخليفةPas encore d'évaluation
- Correction 3Document16 pagesCorrection 3Mohamed NaimiPas encore d'évaluation
- Tests D'identificationDocument2 pagesTests D'identificationAgnaou MohamedPas encore d'évaluation
- Série 3 SMC4Document5 pagesSérie 3 SMC4anwar jakriPas encore d'évaluation
- Chapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESDocument5 pagesChapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESanwar jakriPas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- Corriges Materiaux Polymeres OrganiquesDocument4 pagesCorriges Materiaux Polymeres OrganiquesHind Lebridia ghazyPas encore d'évaluation
- TD OsesDocument11 pagesTD OsesDEMBA SYLLAPas encore d'évaluation
- Série-3-Corrigée Chimie4Document15 pagesSérie-3-Corrigée Chimie4poly educationPas encore d'évaluation
- TD Éffets Électroniques 2020Document3 pagesTD Éffets Électroniques 2020Berthe AmiPas encore d'évaluation
- TD1-composés Carbonylés IIIDocument3 pagesTD1-composés Carbonylés IIIRita No ExistePas encore d'évaluation
- Nomenclature Des Composés OrganiquesDocument16 pagesNomenclature Des Composés OrganiquesRuroniPas encore d'évaluation
- Série 1 Chimie Generale AU 2020Document1 pageSérie 1 Chimie Generale AU 2020rekik hibaPas encore d'évaluation
- TD1 023 024Document7 pagesTD1 023 024ilyesfares49Pas encore d'évaluation
- Chapitre3 Caracterisation de Quelques IonsDocument7 pagesChapitre3 Caracterisation de Quelques IonsAlhou Inabigue HarounaPas encore d'évaluation
- Chimie OrgaDocument76 pagesChimie OrgaYoussef AouinPas encore d'évaluation
- Aldehydes Et CetonesDocument24 pagesAldehydes Et CetonesAhmed Ben AmmarPas encore d'évaluation
- Exercice-Liaison Chimique+Corrigé TypeDocument3 pagesExercice-Liaison Chimique+Corrigé TypejessieholdiePas encore d'évaluation
- 2 Applications NomenclatureDocument11 pages2 Applications Nomenclaturebrahimnourelhouda776Pas encore d'évaluation
- COR706Document132 pagesCOR706raly13100% (1)
- Examen 20141 SDocument7 pagesExamen 20141 SElbachaPas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- DiolsDocument9 pagesDiolsAhmad ElhamriPas encore d'évaluation
- Corrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1Document7 pagesCorrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1charki zakariaPas encore d'évaluation
- Cours de Chimie Organique Licence 1 Semestre 1Document32 pagesCours de Chimie Organique Licence 1 Semestre 1Balla SangarePas encore d'évaluation
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie NimpagaritsePas encore d'évaluation
- Epreuve de Chimie Tle C-D PREPA BAC 2022Document3 pagesEpreuve de Chimie Tle C-D PREPA BAC 2022Charif DjaffarPas encore d'évaluation
- Td11chim2019 2020Document3 pagesTd11chim2019 2020Med Stu DentPas encore d'évaluation
- LPro ElectroDocument23 pagesLPro ElectroYoussef Akr100% (1)
- Chap 4 DiènesDocument16 pagesChap 4 DiènesWahab HoubadPas encore d'évaluation
- Corrigé Série 01 - Chimie 04 - 2019-2020Document3 pagesCorrigé Série 01 - Chimie 04 - 2019-2020Hãfsã Bël Hatice100% (1)
- TD Intermediaires Reactionnels 2 SolutionDocument2 pagesTD Intermediaires Reactionnels 2 SolutionIssa SINDEPas encore d'évaluation
- TD Orga3 L3 S5Document2 pagesTD Orga3 L3 S5DialloPas encore d'évaluation
- TD 1 Glucides 2021Document1 pageTD 1 Glucides 2021ECHAIB ibtissam100% (1)
- C Ex17 Cin CaDocument3 pagesC Ex17 Cin CaHasan RajawiPas encore d'évaluation
- Chim Orga 2 (Suite Du Dernier Chapitre)Document24 pagesChim Orga 2 (Suite Du Dernier Chapitre)Hk Eh100% (1)
- 2013 BCPST Agro Veto A Chimie - CorrigéDocument7 pages2013 BCPST Agro Veto A Chimie - CorrigéLarbi BadrourPas encore d'évaluation
- Car Bony Les Alpha-Beta InsaturesDocument7 pagesCar Bony Les Alpha-Beta InsaturesJean-François Abena100% (2)
- P 05 PT 1 CDocument4 pagesP 05 PT 1 CMihnea GamanPas encore d'évaluation
- Robl EME Ascenseur Spatial: 5, 98 × 10 KG 6, 38 × 10 M M .S .KG Rad.sDocument10 pagesRobl EME Ascenseur Spatial: 5, 98 × 10 KG 6, 38 × 10 M M .S .KG Rad.sMariaGheorghePas encore d'évaluation
- p05pp1c PDFDocument7 pagesp05pp1c PDFMihnea GamanPas encore d'évaluation
- P 05 CT 2 eDocument6 pagesP 05 CT 2 eMihnea GamanPas encore d'évaluation
- P 05 CT 1 CDocument6 pagesP 05 CT 1 CMihnea GamanPas encore d'évaluation
- p05pp1c PDFDocument7 pagesp05pp1c PDFMihnea GamanPas encore d'évaluation
- P 05 LP 1 CDocument4 pagesP 05 LP 1 CMihnea GamanPas encore d'évaluation
- I - Equilibre D'une Particule Solide Dans Un FluideDocument10 pagesI - Equilibre D'une Particule Solide Dans Un FluideMihnea GamanPas encore d'évaluation
- Microscope À Émission D'ions: 1. Partie Préliminaire: Théorie Cinétique Des GazDocument6 pagesMicroscope À Émission D'ions: 1. Partie Préliminaire: Théorie Cinétique Des GazMihnea GamanPas encore d'évaluation
- I - Equilibre D'une Particule Solide Dans Un FluideDocument10 pagesI - Equilibre D'une Particule Solide Dans Un FluideMihnea GamanPas encore d'évaluation
- P 05 LB 1 CDocument12 pagesP 05 LB 1 CMihnea GamanPas encore d'évaluation
- P 05 CT 1 eDocument8 pagesP 05 CT 1 eMihnea GamanPas encore d'évaluation
- P 05 JM 1 eDocument6 pagesP 05 JM 1 eMihnea GamanPas encore d'évaluation
- P 05 JC 1 eDocument11 pagesP 05 JC 1 eMihnea GamanPas encore d'évaluation
- P 05 JP 2 eDocument7 pagesP 05 JP 2 eMihnea GamanPas encore d'évaluation
- P 05 CP 2 eDocument10 pagesP 05 CP 2 eMihnea GamanPas encore d'évaluation
- P 05 Js 2 eDocument6 pagesP 05 Js 2 eMihnea GamanPas encore d'évaluation
- P 05 DT 3 eDocument13 pagesP 05 DT 3 eMihnea GamanPas encore d'évaluation
- Centrale PC 2005 Les Bulles Du Champagne Partie I Formation de BullesDocument7 pagesCentrale PC 2005 Les Bulles Du Champagne Partie I Formation de BullesMihnea GamanPas encore d'évaluation
- École de L'air 2005 MP: Partie I: Onde GuidéeDocument8 pagesÉcole de L'air 2005 MP: Partie I: Onde GuidéeMihnea GamanPas encore d'évaluation
- Physique-Chimie PSI: Epreuve: FilièreDocument6 pagesPhysique-Chimie PSI: Epreuve: FilièreMihnea GamanPas encore d'évaluation
- P 05 JC 1 eDocument11 pagesP 05 JC 1 eMihnea GamanPas encore d'évaluation
- P 05 CP 1 eDocument15 pagesP 05 CP 1 eMihnea GamanPas encore d'évaluation
- N Est en Vehic. M L: Centrale Corrig e PSI Physique 1Document11 pagesN Est en Vehic. M L: Centrale Corrig e PSI Physique 1Mihnea GamanPas encore d'évaluation
- P 05 Cs 2 eDocument14 pagesP 05 Cs 2 eMihnea GamanPas encore d'évaluation
- P 05 Cs 1 eDocument14 pagesP 05 Cs 1 eMihnea GamanPas encore d'évaluation
- Annexe Du Sujet de Physique-Chimie PSIDocument1 pageAnnexe Du Sujet de Physique-Chimie PSIMihnea GamanPas encore d'évaluation
- A. Applications Des Principes de La Thermodynamique: A. I. Étude Des Systèmes FermésDocument14 pagesA. Applications Des Principes de La Thermodynamique: A. I. Étude Des Systèmes FermésMihnea GamanPas encore d'évaluation
- Centrale PC-1 2005 I-A.1/ Pour Un Diélectrique H-L-I, Il N'y A Ni ChargeDocument4 pagesCentrale PC-1 2005 I-A.1/ Pour Un Diélectrique H-L-I, Il N'y A Ni ChargeMihnea GamanPas encore d'évaluation
- Physique-Chimie Filière MPDocument12 pagesPhysique-Chimie Filière MPMihnea GamanPas encore d'évaluation
- tp2-MCA 2Document6 pagestp2-MCA 2Kouraichi ZeinebPas encore d'évaluation
- ThreadDocument18 pagesThreadRma CanelaPas encore d'évaluation
- 02 La Fibre OptiqueDocument2 pages02 La Fibre OptiqueSomaya GhofranPas encore d'évaluation
- Informatique-Portail-des-Jeux - Educatifs - AndroidDocument52 pagesInformatique-Portail-des-Jeux - Educatifs - AndroidNïnà NouPas encore d'évaluation
- SCD T 2010Document174 pagesSCD T 2010MohamadsfPas encore d'évaluation
- Signaux Physiques-Chapitre 6 - Filtrage LineaireDocument21 pagesSignaux Physiques-Chapitre 6 - Filtrage LineaireAlex N'zuePas encore d'évaluation
- TP LVMDocument1 pageTP LVMOussama AlkoryPas encore d'évaluation
- ÉlectricitéDocument18 pagesÉlectricitéSTI2D EEPas encore d'évaluation
- 1-Introduction: Chapitre III: Protection Et Maintenance D'un Transformateur 16MVADocument57 pages1-Introduction: Chapitre III: Protection Et Maintenance D'un Transformateur 16MVAHadji AbdallahPas encore d'évaluation
- TP Instrumentation 2 PDFDocument4 pagesTP Instrumentation 2 PDFAyedi AbderrahmenPas encore d'évaluation
- LEG008011Document11 pagesLEG008011KouassiPas encore d'évaluation
- 2004 These Doctorat PetreDocument174 pages2004 These Doctorat PetreFlorPas encore d'évaluation
- Mise en Service de L'installation Électrique - Explications Et Procédure - Le Blog de L'électricitéDocument9 pagesMise en Service de L'installation Électrique - Explications Et Procédure - Le Blog de L'électricitéRégis ESCOBARPas encore d'évaluation
- Les CompteursDocument7 pagesLes CompteursSoufiane AggourPas encore d'évaluation
- Electronique Et Loisirs 055 - 2003 - DecembreDocument80 pagesElectronique Et Loisirs 055 - 2003 - DecembreIkram IkramPas encore d'évaluation
- Solar ConnectDocument2 pagesSolar ConnectDomingo BenPas encore d'évaluation
- SMA Sunny Tripower CORE1 Onduleur String - SMA SolarDocument10 pagesSMA Sunny Tripower CORE1 Onduleur String - SMA SolarZakaria el jaouhariPas encore d'évaluation
- TRAFIC 3 - Moteur Et PériphériquesDocument210 pagesTRAFIC 3 - Moteur Et Périphériques0001fred50% (2)
- Travaux Dirigés 3 Fonction Electronique Analogique PDFDocument3 pagesTravaux Dirigés 3 Fonction Electronique Analogique PDFSakli AdemPas encore d'évaluation
- LGB PDFDocument22 pagesLGB PDFe-genieclimatique.comPas encore d'évaluation
- CSI 3201 - FRIntroduction Aux Systèmes D - Exploitation - EditedDocument132 pagesCSI 3201 - FRIntroduction Aux Systèmes D - Exploitation - EditedkapiotherPas encore d'évaluation
- 0 DiodeDocument6 pages0 DiodeRomeo Mba TakoudjouPas encore d'évaluation
- Allumage Electronique PDFDocument3 pagesAllumage Electronique PDFRadaodyPas encore d'évaluation
- An 01 FR Conrad Lernpaket Internet of ThingsDocument90 pagesAn 01 FR Conrad Lernpaket Internet of ThingsscribddmailPas encore d'évaluation
- ONE - Eddition de La Liste Du Matériel AgréeDocument24 pagesONE - Eddition de La Liste Du Matériel Agréeanon_115278401Pas encore d'évaluation
- Ofdm PDFDocument17 pagesOfdm PDFaimadjePas encore d'évaluation
- VRL Manual FRDocument35 pagesVRL Manual FRJulienPas encore d'évaluation
- TP Intégration PV Et Éolien Au Réseau 20-21Document5 pagesTP Intégration PV Et Éolien Au Réseau 20-21Hasnae SegaouiPas encore d'évaluation
- Electrodes Pour ERGDocument16 pagesElectrodes Pour ERGJacques CharlierPas encore d'évaluation
- Cours DOPT FinalDocument253 pagesCours DOPT FinalSidahmed Erguiebi omarPas encore d'évaluation