Académique Documents
Professionnel Documents
Culture Documents
Quimica 2 Ano 2 Parte
Transféré par
João PauloCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Quimica 2 Ano 2 Parte
Transféré par
João PauloDroits d'auteur :
Formats disponibles
QUIMICA
QUIMICA
Solubilidade
Soluo uma mistura homognea de duas ou mais
substncias.
Para se obter uma soluo, devemos ter dois
componentes importantes: o soluto e o solvente.
O soluto a substncia que se dissolve
O solvente a substncia que promove a
dissoluo do soluto. Como a gua dissolve muitas
substncias, ela conhecida como solvente universal
Exemplo: Sal de cozinha (soluto) + gua (solvente) =
soluo salina
Regras de solubilidade
Uma substncia polar tende a se dissolver em um
solvente polar e uma substncia apolar tende a se
dissolver em um solvente apolar.
A solubilidade de uma substncia em um solvente
est relacionada com a temperatura em que ocorre a
dissoluo.
Coeficiente de solubilidade
Chamamos de coeficiente de solubilidade CS -
(ou grau de solubilidade) quantidade necessria de
um soluto (em gramas) para saturar 100 gramas de um
solvente, em determinadas condies de temperatura e
presso. Assim podemos obter trs tipos de solues:
Soluo insaturada :Contm menos soluto do
que o estabelecido pelo CS (soluo estvel).
Soluo saturada : Contm exatamente a
quantidade do soluto estabelecido pelo CS (soluo
estvel). Soluo em equilbrio com corpo de cho,
necessariamente uma soluo saturada.
Soluo suersaturada : Contm mais soluto do
que o estabelecido pelo CS (soluo instvel). Este
tipo de soluo obtido por procedimentos especiais
em laboratrio. Mas existem os naturais como por
exemplo o mel e as gelias.
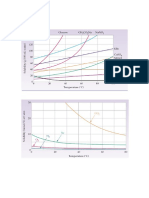
Curva de solubilidade
A Curva de Solubilidade um grfico onde se
relaciona a solubilidade de um determinado soluto com
a temperatura. til para analisar o comportamento da
solubilidade com a variao de temperatura.
Os pontos que se encontram exatamente sobre a
curva so de uma soluo saturada. Qualquer ponto
acima da curva representa uma soluo super saturada
e qualquer ponto abaixo da curva, representa uma
soluo insaturada.
!xerc"cios conceituais
1. (Ufpe 2000) Uma soluo saturada de NH4Cl foi
preparada a 80C utilizando-se 200g de gua.
Posteriormente, esta soluo sofre um resfriamento sob
agitao at atingir 40C. Determine a massa de sal
depositada neste processo. A solubilidade do NH4Cl
varia com a temperatura, conforme mostrado no grfico
abaixo.
2. (Ufpe 2003) A solubilidade do oxalato de clcio a
20C de 33,0 g por 100 g de gua. Qual a massa, em
gramas, de CaC2O4 depositada no fundo do recipiente
quando 100 g de CaC2O4(s) so adicionados em 200 g
de gua a 20C?
3. (Ufrrj) Observe o grfico a seguir e responda s
questes que se seguem.
#rea de
suer
saturao
#rea de
insaturao
Soluo
saturada
$
QUIMICA
a) Qual a menor quantidade de gua necessria para
dissolver completamente, a 60C, 120g de B?
b) Qual a massa de A necessria para preparar, a 0C,
com 100g de gua, uma soluo saturada () e outra
soluo insaturada ()?
4. (Unesp) O grfico a seguir mostra as curvas de
solubilidade em gua, em funo da temperatura, dos
sais KNO3 e MnSO4.
Com base neste grfico, discuta se as afirmaes a e b
so verdadeiras ou falsas.
a) O processo de dissoluo dos dois sais
endotrmico.
b) 100 mL de soluo saturada a 56C contm
aproximadamente 10g de KNO3.
5. (Unicamp) Uma soluo saturada de nitrato de
potssio (KNO3) constituda, alm do sal, por 100g de
gua, est temperatura de 70C. Essa soluo
resfriada a 40C, ocorrendo precipitao de parte do sal
dissolvido. Calcule:
a) a massa do sal que precipitou.
b) a massa do sal que permaneceu em soluo.
A seguir, o grfico da solubilidade do nitrato de potssio
em funo da temperatura.
6. (Uel) A 10C a solubilidade do nitrato de potssio
de 20,0g/100g H2O. Uma soluo contendo 18,0g de
nitrato de potssio em 50,0g de gua a 25C resfriada
a 10C.
Quantos gramas do sal permanecem dissolvidos na
gua?
a) 1,00
b) 5,00
c) 9,00
d) 10,0
e) 18,0
7. (Cesgranrio) A curva de solubilidade de um sal
hipottico :
A quantidade de gua necessria para dissolver 30
gramas do sal a 35C ser, em gramas:
a) 45
b) 60
c) 75
d) 90
e) 105
8. (Fatec) O processo Solvay de obteno do Na2CO3,
matria-prima importante na fabricao do vidro,
envolve os reagentes CO2, NH3 e soluo saturada de
NaCl. Na soluo final encontram-se os ons:
NH4
+
(aq), Na
+
(aq), Cl
-
(aq) e HCO3
-
(aq)
Analisando, no grfico apresentado, as curvas de
solubilidade em funo da temperatura, correto
afirmar que, na temperatura de 20C, o slido que
dever precipitar primeiro o
a) NH4Cl
b) NaHCO3
c) NH4HCO3
d) NaCl
e) Na2CO3
QUIMICA
9. (Fatec 2006) A partir do grfico a seguir so feitas as
afirmaes de a V.
. Se acrescentarmos 250 g de NH4NO3 a 50 g de gua
a 60 C, obteremos uma soluo saturada com corpo de
cho.
. A dissoluo, em gua, do NH4NO3 e do Na ocorre
com liberao e absoro de calor, respectivamente.
. A 40 C, o Na mais solvel que o NaBr e menos
solvel que o NH4NO3.
V. Quando uma soluo aquosa saturada de NH4NO3,
inicialmente preparada a 60 C, for resfriada a 10 C,
obteremos uma soluo insaturada.
Est correto apenas o que se afirma em:
a) e .
b) e .
c) e V.
d) e .
e) e V.
10. (Fei) Tem-se 500g de uma soluo aquosa de
sacarose (C12H22O11), saturada a 50C. Qual a massa de
cristais que se separam da soluo, quando ela
resfriada at 30C?
Dados: Coeficiente de solubilidade (Cs) da sacarose em
gua:
Cs a 30C=220g/100g de gua
Cs a 50C=260g/100g de gua
a) 40,0 g
b) 28,8 g
c) 84,25 g
d) 55,5 g
e) 62,5 g
!xerc"cios conceituais
1. (Fuvest) 160 gramas de uma soluo aquosa
saturada de sacarose a 30C so resfriados a 0C.
Quanto do acar cristaliza?
Temperatura C Solubilidade da sacarose
g/100 g de H,O
0 180
30 220
a) 20 g.
b) 40 g.
c) 50 g.
d) 64 g.
e) 90 g.
2. (Fuvest) O grfico adiante mostra a solubilidade (S)
de K2Cr2O7 slido em gua, em funo da temperatura
(t). Uma mistura constituda de 30g de K K2Cr2O7 e 50g
de gua, a uma temperatura inicial de 90C, foi deixada
esfriar lentamente e com agitao. A que temperatura
aproximada deve comear a cristalizar o K2Cr2O7?
a) 25C
b) 45C
c) 60C
d) 70C
e) 80C
3. (ta 2000) A figura abaixo mostra a curva de
solubilidade do brometo de potssio (KBr) em gua:
Dados
Massa molar (g/mol): K = 39,10; Br = 79,91
Baseando nas informaes apresentadas na figura
ERRADO afirmar que:
a) a dissoluo do KBr em gua um processo
endotrmico.
b) a 30C, a concentrao de uma soluo aquosa
saturada em KBr de aproximadamente 6mol/kg
(molal).
c) misturas correspondentes a pontos situados na
regio da figura so bifsicas.
d) misturas correspondentes a pontos situados na
regio da figura so monofsicas.
e) misturas correspondentes a pontos situados sobre a
curva so saturadas em KBr.
QUIMICA
4. (Puc-rio 2005) As curvas de solubilidade das
substncias KNO3 e Ca(OH)2 (em gramas da substncia
em 100 g de gua) em funo da temperatura so
mostradas a seguir. A partir desses dados, analise as
alternativas a seguir e assinale a que NO apresenta
uma afirmativa correta.
a) Quando se adicionam 10,0 g de KNO3 em 12,0g de
gua a 56 C, se obtm uma soluo insaturada.
b) Observa-se a formao de corpo de fundo quando
uma soluo formada por 25 g de KNO3 e 50 g de gua
a 40 C resfriada a 30 C.
c) A solubilidade do nitrato de potssio aumenta com a
temperatura, enquanto a do hidrxido de clcio diminui.
d) Duas substncias puras podem apresentar a mesma
curva de solubilidade.
e) O hidrxido de clcio muito menos solvel que o
nitrato de potssio em toda faixa de temperatura
estudada.
5. (Puccamp) Considere o grfico, representativo da
curva de solubilidade do cido brico em gua
Adicionando-se 200g de H3BO3 em 1,00kg de gua, a
20C, quantos gramas do cido restam na fase slida?
a) 50,0
b) 75,0
c) 100
d) 150
e) 175
6. (Pucmg) O diagrama representa curvas de
solubilidade de alguns sais em gua.
Com relao ao diagrama anterior, CORRETO
afirmar:
a) O NaCl insolvel em gua.
b) O KClO3 mais solvel do que o NaCl temperatura
ambiente.
c) A substncia mais solvel em gua, a uma
temperatura de 10C, CaCl2.
d) O KCl e o NaCl apresentam sempre a mesma
solubilidade.
e) A 25C, a solubilidade do CaCl2 e a do NaNO3 so
praticamente iguais.
7. (Pucmg) O grfico a seguir representa as curvas de
solubilidade de vrias substncias.
Com relao ao grfico anterior, assinale a afirmativa
NCORRETA:
a) KNO3 mais solvel do que o Pb(NO3)2 em gua, a
qualquer temperatura.
b) A temperatura pouco afeta a solubilidade do NaCl.
c) A substncia que apresenta a maior aumento de
solubilidade com o aumento de temperatura o KNO3.
d) temperatura ambiente, a substncia menos solvel
o MgCl2.
e) A 40C, a solubilidade do KCl e a do NaCl so iguais.
8. (Uel) O grfico a seguir refere-se solubilidade (em
g/100g de gua) de determinado sal em diferentes
temperaturas (emC).
QUIMICA
Se, a 40C forem acrescentados 20,0g do sal em 200g
de gua, e deixada a mistura em repouso sob
temperatura constante obter-se-:
. soluo saturada
. corpo de fundo
. soluo diluda
Dessas afirmaes:
a) apenas correta.
b) apenas correta.
c) apenas correta.
d) , e so corretas.
e) , e so NCORRETAS.
9. (Ufes) Ao se adicionar cloreto de amnio a uma certa
quantidade de gua a 25C, observa-se um
resfriamento na soluo. Com base nessa informao,
pode-se afirmar:
a) O processo exotrmico e a solubilidade do NH4Cl
aumenta com o aumento da temperatura.
b) O processo endotrmico e a solubilidade do NH4Cl
aumenta com o aumento da temperatura.
c) O processo exotrmico e a solubilidade do NH4Cl
diminui com o aumento da temperatura.
d) O processo endotrmico e a solubilidade do NH4Cl
diminui com o aumento da temperatura.
e) O processo endotrmico e a solubilidade do NH4Cl
independe da temperatura.
QUIMICA
10. (Uflavras 2000) A curva de solubilidade de um sal
hipottico :
Se a 20C misturarmos 20g desse sal com 100g de
gua, quando for atingido o equilbrio, podemos afirmar
que:
a) 5 g do sal estaro em soluo.
b) 15 g do sal ser corpo de fundo (precipitado).
c) o sal no ser solubilizado.
d) todo o sal estar em soluo.
e) 5 g do sal ser corpo de fundo (precipitado).
11. (Unifesp 2005) As solubilidades dos sais KNO3 e
NaCl, expressas em gramas do sal por 100 gramas de
gua, em funo da temperatura, esto representadas
no grfico a seguir.
Com base nas informaes fornecidas, pode-se afirmar
corretamente que:
a) a dissoluo dos dois sais em gua so processos
exotrmicos.
b) quando se adicionam 50 g de KNO3 em 100 g de
gua a 25C, todo o slido se dissolve.
c) a solubilidade do KNO3 maior que a do NaCl para
toda a faixa de temperatura abrangida pelo grfico.
d) quando se dissolvem 90 g de KNO3 em 100 g de
gua em ebulio, e em seguida se resfria a soluo a
20C, recupera-se cerca de 30 g do sal slido.
e) a partir de uma amostra contendo 95 g de KNO3 e 5 g
de NaCl, pode-se obter KNO3 puro por cristalizao
fracionada.
C%&C!&'RA()% ! *I+UI()%
Concentrao comum
C , massa do soluto C , m- g/L
Volume da soluo V
Molaridade
. = n
o
de mols da soluo M = n1 mol/L
Volume da soluo V
Nmero de mols
n = massa n- = m1 mol
massa molar M1
Unindo-se as duas ltimas frmulas :
M = m1 mol/L, molar ou M
MM1 / V
Densidade
d = massa da soluo d = m g/cm
3
volume da soluo V
Porcentagem em massa - Ttulo
= massa do soluto = m1 / 100 %
massa da soluo m
Frmulas gerais
C , . d
C , / d , M/MM-
C , M . M1
*iluio de misturas
C1V1 = C2V2
M1V1 = M2V2
Mistura de solutos iguais
C1V1 + C2V2 = C3V3
M1V1 + M2V2 = M3V3
Mistura de solutos diferentes sem reao
C1V1 = C3V3 C2V2 = C3V3
M1V1 = M3V3 M2V2 = M3V3
Mistura de solutos diferentes com reao
na = Ma.Va
nb = Mb.Vb
Exerccios conceituais
1. Uma soluo contm 30%, em massa, de soluto.
Sabendo que a quantidade de solvente de 56 g,
determine a massa dessa soluo.
2. So dissolvidos 45 g de hidrxido de sdio em
gua. Calcule a massa de gua, sabendo que o
soluto corresponde a 15%, em massa, da soluo.
QUIMICA
3. Prepara-se uma soluo dissolvendo-se 8 g de
sacarose em 192 g de gua. Qual o ttulo dessa
soluo?
4. Uma soluo apresenta massa de 30 g e ocupa um
volume de 40 cm
3
. Qual a sua densidade em g/L ?
5. A massa de uma soluo de 86,4g. Calcule o
volume, em litros, dessa soluo, que apresenta
uma densidade de 2,7 g/cm
3
6. So dissolvidos 8 g de sacarose em gua suficiente
para 500 cm
3
de soluo. Qual a concentrao
comum dessa soluo em g/l ?
7. So dissolvidos 19,6 g de H2SO4 em gua suficiente
para 800 cm
3
de soluo. Qual a molaridade
dessa soluo ? Dados : H2SO4 = 98 g/mol
8. Temos 400 ml de uma soluo 0,15 M de NaOH.
Determine a massa de NaOH nessa soluo e a
concentrao em g/l. Dados : NaOH = 40 g/mol
9. Calcule o volume de uma soluo aquosa de NaOH
0,8 M, sabendo que ela contm 32 g de NaOH.
Dados : NaOH = 40 g/mol
10. Calcule a concentrao em g/l de uma soluo de
1,5 g/ml de densidade, sabendo que ela contm 25g
de sulfato de amnio dissolvidos em 275 g de gua.
11. Qual a concentrao molar de uma soluo que,
num volume de 600 cm
3
, contm 0,15 mol de
molculas do soluto ?
12. Uma soluo aquosa, de 1,23 g/cm
3
de densidade,
apresenta 20% em massa de MgSO4 . 7 H2O
.Determine a sua molaridade e sua concentrao
em g/l. Dados : MgSO4.7 H2O = 246 g/mol
13. Qual a massa contida em 200 ml de uma soluo
de H2SO4 cuja densidade de 1395,3 g/l e o ttulo
percentual 50% ?
14. So dissolvidos 50 g de um sal em 200g de gua,
originando uma soluo cuja densidade de 1,2
g/cm
3
. Determine a concentrao em mg/l.
15. Calcular a molaridade de uma soluo aquosa de
NaOH a 20% em massa, que possua densidade de
1,2 g/cm
3
. Dados : NaOH = 40 g/mol
16. Uma soluo de cido sulfrico possui 15% em
massa de H2SO4, e sua densidade de 1,1 g/cm
3
.
Determinar a concentrao em g/l e em mol/l. Dados
: H2SO4 = 98 g/mol
17. Considere 40 mL de uma soluo 0,5 M de NaCl.
Que volume de gua, em mL, que deve ser
adicionado para que a sua concentrao caia para
0,2 M?
18. Qual a quantidade de gua (em litros) necessria
para se diluir 1 litro de uma soluo de
concentrao 3 mol/L para0,5 mol/L ?
19. Adicionando-se 75 ml de gua a 25 ml de uma
soluo 0,20 M de cloreto de sdio, obtm-se uma
soluo de que concentrao ?
20. Temos uma soluo de cido clordrico que
apresenta 20% em massa de soluto e densidade de
1,1 g/mL. Que volume dessa soluo deve ser
diludo para formar 150 mL de uma soluo que
contenha 8% em massa de soluto e que tenha
densidade de 1,05 g/mL?
21. 100 mL de uma soluo de CaCl2 de 0,03 g/mL de
concentrao so misturados com 200 mL de outra
soluo de CaCl2, resultando uma soluo de 0,04
g/mL de concentrao. Calcule a concentrao de
200 mL.
22. 30 cm
3
de soluo 0,1 M de HNO3 foram
adicionados a 20 cm
3
de soluo 0,2 M do mesmo
cido. Calcule a molaridade da soluo resultante.
23. 500 mL de uma soluo 0,4 M de NaCl so
misturados com 300 mL de uma soluo 0,8 M de
KCl. Calcule a concentrao molar da soluo
resultante em relao a cada um dos sais e em
relao aos respectivos ons.
24. Temos 750 mL de uma soluo 1,0 M de Na2SO4 e
250 mL de uma soluo 1,0 M de NaCl. Calcule as
concentraes molares em relao aos sais e em
relao aos ons da soluo resultante da mistura
daquelas solues.
25. Misturam-se 100 mL de uma soluo 0,15 M de
KOH com 150 mL de uma soluo 0,1 M de HCl.
Calcule a concentrao molar em relao ao sal
formado na soluo resultante.
26. Misturam-se 200 mL de uma soluo 0,9 M de
NaOH com 300 mL de uma soluo 0,25 M de
H2SO4. Calcule as concentraes molares em
relao ao sal formado na soluo resultante, ao
cido, base e aos ons presentes na soluo final.
27. Misturam-se 600 mL de uma soluo 0,20 M de
Ca(OH)2 com 400 mL de uma soluo 0,50M de
HCl. Calcule as concentraes molares em relao
base, ao cido, ao sal formado e aos ons
presentes na soluo final.
28. 25,0 mL de uma soluo de NaOH foram
submetidos titulao com uma soluo de H2SO4
de concentrao 0,10 M. Terminada a titulao,
QUIMICA
verificou-se que foram gastos 26,5 mL da soluo
de H2SO4. Calcular a concentrao da soluo de
NaOH.
29. 25,0 mL de uma soluo de KOH foram recolhidos
numa pipeta e transferidos para um erlenmeyer.
Esse volume exigiu, na titulao, 28,0 mL de uma
soluo 0,05 M de H2SO4. Descubra a concentrao
molar da soluo bsica.
30. Quantos cm
3
de gua temos que adicionar a 0,5 L
de soluo 0,50M, a fim de torn-la 0,20 M?
a) 1500
b) 1250
c) 1000
d) 750
e) 500
31. O volume de uma soluo de hidrxido de sdio
(NaOH) 1,5 M que deve ser misturado a 300 mL de
uma soluo 2 M da mesma base, a fim de torn-la
soluo 1,8 M, :
a) 200 mL
b) 20 mL
c) 2000 mL
d) 400 mL
e) 350 mL
2. 250 mL de soluo aquosa de cloreto de sdio
(soluo 1) so misturados a 250 mL de soluo
aquosa de cloreto de sdio de densidade 1,40 g/mL
e ttulo igual a 20% em massa. A concentrao final
de cloreto de sdio 0,8 g/mL. Calcule a massa de
cloreto de sdio existente na soluo 1.
a) 330 g
b) 130 g
c) 50 g
d) 100 g
e) 120 g
3. Considere os sais a seguir relacionados. Qual
deles, ao se dissolver em gua, forma solues em
que a concentrao, em mol por litro, do nion
igual do ction?
a) MgCl2
b) NaNO3
c) K2SO4
d) BaF2
e) Li3PO4
Exerccios avanados
1. (Ufg 2007) Um analista necessita de 100 mL de uma
soluo aquosa de NaCl 0,9 % (m/v). Como no dispe
do sal puro, resolve misturar duas solues de NaCl(aq):
uma de concentrao 1,5 % (m/v) e outra de 0,5 %
(m/v). Calcule o volume de cada soluo que dever ser
utilizado para o preparo da soluo desejada.
2. (Puc-rio 2007) A graduao alcolica que indicada
nos rtulos das bebidas alcolicas (mostrada em % Vol
ou em graus Gay Lussac - GL) indica a percentagem
de lcool em volume que a mistura contm.
Considerando que a vodca comercial tem graduao
igual a 37,5 GL, responda s questes a seguir.
a) Calcule a concentrao em quantidade de matria
(mol L
-1
) de lcool etlico em uma soluo aquosa
com 37,5 % em volume do lcool, sabendo que a
densidade do lcool etlico igual a 0,80 g mL
-1
.
b) Escreva a frmula estrutural do lcool etlico e o seu
nome, segundo a nomenclatura oficial da UPAC.
c) Escreva a frmula estrutural do ismero funcional
do lcool etlico.
d) Escreva a equao da combusto completa do
etanol, balanceada corretamente.
3. (Ueg 2005)
FONTE: FELTRE, Ricardo. "Qumica orgnica". V.3.
So Paulo: Moderna. p. 224
Leia a tira e os textos 1 e 2 apresentados a seguir e
responda ao que se pede.
'!0'% -
As bebidas fermentadas tm teor alcolico menor que
as destiladas: na cerveja, por exemplo, considera-se 4
GL, aproximadamente. Nas bebidas destiladas, o teor
alcolico mais elevado; o usque, por exemplo, de,
aproximadamente, 45GL.
'!0'% 1
Os lcoois tambm se queimam como normalmente
acontece com as substncias orgnicas, dando CO,, CO
ou C, conforme a quantidade de oxignio disponvel.
QUIMICA
a) Considerando os valores dos teores alcolicos
contidos no texto 1, suponha que dois amigos resolvam
ir a uma boate. Um deles tomou cerveja e o outro,
usque. Nessa situao, calcule a quantidade em
volume de cerveja que o indivduo que ingeriu essa
bebida precisaria tomar para alcanar o percentual de
lcool presente em 200 mL de usque ingerido pelo seu
amigo.
Dados: A graduao alcolica expressa em GL e
indica a porcentagem em volume na bebida. Exemplo:
no usque, 45GL significa que 45 % do volume de
lcool.
b) No texto 2, observa-se que, na combusto do etanol,
vrios produtos podem ser obtidos. Sendo assim,
escreva a equao balanceada da reao de
combusto completa desse lcool.
4. (Ufg 2005) m um laboratrio existem trs frascos,
como representados a seguir:
Sobre o contedo desses frascos, sabe-se que:
Sobre o contedo desses frascos, sabe-se que:
- O frasco A contm uma soluo que conduz corrente
eltrica.
- O frasco B contm uma soluo cuja concentrao
de 0,55 mol L
-1
- O frasco C contm uma soluo que apresenta
espcies dissociadas.
- Os frascos contm 50 g de soluto, cada.
- Os frascos podem conter, como soluto, glicose ou
cloreto de sdio.
- Os frascos contm gua, como solvente, em uma
quantidade suficiente para completar o volume
especificado no rtulo.
Quais os solutos e as suas concentraes em cada
frasco? Justifique sua resposta.
5. (Ufla 2007) Com relao a solues salinas,
responda os itens a e b.
a) Juntam-se em um recipiente 100 mL de soluo
aquosa de cido sulfrico 0,2 mol L
-1
com 100 mL de
soluo aquosa 0,4 mol L
-1
de hidrxido de potssio. Ao
completar a reao, tem-se a formao de uma soluo
salina.
Escreva a equao balanceada que representa a
reao entre os dois compostos e calcule a
concentrao (em mol L
-1
) da soluo salina formada.
b) Calcule a concentrao em mol L
-1
de uma soluo
salina de sulfato de sdio (Na2SO4) que contenha 10,65
g desse sal em 500 mL de soluo.
Dado: Na2SO4 = 142.
6. (Ufrj 2005) A eletrlise de solues concentradas de
cloreto de sdio (salmoura) produz cloro gasoso no
eletrodo E1, gs hidrognio e hidrxido de sdio em
soluo no eletrodo E2, restando uma soluo diluda
de NaCl cuja concentrao de 50 g/L, que removida
da clula eletroltica. O esquema a seguir representa
uma clula eletroltica de membrana.
Calcule o volume de gua, em litros, que deve ser
removido de 1000 L da soluo de NaCl a 50 g/L para
que ela atinja a concentrao de 250 g/L e possa ser
reaproveitada no processo.
Para efeito de clculo, despreze a variao de
densidade das solues salinas.
7. (Fatec 2006) Quando se dissolve um comprimido
efervescente contendo 1g de vitamina C em um copo de
gua, obtm-se cerca de 200mL de uma soluo
aquosa na qual a concentrao em mol L
-1
de vitamina
C igual a:
(Dado: massa molar da vitamina C = 1,8 10
2
g mol
-1
)
a) 2,8 10
-2
.
b) 5,0 10
-2
.
c) 1,8 10
-2
.
d) 2,0 10
-1
e) 5,0 10
-1
QUIMICA
8. (Puc-rio 2006) O volume de soluo aquosa de cido
sulfrico 1,0 mol L
-1
necessrio para neutralizar
completamente 0,2 L de uma soluo aquosa de
hidrxido de potssio de concentrao 1,0 mol.L
-1
(ver
reao a seguir) ser:
H2SO4(aq) + 2 KOH(aq) K2SO4(aq) + H2O(l)
a) 0,2 L.
b) 0,4 L.
c) 100 mL.
d) 200 dm
3
.
e) nenhuma das alternativas anteriores.
9. (Puc-rio 2007) 100 mL de uma soluo aquosa 1,0
10
-1
mol L
-1
de HCl so misturados com 150 mL de
soluo aquosa 2,0 10
-2
mol L
-1
de Pb(NO3)2 que
reagem segundo a reao a seguir.
2HCl(aq) + Pb(NO3)2(aq) PbCl2(s) + 2HNO3(aq)
Assinale a alternativa que indica, com maior
aproximao, a quantidade mxima de PbCl2 que pode
ser obtida na reao.
a) 0,06 g
b) 0,41 g
c) 0,83 g
d) 1,6 g
e) 2,6 g
10. (Puc-rio 2007) Considere a reao de 100 mL de
uma soluo aquosa 1,0 10
-1
mol L
-1
de H2SO4 com
200 mL de soluo aquosa 2,0 10
-2
mol L
-1
de
Ca(OH)2, segundo a equao:
H2SO4(aq) + Ca(OH)2(aq) CaSO4(s) + 2H2O(l)
Assinale a alternativa que indica, com maior
aproximao, a quantidade mxima de CaSO4, que
pode ser obtida nessa reao.
a) 0,002 mol
b) 0,004 mol
c) 0,006 mol
d) 0,01 mol
e) 0,08 mol
11. (Pucmg 2006) Fenol (C6H5OH), conhecido como
cido fnico, usado como desinfetante e na
manufatura de plsticos. Para prepararmos um
desinfetante, dissolvemos 0,94 g desse composto em
gua suficiente para completar 500 mL de soluo.
Assinale a concentrao, mol/L, de fenol nessa soluo
desinfetante.
a) 0,1
b) 0,2
c) 0,01
d) 0,02
12. (Pucmg 2006) Na anlise qumica de um suco de
laranja, determinou-se uma concentrao de cido
ascrbico (C6H8O6) igual a 264 mg/L. Nesse suco, a
concentrao de cido ascrbico, em mol/L, igual a:
a) 3,0 10
-2
b) 3,0 10
-3
c) 1,5 10
-2
d) 1,5 10
-3
13. (Pucmg 2007) A hipergua apresenta, em sua
composio, 42,0 mg/L de bicarbonato de sdio
(NaHCO3). A concentrao dessa gua mineral com
relao ao bicarbonato de sdio , em mol.L
-1
, igual a:
a) 5,0 10
-1
b) 5,0 10
-4
c) 5,0 10
-3
d) 5,0 10
-2
14. (Uel 2007) Algumas pessoas acabam culpando o
cozinheiro pelos distrbios estomacais que sentem.
Para eliminar o "mal-estar" freqente usar, como
anticido estomacal, o bicarbonato de sdio (NaHCO3).
A reao que ocorre com o uso deste anticido pode ser
representada pela equao a seguir:
NaHCO3(aq) + HCl(aq) NaCl(aq) + H2O(aq) + CO2(g)
Considerando que o suco gstrico contenha 100 mL de
HCl 0,100 mol L
-1
, para neutralizar completamente essa
quantidade de cido, a massa necessria, em gramas,
de bicarbonato de sdio, ser:
a) 0,100.
b) 0,300.
c) 0,840.
d) 3,00.
e) 84,0
15. (Uerj 2006) Para estudar os processos de diluio e
mistura, foram utilizados, inicialmente, trs frascos
contendo diferentes lquidos.
A caracterizao desses lquidos apresentada na
ilustrao seguinte.
A seguir, todo o contedo de cada um dos frascos foi
transferido para um nico recipiente.
Considerando a aditividade de volumes e a ionizao
total dos cidos, a mistura final apresentou uma
concentrao de ons H
+
, em mol L
-1
, igual a:
QUIMICA
a) 0,60
b) 0,36
c) 0,24
d) 0,12
16. (Uerj 2007) Para evitar a proliferao do mosquito
causador da dengue, recomenda-se colocar, nos pratos
das plantas, uma pequena quantidade de gua sanitria
de uso domstico. Esse produto consiste em uma
soluo aquosa diluda de hipoclorito de sdio, cuja
concentrao adequada, para essa finalidade, igual a
0,1 mol/L.
Para o preparo de 500 mL da soluo a ser colocada
nos pratos, a massa de hipoclorito de sdio necessria
, em gramas, aproximadamente igual a:
a) 3,7
b) 4,5
c) 5,3
d) 6,1
17. (Ufc 2007) Em um balo volumtrico, foram
colocados 6 g de hidrxido de sdio impuro e gua
destilada at completar um volume de 250 mL. Para a
neutralizao completa de 50 mL desta soluo, foram
necessrios 60 mL de H2SO4 0,1 mol.L
-1
. Sabendo que
as impurezas existentes so inertes na presena de
H2SO4, o percentual de pureza do hidrxido de sdio
utilizado igual a:
a) 10
b) 20
c) 40
d) 60
e) 80
18. (Ufrs 2006) O volume, em mililitros, de uma soluo
de 0,5 mol/L de AgNO3 necessrio para preparar 200
mililitros de uma soluo 0,1 mol/L desse sal igual a:
a) 10.
b) 20.
c) 25.
d) 40.
e) 50.
19. (Ufrs 2006) Misturando-se 250 mL de soluo 0,600
mol/L de KCl com 750 mL de soluo 0,200 mol/L de
BaCl2, obtm-se uma soluo cuja concentrao de on
cloreto, em mol/L, igual a:
a) 0,300.
b) 0,400.
c) 0,450.
d) 0,600.
e) 0,800.
20. (Unesp 2007) Com o objetivo de diminuir a
incidncia de cries na populao, em muitas cidades
adiciona-se fluoreto de sdio gua distribuda pelas
estaes de tratamento, de modo a obter uma
concentrao de 2,0 10
-5
mol . L
-1
. Com base neste
valor e dadas as massas molares em g.mol
-1
: F = 19 e
Na = 23, podemos dizer que a massa do sal contida em
500 mL desta soluo :
a) 4,2 10
-1
g.
b) 8,4 10
-1
g.
c) 4,2 10
-4
g.
d) 6,1 10
-4
g.
e) 8,4 10
-4
g.
QUIMICA
21. (Unifesp 2007) A contaminao de guas e solos
por metais pesados tem recebido grande ateno dos
ambientalistas, devido toxicidade desses metais ao
meio aqutico, s plantas, aos animais e vida
humana. Dentre os metais pesados h o chumbo, que
um elemento relativamente abundante na crosta
terrestre, tendo uma concentrao ao redor de 20 ppm
(partes por milho). Uma amostra de 100 g da crosta
terrestre contm um valor mdio, em mg de chumbo,
igual a:
XXXXXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXX XXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXX3g
+,VWXYZ^_stuwxyz}~
@4@4l@`@df@l@
@G@@ @
*x
q *x
T
S .`
T *x
E 2
0.
XXXXXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXX XXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXX3g
+,VWXYZ^_stuwxyz}~
@4@4l@`@df@l@
@G@@ @
*x
q *x
T
S .`
T *x
E 1
0.
XXXXXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXX XXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXX3g
+,VWXYZ^_stuwxyz}~
@4@4l@`@df@l@
@G@@ @
*x
q *x
T
S .`
T *x
E 5
.
XXXXXXXVXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXX XXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXX3g
+,VWXYZ^_stuwxyz}~
@4@4l@`@df@l@
@G@@ @
*x
q *x
T
S .`
T *x
E 2
.
QUIMICA
XXXXXXXVXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXXXXXXXXX XXXXXXX
XXXXXXXXXXXXXXXXXXXXXXXX
XXXXXXXX3g
+,VWXYZ^_stuwxyz}~
@4@4l@`@df@l@
@G@@ @
*x
q *x
T
S .`
T *x
E 1
.
2roriedades Coligativas
As propriedades coligativas so estudadas
comparando-se o comportamento da soluo em
determinadas condies com o comportamento do
respectivo solvente puro nas mesmas condies.
So as seguintes:
'%&%M!'RIA %U '%&%SC%2IA3
o estudo da diminuio da presso mxima
de vapor de um solvente, provocada pela adio de um
soluto no voltil.
Quando a presso mxima de vapor se iguala presso
externa local, o lquido entra em ebulio.
A presso atmosfrica diminui conforme a
altitude aumenta, ou seja, quanto maior a altitude,
menor a presso atmosfrica.
PRESSO MXMA DE VAPOR:
A presso de vapor de um solvente na soluo
sempre menor que a do respectivo solvente puro.
Obs: Quanto maior for o nmero de partculas (n de
mol) do soluto no voltil na soluo, maior ser o
abaixamento absoluto da presso mxima de vapor.
!4U+I%SC%2IA %U !4U+I%M!'RIA3
o estudo da elevao do ponto de ebulio do
solvente em uma soluo.
Solues preparadas pela adio de solutos no
volteis a um solvente apresentam um ponto de
ebulio (PE) maior que a do solvente puro.
O aumento do PE pode ser justificado pela
diminuio da presso mxima de vapor que devida
presena do soluto.
Para que ocorra a ebulio da soluo,
necessrio que ela seja aquecida at que sua presso
de vapor se iguale presso atmosfrica.
CRI%SC%2IA %U CRI%M!'RIA3
o estuda da diminuio do ponto de
congelamento de um solvente em uma soluo.
Solues preparadas pela adio de solutos
no volteis a um solvente apresentam um ponto de
solidificao (congelamento) menor que a do solvente
puro.
A adio de um soluto no voltil provoca um
abaixamento do ponto de congelamento. Esse
abaixamento pode ser explicado pelo fato das partculas
do soluto dificultarem a cristalizao do solvente.
5- %SM%C%2IA %U %SM%M!'RIA %U %SM%S!3
Difuso o movimento espontneo das
partculas de uma substncia de se espalharem
uniformemente em meio a partculas de outra
substncia ou, ento, de atravessarem uma parede
porosa.
*I6US)% !&'R! S%+U(7!S3
Memranas semi-!erme"veis
Possuem ao seletiva (deixam passar certo
tipo de substncia e outras no).
Exemplo: membrana celular, papel celofane, usado em
aparelhos de hemodilise, etc.
A passagem do solvente atravs de membranas
semipermeveis denominada osmose e ocorre no
seguinte sentido:
Soluo ou soluo menos concentrada soluo
mais concentrada.
Para impedir a osmose, teremos que exercer
uma presso sobre o sistema no sentido inverso ao da
osmose.
A presso que preciso exercer sobre um
sistema para impedir que a osmose ocorra
espontaneamente denominada de presso osmtica
().
8/9 , n/R/' ou 8 , M/R/' %nde M , molaridade
As solues podem ser classificadas quanto s
suas presses osmticas:
Meio hipertnico: A : B
Meio hipotnico: A ; B
sotnica A = B
Dependendo da natureza do soluto, a frmula
acima deve ser acrescida de um fator de correo, que
chamaremos de i.
8/9 , n/R/'i ou 8 , M/R/'i
QUIMICA
6ator de correo de van<t =off >i?
i , - @ A / >B--?
A = grau de dissociao ou ionizao.
B = nmero total de ons liberados na ionizao ou na
dissociao de um composto.
2AR'CCU+AS *ISS%+9I*AS3
Os solutos no volteis podem ser de 2 tipos:
moleculares ou inicos.
Solutos moleculares >no-eletrDlito?3 A maioria
desses solutos origina solues moleculares (q=1).
As solues moleculares no sofrem
dissociao e nem ionizao (exceto cidos) e so
compostos que fazem ligaes covalentes (FONClBr...).
Exemplo: soluto glicose (C6H12O6)
1 mol de glicose(s) 1 mol de glicose (aq)
Solutos iEnicos >eletrDlito?3 Originam solues
inicas.
Os solutos inicos sofrem ionizao em
presena de gua, que promove a separao dos ons
presentes no soluto.
Exemplo:
K3PO4 3K
+
+ SO4
2
O nmero de partculas (ons) presente na soluo 4
vezes o nmero de partculas adicionado gua (q=4).
Encontramos ons, tambm, provenientes da
ionizao do cido, que um soluto molecular.
Exemplo:
H2SO4 2 H
+
+ 1 SO4
2
O nmero de partculas (ons) presente na soluo 3
vezes o nmero de partculas (molculas) adicionado
gua (q=3).
Nas mesmas condies experimentais, o efeito
coligativo das solues inicas sempre maior que o
das solues moleculares.
Exerccios conceituais
1. (Unifesp 2007) Os polmeros fazem parte do nosso
cotidiano e suas propriedades, como temperatura de
fuso, massa molar, densidade, reatividade qumica,
dentre outras, devem ser consideradas na fabricao e
aplicao de seus produtos. So apresentadas as
equaes das reaes de obteno dos polmeros
polietileno e nilon-66.
a) Quanto ao tipo de reao de polimerizao, como
so classificados os polmeros polietileno e nilon-66?
b) A medida experimental da massa molar de um
polmero pode ser feita por osmometria, tcnica que
envolve a determinao da presso osmtica (8) de
uma soluo com uma massa conhecida de soluto.
Determine a massa molar de uma amostra de 3,20 g de
polietileno (PE) dissolvida num solvente adequado, que
em 100 mL de soluo apresenta presso osmtica de
1,64 10
-2
atm a 27 C.
Dados: 8 = iRTM, onde i (fator de n=vant Hoff) = 1
R = 0,082 atm.L.K
-1
.mol
-1
T = temperatura Kelvin
M = concentrao em mol.L
-1
2. Assinale a alternativa que apresenta uma situao
em que se faz uso de uma propriedade coligativa.
a) Preparao de charque por adio de sal carne.
b) Adio de suco de limo para talhar o leite.
c) Uso de sulfato de alumnio para tratamento de gua.
d) Abaixamento de temperatura da gua para adicionar
CO2.
e) Adio de lcool anidro gasolina.
3. (Pucmg 2006) Considere as seguintes solues
aquosas, a 25 C e 1 atm:
X - 0,20 mol/L de sacarose (C12H22O11)
Y - 0,50 mol/L de cloreto potssio (KCl)
Z - 0,50 mol/L de sulfato de sdio (Na2SO4)
Considerando-se as propriedades coligativas de tais
solues, NCORRETO afirmar que:
a) a soluo X a de maior presso de vapor.
b) a soluo Y tem uma temperatura de congelamento
menor do que a soluo Z.
c) as trs solues apresentam temperatura de ebulio
superior a 100 C.
d) a ordem crescente de temperatura de ebulio
dessas solues : X Y Z.
4. (Pucmg 2006) As temperaturas normais de ebulio
da gua, do etanol e do ter etlico so,
respectivamente, 100 C, 78 C e 35 C. Observe as
curvas no grfico da variao de presso de vapor do
lquido ( Pv ) em funo da temperatura ( T ).
QUIMICA
As curvas , e correspondem, respectivamente, aos
compostos:
a) gua, etanol e ter etlico.
b) ter etlico, etanol e gua.
c) ter etlico, gua e etanol.
d? FguaG Hter et"lico e etanol/
5. (Pucmg 2006) Sejam dadas as seguintes solues
aquosas:
. 0,1 mol/L de cloreto de potssio (KCl)
. 0,3 mol/L de glicose (C6H12O6)
. 0,1 mol/L de sacarose (C12H22O11)
V. 0,3 mol/L de sulfato de sdio (Na2SO4)
Assinale a alternativa que apresenta as solues em
ordem decrescente de temperatura de ebulio.
a) V
b) V
c) V
d) V
6. (Pucmg 2006) Certas propriedades fsicas de um
solvente, tais como temperatura de ebulio e de
solidificao, so alteradas quando nele dissolvemos
um soluto no-voltil. Para se verificar esse fato, quatro
sais distintos foram dissolvidos em frascos contendo a
mesma quantidade de gua, formando as solues , ,
e V, como indica o esquema a seguir:
Assinale a alternativa que apresenta solues em
ordem CRESCENTE de abaixamento da temperatura de
solidificao.
a) V
b) V
c) V
d) V
7. (Pucmg 2007) Em um laboratrio, um estudante
recebeu trs diferentes amostras (X, Y e Z). Cada uma
de um lquido puro, para que fosse estudado o
comportamento de suas presses de vapor em funo
da temperatura. Realizado o experimento, obteve-se o
seguinte grfico da presso de vapor em funo da
temperatura.
Considerando-se essas informaIesG H C%RR!'%
afirmar Bue3
a) o liquido Z aquele que apresenta maior volatilidade.
b) o lquido X o que apresenta maior temperatura de
ebulio ao nvel do mar.
c) as foras de atrao intermoleculares dos lquidos
aumentam na ordem: X Y Z.
d) a temperatura de ebulio do liquido Z, presso de
700 mmHg, 80 C.
QUIMICA
8. (Ufsc 2004) A panela de presso permite que
alimentos sejam cozidos em gua muito mais
rapidamente do que em panelas convencionais. Sua
tampa possui uma borracha de vedao que no deixa
o vapor escapar a no ser atravs de um orifcio sobre o
qual assenta um peso (vlvula) que controla a presso.
O esquema da panela de presso e um diagrama de
fases da gua so apresentados abaixo. A presso
exercida pelo peso da vlvula de 0,4 atm e a presso
atmosfrica local de 1,0 atm.
De acordo com as informaes do enunciado e do
grfico acima, assinale a(s) proposio(es)
CORRETA(S).
(01) A gua, dentro da panela de presso, entrar em
ebulio a 110C.
(02) Reduzindo o peso da vlvula pela metade, a gua
entrar em ebulio a 100C.
(04) Aumentando a intensidade da chama sob a panela,
a presso interna do sistema aumenta.
(08) Se, aps iniciar a sada de vapor pela vlvula, a
temperatura for reduzida para 60C, haver
condensao de vapor dgua at que a presso caia
para 0,5 atm.
(16) Na vaporizao da gua o principal tipo de
interao que est sendo rompida entre as molculas
so ligaes de hidrognio.
Exerccios avanados
1) Em uma amostra de gua do mar dissolve-se um
pouco de sacarose. Em relao conseqncia deste
acrscimo de sacarose, so feitas as seguintes
afirmaes:
. A presso de vapor da gua diminui.
. A presso osmtica da soluo aumenta.
. A condutividade eltrica da soluo permanece
praticamente a mesma.
V. A temperatura precisar descer mais para que possa
comear a solidificao.
V. O grau de dissociao dos sais presentes na gua do
mar permanecer praticamente o mesmo.
Das afirmaes, esto CORRETAS:
a) Apenas , e .
b) Apenas , e V.
c) Apenas , V e V.
d) Apenas , , V e V.
e) Todas.
2)
a) No topo do Monte Everest a gua entra em ebulio
a 76C. Consultando o grfico, qual deve ser o ponto de
ebulio do ter dietlico no mesmo local? Justifique.
b) Atravs dos dados do grfico pode-se afirmar
que, sob uma mesma presso, o ponto de ebulio do
1-butanol maior do que o do ter dietlico. Explique
esse comportamento com base na estrutura desses
compostos.
3) Em um mesmo local, a presso de vapor de todas as
substncias puras lquidas:
a) tem o mesmo valor mesma temperatura.
b) tem o mesmo valor nos respectivos pontos de
ebulio.
c) tem o mesmo valor nos respectivos pontos de
congelao.
d) aumenta com o aumento do volume do lquido
presente, temperatura constante.
e) diminui com o aumento do volume de lquido
presente, temperatura constante.
4) A uma dada temperatura, possui a MENOR presso
de vapor a soluo aquosa:
a) 0,1 mol/L de sacarose.
b) 0,2 mol/L de sacarose.
c) 0,1 mol/L de cido clordrico.
d) 0,2 mol/L de cido clordrico.
e) 0,1 mol/L de hidrxido de sdio.
5) Tem-se duas solues aquosas, ambas de
concentrao igual a 0,1M, uma de cloreto de sdio e
outra de cloreto de magnsio. Com respeito a essas
solues, indicar entre as alternativas a seguir, a que
contm a afirmao correta.
a) A soluo de cloreto de magnsio melhor condutora
de eletricidade.
b) Ambas as solues tm a mesma normalidade.
c) A soluo de cloreto de sdio congela a uma
temperatura inferior da soluo de cloreto de
magnsio.
QUIMICA
d) Ambas as solues apresentam a mesma presso
osmtica.
e) Os pontos de ebulio das duas solues so iguais
ao da gua pura.
6) Comparando-se as estruturas moleculares do
etanol e do etilenoglicol (etanodiol) podemos concluir
que
a) ambos so solveis em gua.
b) o etanol mais viscoso que o etilenoglicol.
c) a presso de vapor do etilenoglicol maior que a do
etanol.
d) o ponto de ebulio do etanol maior que o
etilenoglicol.
e) o etanol pode ser queimado enquanto o etilenoglicol
no.
7) Aquecendo gua destilada, numa panela aberta e
num local onde a presso ambiente 0,92 atm, a
temperatura de ebulio da gua:
a) ser inferior a 100 C
b) depende da rapidez do aquecimento
c) ser igual a 100 C
d) alcanada quando a presso mxima de vapor
saturante for 1atm.
e) ser superior a 100 C
8) A aparelhagem esquematizada na figura (1)
mantida a 25 C. nicialmente, o lado direito contm
uma soluo aquosa um molar em cloreto de clcio,
enquanto que o lado esquerdo contm uma soluo
aquosa um dcimo molar do mesmo sal. Observe que a
parte superior do lado direito fechada depois da
introduo da soluo e provida de um manmetro.
No incio de uma experincia as alturas dos nveis dos
lquidos nos dois ramos so iguais, conforme indicados
na figura, e a presso inicial no lado direito igual a
uma atmosfera.
Mantendo a temperatura constante, medida que passa
o tempo, a presso do ar confinado no lado direito ir se
comportar de acordo com qual das curvas
representadas na figura (2)?
a) A.
b) B.
c) C.
d) D.
e) E.
9) Foi observado que o cozimento de meio quilo de
batatas em 1 litro de gua mais rpido se
adicionarmos 200 gramas de sal gua de cozimento.
Considere as seguintes possveis explicaes para o
fato:
1- a adio de sal provoca um aumento da temperatura
de ebulio da gua;
2- a adio de sal provoca um aumento da presso de
vapor da gua;
3- o sal adicionado no altera a temperatura de ebulio
da gua, mas reage com o amido das batatas.
Est(o) correta(s) a(s) explicao(es):
a) 1 apenas
b) 2 apenas
c) 3 apenas
d) 1 e 2 apenas
e) 1, 2 e 3
10) Uma srie de solues foram preparadas
dissolvendo-se diferentes massas de sacarose em 1000
g de H,O. Essas solues foram resfriadas e as suas
temperaturas de congelao, determinadas. Os
resultantes obtidos encontram-se descritos no grfico a
seguir.
Com relao s solues R e S, indicadas no grfico, a
afirmativa FALSA
a) a concentrao da soluo R menor que a da
soluo S.
b) a presso de vapor da soluo R maior que a da
soluo S, numa dada temperatura.
c) a temperatura de ebulio da soluo S maior que
a da gua pura.
d) adicionando-se sacarose soluo S, a sua
temperatura de ebulio aumentar.
e) evaporando-se 10% do solvente da soluo S, a sua
presso de vapor aumentar.
11) As paredes dos glbulos brancos e vermelhos
do sangue so membranas semipermeveis. A
concentrao de soluto no sangue cerca de 0,60 M.
Os glbulos brancos e vermelhos foram isolados de
uma amostra de sangue.
Constante universal dos gases = 0,082 atm.L/K.mol
a) O que acontecer se as clulas sangneas forem
colocadas em soluo salina 1,0 M? Justificar.
b) Calcular a diferena de presso existente entre o
interior e o exterior das clulas do sangue, quando
colocadas em gua pura a 27 C.
12) A variao das presses de vapor de HCCl3 e
C2H5Cl com a temperatura mostrada no grfico.
QUIMICA
Considere a presso de 1 atmosfera:
a) a que temperatura cada substncia entrar em
ebulio?
b) qual o efeito da adio de um soluto no voltil
sobre a presso de vapor das solues?
13) Em pases onde os invernos so rigorosos,
coloca-se sobre o leito de ruas consideradas prioritrias
ao trnsito, uma mistura de sal (NaCl), cloreto de clcio
(CaCl2) e areia, para diminuir os riscos de derrapagens
dos veculos, durante os perodos de nevadas. Cada um
desses produtos tem uma funo definida, que
associadas so muito eficientes.
ndique a afirmao correta.
a) O sal abaixa o ponto de congelamento da gua,
o cloreto de clcio quando se dissolve, absorve calor, e
a areia aumenta a aderncia dos pneus ao solo.
b) O sal eleva o ponto de congelamento da gua, o
cloreto de clcio quando se dissolve, absorve calor, e a
areia aumenta a aderncia dos pneus ao solo.
c) O sal abaixa o ponto de congelamento da gua,
o cloreto de clcio quando se dissolve, libera calor, e a
areia aumenta a aderncia dos pneus ao solo.
d) O sal abaixa o ponto de congelamento da gua,
o cloreto de clcio dissolve-se atravs de uma reao
endotrmica, e a areia aumenta a aderncia dos pneus
ao solo.
e) O sal eleva o ponto de congelamento da gua, o
cloreto de clcio dissolve-se atravs de uma reao
endotrmica, e a areia aumenta a aderncia dos pneus
ao solo.
14) Foram realizadas medidas de presso de vapor
em experincias com o tubo de Torricelli utilizando os
lquidos puros: gua, lcool, ter e acetona, todos na
mesma temperatura de 20 C e ao nvel do mar. Os
resultados foram os seguintes:
Considerando os mesmos lquidos, a 20 C, os que
entrariam em ebulio na referida temperatura num
ambiente onde a presso fosse reduzida a 150 mmHg
seriam:
a) nenhum dos lquidos
b) apenas a acetona
c) apenas o ter e a acetona
d) apenas a gua
e) apenas a gua e o lcool
Vous aimerez peut-être aussi
- Coeficiente de SolubilidadeDocument5 pagesCoeficiente de SolubilidadeRubia MariathPas encore d'évaluation
- 16 SolubilidadeDocument7 pages16 SolubilidadeFRANKE MERO TESTEPas encore d'évaluation
- 16 SolubilidadeDocument6 pages16 SolubilidadeEverton FisicoPas encore d'évaluation
- Solucoes PDFDocument15 pagesSolucoes PDFThiago Magno Tavares Machado100% (1)
- SOLUCOESDocument15 pagesSOLUCOESRaquel Reis Duarte PinheiroPas encore d'évaluation
- Estudo Das Solucoes Coeficiente de SolubilidadeDocument13 pagesEstudo Das Solucoes Coeficiente de SolubilidadeGildo Silva100% (1)
- SolubilidadeDocument4 pagesSolubilidadeCleber SerafinPas encore d'évaluation
- Coeficiente de SolubilidadeDocument38 pagesCoeficiente de SolubilidadeMarguiené BragaPas encore d'évaluation
- 36 20solubilidade 20 - 20conceitos 20e 20curvas PDFDocument12 pages36 20solubilidade 20 - 20conceitos 20e 20curvas PDFCarolynne MourãoPas encore d'évaluation
- SolubilidadeDocument38 pagesSolubilidadeLXM10% (1)
- 20080325103157Document6 pages20080325103157Renan Barcelos MendesPas encore d'évaluation
- Lista+de+exercícios+para+1 +prova+Quimica+AnalíticaDocument5 pagesLista+de+exercícios+para+1 +prova+Quimica+Analíticabenedito.nasaPas encore d'évaluation
- Coeficiente de Solub.Document8 pagesCoeficiente de Solub.Rafael MottaPas encore d'évaluation
- Exercicios de SolubilidadeDocument6 pagesExercicios de Solubilidadesua mae de 4Pas encore d'évaluation
- Coeficiente de Solubilidade e Tipos de SaturaçãoDocument5 pagesCoeficiente de Solubilidade e Tipos de SaturaçãoWelff Junior100% (2)
- 12 - Soluções Curvas de SolubilidadeDocument4 pages12 - Soluções Curvas de SolubilidadeRodrigo MettePas encore d'évaluation
- Soluções (Curvas de Solubilidade)Document38 pagesSoluções (Curvas de Solubilidade)GleisonPas encore d'évaluation
- Atividade Sobre Coeficiente de SolubilidadeDocument13 pagesAtividade Sobre Coeficiente de SolubilidadePedro HélioxPas encore d'évaluation
- Lista de Exercc3adcio Soluc3a7c3b5esDocument5 pagesLista de Exercc3adcio Soluc3a7c3b5esAna Ester CavalcantePas encore d'évaluation
- DL 50Document11 pagesDL 50Rita Sofia Ramos MesquitaPas encore d'évaluation
- Lista 1 QG 1-19Document6 pagesLista 1 QG 1-19schottbpPas encore d'évaluation
- Capítulo 1 - SoluçõesDocument18 pagesCapítulo 1 - SoluçõesGerson LimaPas encore d'évaluation
- Soluções 321 QuestõesDocument83 pagesSoluções 321 QuestõesThiago Alonso Rodrigues da Hora67% (3)
- Gabarito Lista 1 - SoluçõesDocument5 pagesGabarito Lista 1 - Soluçõesbrigida.lucinPas encore d'évaluation
- Gama - Módulo 19Document23 pagesGama - Módulo 19Koelho CoelhoPas encore d'évaluation
- Fisico Quimica Solubilidade ExerciciosDocument10 pagesFisico Quimica Solubilidade ExerciciosRubia MariathPas encore d'évaluation
- 2012 - TMedicina - Quimica - Borges - Exercícios de Solubilidade - SiteDocument12 pages2012 - TMedicina - Quimica - Borges - Exercícios de Solubilidade - SiteDhieniffer FerreiraPas encore d'évaluation
- Curva de SolubilidadeDocument5 pagesCurva de Solubilidadealexchacal100% (2)
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Document5 pagesA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10Pas encore d'évaluation
- Química Prof. Durval Exercícios Corrigidos 02.03 2º AnoDocument3 pagesQuímica Prof. Durval Exercícios Corrigidos 02.03 2º Anothomasbarreto213Pas encore d'évaluation
- CE Quimica 2 Ano 1 BimDocument12 pagesCE Quimica 2 Ano 1 Bimguilhermestadlerdefreitas1Pas encore d'évaluation
- Atividade 5 de Abril - Pré ProvaDocument5 pagesAtividade 5 de Abril - Pré ProvaAlfredo Sahade VespaPas encore d'évaluation
- 31-Soluções e SolubilidadeDocument4 pages31-Soluções e Solubilidadenv77vnm100% (2)
- Lista de Exercicio de Quimica Introducao As SolucoesDocument3 pagesLista de Exercicio de Quimica Introducao As SolucoesEtiany Oliveira SantosPas encore d'évaluation
- Atividade 1 FQ2ADocument3 pagesAtividade 1 FQ2AAlfredo Sahade VespaPas encore d'évaluation
- Quimica - 002 SolucoesDocument5 pagesQuimica - 002 Solucoescon_seguir100% (1)
- Atividade (Soluções) - Roteiros de Estudo de Química e de Ciências Da Natureza.Document4 pagesAtividade (Soluções) - Roteiros de Estudo de Química e de Ciências Da Natureza.André DiogoPas encore d'évaluation
- DispersõeDocument5 pagesDispersõeHelton ClistenesPas encore d'évaluation
- CoeficienteDocument12 pagesCoeficienteOtoazevedo OtoazevedoPas encore d'évaluation
- Aula01 Quimica2 ExercíciosDocument4 pagesAula01 Quimica2 ExercíciosMarko Aurelio Ferreira Da CostaPas encore d'évaluation
- Apostila QUIMICA Com GabaritoDocument39 pagesApostila QUIMICA Com Gabaritobio1988Pas encore d'évaluation
- Exercicios de COEFICIENTE DE SOLUBILIDADE e SoluçõesDocument26 pagesExercicios de COEFICIENTE DE SOLUBILIDADE e Soluçõeslardiao0% (1)
- Fisico Quimica Solubilidade Exercicios GabaritoDocument10 pagesFisico Quimica Solubilidade Exercicios GabaritoLuana GregórioPas encore d'évaluation
- Ficha Ex.11-Curvas Solubilidade PDFDocument4 pagesFicha Ex.11-Curvas Solubilidade PDFIsabel FreitasPas encore d'évaluation
- Exercicios Solubilidade IIDocument6 pagesExercicios Solubilidade IIDauson CuigicjenhiPas encore d'évaluation
- Exercícios Coeficiente de SolubilidadeDocument7 pagesExercícios Coeficiente de SolubilidadeGraciete QuentalPas encore d'évaluation
- Química: 3 Lista de ResoluçãoDocument5 pagesQuímica: 3 Lista de ResoluçãoJader Pereira de AraujoPas encore d'évaluation
- Exercicios de Coeficiente de SolubilidadeDocument4 pagesExercicios de Coeficiente de SolubilidadeCleber SerafinPas encore d'évaluation
- Exercicios Coeficiente de SolubilidadeDocument4 pagesExercicios Coeficiente de SolubilidadeAndré Luís Della VolpePas encore d'évaluation
- Coeficiente de Solubilidadeaula 12 04 12blogDocument7 pagesCoeficiente de Solubilidadeaula 12 04 12blogThania ArrudaPas encore d'évaluation
- Soluções BásicaDocument4 pagesSoluções BásicaLarissa DalapícolaPas encore d'évaluation
- Lista Química 2º (A, B, C e D)Document4 pagesLista Química 2º (A, B, C e D)wwwisaque18Pas encore d'évaluation
- Lista 2 - Concentração DassoluçõesDocument4 pagesLista 2 - Concentração Dassoluçõesbrigida.lucinPas encore d'évaluation
- Exercicios de Coeficiente de SolubilidadeDocument4 pagesExercicios de Coeficiente de SolubilidadeEng Renato De Marchi Vieira Dos SantosPas encore d'évaluation
- Química Lista de ExercíciosDocument4 pagesQuímica Lista de Exercícioshtq87rbdjgPas encore d'évaluation
- Exe SolucoesDocument48 pagesExe Solucoesandreik83100% (1)
- Apostila Química Orgânica: Carbono, Dienos E AromáticosD'EverandApostila Química Orgânica: Carbono, Dienos E AromáticosPas encore d'évaluation
- Apostila Química Orgânica: Terpenos E Rotas De SínteseD'EverandApostila Química Orgânica: Terpenos E Rotas De SíntesePas encore d'évaluation
- Cartilha Versao FinalDocument14 pagesCartilha Versao FinalJoão PauloPas encore d'évaluation
- 1 Invertebrados IIDocument74 pages1 Invertebrados IIJoão PauloPas encore d'évaluation
- Interpretação de ChargesDocument13 pagesInterpretação de ChargesJoão PauloPas encore d'évaluation
- Chave de InsetosDocument3 pagesChave de InsetosJoão PauloPas encore d'évaluation
- Ufpi 2016Document4 pagesUfpi 2016Tassio MasterPas encore d'évaluation
- Atividades de Ensino de Lc3adngua Inglesa 6c2ba Ao 9c2ba Ano1Document2 pagesAtividades de Ensino de Lc3adngua Inglesa 6c2ba Ao 9c2ba Ano1João PauloPas encore d'évaluation
- Exercicios Genetica 3 AnoDocument3 pagesExercicios Genetica 3 AnoJoão PauloPas encore d'évaluation
- PESQUISADocument4 pagesPESQUISAJoão PauloPas encore d'évaluation
- IMUNOLOGIADocument3 pagesIMUNOLOGIAJoão PauloPas encore d'évaluation
- Apostila InglêsDocument39 pagesApostila InglêsTpsoares100% (1)
- PESQUISADocument1 pagePESQUISAJoão PauloPas encore d'évaluation
- Apostila - Entomologia - Basica (Taxonomia, Identificação, Nomenclatura de Especies)Document50 pagesApostila - Entomologia - Basica (Taxonomia, Identificação, Nomenclatura de Especies)antonioandreoPas encore d'évaluation
- Genética de PopulaçõesDocument4 pagesGenética de PopulaçõesJoão PauloPas encore d'évaluation
- Física - CEESVO - Apostila2Document70 pagesFísica - CEESVO - Apostila2Física Caderno de Resoluções100% (5)
- Provão 1 SérieDocument4 pagesProvão 1 SérieJoão PauloPas encore d'évaluation
- Nono AnoDocument53 pagesNono AnoRose NunesPas encore d'évaluation
- Ingles 6 AnoDocument50 pagesIngles 6 AnoJoão PauloPas encore d'évaluation
- Exercício Celulas e TecidosDocument1 pageExercício Celulas e TecidosFernando PinheiroPas encore d'évaluation
- 3º AnoDocument5 pages3º AnoJoão PauloPas encore d'évaluation
- Química OrgânicaDocument16 pagesQuímica OrgânicaJoão PauloPas encore d'évaluation
- 1 Semana (6º Ano)Document22 pages1 Semana (6º Ano)João PauloPas encore d'évaluation
- Provão 1 SérieDocument4 pagesProvão 1 SérieJoão PauloPas encore d'évaluation
- Oi Futuro - Patrocínios CulturaisDocument1 pageOi Futuro - Patrocínios CulturaisJoão PauloPas encore d'évaluation
- Immediate FutureDocument2 pagesImmediate FutureJoão Paulo60% (5)
- SONDAGEM MilleniumDocument1 pageSONDAGEM MilleniumJoão PauloPas encore d'évaluation
- 9 Ano Eja 3 Bim RecuperaçãoDocument1 page9 Ano Eja 3 Bim RecuperaçãoJoão PauloPas encore d'évaluation
- BOTULISMO - Diogo IzecsonDocument17 pagesBOTULISMO - Diogo IzecsonJoão PauloPas encore d'évaluation
- Exercício Celulas e TecidosDocument1 pageExercício Celulas e TecidosFernando PinheiroPas encore d'évaluation
- JPDocument20 pagesJPJoão PauloPas encore d'évaluation
- Enzimas e BioenergeticaDocument49 pagesEnzimas e BioenergeticaRones Dias100% (1)
- Aula-6 - Eixos e ArvoresDocument45 pagesAula-6 - Eixos e ArvoresRômulo Castro100% (1)
- Física Geral e Experimental: MecânicaDocument12 pagesFísica Geral e Experimental: MecânicaRodrigo_Miguel_CEPas encore d'évaluation
- 8800 - Estrutura de AçoDocument10 pages8800 - Estrutura de AçoCipriano NetoPas encore d'évaluation
- Estrutura Cubica de Face Centrada NiODocument105 pagesEstrutura Cubica de Face Centrada NiOGuilherme EstevesPas encore d'évaluation
- Motor Acionador, Remoção MCBDocument5 pagesMotor Acionador, Remoção MCBAlexandrePas encore d'évaluation
- Ficha Tecnica Celenit Abe pdf1504866627Document3 pagesFicha Tecnica Celenit Abe pdf1504866627armindoPas encore d'évaluation
- Ficha 2 - Extensão Das ReaçõesDocument3 pagesFicha 2 - Extensão Das ReaçõesRafael TeixeiraPas encore d'évaluation
- Curso 12168 Aula 10 v1Document80 pagesCurso 12168 Aula 10 v1Gerson GersonPas encore d'évaluation
- Mod 06 Materiais e Equiapamentos FísicosDocument357 pagesMod 06 Materiais e Equiapamentos FísicosDaniel MotaPas encore d'évaluation
- Dilatação Térmica Dos Sólidos e LíquidosDocument23 pagesDilatação Térmica Dos Sólidos e LíquidosLeandroBritoPas encore d'évaluation
- NBR 12952Document6 pagesNBR 12952Daniel Barni HulbertPas encore d'évaluation
- Abnt CB 02 NBR 14323 PDFDocument75 pagesAbnt CB 02 NBR 14323 PDFWilliamPas encore d'évaluation
- Movimento FQ 9º AnoDocument3 pagesMovimento FQ 9º Anoc2mfPas encore d'évaluation
- Rev. G 07 / 2020: ProcedimentoDocument65 pagesRev. G 07 / 2020: ProcedimentoJosuel SantosPas encore d'évaluation
- Ligas de AluminioDocument68 pagesLigas de Aluminiopandapandolino100% (1)
- Perguntas e Respostas Sobre Refrigeração e ClimatizaçãoDocument37 pagesPerguntas e Respostas Sobre Refrigeração e Climatizaçãogilbertofb87% (15)
- P1-5-Analise GranulometricaDocument41 pagesP1-5-Analise GranulometricaCristiano Manuel da Costa100% (1)
- C - Corte PuroDocument8 pagesC - Corte PuroReginaldo G SoaresPas encore d'évaluation
- Edil Química Orgânica Unidade 1 - Teoria EstruturalDocument132 pagesEdil Química Orgânica Unidade 1 - Teoria Estruturalleticia trindadePas encore d'évaluation
- MODULO 1 - Introducao Ao Comportamento Das EstruturasDocument28 pagesMODULO 1 - Introducao Ao Comportamento Das EstruturasInacio Mauricio TomasPas encore d'évaluation
- Mapa Mental (TCC)Document1 pageMapa Mental (TCC)JAIRO SANTOS100% (1)
- Recuperação de Física Do 3º Ano. 1º Bi.Document3 pagesRecuperação de Física Do 3º Ano. 1º Bi.ceciliamunizPas encore d'évaluation
- Prova Quím 1c MatDocument2 pagesProva Quím 1c MatjuscilainePas encore d'évaluation
- Magnetismo TerceiroDocument3 pagesMagnetismo TerceiroÉder MartinsPas encore d'évaluation
- Turbo MaquinasDocument20 pagesTurbo Maquinasnate91_rcPas encore d'évaluation
- Prova UNICAMP 2020 Física ComentadaDocument23 pagesProva UNICAMP 2020 Física ComentadaMarcelePas encore d'évaluation
- Apostila Mecanica Dos Solos IIDocument122 pagesApostila Mecanica Dos Solos IIRaiane100% (1)
- Data Sheet Loctite 620Document3 pagesData Sheet Loctite 620Reginaldo AlvesPas encore d'évaluation
- 2-Munição CompletoDocument43 pages2-Munição CompletoMarcio Nascimento100% (2)