Académique Documents
Professionnel Documents
Culture Documents
Propieades Fidicas Hidrocarburos
Transféré par
Francisco Daniel Montes RomeroTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Propieades Fidicas Hidrocarburos
Transféré par
Francisco Daniel Montes RomeroDroits d'auteur :
Formats disponibles
PROPIEDADES FSICAS DE HIDROCARBUROS SATURADOS
INTRODUCCIN En pases como el nuestro, en el que cada vez se hace ms acuciante el problema de la disponibilidad de agua por la escasez de lluvia y la falta de caudal en los ros; se est haciendo necesario recurrir al agua subterrnea en muchos casos para poder abastecer a la demanda, sobre todo de la costa del levante. Pero el uso de acuferos, aparte de a problemas de tipo tcnico de explotacin est limitado por la presencia en muchos de ellos de contaminacin debida a causas antrpicas. Aunque la llegada de contaminantes es difcil en un principio que se produzca, en comparacin, por ejemplo con un ro o un lago, una vez ha dado lugar el proceso de limpieza es mucho ms costoso que en los casos de aguas superficiales, por la dificultad de acceder a ese medio subterrneo. Este trabajo trata sobre uno de los casos de contaminacin ms frecuentes de acuferos, la originada por vertidos de hidrocarburos, los cuales en su totalidad casi proceden de derivados del petrleo, siendo ms del 90% de los derrames causados por derrames accidentales en transporte de gasolinas, gasoil,carburantes en general, y por fugas en depsitos de derivados del petrleo. Tambin trata de los tipos de descontaminacin que se utilizan actualmente para limpiar dentro de lo posible aquellos acuferos que se han visto afectados por la llegada de hidrocarburos, ya que aunque un acufero sea descontaminado , el agua que en l se haya inmersa no va a poder ser utilizada por el hombre hasta que transcurra un tiempo determinado que asegure que no va a provocar daos sobre la salud. Por ello es que en este caso, como en el de casi todos los medios, es mucho mejor impedir que el vertido llegue al subsuelo, tanto por el encarecimiento del tratamiento de descontaminacin como por la larga inutilizacin de esta agua tratada.
DEFINICIN Los hidrocarburos son compuestos de gran abundancia en la naturaleza y estn integrados por tomos de carbono e hidrgeno, los primeros disponen un armazn de estructural al que se unen los tomos de hidrgeno. Forman el esqueleto bsico de las molculas de la materia orgnica, por lo que tambin son conocidos como compuestos orgnicos. Asimismo los podemos encontrar en formaciones geolgicas, tanto en estado lquido (denominado comnmente con el nombre de petrleo) como en estado gaseoso (gas natural). As es como estos hidrocarburos estipulan una actividad econmica de primera importancia a nivel mundial, pues constituyen los principales combustibles fsiles, adems sirven de materia prima para todo tipo de plsticos, ceras y lubricantes. Pero, son estas formas de elevado valor econmico (petrleo y sus derivados), las responsables de graves problemas de contaminacin en el medio natural, a nivel de superficie e incluso afectan a grandes reservas de agua subterrnea. Es por ello por lo que al final de este ttulo se les dedica un epgrafe especial. CLASIFICACIN Los hidrocarburos se clasifican segn la estructura de los enlaces existentes entre los tomos de carbono que componen la molcula.
1. Hidrocarburos alifticos: En este primer apartado, los tomos de carbono se disponen formando una cadena lineal; stos se subdividen en: 1.1. Alcanos (hidrocarburos saturados o parafinas), tienen enlaces simples o sigma, es decir, covalentes por comparticin de un par de electrones en un orbital s entre sus tomos de carbono. Se presentan en estado gaseoso, lquido o slido segn el tamao de la cadena de carbonos. Hasta 4 5 carbonos son gases, de seis a 12 son lquidos y de 12 y superiores se presentan como slidos aceitosos (parafinas). Todos son combustibles, y liberan grandes cantidades de energa durante la combustin. Su reactividad es muy reducida en comparacin con otros compuestos orgnicos (parafinas viene del latn y significa poca afinidad). La relacin C/H es de CnH2n+2 siendo n el nmero de tomos de carbono de la molcula (advertir que esta relacin slo se cumple en alcanos lineales o ramificados no cclicos, por ejemplo el ciclobutano, donde la relacin es CnH2n). La estructura de un alcano sera de la forma: 3H H H H |||| H C C ... C C H ||||HHHH
Los alcanos se obtienen en su mayora del petrleo, ya sea de forma directa o mediante pirolisis (rotura de trmica de molculas de mayor tamao). Son los compuestos de partida para la fabricacin de otros compuestos orgnicos. Son importantes sustancias de la industria qumica y tambin los combustibles ms importantes de la economa mundial. El punto de partida para la elaboracin de alcanos es siempre el gas natural y el petrleo (que es destilado en las refineras y procesado en varios productos diferentes, por ejemplo la gasolina). 1.2. Hidrocarburos insaturados, son los que tienen uno o ms enlaces dobles (alquenos u olefinas) o triples (alquinos) entre sus tomos de carbono, estos enlaces se caracterizan por ser ms fuertes que los simples, por lo que su degradacin requiere de una mayor aportacin de energa.
2. Hidrocarburos cclicos, que se subdividen en: 2.1. Hidrocarburos policclicos, que tienen cadenas cerradas de 3, 4, 5, 6, 7 y 8 tomos de carbono saturados o no saturados. Como ejemplo, encontraramos el ciclohexano. 2.2.Hidrocarburos aromticos, son los que ostentan al menos un anillo aromtico aparte de otros tipos de enlaces que puedan tener. Son polienos ciclcos conjugados que cumplen la Regla de Hckel , o sea, que tienen un total de 4n+2 electrones pi en el anillo. Y que cumplen, al menos las siguientes premisas, que los dobles enlaces resonantes de la molcula estn conjugados y que se den al menos dos formas resonantes equivalentes. La caracterstica fundamental de este grupo de hidrocarburos, sin contar con su aromicidad, es su gran estabilidad y la dificultad de romper los enlaces entre sus carbonos.El mximo exponente de la familia de los hidrocarburos aromticos es el benceno (C6H6), pero existen otros ejemplos, como la familia de anulenos . Entre los exponentes ms importantes se encuentran los llamados BTEX, benceno, tolueno, etilbenceno y xileno, muy perjudiciales para la salud por estar implicados en numerosos tipos de cncer y que habrn de tomar muchas medidas al respecto en caso de fugas o derrames. 2.3.Hidrocarburos naftalnicos o hidrocarburos aromticos policclicos. Los hidrocarburos aromticos policclicos tambin conocidos por sus siglas, HAP's; estn constituidos por dos o ms anillos fusionados, con resonancia electrnica entre sus tomos de carbono. Los HAPs constituyen contaminantes orgnicos relacionados con las actividades humanas, en especial con aquellas derivadas del tratamiento y posterior combustin del petrleo y sus derivados. Son compuestos estables y altamente txicos, algunos potentes carcingenos y otros mutagnicos. Dentro de este subgrupo hay dos clases: los de bajo peso molecular que tienen de 2 a 3 anillos aromticos como el naftaleno, fluoreno, fenantreno y antraceno y derivados,
y los de alto peso molecular que tienen de 4 a 7 anillos aromticos como el criseno , que son relativamente 4inmviles y, por ende, de baja volatilidad. Estos compuestos se encuentran distribuidos en el suelo, mar, sistemas fluviales y sedimentos, su presencia se ha atribuido principalmente a los derrames de petrleo y descargas de plantas petroqumicas. Algo que es muy comn en cualquiera de los grupos de hidrocarburos expuestos ms arriba es la sustitucin de uno o varios de sus hidrgenos por otro tomo o grupos funcionales que se mencionarn ms adelante. La importancia de estas sustituciones, en el caso que nos ocupa radica que, ya que variar el comportamiento qumico de molcula, tambin lo har la facilidad con la que estos compuestos podrn ser degradados, tanto de forma natural como antrpica, una vez que hayan acabado en el medio. Las sustituciones ms habituales son: Por tomos halgenos .Tienen una alta densidad. Son usados en refrigerantes, disolventes, pesticidas, repelentes de polillas, en algunos plsticos y en funciones biolgicas (ejemplo: DDT, cloroformo, PCB, .) Por grupos hidroxilo (OH); formando el grupo de los llamados alcoholes. Son no polares y por lo que atrae a las molculas de agua. Tienen un punto de ebullicin elevado, por lo que se volatilizan con facilidad.Los alcoholes con alto peso molcular son solubles en agua. Por grupo carboxilo (COOH) dando lugar a los cidos carboxlicos, por lo general son solubles en agua. Tienen un fuerte olor desagradable y forman sales metlicas en las reacciones cidobase. Los steres son derivados de los cidos carboxlicos en los que OH del grupo carboxilo ha sido reemplazado por un O R de un alcohol. Tienen aromas fuertes y son voltiles. Los teres casi no son reactivos. No son solubles pero s son voltiles. La estructura del los teres es: ROR'; un tomo de oxgeno unido a dos grupos hidrocabonados. Fraccin de hidrocarburos separados por destilacin Fraccin Nmero de carbonos por molcula Rango de temperatura de ebullicin (C) Usos Gas 1 a 4 20 Calefaccin domstica, cocina, Gasolina 5 a 10 20 a 190 Fuel, benceno, Keroseno 11 a 13 190 a 260 Fuel, jet fuel, Diesel 14 a 18 260 a 360 Dieselfuel, fueloil,.. Gases pesados y aceites
lubricantes 19 a 40 360 a 530 Ceras, vaselinas, lubricantes,.. PROPIEDADES El comportamiento de los contaminantes en el medio es funcin de sus propiedades fisicoqumicas, dentro de las cuales se incluyen, esencialmente, la densidad, la solubilidad, la tensin de vapor; adems de las reacciones que sean propensos a sufrir y de la concentracin en la que estn. Conjuntamente, habr que considerar las caractersticas del medio que los rodea como son: el tipo de suelo, adsorcin, permeabilidad, tamao de las partculas, contenido de humedad y de materia orgnica, succin, profundidad del nivel del agua entre otros.
Densidad. Es la relacin entre la masa y la unidad de volumen. Atendiendo a esta caracterstica intrnseca, los compuestos orgnicos se pueden clasificar en dos grupos: 5Compuestos orgnicos ligero, que son aquellos cuya densidad es menor que la del agua. Compuestos orgnicos densos, que son aquellos que poseen una densidad mayor a la del agua. La densidad determina los procesos de transporte en el acufero, por ejemplo: los ligeros (aceites, gasolinas y el petrleo crudo) tienden a formar una capa en sobre el nivel fretico, movindose horizontalmente en la direccin del flujo del agua subterrnea; en cambio los densos (PCBs) migran hacia la base del acufero creando una columna a partir de la cual pueden viajar en la direccin del flujo de agua subterrnea . Presin de vapor, determina la rapidez o facilidad con la que un compuesto se volatiliza. Cuanta ms alta sea la presion de vapor de una sustancia mayor ser su tendencia a volatilizarse, as , la gasolina se evapora rpidamente, aunque est en poros y fracturas. Punto de ebullicin de algunos alcanos Alcano tomos de carbono Punto de ebullicin (C) Butano 4 0 Pentano 5 36 Hexano 6 69 Heptano 7 98 Octano 8 126 Nonano 9 151 Decano 10 174 Concentracin, es la cantidad de una sustancia dada que se encuentra disuelta en un volumen especfico de solvente, generalmente se representa en unidades de partes por milln para el caso de contaminantes en suelo
o agua. La concentracin de un hidrocarburo constituye el mecanismo ms relevante para el trasporte de los vapores de hidrocarburos desde el derrame flotando sobre el nivel esttico hasta la superficie de la tierra. Hay que considerarlo teniendo en cuenta los gradientes formados en las direcciones principales: x, y, z. Polaridad. Est referida a la existencia o no de una distribucin equitativa de las nubes electrnicas que forman varios enlaces. Si no es equitativa, una parte de la molcula ser ms positiva y la otra ser ms negativa, por tanto, la molcula se comporta como un dipolo. Si las nubes electrnicas estn igualmente distribuidas, decimos que la molcula es no polar. La polaridad depende de la electronegatividad de los tomos y la forma de la molcula.Los compuestos orgnicos contienen carbono e hidrgeno, y la leve diferencia que existe en electronegatividad entre ambos hace que la mayora de estos compuestos son no polares. Esto desemboca en una baja solubilidad de los mismos. Solubilidad en el agua. Con esta caracterstica, aparte de conocer lo propenso que va a ser un contaminante en medio acuoso, tambin nos va a dar una idea de su estabilidad, su bioacumulacin y su sorcin qumica en el ambiente.La alta solubilidad al agua de un compuesto qumico promueve su mayor movilidad, y es menos probable a ser acumulativo, bioacumulativo, voltil y persistente; un compuesto qumico altamente soluble es propenso a ser biodegradado y metabolizado por los microorganismos. Si por el contrario es poco soluble,tiene ms probabilidad de ser inmovilizado por va adsorcin y es menos mvil, ms bioacumulativo y persistente en los compartimentos ambientales La solubilidad de los hidrocarburos vara de acuerdo a sus caractersticas qumicas y fsicas que influyen de manera determinante en el transporte de tales compuestos hacia zonas profundas del subsuelo. 6Grupo de Hidrocarburo Hidrocarburo Representativo Solubilidad en agua (mgL1) nAlcanos C4 nbutano 61.4 C5 npentano 38.5 C6 nhexano 13.3 C7 nheptano 2.2 C8 noctano 0.43 C9 nnonano 0.12 C10C14 ndecano 0.05 Alcanos Ramificados C4 Isobutano 49 C5 Isopentano 48
C6 2metilpentano 78 C7 2metilhexano 2.54 C8 2,4dimetilhexano 1.29 C9 2,2,4trimetilhexano 0.53 Cicloalcanos C6 Ciclohexano 55 C7 Metilciclohexano 14 C8 1,2,4Trimetilciclopentano C9 1,1,3Trimetilciclohexano 1.77 Oleofinas C4 1buteno 222 C5 1pentano 148 C6 1hexano 69.7 Monoaromticos Benceno Benceno 1,760 Tolueno Tolueno 470 Xilenos mxilenos 172 Etil benceno Etilbenceno 140 C3bencenos 1,3,4trimetilbenceno 48.2 C4bencenos 1,4dietilbenceno 15 Fenoles Fenol Fenol 82,000 C1fenoles ocresol 31,000 C2fenoles 2,4dimetilfenol 4,600 C3fenoles 2,4,6trimetilfenol 14,000 C4fenoles metilfenol Los valores numricos de la solubilidad son los siguientes: solubilidad baja < de 10 ppm solubilidad media entre 10 y 1000 ppm 7solubilidad alta >1000 ppm
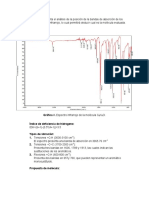
Estructura y propiedades de algunos hidrocarburos aromticos y aromticos policclicos
NOMBRE PESO MOLECULAR SOLUBILIDAD EN AGUA (mg/l) COEFICIENTE DE PARTICIN SUELOAGUA Benceno 78.11 1780 97 Tolueno 92.1 500 242 Ortoxileno 106.17 170 363 Etilbenceno 106.17 150 622 Naftaleno 128.16 31.7 1300 Acenafteno 154.21 3.93 2580 Acenaftileno 152.2 3.93 3814 Fluoreno 166.2 1.98 5835 Fluoroanteno 202 0.275 19000 Fenantreno 178.23 1.29 23000 Antraceno 178.23 0.073 26000 Pireno 202.26 0.135 63000 Benzoantraceno 228 0.014 125.719 Benzopireno 252.3 0.0038 282.185 Criseno 228.2 0.006 420.108 Benzofluoroanteno 252 0.0012 1148497 Dibenzoantraceno 278.35 0.00249 1668800
Los hidrocarburos son compuestos orgnicos formados exclusivamente por carbono e hidrgeno.
Los hidrocarburos se clasifican en: Hidrocarburos saturados, llamados tambinalcanos, que presentan enlaces sencillos. Los alquenos, que tienen enlaces dobles y los alquinos, con enlaces triples.
Explora los enlaces con el cursor
Alcanos: Los tomos de carbono de un alcano pueden ser clasificados como: tomo primario cuando se unen a un carbono, secundario, si se unen a dos carbonos, terciario, si se unen a tres o cuaternario si se unen a cuatro.
Explora los elementos en rojo con el cursor
Propiedades
Fsicas
de
los
alcanos:
Punto de ebullicin: el punto de ebullicin aumenta con el tamao del alcano porque las fuerzas intermoleculares (fuerzas de Van der Waals y de London), son ms efectivas cuando la molcula presenta mayor superficie. Es as, que los puntos de fusin y ebullicin van a aumentar a medida que se incrementa el nmero de tomos de carbono.
Punto de Ebullicin
PUNTO DE EBULLICION Los alcanos que se presentan a la izquierda, tienen el mismo nmero de carbonos pero sus puntos de ebullicin son distintos. Esto se debe a que la superficie efectiva de contacto entre dos molculas disminuye cuanto ms ramificadas sean stas. Las fuerzas intermoleculares son menores en los alcanos ramificados por ello tienen puntos de ebullicin ms bajos. Isomeros C5H12 Puntos ebullicin de
Punto de fusin: El punto de fusin tambin aumenta con el tamao del alcano por la misma razn que aumenta el punto de ebullicin. Los alcanos con nmero impar de carbonos se empaquetan en una estructura cristalina y poseen puntos de ebullicin un poco menores de lo esperados en los pares.
Punto de Fusin
Densidad: a medida que aumenta el nmero de carbonos, las fuerzas intermoleculares son mayores y por lo tanto la cohesin intermolecular. Esto da como resultando un aumento de la proximidad molecular y, por tanto, de la densidad.
Densidad del estado liquido
Solubilidad: Los alcanos por ser compuestos apolares no se disuelven en agua, sino en solventes no polares como el benceno, ter y cloroformo. A temperatura ambiente es posible encontrar alcanos en diferentes estados fsicos as: De metano a butano son gaseosos. De pentano a hexadecano son lquidos De heptadecano en adelante son slidos.
Propiedades qumicas Oxidacin completa (Combustin): los alcanos se oxidan en presencia de aire u oxgeno y el calor de una llama, produciendo dixido de carbono, luz no muy luminosa y calor. Ese calor emitido puede ser calculado y se denomina calor de combustin. Consideremos la combustin de gas etano (C2H6). Esta reaccin consume oxgeno (O2) y produce agua (H2O) y dioxido de carbono (CO2). La ecuacin qumica es la siguiente: Si contamos el nmero de tomos de cada elementos de los compuestos reaccionantes y de los productos notaremos que en la ecuacin hay dos veces ms
tomos de carbono en los reactivos que en los productos: Para solucionar y acercarnos tericamente a lo que sucede en la realidad, debe realizarse el balanceo de la ecuacin, esto puede realizarse de la siguiente manera con base en el nmero de carbonos del alcano:
Ejemplo:
Una vez balanceada la ecuacin es posible calcular el calor de combustin ( alcano.
) en Kcal/mol de un
El nmero de electrones de valencia se calcula sumando los electrones de valencia de los hidrgenos + los electrones de valencia de los carbonos. As: el hidrgeno tiene 1 electrn de valencia.El carbono tiene 4 electrones de valencia. Como un alcano tiene n carbonos y su frmula general es CnH2n+2 : 4 x n x 1 x (2n+2) para luego sumar: 4n + 2n + 2 De la ecuacin resulta que el nmero de electrones de valencia para los alcanos es igual a 6n + 2. As para calcular el calor de combustin de un alcano. compuesto, basta aplicar la frmula: = (6n + 2) x 26,05 Kcal/mol Para calcular el calor de combustin del etano: : cantidad producida al quemar un mol del
n=2 6n + 2 = = 14 x 26,05 = 346,7 Kcal/mol.
14
CALCULO DE CALOR DE COMBUSTION Pirlisis o cracking: este es un proceso usado en la industria petrolera y consiste en pasar un alcano pesado por tubos calentados de 500 a 800 C lo que permite que el compuesto se descomponga enalquenos e hidrgeno. Halogenacin: Los alcanos halgenos, en presencia de desde 250C hasta 400 C, halogenados al sustituir uno tomos del halgeno. reaccionan con los luz solar o ultravioleta produciendo derivados o ms hidrgenos por
La halogenacin ocurre en tres etapas que se ejemplificaran con la reaccin de cloracin del metano:
Primera etapa: la energa luminosa o calrica produce la disociacin de la molcula de cloro en dos tomos.
(58 Kcal) indica la cantidad de energa necesaria para romper el enlace.
Segunda etapa: sustitucin del hidrgeno por el cloro
Tercera etapa: Se unen los radicales libres.
Ecuacin neta: = - 25 Kcal por cada mol de metano convertido en cloro-metano, siendo por lo tanto una reaccin exotrmica.
Nitratacin: Los alcanos en estado gaseoso reaccionan con vapores de cido ntrico a 420C para producir nitroderivados, la accin fuertemente oxidante del cido ntrico transforma gran parte del alcano en dixido de carbono y agua.
Cicloalcanos: Propiedades fsicas: Tienen puntos de ebullicin y puntos de fusin ms altos y densidades mayores que los correspondientes alcanos acclicos lineales, debido probablemente a su mayor rigidez y simetra que permiten unas fuerzas intermoleculares de atraccin (London) ms efectivas.
Punto de Ebullicin
Punto de fusin
Densidad
Los Alquenos u olefinas: constituyen una serie homloga que se caracteriza por la presencia de un doble enlace entre sus carbonos, lo que los distingue como hidrocarburos insaturados. Propiedades fsicas de los alquenos: las propiedades fsicas de los alquenos son semejantes a la de los alcanos. Al igual que los alcanos pueden encontrarse compuestos en estado gaseoso como el eteno, 1-buteno y sus ismeros son gaseosos. A partir de 5 carbonos los compuestos son lquidos. Polaridad de la molcula
Cis-2- butano.Momento bipolar neto
Trans-2-buteno Momento bipolar nulo
La polaridad de la molcula depende de la estereoqumica del alqueno. En los ismeros geomtricos, el ismero Cis, por ser ms polar y acomodarse ms perfectamente en el retculo cristalino, generalmente presenta punto de ebullicin ms elevado y punto de fusin menor que el ismero Trans. Propiedades Qumicas de los alquenos: Los alquenos no se pueden catalogar como cidos pero sus propiedades cidas son un milln de veces mayores que las de los alcanos. En las reacciones qumicas a la derecha, se observa un mayor desplazamiento del equilibrio por perdida de protones del -44 -50 etileno (K=10 ), en comparacin con el etano (K= 10 )
El etileno permite preparar unos 50 derivados simples de gran importancia industrial, de los que los ms importantes, en miles de toneladas anuales de produccin. Propiedades Fsicas de los Alquinos: Los alquinos tienen propiedades fsicas parecidas a los alcanos y alquenos correspondientes, como se observa en la siguiente tabla: Punto fusin C -138,3 -185,0 -122,5 de Punto de Energa de enlace ebullicin C distintivo -0,5 -0,3 8,1 C-C: 83 Kcal/mol C=C: 173 Kcal/mol : 229 Kcal/mol
Compuesto Butano 1-buteno 1-butino
Los alquenos pueden encontrarse como gases a temperatura ambiente como el etino, el propino y el 1butino. A partir del 2-butino los alquinos son lquidos. Son menos insolubles en agua que los alcanos y los alquenos, esto debido a una la atraccin que experimentan los tomos de hidrgeno del agua por los electrones del triple enlace. El conocimiento de las propiedades fsicas y qumicas tiene importancia prctica no slo en el manejo de las sustancias en el laboratorio, sino tambin en la industria y el hogar o donde se manipulan compuestos qumicos. El acetileno por ejemplo es el alquino ms inestable, lo que hace difcil su almacenamiento, cuando se somete a presin o a la presencia de cobre se desdobla en sus elementos constitutivos generando una fuerte explosin. Propiedades qumicas de los alquinos: los alquinos terminales se comportan como cidos porque, en presencia de bases fuertes, pueden ceder un protn. Por ejemplo: El amiduro sdico puede arrancar el protn de un acetileno.
Vous aimerez peut-être aussi
- Espectros InfrarrojoDocument14 pagesEspectros InfrarrojoMaira Alejandra Cubillos TorresPas encore d'évaluation
- IEA CatalogoDocument197 pagesIEA CatalogonarcisorsPas encore d'évaluation
- TYRO - CompletoDocument593 pagesTYRO - CompletoRodrigo Lara Marrugo100% (3)
- Elucidacion EstructuralDocument13 pagesElucidacion EstructuralAlbertoCaceresMuñozPas encore d'évaluation
- AMORTDocument2 pagesAMORTFrancisco Daniel Montes RomeroPas encore d'évaluation
- Balero SDocument2 pagesBalero SFrancisco Daniel Montes RomeroPas encore d'évaluation
- Guia de Examen de I.ODocument3 pagesGuia de Examen de I.OFrancisco Daniel Montes RomeroPas encore d'évaluation
- Solicitud de CreditoDocument1 pageSolicitud de CreditoFrancisco Daniel Montes RomeroPas encore d'évaluation
- Andrés Sánchez MagallanesDocument7 pagesAndrés Sánchez MagallanesFrancisco Daniel Montes RomeroPas encore d'évaluation
- Precios de RepsetDocument2 pagesPrecios de RepsetFrancisco Daniel Montes RomeroPas encore d'évaluation
- Formato de CreditoDocument2 pagesFormato de CreditoFrancisco Daniel Montes RomeroPas encore d'évaluation
- El Sacerdocio Levitico Del at y El PastoDocument5 pagesEl Sacerdocio Levitico Del at y El PastoFrancisco Daniel Montes RomeroPas encore d'évaluation
- ReporteDocument22 pagesReporteFrancisco Daniel Montes RomeroPas encore d'évaluation
- Listado de productos con precios de costo e importesDocument1 pageListado de productos con precios de costo e importesFrancisco Daniel Montes RomeroPas encore d'évaluation
- Balero SDocument2 pagesBalero SFrancisco Daniel Montes RomeroPas encore d'évaluation
- Libro 1Document4 pagesLibro 1Francisco Daniel Montes RomeroPas encore d'évaluation
- Cotizacion Agustin PachecoDocument4 pagesCotizacion Agustin PachecoFrancisco Daniel Montes RomeroPas encore d'évaluation
- PatyDocument1 pagePatyFrancisco Daniel Montes RomeroPas encore d'évaluation
- Pedido RoaDocument4 pagesPedido RoaFrancisco Daniel Montes RomeroPas encore d'évaluation
- CelsoDocument1 pageCelsoFrancisco Daniel Montes RomeroPas encore d'évaluation
- Posible Pedido C. Del .GDocument2 pagesPosible Pedido C. Del .GFrancisco Daniel Montes RomeroPas encore d'évaluation
- Lista precios repuestosDocument432 pagesLista precios repuestosFrancisco Daniel Montes Romero100% (1)
- CelsoDocument1 pageCelsoFrancisco Daniel Montes RomeroPas encore d'évaluation
- Inventario de Bienes UtilitariosDocument1 pageInventario de Bienes UtilitariosFrancisco Daniel Montes RomeroPas encore d'évaluation
- PatyDocument1 pagePatyFrancisco Daniel Montes RomeroPas encore d'évaluation
- Reporte de ventas negadas de refacciones con menos deDocument2 pagesReporte de ventas negadas de refacciones con menos deFrancisco Daniel Montes RomeroPas encore d'évaluation
- PatyDocument1 pagePatyFrancisco Daniel Montes RomeroPas encore d'évaluation
- Importancia de La Administración Del Mantenimiento de Los Equipos en La Industria.Document2 pagesImportancia de La Administración Del Mantenimiento de Los Equipos en La Industria.Gerardo Alanis63% (8)
- SAZH620721UF8FFE13004Document1 pageSAZH620721UF8FFE13004Francisco Daniel Montes RomeroPas encore d'évaluation
- Mantenimiento (14) CatorceDocument14 pagesMantenimiento (14) CatorceFrancisco Daniel Montes RomeroPas encore d'évaluation
- Administración de MantenimientoDocument9 pagesAdministración de MantenimientoCésarRenatoCopacondoriCuaylaPas encore d'évaluation
- SAZH620721UF8FFE13007Document2 pagesSAZH620721UF8FFE13007Francisco Daniel Montes RomeroPas encore d'évaluation
- SAZH620721UF8FFE13004Document1 pageSAZH620721UF8FFE13004Francisco Daniel Montes RomeroPas encore d'évaluation
- Serie Aromáticos!!!Document4 pagesSerie Aromáticos!!!alan abanPas encore d'évaluation
- Taller Compuestos Aromaticos.Document4 pagesTaller Compuestos Aromaticos.glagarbe271100% (1)
- Informe Hidrocarburos Aromaticos Chamaco Mamani Leslie LisbethDocument15 pagesInforme Hidrocarburos Aromaticos Chamaco Mamani Leslie LisbethJhoselyn Isabel Usmayo QuispePas encore d'évaluation
- TP 9 Resuelto - AromaticosDocument9 pagesTP 9 Resuelto - AromaticosPia AmablePas encore d'évaluation
- Tarea 2 - Hidrocarburos Aromáticos, Alcoholes y Aminas 100416 - 51Document15 pagesTarea 2 - Hidrocarburos Aromáticos, Alcoholes y Aminas 100416 - 51Mila Gomez Badillo50% (2)
- El Clotrimazol FarmacodinamiaDocument7 pagesEl Clotrimazol FarmacodinamiaEmmanuel Minimal LesedPas encore d'évaluation
- 02.09-Pdf-Power - Comp - Bencenicos o AromáticosDocument19 pages02.09-Pdf-Power - Comp - Bencenicos o AromáticosNicole de la RosaPas encore d'évaluation
- Grupos Activadodes y DesactivadoresDocument7 pagesGrupos Activadodes y DesactivadoresBennett Valverde Cristian JairoPas encore d'évaluation
- Actividad 7: INSATURADOS Y AROMATICOSDocument7 pagesActividad 7: INSATURADOS Y AROMATICOSSamuel YepesPas encore d'évaluation
- Práctica 4Document6 pagesPráctica 4José Luis ValenciaPas encore d'évaluation
- Quimica 3Document5 pagesQuimica 3Juan Pablo MachadoPas encore d'évaluation
- P02 - La Industria de Los Colorantes y PigmentosDocument9 pagesP02 - La Industria de Los Colorantes y PigmentosClaudia Gianella Ramirez NoblecillaPas encore d'évaluation
- La Degradación de Tolueno Por Las Enzimas de Escisión en OrtoDocument27 pagesLa Degradación de Tolueno Por Las Enzimas de Escisión en OrtoWoming X IOnPas encore d'évaluation
- Alquinos, PolienosDocument19 pagesAlquinos, PolienosMaria Chantal CarballoPas encore d'évaluation
- (Lescano, 2009) Las Palabras en El Texto DisciplinarDocument16 pages(Lescano, 2009) Las Palabras en El Texto DisciplinarLucia ZanfardiniPas encore d'évaluation
- Diapositivas Tema 2. Compuestos AromáticosDocument7 pagesDiapositivas Tema 2. Compuestos AromáticosTonyFontanaPas encore d'évaluation
- Act - Mapa Mental BencenoDocument1 pageAct - Mapa Mental BencenoAri AnzuresPas encore d'évaluation
- 12 Compuestos OrganicosDocument122 pages12 Compuestos OrganicosNicolas Patricio SitjaPas encore d'évaluation
- Hidrocarburos AromaticosDocument6 pagesHidrocarburos AromaticosJuan Alex Osorio RomanPas encore d'évaluation
- P XilenoDocument39 pagesP XilenomagdaPas encore d'évaluation
- YodobencenoDocument2 pagesYodobencenocatfrancis100% (1)
- 3 Sintesis de FarmacosDocument54 pages3 Sintesis de FarmacosMargot Mendoza SalasPas encore d'évaluation
- AromaticosDocument6 pagesAromaticosDamir Ojeda JusayuPas encore d'évaluation
- Compuestos HeterociclicosDocument43 pagesCompuestos HeterociclicosEder Aquino Galarza100% (2)
- Equipo #2 Caracteristicas Fisicas, Quimicas y Biologicas de Las Rocas GeneradorasDocument20 pagesEquipo #2 Caracteristicas Fisicas, Quimicas y Biologicas de Las Rocas GeneradorasRoberto Montiel Arias100% (2)
- Síntesis y Propiedades de ColorantesDocument7 pagesSíntesis y Propiedades de ColorantesAndres AlvarezPas encore d'évaluation
- Cloración aromáticaDocument3 pagesCloración aromáticaValeria Gutierrez LopezPas encore d'évaluation