Académique Documents
Professionnel Documents
Culture Documents
Relatorio de Quimica Analitica
Transféré par
Camila MoraisCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Relatorio de Quimica Analitica
Transféré par
Camila MoraisDroits d'auteur :
Formats disponibles
UNIVERSIDADE TECNOLGICA FEDERAL DO PARAN CURSO DE ENGENHARIA AMBIENTAL DISCIPLINA DE QUMICA ANALTICA
CAMILA CRISTINA DE MORAIS CUNHA EDSON STUPP ELIZABETI ROSSETTI JSSICA MAIARA VICELI
AULA PRTICA DE QUMICA ANALTICA N4 TITULAO DE UM CIDO FORTE BASE FORTE
FRANCISCO BELTRO - PR 2013
CAMILA CRISTINA DE MORAIS CUNHA EDSON STUPP ELIZABETI ROSSETTI JSSICA MAIARA VICELI
AULA PRTICA DE QUMCA ANALTICA N1 TITULAO DE UM CIDO FORTE BASE FORTE
Relatrio da disciplina de Qumica Analtica, apresentado como requisito parcial aprovao no curso de Engenharia Ambiental, da Universidade Tecnolgica Federal do Paran Cmpus Francisco Beltro PR. Professora: Ivane Benedetti Tonial. FRANCISCO BELTRO - PR 2013
Sumrio 1. INTRODUO ...................................................................................................... 2 2. OBJETIVO ............................................................................................................ 3 3. MATERIAIS: ......................................................................................................... 3 4. EQUIPAMENTOS: ................................................................................................ 3 5. MTODOS:........................................................................................................... 3 5.1. 5.2. Titulao com Vermelho de Metila .................................................................... 4 Titulao com Fenolftalena .............................................................................. 4
6. RESULTADOS E DISCUSSES .......................................................................... 4 7. CONCLUSO ....................................................................................................... 8 8. REFERNCIAS .................................................................................................... 9
1. INTRODUO O objetivo da titulao de uma soluo bsica com uma soluo padronizada de um acido a determinao da quantidade exata de cido. O ponto em que isto ocorre o ponto de equivalncia. Se o cido e a base forem eletrlitos fortes, a soluo ser neutra (pH 7); Se o cido ou a base forem um eletrlito fraco, a soluo ser ligeiramente bsica ou ligeiramente cida. (VOGEL, 2002) A titulao de cido forte com base forte apresenta um clculo simples, durante o incio da titulao o valor do pH tende a subir lentamente, quando este chega no ponto estequiomtrico, o pH tem uma mudana brusca passando por pH 7, ento volta a subir lentamente. o grfico de pH conhecido como curva de neutral izao( ou curva de titulao). Esta curva pode ser levantada experimentalmente pela determinao do pH durante a titulao por um mtodo potenciomtrico ou ento, calculada a partir de princpios tericos. (VOGEL, 2002) Os reagentes padro utilizados nas titulaes cidos bases so sempre cidos ou bases fortes, sendo que os cidos e bases fracos nunca so empregados como reagentes padro porque reagem de forma incompleta com os analitos. (SKOOG, 2006) Podemos encontrar dois tipos de erro em titulaes cidos/bases: O primeiro erro determinado o que ocorre quando o pH no qual o indicador muda de cor difere do pH do ponto de equivalncia; o segundo tipo corresponde a um erro indeterminado, que originado da habilidade limitada da nossa viso em distinguir reprodutivelmente a cor intermediaria do indicador. (SKOOG, 2006) Uma forma tpica de pHmetro de vidro, apresenta forma de tubo de ensaio terminando em um bulbo de vidro de paredes delgadas sensveis ao pH. Toda via apresenta limitaes definidas, pois a superfcie do vidro pode absorver seletivamente alguns ons especficos, o que podem causar erros na medida, geralmente uma cuidadosa lavagem evita dificuldades. (EWING, 1972)
2. OBJETIVO
Determinar o Ponto de Equivalncia e conhecer a concentrao exata do cido Clordrico (HCl); Observar a diferena na zona de viragem, com a utilizao de diferentes indicadores.
3. MATERIAIS:
gua destilada; Indicador fenolftalena; Indicador vermelho de metila; Soluo de cido Clordrico (HCl), de concentrao 0,1 Mol/L; Soluo de Hidrxido de Sdio (NaOH), de concentrao 0,1 Mol/L.
4. EQUIPAMENTOS:
Becker; Bureta; Erlenmeyers; Pera; Pipeta graduada; pHmetro; Suporte universal;
5. MTODOS:
Fez-se a calibrao o pHmetro: retirou-se o eletrodo da soluo de descanso (Cloreto de Potssio), lavou-se o eletrodo com gua destilada, o aparelho requisitou a soluo tampo de pH 7 e lavando-o novamente, o aparelho soluo uma nova soluo tampo sendo essa de pH 4. O pHmetro acusou 97,47 % de preciso.
3
Em seguida verificou-se a limpeza da bureta com o teste do filme homogneo usando gua destilada, que indicou que a mesma estava limpa.
5.1.
Titulao com Vermelho de Metila
Mediu-se 25mL de cido Clordrico (HCl) de 0,1 Mol/L com o auxlio da pipeta graduada e da pera, transferindo-a para um erlenmeyer , utilizando o pHmetro constatou-se que o pH foi de 1,16. Adicionou-se na soluo de cido Clordrico 3 gotas do indicador vermelho de metila. Encheu-se a bureta com a soluo padro de Hidrxido de Sdio (NaOH) de 0,1 Mol/L com fator de correo de 0,99. Previamente fez-se o clculo para saber o volume necessrio para a neutralizao total do cido, obteve-se o valor aproximado de 25mL de NaOH. Posicionou-se o erlenmeyer para a titulao. A cada 5mL da NaOH adicionado na soluo de HCl, media-se o pH, fezse sucessivamente at o ponto de viragem que ocorreu em aproximadamente 27mL. Aps a viragem, continuou-se com a adio do NaOH e a verificao do pH, para a construo da curva de titulao.
5.2.
Titulao com Fenolftalena
Fez-se o procedimento com o uso de 3 gotas indicador fenolftalena na soluo de cido Clordrico. Posicionou-se o erlenmeyer para a titulao. A cada 5mL da NaOH adicionado na soluo de HCl, media-se o pH, fez-se sucessivamente at o ponto de viragem que ocorreu em aproximadamente 26,5mL. Aps a viragem, continuou-se com a adio do NaOH e a verificao do pH, para a construo da curva de titulao.
6. RESULTADOS E DISCUSSES
(
(
)
)
[ [
] ]
( (
( ) ( [ (
) ) ] )
1.
Clculo para saber aproximadamente o ponto de viragem.
2.
3.
) (
4.
) (
5.
) (
6.
) (
7.
) (
A partir do ponto de equivalncia, calcula-se a concentrao de soluo utilizando a seguinte formula:
[ ] ( ) ( ( ) )
na
8.
]
5
9.
10.
11.
12.
Na primeira titulao utilizando o indicador Vermelho de Metila houve erro, pois os clculos mostravam uma viragem no volume de 25mL sendo que foi verificado o pH no pHmetro foi de pH 2,58 e continuando a titulao no ponto de equivalncia pelo indicador havendo a mudana de cor o pH indicado pelo pHmetro foi de 10,63. Na segunda titulao utilizando a Felnoftalena, o erro ocorrido foi quando o hidrxido de sdio atingiu o volume necessrio para a viragem, houve mudana na cor, mas no no pH, o cido clordrico deveria atingir o pH 7 e atingiu o pH 6,68, onde no aconteceu a neutralizao total.
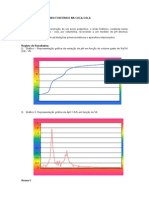
Curvas de titulao de HCl com NaOH.
14
12 10 8 pH Fenolftalena 6 4 2 0 0 10 20 30 40 50 60 Volume de NaOH 0,1 mol L =0,99 (grafico 1) Vermelho de metila Calculo
Indicador Vermelho de Metila Volume NaOH mL pH 0 1,16 5 1,27 10 1,44 15 1,63 20 1,9 25 2,58 27 10,63 30 11,85 35 12,21 40 12,37 45 12,48 Quadro 1
Clculo Volume NaOH mL 0 5 10 15 20 25 30 35 40 45 Quadro 2
Indicador Fenolftalena
pH 1 1,17 1,36 1,60 1,95 7 11,95 12,22 12,36 12,45 Volume NaOH mL 0 5 10 15 20 25 26,5 30,5 35 40 45 Quadro 3 pH 1,18 1,3 1,46 1,66 1,93 2,62 6,68 11,87 12,2 12,37 12,45
7. CONCLUSO
No inicio do procedimento, refez-se a calibrao do pHmetro, pois o mesmo no apresentou a opo pH. E no fim dos experimentos percebeu-se que os indicadores apresentam faixa de viragem diferentes. Aps as experincias e os clculos realizados, notou-se diferentes valores do pH da titulao pratica terico, no entanto a curva de titulao ficou prxima ao calculado e ao realizado.
8. REFERNCIAS
A. Skoog, D., M. West, D., Holler, J., & R. Crouch, S. (2006). Fundamentos da Qumica Analtica. So Paulo: Cengage Learning. Ewing, Galen Wood.(1972). Mtodos Instrumentais de Anlise Qumica. So Paulo. Edgard Blucher.
Vogel, A. I., Mendham, J., Denney, R. C., Barnes, J. D., & Thomas, M. J. (2002). Anlise Qumica Quantitativa. Rio de Janeiro: LTC.
Vous aimerez peut-être aussi
- Princípios de química analítica: Abordagem teórica qualitativa e quantitativaD'EverandPrincípios de química analítica: Abordagem teórica qualitativa e quantitativaÉvaluation : 5 sur 5 étoiles5/5 (1)
- Hoodoo FeitiçosDocument45 pagesHoodoo FeitiçosEduardo Hortenciano83% (12)
- Uma Licao de Vida Meir SchneiderDocument162 pagesUma Licao de Vida Meir SchneiderOswaldo Ayres SanchiniPas encore d'évaluation
- Relatório Solução TampãoDocument8 pagesRelatório Solução TampãoGizeleLannayPas encore d'évaluation
- Honda New Civic 1.8 2006Document3 pagesHonda New Civic 1.8 2006Pedro Almeida Junior100% (1)
- Laudo Talha ARTDocument3 pagesLaudo Talha ARTAnonymous zhGvQ867% (3)
- Preparo e padronização de solução de NaOH 0,1 mol L-1Document9 pagesPreparo e padronização de solução de NaOH 0,1 mol L-1Franciellen CostaPas encore d'évaluation
- Teoria Da Personalidade e Do ComportamentoDocument37 pagesTeoria Da Personalidade e Do ComportamentoElisângela de AlbuquerquePas encore d'évaluation
- Chef Flexivel - 100 Receitas para Bater Os MacrosDocument131 pagesChef Flexivel - 100 Receitas para Bater Os MacrosallonsoPas encore d'évaluation
- Neurotransmissores, Neuroreceptores e Neuromoduladores.Document9 pagesNeurotransmissores, Neuroreceptores e Neuromoduladores.Júnia CarvalhoPas encore d'évaluation
- Ficha de Segurança Fordor 750 WGDocument9 pagesFicha de Segurança Fordor 750 WGMarcelo TavaresPas encore d'évaluation
- Engenharia de Alimentos UFAPEDocument20 pagesEngenharia de Alimentos UFAPEJacinta OliveiraPas encore d'évaluation
- Determinação do pH de substânciasDocument12 pagesDeterminação do pH de substânciasGeise Mezzari100% (1)
- Guia para iniciantes no Muay ThaiDocument18 pagesGuia para iniciantes no Muay ThaiDoutor NordsonPas encore d'évaluation
- Determinação da acidezDocument6 pagesDeterminação da acidezFernanda SilvaPas encore d'évaluation
- Relatório - Volumetria de NeutralizaçãoDocument19 pagesRelatório - Volumetria de NeutralizaçãoGabi Bitto86% (7)
- Psicologia e ReligiãoDocument7 pagesPsicologia e ReligiãoFranciscoWalissonPas encore d'évaluation
- Império Romano - História A/ 10.º AnoDocument8 pagesImpério Romano - História A/ 10.º AnoCarlos Vicente100% (3)
- Titulação Ácido PolipróticoDocument8 pagesTitulação Ácido PolipróticoMarcoPas encore d'évaluation
- TitulaçãoDocument7 pagesTitulaçãoLetyJoaquinaPas encore d'évaluation
- Experimento 11 - Giovana Jabur Teixeira e Cleidiane Aparecida AraújoDocument6 pagesExperimento 11 - Giovana Jabur Teixeira e Cleidiane Aparecida AraújoGiovana JaburPas encore d'évaluation
- Potenciometria de NeutralizaçãoDocument12 pagesPotenciometria de NeutralizaçãoFlavia MelloPas encore d'évaluation
- Curva de Titulação de Ácido Forte Com Base ForteDocument13 pagesCurva de Titulação de Ácido Forte Com Base ForteJulio GonçalvesPas encore d'évaluation
- Determinação da acidez em leite por titulação com NaOHDocument22 pagesDeterminação da acidez em leite por titulação com NaOHJennifer0% (1)
- Relatorio Aula PraticaDocument6 pagesRelatorio Aula PraticaBielPas encore d'évaluation
- PRÁTICA V– DETERMINAÇÃO DO PH DE SOLUÇÕES SALINASDocument9 pagesPRÁTICA V– DETERMINAÇÃO DO PH DE SOLUÇÕES SALINASjuliofreitassbPas encore d'évaluation
- Titulação Ácido Base Determina Concentração VinagreDocument8 pagesTitulação Ácido Base Determina Concentração VinagreAmanda AlvesPas encore d'évaluation
- Relatorio Analitica FarmaciaDocument8 pagesRelatorio Analitica FarmaciaLauriene RibeiroPas encore d'évaluation
- Relatório Acidos e BasesDocument13 pagesRelatório Acidos e Basesdrex4538Pas encore d'évaluation
- Relatório - Soluções-TampãoDocument7 pagesRelatório - Soluções-TampãoMarcela SilvaPas encore d'évaluation
- Relatório - Química Experimental - Determinação Da Acidez Do VinagreDocument7 pagesRelatório - Química Experimental - Determinação Da Acidez Do VinagreColoristajr33% (3)
- Determinação da constante de dissociação do indicador vermelho de metila por espectrofotometriaDocument7 pagesDeterminação da constante de dissociação do indicador vermelho de metila por espectrofotometriaangiegelainPas encore d'évaluation
- Curvas de pH e determinação do ponto de neutralizaçãoDocument15 pagesCurvas de pH e determinação do ponto de neutralizaçãoBruno ThomaziniPas encore d'évaluation
- Determinação da acidez total em frutas cítricasDocument9 pagesDeterminação da acidez total em frutas cítricasEmílioDosSantosPas encore d'évaluation
- Apostila Bioquimica Aplicada 2011Document32 pagesApostila Bioquimica Aplicada 2011Vanessa NeresPas encore d'évaluation
- Medição de pH de SoluçõesDocument9 pagesMedição de pH de SoluçõesThais FerreiraPas encore d'évaluation
- Ácido fosfórico Coca-ColaDocument9 pagesÁcido fosfórico Coca-ColaKiany SirleyPas encore d'évaluation
- Relatório de Química Analítica - Barbarah e ItaloDocument7 pagesRelatório de Química Analítica - Barbarah e ItaloItalo SoaresPas encore d'évaluation
- RELATORIO 4 - Dosagem Do Ácido Acetilsalicílico (AAS) em Medicamentos Por Potenciometria IndiretaDocument12 pagesRELATORIO 4 - Dosagem Do Ácido Acetilsalicílico (AAS) em Medicamentos Por Potenciometria IndiretaRaphael Brigagão100% (1)
- Relatório 6Document12 pagesRelatório 6Lucas Correia CassianiPas encore d'évaluation
- Relatório Soluções Tampão TLBDocument10 pagesRelatório Soluções Tampão TLBMafalda TeixeiraPas encore d'évaluation
- Curva de Titulação de Ácido AcéticoDocument9 pagesCurva de Titulação de Ácido AcéticoAnonymous lI98QT100% (1)
- Relatório do Trabalho Prático de Química Aplicada sobre Titulação de Ácido AcéticoDocument13 pagesRelatório do Trabalho Prático de Química Aplicada sobre Titulação de Ácido AcéticoPedro GasparPas encore d'évaluation
- Padronização de soluções de NaOH e HCl e determinação do teor de ácido acético em vinagre por titulação potenciométricaDocument7 pagesPadronização de soluções de NaOH e HCl e determinação do teor de ácido acético em vinagre por titulação potenciométricaVitoriaPas encore d'évaluation
- Relatorio Apl 2.1 - AcidooubaseDocument6 pagesRelatorio Apl 2.1 - Acidooubaserebordosa4Pas encore d'évaluation
- Química 12ºanoDocument12 pagesQuímica 12ºanoDaniela CoelhoPas encore d'évaluation
- Relatórios química analíticaDocument21 pagesRelatórios química analíticaanygabrielly.bcPas encore d'évaluation
- Acido BaseDocument6 pagesAcido BasejustroherPas encore d'évaluation
- Titulação de Ácido-BaseDocument3 pagesTitulação de Ácido-BaseMatilde HenriquePas encore d'évaluation
- Padronização de Soluções de Ácidos e BasesDocument18 pagesPadronização de Soluções de Ácidos e BasesDaniela SilvaPas encore d'évaluation
- Relatório Prática IFRNDocument4 pagesRelatório Prática IFRNEmanuele VitóriaPas encore d'évaluation
- Medidas de pH em águasDocument13 pagesMedidas de pH em águasJamile De Souza Silva100% (1)
- Relatorio de Quimica - TAMPAODocument11 pagesRelatorio de Quimica - TAMPAOFilipa MendesPas encore d'évaluation
- E7 EquilibrioDocument2 pagesE7 EquilibrioWestrup01Pas encore d'évaluation
- Relatorio 1 - Preparo e Padronizaçao de NaOH e HCL - ConcluidoDocument9 pagesRelatorio 1 - Preparo e Padronizaçao de NaOH e HCL - Concluidojeneffer alice reisPas encore d'évaluation
- Upo 1Document17 pagesUpo 1j rp (drive livros)Pas encore d'évaluation
- Volumetria ácido-baseDocument6 pagesVolumetria ácido-baseNatália Lussari VrechPas encore d'évaluation
- Relatório 1 - Quimica AnaliticaDocument11 pagesRelatório 1 - Quimica AnaliticaHemerson DanyelPas encore d'évaluation
- Relatorio Qa 10-DezDocument13 pagesRelatorio Qa 10-DezMarta LealPas encore d'évaluation
- Análises de frutas e hortaliçasDocument59 pagesAnálises de frutas e hortaliçasFabiano Tavares de MouraPas encore d'évaluation
- Química - Titulação Ácido-BaseDocument14 pagesQuímica - Titulação Ácido-BaseSato DanPas encore d'évaluation
- Volumetria ácido-base: exercícios de titulação e determinaçõesDocument7 pagesVolumetria ácido-base: exercícios de titulação e determinaçõesPaulinha Paula PaulinoPas encore d'évaluation
- Titulação potenciométrica de HCl e CH3COOHDocument14 pagesTitulação potenciométrica de HCl e CH3COOHMilena LimaPas encore d'évaluation
- PotenciometriaDocument4 pagesPotenciometriaAlexandre Sâmio0% (1)
- Balanceamento Por TitulaçãoDocument3 pagesBalanceamento Por TitulaçãoTallton Chalaco La CerdaPas encore d'évaluation
- Experimento 3Document10 pagesExperimento 3Cida LimaPas encore d'évaluation
- Caracterização de base obtida no laboratórioDocument15 pagesCaracterização de base obtida no laboratórioEster GomesPas encore d'évaluation
- Projetos Em Clp Ladder Baseado No Twidosuite Parte XiiD'EverandProjetos Em Clp Ladder Baseado No Twidosuite Parte XiiPas encore d'évaluation
- Projetos Com Esp8266 Programado Em Lua - Parte XxiD'EverandProjetos Com Esp8266 Programado Em Lua - Parte XxiPas encore d'évaluation
- Apostila de Geometria Analítica (Professor)Document27 pagesApostila de Geometria Analítica (Professor)Leonardo Tizatto WeinfurterPas encore d'évaluation
- Ficha 4283Document2 pagesFicha 4283JORCY DE CARVALHO ALVES - SDPas encore d'évaluation
- AULA 10 Sem Centros Introducao PDFDocument23 pagesAULA 10 Sem Centros Introducao PDFMarcos SídneyPas encore d'évaluation
- 3º Ano - AngiospermasDocument52 pages3º Ano - AngiospermasJhonPas encore d'évaluation
- TP1 - Hidrologia e Hidraulica ComputacionalDocument24 pagesTP1 - Hidrologia e Hidraulica ComputacionalThais SallesPas encore d'évaluation
- Teoria Dos SistemasDocument4 pagesTeoria Dos SistemaspghopoPas encore d'évaluation
- Ficha Técnica Conservação e RestauraçãoDocument7 pagesFicha Técnica Conservação e RestauraçãoLiz RamírezPas encore d'évaluation
- Circuitos resistivos série e paralelo experimentoDocument4 pagesCircuitos resistivos série e paralelo experimentoRodrigo BrazãoPas encore d'évaluation
- Análise das mensagens ocultas nos clássicos da Disney Cinderela, Hércules e A Bela e a FeraDocument9 pagesAnálise das mensagens ocultas nos clássicos da Disney Cinderela, Hércules e A Bela e a FeraEder MendesPas encore d'évaluation
- Sobonfu Some o Espirito Da Intimidade LegívelDocument141 pagesSobonfu Some o Espirito Da Intimidade LegívelLuisa ArmazémPas encore d'évaluation
- Ventilador pulmonar VLP 6000 para emergênciasDocument1 pageVentilador pulmonar VLP 6000 para emergênciasailson.marins sl98104120Pas encore d'évaluation
- A Estrutura de Tomada de Decisão de Política Externa em Moçambique - O Papel Da Opinião PúblicaDocument63 pagesA Estrutura de Tomada de Decisão de Política Externa em Moçambique - O Papel Da Opinião PúblicaAlves Manjate100% (2)
- Bruno de Almeida Simoes - 230530 - 192925Document7 pagesBruno de Almeida Simoes - 230530 - 192925Red SunPas encore d'évaluation
- A Importância Dos Lubrificantes Automóveis - ROCHA PNEUS - 1621833714923Document5 pagesA Importância Dos Lubrificantes Automóveis - ROCHA PNEUS - 1621833714923JULIOPas encore d'évaluation
- Penas, Características Externas e Esqueleto Das AvesDocument85 pagesPenas, Características Externas e Esqueleto Das AvesGraziele SilvaPas encore d'évaluation
- Folha Dízima 8º AnoDocument1 pageFolha Dízima 8º AnoFrancisco UlissesPas encore d'évaluation
- Regulamento de Urbanização e EdificaçãoDocument35 pagesRegulamento de Urbanização e EdificaçãoAnonymous wXNVIXbUPas encore d'évaluation
- G Series Catalogo ROSSI PTDocument482 pagesG Series Catalogo ROSSI PTViniciusPas encore d'évaluation
- Motovibradores IndustriaisDocument45 pagesMotovibradores IndustriaisalanfbventuraPas encore d'évaluation