Académique Documents
Professionnel Documents
Culture Documents
Mecanismos y Vias Del Dolor
Transféré par
Jessner Rendon RiañoCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Mecanismos y Vias Del Dolor
Transféré par
Jessner Rendon RiañoDroits d'auteur :
Formats disponibles
MECANISMOS Y VIAS DEL DOLOR
Dr. Samuel Torregrosa Ziga Profesor Auxiliar de Anestesiologa Departamento de Anestesiologa.
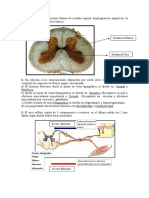
El conocimiento de la neuroanatoma y de la neurofisiologa del dolor constituyen las bases que sustentan su tratamiento racional. De ah la importancia clnica de conocer estos procesos en forma general. Los fenmenos que participan en el proceso nociceptivo pueden esquematizarse en los cuatro aspectos que muestra la Tabla 1. Revisaremos los puntos ms relevantes de los tres primeros. TRANSDUCCION Durante aos se pens que el proceso ocurra en terminaciones sensoriales especficas (corpsculos de Ruffini, Meissner y otros), estructuras encapsuladas que estn en contacto con fibras A beta, que transmiten estmulos mecnicos de pequea intensidad (Tabla 2). Hoy se sabe que ocurre en las terminaciones nerviosas libres, ramificaciones distales de fibras C amielnicas y de fibras A delta, que a este nivel han perdido su delgada capa de mielina. All se inicia la depolarizacin y la transmisin de los impulsos dolorosos hacia la mdula. La respuesta de estos receptores perifricos puede ser modificada por factores que la sensibilizan, aumentando la respuesta (acidez del medio, presencia de sustancias alggenas como prostaglandinas o bradikininas) o por otros que causan fatiga, disminuyendo su respuesta (estmulos mecnicos repetidos). Algunos receptores slo responden a estmulos mecnicos intensos, otros a estmulos nocivos mecnicos y trmicos y otros tienen respuestas polimodales ante estmulos mecnicos, trmicos y qumicos. Estos receptores aumentan significativamente su respuesta elctrica cuando los estmulos se hacen dolorosos. TRANSMISION DE LA PERIFERIA A LA MEDULA Con algunas excepciones, todos los impulsos dolorosos se transmiten por fibras C, con velocidad de conduccin lenta (0,5-2 m/seg) y por las A delta, con mayor velocidad de conduccin (4-30 m/seg). Estas fibras, parte de la neurona en T o neurona perifrica, tienen su soma en el ganglio espinal y penetran a la mdula por el asta posterior (Figura 1). Las fibras de las astas anteriores, que se pensaba
eran slo eferentes y motoras, transmiten tambin impulsos sensoriales en ms de un 15%; esto puede explicar el fracaso de algunas tcnicas quirrgicas, como la rizotoma, que slo lesiona las races posteriores de los nervios espinales. En relacin al dolor visceral, las vas aferentes son fibras simpticas que, pasando por los plexos, llegan a la mdula a travs de las astas posteriores. Esta transmisin por fibras amielnicas y de conducin lenta, y que tambin puede ser somtica, es responsable de una sensacin dolorosa sorda, vaga y profunda. La sensacin dolorosa ms definida, intensa y breve, que se puede percibir ante un estmulo somtico, es trasmitida por las fibras A delta. La evidencia de transmisin dolorosa por va vagal no est comprobada en el hombre, pero pudiera tener importancia en casos especiales de dolor de origen visceral, como ocurre en el cncer. Lo caracterstico de las fibras sensitivas es su ingreso a la mdula, siguiendo una cierta distribucin topogrfica, de manera que a cada dermatoma sensitivo le corresponde un metmero medular, aun cuando existe un cierto grado de superposicin que hace que un dermatoma tctil propioceptivo no corresponda exactamente a uno trmico, o que bajo anestesia espinal con analgesia de piel desde nivel T8 se pueda experimentar dolor a nivel de la cadera. En las astas posteriores de la mdula se produce la sinapsis con la segunda neurona en la sustancia gelatinosa de Rolando. La sustancia gris medular de las astas posteriores fue clasificadas por Rexed en 6 lminas. La zona sinptica de las fibras polimodales corresponde a las lminas II y III (Figura 2). Muchas fibras nociceptivas, antes de su ingreso a la sustancia gris, emiten colaterales descendentes y ascendentes, constituyendo parte del haz de Lissauer. Estas colaterales tienen la posibilidad de formar sinapsis hasta dos segmentos medulares inferiores o superiores al del ingreso, lo que significa que la transmisin de una neurona primaria puede propagarse a varias races vecinas. El soma de la segunda neurona de esta va se puede encontrar en la lmina I de Rexed o en las lminas IV, V oVI. Es importante destacar que la segunda neurona puede formar sinapsis con ms de una primera neurona, proveniente de la piel o de una vscera, y que esta sinapsis se produce siempre en la sustancia gelatinosa de Rolando, cualquiera sea la distribucin del soma en el asta posterior. Aqu existen pequeas neuronas caractersticas de esta zona, las interneuronas, que de alguna manera modulan estas sinapsis. Estos hechos tienen importancia, pues dan un sustrato antomofisiolgico a fenmenos como el dolor referido y a la modulacin que sobre la transmisin nerviosa pueden ejercer centros superiores.
VIAS ASCENDENTES Las segundas neuronas dan origen a tres haces ascendentes contralaterales: el neoespinotalmico y el paleoespinotalmico, que conforman la va espinotalmica, y el espinoreticulotalmico (Figura 2). Las fibras cruzan entre el epndimo y la comisura gris anterior, cruce que puede realizarse en el mismo segmento medular o ascender antes de hacerlo. Algunos axones ascienden enforma ipsilateral y otros lo hacen a travs de los cordones posteriores que conducen fibras propioceptivas de tipo A, para luego cruzar a nivel del bulbo y ascender al tlamo (Figura 3). Esto puede explicar algunos de los fracasos de tcnicas analgsicas, como la cordotoma anterolateral (destruccin de los cruces descritos). El haz neoespinotalmico, que hace sinapsis con los ncleos ventral posterior y psterolateral del tlamo y de all con la corteza parietal, parece ser importante en la ubicacin topogrfica del dolor. El haz paleoespinotalmico se proyecta en forma bilateral a los ncleos inespecficos del tlamo y luego a zonas frontales de la corteza, adquiriendo importancia en la evaluacin cualitativa del dolor. El haz espinoreticulotalmico hace sinapsis con la formacin reticular a diferentes niveles: bulbo, protuberancia, zona mesenceflica y sustancia gris periacueductal y de all en forma bilateral hacia los ncleos inespecficos del tlamo; a este haz se le atribuye mayor importancia en relacin al componente afectivo del dolor. VIAS DESCENDENTES Desde hace cuarenta aos se conoce la posibilidad de controlar el ingreso de estmulos nociceptivos desde las estructuras centrales. La estimulacin elctrica de la zona periacueductal o del ncleo del rafe bulbar, ricos en receptores morfnicos, provoca analgesia sin alteracin motora, probablemente a travsde una va inhibitoria descendente, el fascculo dorsolateral (Figura 3). Experimentalmente se puede obtener analgesia con microinyecciones de morfina en estas zonas. Estas vas inhibitorias descendentes tambin pueden ser estimuladas por el dolor y el estrs y provocar alguna modulacin a nivel medular. Es necesario dejar en claro que existen sistemas inhibidores descendentes mediados por opioides y tambin por otros mediadores, entre los que destacan dos sistemas: uno mediado por norepinefrina y otro por serotonina. MODULACION Y CONTROL DEL DOLOR El dolor puede entonces iniciarse a travs de la activacin de receptores perifricos directamente daados por el trauma o estimulados por fenmenos inflamatorios, infecciosos o isqumicos, que producen liberacin de mediadores. Estos pueden ser directamente alggenos o sensibilizar a los receptores. El
fenmeno inflamatorio incluye la liberacin de substancias como la histamina, serotonina, prostaglandinas y bradiquinina, el aumento del potasio extracelular y de iones hidrgeno, que facilitan el dolor. La sustancia P, un cotransmisor que se sintetiza en el soma de la neurona perifrica y de gran importancia a nivel medular, puede ser liberado tambin a nivel perifrico, facilitando la transmisin nerviosa o incluso provocando vasodilatacin, aumento de la permeabilidad capilar y edema. Por otra parte, un estmulo traumtico o quirrgico intenso puede provocar una contractura muscular refleja, que agrava el dolor en la zona, o un aumento de la actividad simptica eferente, que a su vez modifica la sensibilidad de los receptores del dolor. Esto puede explicar en parte el dolor de la causalgia. A nivel perifrico se puede intentar modificar el dolor a diferentes niveles: 1) La infiltracin de una herida con anestsicos locales o su uso intravenoso en una extremidad, impiden la transduccin al estabilizar la membrana de los receptores. Esta analgesia puede mejorarse utilizando narcticos probablemente por la existencia de receptores morfnicos a nivel perifrico 2) Los AINES actan a nivel perifrico, aun cuando parece claro que existe tambin un mecanismo central. 3) El bloqueo de un nervio perifrico con anestsicos locales o su destruccin impide la transmisin de impulsos hacia y desde la mdula espinal (Figura 4). DOLOR VISCERAL La identificacin de receptores y de estmulos nociceptivos ha sido ms difcil. La distensin anormal o la contractura intensa de la musculatura de una vscera hueca es dolorosa, al igual que una distensin de la cpsula del hgado o del bazo. La anoxia brusca de la musculatura visceral o la necrosis en rganos como pncreas o miocardio tambin provocan dolor. La traccin de ligamentos y vasos y los fenmenos inflamatorios de pleura o peritoneo son otros estmulos identificados. De cualquier manera, el ingreso a la mdula por va simptica y por las astas posteriores es mucho menos preciso que en el caso de los estmulos somticos, y puede realizarse en varios segmentos medulares, provocando sensaciones ms vagas e imprecisas. Estos segmentos pueden, a su vez, recibir impulsos de diferentes zonas de la piel que no necesariamente estn en contacto con la vscera que origin el dolor (dolor referido), y pueden provocar respuestas reflejas simpticas y de contractura muscular que aumentan la sensacin dolorosa. El control del dolor visceral es ms difcil a nivel perifrico. Los
antiinflamatorios no esteroidales (AINES) son claramentemenos eficaces que en el dolor somtico, y slo se usan como coadyudantes. S son tiles los bloqueos con anestsicos locales u otras drogas, a nivel de plexos simpticos en dolores crnicos (por ejemplo celaco) o a nivel de las races posteriores y en mdula con una analgesia peridural, con o sin narcticos agregados (Figura 4). MODULACION MEDULAR Es la zona en la que ms se ha estudiado el fenmeno. La sustancia P es capaz de depolarizar la segunda neurona y tambin se pueden liberar otras sustancias neuromoduladoras, como somatostatina, colecistoquininas, glutamato y cido gamaaminobutrico (GABA). Este ltimo actuara como inhibidor presinptico. Las numerosas interneuronas del asta posterior, que hacen sinapsis con la primera o segunda neurona en los diferentes niveles descritos, reciben a su vez aferencias desde la periferia y de vas descendentes. Tambin existen colaterales desde las fibras A-alfa que liberan encefalinas que inhiben la liberacin de sustancia P (Figura 4). Las endorfinas, un grupo de sustancias endgenas denominadas as por su accin semejante a la de la morfina, constituyen otro de los sistemas de control y modulacin endgena del dolor. Las encefalinas, que probablemente actan como neurotransmisores, se encuentran especialmente en zonas de alta concentracin de receptores morfnicos. La b-endorfina, un polipptido de mayor tamao, tambin tiene una accin agonista opioide intensa; se encuentra en hipfisis, hipotlamo y en tejidos perifricos, pero por degradarse ms lentamente y tener la propiedad de actuar a distancia, es ms bien considerado un agente hormonal. La teora de Melzack y Wall o teora de la puerta de entrada, enfatiza el hecho que la percepcin de la sensacin dolorosa no slo depende de la estimulacin perifrica y de la transmisin, sino que de la modulacin medular y central. Su formulacin ha estimulado el estudio de muchas drogas y tcnicas analgsicas. La estimulacion elctrica transcutnea (TENS) y la estimulacin elctrica intrarraqudea, se basan en el hecho de que todas las fibras nerviosas aferentes tiene la capacidad de influenciar otros impulsos aferentes, principalmente a travs de una inhibicin presinptica. Estimulando un nervio mixto con impulsos no dolorosos, las primeras fibras en responder son las de mayor dimetro, y estas descargas a nivel medular seran capaces de inhibir la transmisin ceflica de los impulsos nociceptivos. ANALGESIA PREVENTIVA Y ANALGESIA BALANCEADA
Los estudios experimentales han demostrado el aumento de las descargas elctricas aferentes hacia la mdula y la sensibilizacin de los nociceptores perifricos y centrales luego de un trauma. Esto puede aumentar el campo de recepcin medular y el nmero de descargas elctricas que se reciben en esa zona, apareciendo cambios electrofisiolgicos y tambien morfolgicos (alteraciones neuroplsticas) que pueden persistir despus del estmulo nociceptivo inicial. Un fenmeno de este tipo tambin ocurrira con el dolor postoperatorio. Durante la ciruga, incluso bajo los efectos de una anestesia general, la mdula espinal contina recibiendo impulsos nociceptivos; la administracin previa de anestsicos locales, con o sin narcticos, e incluso de AINES, pudieran prevenir los cambios descritos en el prrafo anterior y mejorar significativamente la calidad de la analgesia postoperatoria (analgesia preventiva). Aun cuando existen algunas demostraciones experimentales de que esto pudiera ser as y que clnicamente es una alternativa atractiva, los resultados son contradictorios. Siendo el dolor de un fenmeno tan complejo, es difcil imaginar que un slo analgsico pueda eliminar completamente el dolor postoperatorio. Incluso, en la analgesia peridural con anestsicos locales pueden aparecer fenmenos como la taquifilaxia, todos los que pueden minimizarse agregando morfnicos. La combinacin de diferentes analgsicos que afectan el proceso nociceptivo a diferentes niveles podra disminuir o abolir los cambios descritos, mejorar la calidad de la analgesia, permitiendo disminuir las dosis y eventualmente sus efectos adversos. En la anlgesia balanceada se combinan AINES, que alteran la transduccin, anestsicos locales que afectan la transmisin y narcticos que afectan la modulacin del dolor. REFERENCIAS 1.- Paille C. Vas de conduccin del estmulo doloroso. En C. Paille, H. Saavedra (Eds). El dolor, aspectos bsicos y clnicos. Santiago: Mediterrneo, 1990: 31-47. 2.- McQuay HJ. Pre-emptive analgesia. Br J Anaesth 1992; 69: 1-3. 3.- Ferrante FM. Acute pain management. Anesth Analg 1993; 76: S102-S103. 4.- Phillips GD, Cousins M. Neurological mechanisms of pain and the relationship of pain, anxiety, and sleep. En MJ Cousins, GD Phillips. Acute pain management. New York: Churchill Livingstone.1986: 21-48. 5.- Bonica JJ. Anatomic and physiologic basis of nociception and pain. En JJ Bonica. The management of pain. 2nd ed. Philadelphia: 1990: 19-28.
Vous aimerez peut-être aussi
- Epilepsia Idiopática LucasDocument33 pagesEpilepsia Idiopática LucasJessner Rendon RiañoPas encore d'évaluation
- Queso Campesino PDFDocument7 pagesQueso Campesino PDFJessner Rendon Riaño0% (1)
- 12 LaparotomiasDocument17 pages12 LaparotomiasYanella BarriaPas encore d'évaluation
- Constantes Clínicas AnimalesDocument1 pageConstantes Clínicas AnimalesChristian VillarrealPas encore d'évaluation
- Muda forzada de gallinas ponedoras: métodos, fases y consideracionesDocument34 pagesMuda forzada de gallinas ponedoras: métodos, fases y consideracionesJessner Rendon RiañoPas encore d'évaluation
- FósforoDocument27 pagesFósforoJessner Rendon RiañoPas encore d'évaluation
- Ascitis Aviar (Edema Aviar)Document36 pagesAscitis Aviar (Edema Aviar)Jessner Rendon Riaño0% (1)
- Clasificacion Europea Tce EsDocument24 pagesClasificacion Europea Tce EsAmérica FloresPas encore d'évaluation
- Guia Neuro V SemestreDocument3 pagesGuia Neuro V SemestreSALOME PANTOJAPas encore d'évaluation
- Epilepsia NicoDocument91 pagesEpilepsia NicoNicole Ignacia Rosales LanderoPas encore d'évaluation
- Clase 06 Sindromes CorticalesDocument31 pagesClase 06 Sindromes Corticalesraul100% (1)
- Lesiones Cerebrales Inflamatorias, Infecciosas y ParasitariasDocument90 pagesLesiones Cerebrales Inflamatorias, Infecciosas y ParasitariasJose Adolfo Diaz TantaleanPas encore d'évaluation
- Síndrome del EncierroDocument2 pagesSíndrome del EncierroGreii JoePas encore d'évaluation
- Cuestionario CerebeloDocument7 pagesCuestionario CerebeloDayana Hernandez Urbina100% (1)
- Clase LenguajeDocument10 pagesClase Lenguajegbarag88Pas encore d'évaluation
- Facundo Manes: El Cartógrafo CerebralDocument6 pagesFacundo Manes: El Cartógrafo CerebralMartín Jali100% (1)
- Afasias Modelo de Boston y Modelo de LuriaDocument2 pagesAfasias Modelo de Boston y Modelo de LuriaJacobo Pérez100% (1)
- GuayaquilDocument14 pagesGuayaquilantonia pulidoPas encore d'évaluation
- Prueba de Neuroanatomía Ya Respondida Segundo SemestreDocument21 pagesPrueba de Neuroanatomía Ya Respondida Segundo SemestreJhuannyPq100% (1)
- Tema 5.5. LenguajeDocument7 pagesTema 5.5. LenguajecristinaPas encore d'évaluation
- Traumatismo Cráneo EncefálicoDocument1 pageTraumatismo Cráneo EncefálicoOskar VillegasPas encore d'évaluation
- Síndromes Neuropsicológicos Del Desarrollo, Una Introducción y Una Aproximación Desde La Atención PrimariaDocument14 pagesSíndromes Neuropsicológicos Del Desarrollo, Una Introducción y Una Aproximación Desde La Atención PrimariaOscar Lima CarroPas encore d'évaluation
- 9º Rendimiento EscolarDocument55 pages9º Rendimiento EscolarPsicoCCFFPas encore d'évaluation
- Apunte AcufenometríaDocument7 pagesApunte AcufenometríaCarolina CornejoPas encore d'évaluation
- Malformaciones Del Sistema Nervioso CentralDocument9 pagesMalformaciones Del Sistema Nervioso CentralAlejandro ArellanoPas encore d'évaluation
- Apuntes de NeurologíaDocument33 pagesApuntes de NeurologíaOscar Arias GoubetPas encore d'évaluation
- Modelo NeurobiologicoDocument1 pageModelo NeurobiologicovalcarsalsonPas encore d'évaluation
- Caso Clinico PaeDocument13 pagesCaso Clinico PaeAndrea VdlcPas encore d'évaluation
- DiapasonesDocument4 pagesDiapasonesJaneth GuzmanPas encore d'évaluation
- Lesiones EstaticasDocument6 pagesLesiones Estaticascvarmen moralesPas encore d'évaluation
- Vías Sensoriales y MotorasDocument21 pagesVías Sensoriales y MotorasDaYana GonzalesPas encore d'évaluation
- Charla Naira TerapiasDocument53 pagesCharla Naira TerapiasMarina BPas encore d'évaluation
- Caso Clínico Hipoacusia NeurosensorialDocument7 pagesCaso Clínico Hipoacusia NeurosensorialJOHANA JIMENEZ RIVERAPas encore d'évaluation
- Usat Enfermedad CerebrovascularDocument52 pagesUsat Enfermedad CerebrovascularVanniaPas encore d'évaluation
- Residencia - 05 Neuropsicología UNAMDocument4 pagesResidencia - 05 Neuropsicología UNAMerikg07Pas encore d'évaluation
- Nervios craneales: estructura y funcionesDocument58 pagesNervios craneales: estructura y funcionesKika Rivesco100% (1)
- C. - Cuadro Comparativo de Disartrias (Apuntes)Document3 pagesC. - Cuadro Comparativo de Disartrias (Apuntes)Yenny OteloPas encore d'évaluation