Académique Documents
Professionnel Documents
Culture Documents
Tecnología de Los Materiales
Transféré par
bry_lheCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Tecnología de Los Materiales
Transféré par
bry_lheDroits d'auteur :
Formats disponibles
Tecnologa de los
materiales
REALIZADO POR:
Bryams Amin C.I v-20.535.105
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN PORLAMAR
Porlamar, julio de 2014
DIAGRAMA DE FASES
En ciencia de materiales se denomina diagrama de fase o diagrama de estados de la
materia, a la representacin entre diferentes estados de la materia, en funcin de
variables elegidas para facilitar el estudio del mismo. Cuando en una de estas
representaciones todas las fases corresponden a estados de agregacin diferentes se
suele denominar diagrama de cambio de estado.
Los diagramas de equilibrio que pueden estar diferentes concentraciones de
materiales que forma una aleacin a distintas temperaturas. Dichas temperaturas van
desde la temperatura por encima de la cual un material est en fase lquida hasta la
temperatura ambiente y en que generalmente los materiales estn en estado slido.
Existen diferentes diagramas segn los materiales sean totalmente solubles en estado
slido y lquido o sean miscibles a que sean insolubles. Tambin pueden darse casos
particulares. Uno de los diagramas de equilibrio ms clsico es el de los aceros que
tiene particularidades y donde afecta claramente la concentracin y las diferentes
cristalizaciones que puede darse en el hierro estando en estado slido y a diferentes
temperaturas.
Los pares (presin, temperatura) que corresponden a una transicin de fase entre:
Dos fases slidas: Cambio alotrpico;
Entre una fase slida y una fase lquida: fusin - solidificacin;
Entre una fase slida y una fase vapor (gas): sublimacin - deposicin (o
sublimacin inversa);
Entre una fase lquida y una fase vapor: vaporizacin - condensacin (o
licuefaccin).
Es importante sealar que la curva que separa las fases vapor-lquido se detiene en
un punto llamado punto crtico (La densidad del lquido y vapor son iguales). Ms all
de este punto, la materia se presenta como un fluido supercrtico que tiene
propiedades tanto de los lquidos como de los gases. Modificando la presin y
temperatura en valores alrededor del punto crtico se producen reacciones que pueden
tener inters industrial, como por ejemplo las utilizadas para obtener caf
descafeinado.
Es preciso anotar que, en el diagrama P-T del agua, la lnea que separa los estados
lquido y slido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere
decir que aumentando la presin el hielo se funde, y tambin que la fase slida tiene
menor densidad que la fase lquida.
DIAGRAMA HIERRO-CARBONO
En el diagrama de equilibrio o de fases, Fe-C se representan las transformaciones que
sufren los aceros al carbono con la temperatura, admitiendo que el calentamiento (o
enfriamiento) de la mezcla se realiza muy lentamente de modo que los procesos
redifusin (homogeneizacin) tienen tiempo para completarse. Dicho diagrama se
obtiene experimentalmente identificando los puntos crticos temperaturas a las que
se producen las sucesivas transformaciones por mtodos diversos.
DIAGRAMA DE FASE PARA METALES
Los metales puros tienes poca utilidad en la industria por no cumplir con una serie de
especificaciones. Para conseguirlas se mesclan con otros metales y no metales,
formando aleaciones. La aleacin es todo producto que resulta de la unin de dos o
ms elementos qumicos, uno de los cuales tiene carcter metlico. Deben cumplir las
siguientes condiciones:
Que los elementos sean totalmente miscibles en estado lquido, de forma que
al solidificarse sea un producto totalmente homogneo.
Que el producto resultante tenga carcter metlico
Disolvente y soluto Disolvente es el componente que entra en mayor proporcin, y
soluto el que lo hace en menor proporcin. Cuando los elementos solubles no
poseen la misma red cristalina, se considera disolvente al elemento que conserva
la red.
Tipos de disoluciones slidas. Deformaciones en la red cristalina Solucin por
sustitucin: Los tomos de disolvente y soluto tienen estructura cristalina similar y
ambos forman parte del edificio cristalino al reemplazase tomos de disolvente por
tomos de soluto. Solucin por insercin: Se presenta cuando los tomos de soluto
son muy pequeos comparados con los tomos del disolvente, y se colocan en el
interior, en los intersticios, de la red cristalina del disolvente.
REGLA DE LA PALANCA
La utilidad de los diagramas de fases consiste en la posibilidad de predecir las
transformaciones y las microestructuras resultantes de los cambios de fase, que
pueden estar o no en equilibrio. Los diagramas de equilibrio de fases representan
la relacin entre la estructura de composicin y el nmero de fases presentes en el
equilibrio, as como las transformaciones que se producen desde el estado lquido
hasta la temperatura ambiente. La temperatura la presin y la composicin son las
variables principales. Como la presin suele ser la atmosfrica, solo quedan
temperatura y composicin. A las diferentes fases se las denomina con letras
griegas (excepto al material fundido que simplemente se le llama lquido). Con el
uso de estos diagramas se puede determinar la composicin o porcentaje de cada
fase para una concentracin y temperatura determinadas de los materiales que
entran en la aleacin.
ALEACIONES HIERRO-CARBONO:
COMPOSICIN, CONSTITUCIN Y ESTRUCTURA
El hierro puro tiene pocas aplicaciones industriales, pero formando aleaciones con
el carbono y otros elementos, es el metal ms empleado en la industria. Las
aleaciones con contenidos de carbono entre 0,1 y 1,76 % son los aceros. Si el
porcentaje de carbono sobrepasa el 1,76% tenemos las fundiciones. Constitucin
de las aleaciones Fe-C Ferrita: solucin slida de carbono en hierro a. Se
considera a la ferrita como hierro puro. Es el ms blando y dctil constituyente de
los aceros, posee propiedades magnticas. Cementita (Fe3C): es el constituyente
ms duro y frgil de los aceros. Tiene propiedades magnticas hasta los 210C.
Perlita: formada por 85,5% de ferrita y 13,5 de cementita. Ausentita: formada por
una solucin slida por insercin de carbono en hierro. La proporcin de carbono
disuelto vara de 0 al 1,76%. Es el constituyente ms denso de los aceros. No es
magntica. Martensita: es una solucin slida sobresaturada de carbono en hierro
a. Se obtiene por enfriamiento rpido de la austenita de los aceros, despus de
haber sido calentada para conseguir una constitucin austentica. Presenta
propiedades magnticas.
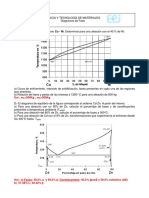
El punto E es el de mxima solubilidad del carbono en hierro que corresponde al
1,76%. El punto D est en el lmite del diagrama 6,67% de carbono (cementita
pura). En el punto 5 (eutectoide), la austenita se transforma en perlita con un
0,89% de carbono. Estudiamos el proceso de solidificacin de seis aleaciones con
porcentajes de carbono de: 0,5; 0,89; 1,2; 3,2; 4,3 y 5,4%. Aleacin I (0,5% de C).
Por encima de 1 existe solamente la fase lquida. Comienza la formacin de
austenita hasta que en 2 solidifica totalmente. En el punto 3 el hierro se transforma
totalmente en ferrita o hierro a. Durante la transformacin anterior, la austenita
residual se enriquece en carbono hasta que en el punto 4, con una proporcin del
0,89% de C se convierte en perlita. Aleacin II (0,89% de
C). Comportamiento idntico al anterior, salvo que no existe el punto 3, porque
toda la austenita se transforma bruscamente en perlita. Es la llamada eutectoide.
Aleacin III (1,2% de C). En el punto 5 comienzan a separarse cristales de
cementita, hasta que en el punto 6 a 723 C con porcentaje de 0,89% de C se
transforma en perlita. Aleacin IV (3,2% de C). En el punto 7 comienza la
solidificacin y se forma austenita. Todo se transforma en ledebu-rita en el punto 8.
En el punto 9 se convierte en perlita.
CLASIFICACIN DE LOS ACEROS En funcin del procedimiento de fabricacin
En funcin del porcentaje de carbono Aceros hipoeutectoides. En ellos, el
porcentaje de carbono es inferior al punto eutectoide. Aceros eutectoides. En ellos,
el porcentaje de carbono es igual al punto eutectoide. Aceros hipereutectoides. En
ellos, el porcentaje de carbono es superior al punto eutectoide. El punto eutectoide
para los aceros para los aceros al carbono corresponde a un 0,89% de carbono.
En funcin de su constitucin interna. Aceros perlticos. Constituidos despus del
enfriamiento por perlita y ferrita o perlita y cementita, dependiendo de si el
porcentaje de carbono es menor o mayor al eutectoide. Son los aceros normales,
los aceros al carbono y los aceros de baja y media aleacin. Aceros martensticos.
Formados en su mayor parte por martensita. En realidad son aceros perlticos,
cuya velocidad de temple es muy lenta, y son templados despus del enfriamiento
al aire. Aceros austenticos. Costituidos por auastenita a la temperatura ambiente.
No son atraidos por un imn. Aceros ferrticos. Formados por ferrita acualquier
temperatura. No se pueden templar.
Vous aimerez peut-être aussi
- Webconferencia 5 761Document24 pagesWebconferencia 5 761Yurasit Ovallos0% (1)
- Diagrama de Fases y TTDocument31 pagesDiagrama de Fases y TTRodrigoPas encore d'évaluation
- Separadores NuevoDocument34 pagesSeparadores NuevojpajohnnyPas encore d'évaluation
- Diagrama de FasesDocument12 pagesDiagrama de FasesJhon LeonPas encore d'évaluation
- Diagrama de FasesDocument48 pagesDiagrama de FasesYaquelin Yina Ayala LazaroPas encore d'évaluation
- Ensayo de Diagramas de FasesDocument7 pagesEnsayo de Diagramas de FasesEdira Alvarado DosalPas encore d'évaluation
- Tema 1Document13 pagesTema 1CURSO FISICAPas encore d'évaluation
- Diagrama de FasesDocument26 pagesDiagrama de FasesGianfranco Romero MendezPas encore d'évaluation
- Diagrama TernarioDocument3 pagesDiagrama TernarioCamila SorianoPas encore d'évaluation
- Equilibrio Líquido-VaporDocument9 pagesEquilibrio Líquido-VaporGianCarlosQVPas encore d'évaluation
- A Closer Look at Phase Diagrams For The General Chemistry Course - En.esDocument7 pagesA Closer Look at Phase Diagrams For The General Chemistry Course - En.esAmayrani ApolinarPas encore d'évaluation
- Introducción Diagramas de Fases. Editado para Aula Virtual. Materiales Metálicos 8-10 Septiembre 2021Document5 pagesIntroducción Diagramas de Fases. Editado para Aula Virtual. Materiales Metálicos 8-10 Septiembre 2021Another KidPas encore d'évaluation
- Compresion Acond y Transp Gas 3Document107 pagesCompresion Acond y Transp Gas 3yair naumPas encore d'évaluation
- Cuestionario #3 Diagrama de FaseDocument4 pagesCuestionario #3 Diagrama de FaseNicolas CisnerosPas encore d'évaluation
- Guía Pedagógica ESTADOS DE LA MATERIA.Document7 pagesGuía Pedagógica ESTADOS DE LA MATERIA.juan esteban alvarez henaoPas encore d'évaluation
- Diagrama de Fases - Quimica - TeoriaDocument26 pagesDiagrama de Fases - Quimica - TeoriaAnthony Ruiz ChavezPas encore d'évaluation
- Capitulo 12..Document3 pagesCapitulo 12..Luis Angel RojasPas encore d'évaluation
- Tema 8 (II) (Curso 19-20)Document7 pagesTema 8 (II) (Curso 19-20)JORGE DAVID RAMOS ROZALENPas encore d'évaluation
- Regla de Las FasesDocument17 pagesRegla de Las FasesSaúl Yair Pineda SilvaPas encore d'évaluation
- Energía LibreDocument35 pagesEnergía Librechio_garcia_2Pas encore d'évaluation
- Cuestionario 6 LiquidosDocument4 pagesCuestionario 6 LiquidospabloPas encore d'évaluation
- Equilibrio QuimicoDocument8 pagesEquilibrio QuimicoDennis LinoPas encore d'évaluation
- Equilibrio Líquido-Líquido en SistemasDocument14 pagesEquilibrio Líquido-Líquido en SistemasFrancisco Amador RamirezPas encore d'évaluation
- Diagramas de Equilibrio (PAU)Document10 pagesDiagramas de Equilibrio (PAU)fagonzalez1958Pas encore d'évaluation
- Clase Equilibrio de FasesDocument36 pagesClase Equilibrio de Fasesjose contreras0% (1)
- Informe N4Document21 pagesInforme N4Eduardo JulienPas encore d'évaluation
- Ensayo de Construccion de Diagramas de FasesDocument10 pagesEnsayo de Construccion de Diagramas de FasesChristianQuirogaPas encore d'évaluation
- Boletin CTM 2 PDFDocument4 pagesBoletin CTM 2 PDFMrulrerPas encore d'évaluation
- Informe Lab Organica Punto de Fusión y SublimaciónDocument5 pagesInforme Lab Organica Punto de Fusión y SublimaciónMartin EliasPas encore d'évaluation