Académique Documents
Professionnel Documents
Culture Documents
Apostila Bioquimica 2014 PDF
Transféré par
NatannyKellerTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Apostila Bioquimica 2014 PDF
Transféré par
NatannyKellerDroits d'auteur :
Formats disponibles
Universidade Federal de Pernambuco
Departamento de Engenharia Qumica
Laboratrio de Microbiologia Industrial
Bioqumica Industrial
Professor: Jenyffer Medeiros Campos
Glria Maria Vinhas
Recife, 2014
SUMRIO
Prtica 1: Anlise de protenas: Caractersticas e pesquisa de aminocidos em
ovoalbumina.
Prtica 2: Ponto isoeltrico da casena.
Prtica 3: Produo de enzimas Preparao de meio de cultivo.
Prtica 4: Produo de enzimas (continuao) Inoculao.
Prtica 5: Produo de enzimas (continuao) Fatores de afetam a estrutura e/ou
desnaturam a enzima.
Prtica 6: Determinao de acares redutores pelo mtodo DNS
Prtica 7: Metabolismo Preparao de meio.
Prtica 8: Metabolismo Inoculao.
Prtica 9: Metabolismo Determinao de biomassa.
Prtica 10: Caracterizao de lipdeos.
Prtica 11: ndice de saponificao.
PRTICA 1: ANLISE DE PROTENAS: CARACTERSTICAS E
PESQUISA DE AMINOCIDOS EM OVOALBUMINA
Introduo
Protenas so macromolculas naturais com uma ou mais cadeias
polipepetdicas, isto , so polmeros de -aminocidos de configurao L. Constituem
50% ou mais de matria seca celular, sendo fundamentais tanto ao aspecto estrutural
como funcional. As protenas podem ser separadas uma das outras e de outros tipos de
molculas atravs de mtodos, que se baseiam em certas propriedades caractersticas,
tais como solubilidade, massa molar, carga eltrica e afinidade por certos compostos. As
protenas podem ser tambm caracterizadas por reaes de precipitao e colorao. Em
condies fisiolgicas, todas as molculas de uma mesma protena apresentam a mesma
conformao, que denominada nativa.
Ao preceder-se o isolamento e purificao de uma protena, so introduzidas
alteraes fsicas e qumicas no seu meio ambiente que podem afetar sua estrutura
espacial e ocasionar a perda da funo biolgica. A protena dita ento desnaturada.
Vrios fatores podem conduzir, desnaturao, entre eles, o aquecimento, valores de
pH muitos baixos ou altos, solventes orgnicos polares e compostos com grande
capacidade para formar pontes de hidrognio.
Objetivo
Evidenciar as diversas reaes, que permitem identificar alguns grupos R dos
resduos dos aminocidos componentes das protenas, assim como reaes de
identificao de protenas com reativo especfico para caracterizao das mesmas.
Destacar a desnaturao protica por diversos tipos de situaes desnaturantes.
Procedimento
1. Desnaturao da protena
Amostra da clara de ovo: separe a clara de um ovo a adicione gua destilada na
proporo de 3/1.
- Ao do calor: Adicionar 3,0 mL da soluo da clara de ovo em um tubo de ensaio.
Aquecer direto no bico de Bunsen por alguns minutos. Tente solubilizar o precipitado
em solventes comuns: gua, lcool etlico, acetona. Conclua.
- Ao de cido orgnico: Adicionar 3,0 mL da soluo da clara de ovo em tubo de
ensaio e adicionar, gota a gota, cido clordrico 10% ou cido actico 10%.
- Ao de solventes orgnicos: Prepare 2 tubos de ensaio com 1,0 mL da soluo da
clara de ovo, a cada tubo e adicione os seguintes solventes:
Tubo 1: 1,0 mL de lcool etlico
Tubo 2: 1,0 mL de acetona
Agite os tubos vigorosamente. Observe e conclua.
2. Solubilidade a diferentes pH
Colocar 2 mL da soluo da clara de ovo em cada tubo de ensaio, adicionar 2
mL da soluo a pH 2,0 para o tubo 1; 2 mL da soluo a pH 4,0 para o tubo 2; 2 mL
da soluo a pH 7,0 para o tubo 3; 2 mL da soluo a pH 8,0 para o tubo 4.
3. Reao Xantoproteica: Pesquisa de tirosina e triptfano
Adicionar 3 mL da soluo de clara de ovo em um tubo de ensaio, adicionar 1
mL da soluo de cido ntrico (HNO
3
) 20% ou concentrado. Aquecer em bico de
Bunsen por alguns segundos. Observe a formao de um precipitado amarelo.
Acrescente 0,5 mL de hidrxido de amnio (NH
4
OH) 2M ou hidrxido de sdio
(NaOH) 2M e observe a formao de colorao laranja.
4. Pesquisa do triptfano
Em um tubo de ensaio, coloque 2,0 mL de cido actico glacial e 2 mL de
soluo de clara de ovo. Agite, adicione 5,0 mL de cido sulfrico (H
2
SO
4
)
concentrado
(CUIDADO), escorrendo pelas paredes. O aparecimento de cor violeta na interface dos
lquidos indica a presena de triptfano.
5. Reao do biureto das protenas
Colocar 3,0 mL da soluo de clara de ovo em um tubo de ensaio e adicione 5
gotas da soluo de sulfato cprico 5%, surge um precipitado. Adicione uma soluo de
NaOH 10%, gota a gota, at dissoluo deste precipitado. O aparecimento da colorao
violeta indica a formao do complexo biureto-cobre.
Pesquisar, para os aminocidos, as reaes envolvidas nas anlises acima.
PRTICA 2: DETERMINAO DO PONTO ISOELTRICO DA
CASENA
Introduo
A carga eltrica total de uma protena o somatrio das cargas dos aminocidos
que compem a molcula, e depende do valor de pKa dos resduos de aminocidos e do
pH do meio. O ponto isoltrico (pI) da protena o pH onde o numero de cargas
positivas equivale ao numero de cargas negativas. Nesse pH a molcula da protena
eletricamente neutra e ela no migra para nenhum dos plos, quando submetida a um
campo eltrico. O pI das protenas no pode ser calculado a partir dos valores de pKa
dos aminocidos componentes isolados, pois os valores variam de acordo com a
localizao do aminocidos na protena.
Os valores do pI das protenas so caractersticos e refletem a proporo de
aminocidos carregados positiva e negativamente na sua molcula. A pepsina uma das
enzimas da digesto, apresenta um valor de pI igual a 1 e a relao entre os aminocidos
cidos e bsicos de 15:1, refletido no seu valor de pI.
Em valores do pI abaixo do pI, a protena apresenta carga liquida positiva,
devido a protonao dos grupos bsicos e cidos e acima do pI apresenta carga liquida
negativa.
A variao da carga liquida da protena interfere com sua solubilidade. No pI a
solubilidade menor do que em outros valores de pH, onde as molculas tem a mesma
carga e se repelem eletrostaticamente, impedindo a precipitao.
Objetivo
Determinar experimentalmente o valor do ponto isoeltrico da casena do leite.
Procedimento
A 50 mL de leite desnatado adicione cido actico 1,0 mol/L at a precipitao.
A seguir adicione mais 5,0 mL do cido actico 1,0 mol/L. centrifugue a 3000 rpm por
5 minutos. Despreze o sobrenadante. Ressuspenda o precipitado com gua destilada e
centrifuga novamente. Despreze o sobrenadante.
Para dissolver o precipitado adicione 25 mL de gua destilada em um Beker,
junte 5 mL de NaOH 1 mol/L aquea em 40
o
C at precipitar. Adicione ento o
precitpitado de casena at a dissoluo completa. Transfira para um balo volumtrico
de 50 mL, adicione 5 mL de cido actico 1 mol/L e complete com gua destilada. Se
houver turvao filtre.
Prepare nove tubos de ensaio e numere de 1 a 9. Ao tubo 1 adicione 3,2 mL de
cido actico 1 mol/L e 6,8 mL de gua destilada. Misture bem. A seguir adicione
exatamente 8 mL de gua destilada nos outros 8 tubos de ensaio. Do tubo 1 retire 2,0
mL e transfira para o tubo 2. Agite e retire 2,0 mL do tubo 2 e transfira para o tubo 3 e
assim sucessivamente at o ultimo tubo. Do tubo 9 retire 2 mL e despreze. Faa a leitura
dos valores de pH usando um potencimetro.
A cada um dos tubos adicione 1,0 mL de casena agite e observe o resultado
imediatamente a aps 15 minutos. Determine o ponto isoeltrico da casena.
Tubos
1 2 3 4 5 6 7 8 9
pH
PRTICAS 3/4/5: PRODUO DE ENZIMAS
Introduo
A Cintica Enzimtica estuda os mecanismos de reaes qumicas catalisadas
por enzimas. H na estrutura da enzima, uma determinada regio diretamente
responsvel pela ao cataltica. Essa regio denominada stio ativo e a sua
conformao correta fundamental para a atividade enzimtica. Ali se localizam
diversos resduos de aminocidos que podem desempenhar funes de orientao do
substrato e de direta interao com este, permitindo que a reao ocorra. Em 1913, L.
Michaelis e M. L. Menten, desenvolveram estudos considerando as principais
propriedades das enzimas e aplicando as teorias conhecidas de Cintica Qumica para
um modelo simplificado, o qual envolvia a enzima livre (E), o substrato (S), o complexo
enzima-substrato (ES) e o produto (P). Esse modelo pode ser expresso pela equao
qumica:
Michaelis e Menten, com essas consideraes, desenvolveram a expresso de
velocidade para uma reao catalisada enzimaticamente, onde V funo de [S] e
Vmax e Km so constantes:
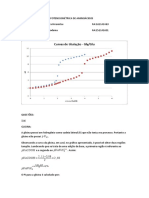
Na Figura 7 est apresentada a curva de velocidade inicial de reao em funo
da concentrao de substrato para uma enzima que siga o modelo proposto por
Michaelis e Menten. Essa enzima dita de caractersticas michaelianas e obedece
expresso de velocidade apresentada acima.
Figura 6 - Deduo da equao de Michaelis-Menten.
Figura 7 Velocidade de reao em funo da concentrao de substrato para uma
enzima michaeliana.
Nesta curva pode-se facilmente identificar o efeito de saturao do substrato.
Nestas circunstncias, o sistema tende a adquirir velocidade de reao mxima (V
mx
),
grandeza que funo da concentrao inicial da enzima livre (E). Podemos tambm
definir uma concentrao de substrato na qual se obtm metade de V
mx
. Esse valor de
[S] numericamente igual ao Km, parmetro que dentro de certos limites mede a
afinidade da enzima pelo substrato.
O mtodo mais preciso para determinao grfica dessas grandezas num
experimento de Cintica Enzimtica atravs do grfico de duplo-recproco ou de
Lineweaver-Burk. Para tanto se deve plotar 1/V em funo de 1/[S].
A enzima escolhida para este estudo a invertase de levedura que catalisa a
hidrlise da sacarose para produzir glicose e frutose:
A invertase uma enzima hidroltica que catalisa a hidrlise da sacarose, dando
como produtos a glicose e a frutose. A sacarose, dando como produtos a glicose e a
frutose. A sacarose um dissacardeo no redutor assim para cada molcula de sacarose
hidrolisada, duas molculas de acar redutor so formados.
O nome de invertase foi dado a esta enzima porque ao hidrolisar a sacarose
liberando glicose e frutose, ocorre uma inverso no sinal da rotao tica de positivo
para negativo, sendo denominado acar invertido.
A sacarose tem desvio de +66,5, a glicose de +52,7, enquanto o desvio da
frutose de -92, portanto, aps a hidrlise, a rotao ptica que era de +66,5 passa
para -39,3. As propriedades qumicas da sacarose e sacarose invertida (tambm
conhecida como acar invertido) so bem diferentes quanto ao poder edulcorante,
solubilidade, poder redutor, etc.
As enzimas que catalizam a hidrolise da sacarose so largamente distribudas.
As mais conhecidas so invertase de leveduras e a invertase intestinal, tambm
conhecida como sacarase.
A determinao da velocidade da reao (ou da atividade enzimtica) pode ser
feita atravs da dosagem dos acares redutores formados (frutose e glicose). A
dosagem baseia-se na reao entre o cido 3,5-dinitro-saliclico (DNS) e os acares
redutores. Estes monossacardeos reduzem o DNS fornecendo um produto de cor
caracterstica, cuja formao pode ser acompanhada a 540nm. Conhecendo-se por
colorimetria a quantidade (mols) de acares redutores formada, por um clculo
estequiomtrico simples, pode-se determinar a quantidade correspondente (mols) de
sacarose hidrolisada. Nestas experincias as velocidades da reao sero expressas em
mols de sacarose hidrolisada por minuto.
Para estudos de velocidade, o tempo de reao deve ser medido com a maior
exatido possvel. Para isso, o grupo dever organizar-se de maneira a no permitir que
a reao se inicie em tempos diferentes nos vrios tubos. Para tal, importante manter
os tubos em gelo durante a adio dos reagentes. Esses devem ser adicionados na ordem
em que aparecem nos protocolos, com a enzima sendo adicionada por ltimo. Leva-se
ento os tubos, todos juntos, ao banho a 37C para reagir. Transcorrido o tempo
determinado, os tubos devem voltar, todos juntos e simultaneamente, para o gelo. Neste
ponto a reao pra. A atividade enzimtica medida em unidade (U), sendo que 1 U
a quantidade de enzima necessria para a formao de 1 mol de produto por minuto.
Princpio do mtodo
Sendo a sacarose um acar no redutor, pode-se medir a atividade hidroltica da
enzima pelo aparecimento de acar redutor (glicose mais frutose) aps sua incubao
com a enzima. Para se determinar a quantidade de acar redutor formado, basta utilizar
uma curva-padro de acar redutor elaborada nas mesmas condies (mesmo mtodo).
As leveduras de panificao contem considervel quantidade de invertase, o que
permite obter preparaes ativas da enzima com relativa facilidade. A invertase de
levedura catalisa a ciso da molcula de sacarose em a-glicose e b-frutose. No
especifica para a sacarose atuando tambm sobre outros oligossacardeos como a
rafinose, estaquiose entre outros.
Objetivo
Produo da enzima invertase de Saccharomyces cerevisiae utilizando diferentes
fontes de carbono.
MATERIAL
- Microrganismo: Saccharomyces cerevisiae.
- Meios de cultura: Caldo Nutritivo modificado
- Equipamentos/Materiais:
. Espectrofotmetro
. Mesa agitadora
. Balana semi-analtica
. Cubetas do espectrofotmetro
. Tubos de ensaio estreis
. Erlenmeyers, 1000mL
. Pipetas: 1mL e 10mL
Procedimento:
A) Produo da invertase
1. Preparar 1,5 litros de caldo Nutritivo, distribuir 500mL em 3 Erlenmeyers de
1000ml de capacidade. Adicionar no primeiro 10g de glicose, no segundo 10g de
sacarose e no terceiro 10g de frutose, homogeneizar e esterilizar a 121
o
C por 15
minutos. Deixar esfriar.
2. Colocar os Erlenmeyers na balana semi-analtica e inocular esterilmente cerca de
1,0 5,0g do microrganismo Saccharomyces cerevisiae (fermento liofilizado) e
incubar a temperatura ambiente sob agitao.
3. Centrifugar o caldo fermentado a 10000 rpm por 10 min.
4. Remover o sobrenandante, caldo fermentado contendo a enzima invertase, para um
Erlenmeyers estril e conserv-lo sob refrigerao.
B) Determinar a ati vidade da invertase, variando a temperatura e pH
Material:
- Enzima: invertase obtida das fermentaes anteriores.
- Equipamentos/Materiais:
. Espectrofotmetro
. Banho termosttico
. Balana semi-analtica
. Cubetas do espectrofotmetro
. Tubos de ensaio estreis
. Erlenmeyers
. Pipetas: 1mL e 10mL
Procedimento:
Atividade enzimtica
No reator adicionar 9,0 mL da soluo de sacarose a 0,06 M, diluda em tampo
fosfato de sdio 0,05 M a pH 5,2 aquecer a 50
o
C e adicionar 1,0 mL da amostra
convenientemente (mosto filtrado obtido no item anterior). A reao ser realizada a
50
o
C, por 10 minutos. Aps o trmino da reao:
- Transferir 0,5mL da amostra para o tubo de Folin Wu e adicionar 1mL de DNS.
- Homogeneizar;
- Levar o tubo de Folin Wu a banho-maria por 5min a 100C;
- Banho de gelo para finalizar a reao
- Aferir o volume para 12,5mL com gua destilada;
- Homogeneizar a amostra e realizar a leitura da Transmitncia no espectrofotmetro
devidamente calibrado utilizando comprimento de onda = 540nm.
Com o auxlio de uma curva de calibrao previamente determinada pelo
mtodo de DNS (anexo 1) pode-se determinar a atividade enzimtica.
1) Efeito do pH na atividade da invertase
A reao ser realizada em diferentes tubos de ensaio contendo a soluo de
sacarose a 0,06 M, diluda em tampo fosfato de sdio 0,05 M (4,5ml) variando o pH
(Tabela 1). Inicialmente a soluo deve ser inserida no tubo, submetida ao banho,
quando a temperatura atingir a T da reao (50
o
C), adiciona-se a invertase (0,5ml). O
tempo da reao ser de 10 min (idem item 2).
Tabela 1- Atividade enzimtica da invertase em
funo do pH, diluda em tampo acetato de sdio 0,1M.
pH UI/mL
3,6
4,0
4,4
4,8
5,2
5,6
2) Efeito da Temperatura na atividade da invertase
A reao ser realizada em diferentes tubos de ensaio contendo a soluo de
sacarose a 0,06 M, diluda em tampo fosfato de sdio 0,05 M (4,5mL) variando a
Temperatura de acordo com a tabela abaixo. Inicialmente a soluo deve ser inserida no
tubo, submetida ao banho, quando a temperatura atingir a T desejada, adiciona-se a
invertase (0,5mL). O tempo da reao ser de 10 min (idem item 2).
Temperatura (
o
C) (UI/mL) E
a
30
40
50
60
70
Anexo1
Clculo
1
:
Determinao da atividade enzimtica:
AE= [ ] x 10
6
/ 1000.PM t
AE = Atividade enzimtica
t = tempo de reao
1000= fator de converso de L ml
PM= peso molecular:180g (glicose); 342g ( sacarose)
10
6
= fator de converso de mol em mol
[ ] = concentrao de glicose em g/L
Mtodo de determinao da atividade enzimtica por inclinao da reta:
AE= (/) x 27,777 x d
d= diluio da invertase
= coeficiente angular da amostra (absorbncia x tempo de reao)
= coeficiente angular de padro de glicose na sacarose (absorbncia do padro x
concentrao de acar)
A
b
s
o
r
b
n
c
i
a
Conc de acar
A
b
s
o
r
b
n
c
i
a
t (min)
PRTICA 6: DETERMINAO DE ACARES REDUTORES
PELO MTODO DO DNS
Introduo:
Os acares redutores das amostras podem ser determinados pelo mtodo do DNS.
Este mtodo consiste na reduo, em meio alcalino, do cido 3,5dinitrossaliclico em
cido 3-amino-5-nitrossalcilico por ao dos acares redutores, dando origem a um
composto acastanhado que obedece a lei de Lambert-Beer, ou seja, a transmitncia
proporcional concentrao da substncia dissolvida, neste caso, os acares redutores.
Reagentes:
cido 3,5-dinitrossaliclico 1,0 g
Soluo NaOH 2N 20,0 mL
Sal de Rochellle (ver nota A) 30,0g
gua destilada at 100,0 mL
Procedimento:
Dissolver temperatura ambiente (ver nota B) 1,0g de cido 3,5-
dinitrossaliclico em 50 mL de gua destilada (ocorre dissoluo parcial do cido). Aos
poucos, adicionar os 20mL da soluo NaOH 2N, agitando sempre, at a dissoluo
completa do cido. Adicionar 30g de sal de Rochelle; dissolver e completar o volume
at 100mL (ver nota C).
Notas:
A: O sal de Rochelle o tartarato de potssio e sdio tetrahidratado. Sua funo
proteger o reagente e, conseqentemente, o acar da amostra, da ao do oxignio
dissolvido.
B: Essa dissoluo demorada, necessitando de agitao constante. Para favorecer o
processo, ela pode ser feita a uma temperatura prxima a 30
0
C.
C: Proteger o reagente da ao do CO
2
; hidrxido de sdio na soluo.
Curva de Calibrao do DNS
1. Em um Bquer de 50mL pesar em balana semi-analtica, 20g de glicose, anotando
o valor exato. Diluir em um pouco de gua e transferir, analiticamente, para um balo
de 1000mL. Completar o volume e homogeneizar;
2. A partir da concentrao da suspenso padro escolher os valores para as
concentraes, de forma a cobrir uma determinada faixa de concentraes;
3. Realizar uma srie de diluies com um conjunto de pipetas e bales volumtricos
adequados. Utilizar como sugesto os valores da tabela abaixo.
Suspenso
nmero
Conc. da
diluio,
X (g/L)
Fator de
diluio
Modo de preparo
(mL da susp.
padro)
Absorbncia
1 0,2 100x 5 at 500
2 0,4 50x 1 at 500
3 0,6 33,3x 15 at 500
4 0,8 25x 2 at 50
5 1,0 20x 2,5 at 50
6 1,2 16,67x 3,0 at 50
7 1,5 13,33x 19 at 250
8 1,6 12,5x 20 at 250
4. Homogeneizar cada suspenso e fazer as leituras em espectrofotmetro com
comprimento de onda de 540nm.
5. Realizar, pelo menos, duas leituras do valor da absorbncia para cada concentrao.
O espectrofotmetro calibrado antes de cada leitura, com um branco de gua
destilada.
6. Construir um grfico, colocando no eixo das ordenadas os valores da concentrao
de glicose X (g/L) e no eixo das abscissas os valores da absorbncia (D.O).
7. Fazer uma regresso linear com o auxlio de um programa de computador ou
utilizando o mtodo dos mnimos quadrados.
8. Calcular o coeficiente de correlao, r, e determinar o intervalo de concentraes,
X
1
- X
2
, no qual a expresso vlida.
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
A
b
o
s
r
b
n
c
i
a
D
O
Concentrao g/L
Curva de calibrao Glicose
Y= -0,06386+0,20038X
r=0,99554
Procedimento experimental para a amostra
1. Preparao das amostras contendo sacarose
Transferir 1mL da amostra para um tubo de ensaio;
Adicionar 1mL de HCl concentrado;
Aquecer em banho-maria a 68C por 15min;
Neutralizar com NaOH utilizando fenolftalena como indicador;
Aferir o volume diluio desejada.
2. Teste com DNS
Transferir 0,5mL da amostra para o tubo de Folin Wu e adicionar 1mL de DNS.
Homogeneizar;
Levar o tubo de Folin Wu a banho-maria por 5min a 100C;
Aferir o volume para 12,5mL com gua destilada;
Homogeneizar a amostra e realizar a leitura da Transmitncia no
espectrofotmetro devidamente calibrado utilizando comprimento de onda =
540nm.
3. Preparao do Branco
Repete-se o mesmo procedimento para a preparao da amostra, entretanto a
alquota retirada deve ser gua. Em seguida, realizam-se os procedimentos para o teste
com DNS.
PRTICA 7/8/9: METABOLISMO
Objetivo:
- Fatores que influenciam o metabolismo celular.
- Observar o crescimento celular da levedura Saccharomyces cervisiae em diferentes
condies ambientais tais como: fontes de carbono, sais, temperatura e pH.
Material:
- Micro-organismo: Saccharomyces cervisiae.
- Meio de cultura bsico (g/l):
Glicose -----------------------100
Extrato de levedura ---------2
Uria-----------------------------1
KH
2
PO
4
-------------------------1
MgSO
4
.7H
2
O ------------------0,5
H
2
O ----------------------------- 1L
Observao: todos os inculos devem ser feitos assepticamente, utilizando pipetas e
tubos de ensaio estreis, um tubo para cada anlise.
Procedimento:
1-Efeito da temperatura
Inocular 0,1ml da suspenso de levedura em 04 tubos de ensaio contendo o meio bsico
e encubar nas temperaturas a seguir: 5C, 30C, 45C e 60C por 48h.
Tubo Temperatura
C
Houve
crescimento?
Concluso
1 4
2 30
4 60
2-Efeito do pH
Inocular 0,1ml do microrganismo em tubos de ensaio contendo meio adequado a
diferentes pH (2,0; 4,0; 8,0; 10,0)e encubar a 30C por 48h
Tubo pH Houve
crescimento?
Concluso
1 2,0
2 4,0
3 7,0
4 10,0
3-Efeito da fonte de carbono
Inocular 0,1ml do microrganismo em tubos de ensaio contendo meios adequados (**),
todos os nutrientes so iguais com exceo a fonte de carbono. Encubar a 30C por 48h
de acordo com a tabela a seguir:
Tubo Fonte de carbono Houve
crescimento?
Concluso
1 Glicose
2 Celulose 1%(P/P)
3 Sacarose
4 Amido
5 Etanol (20%V/V)
6 Glicerol
3-Efeito da concentrao de sais
Inocular 0,1ml do microrganismo em tubos de ensaio contendo meios adequados (**),
todos os nutrientes so iguais com exceo concentrao de sal (NaCl). Encubar a
30C por 48h de acordo com a tabela a seguir:
Tubo Fonte de
carbono
Houve
crescimento?
Concluso
1 0,0% NaCl
3 1% NaCl
3 5% NaCl
4 8% NaCl
5 10% NaCl
Pergunta-se:
1. Voc espera que a levedura cresa em anaerobiose, aerobiose ou facultativa?
2. Quais as funes dos nutrientes de um meio de cultura?
3. Escolha um meio para autotrficos e outro para heterotrficos. Explique-os
4. Qual a funo especifica dos sais no crescimento celular?
5. Descreva etapa por etapa a via metablica envolvida
6. Quais os caminhos para o piruvato em aerobiose e anaerobiose? (use aqueles
dados em sala)
7. D 05 exemplos do uso industrial da via glicoltica
Descreva a lanadeira de eltrons em todas as suas etapas e onde ocorre na clula?
PRTICA 10: CARACTERIZAO DE LIPDIOS
Introduo
Lipdios podem ser caracterizados atravs de suas propriedades fsico-qumicas.
Em geral so solveis em gua e solveis em solventes apolares ou de baixa polaridade.
Os triacilgliceris, que constituem o principal grupo de lipdios, podem ser analisados
por hidrlise seguida de separao e caracterizao dos constituintes. Os triacilgliceris
podem ser hidrolisados por cidos minerais concentrados e por enzimas especficas
(lipases), liberando glicerol e cidos graxos. Na presena de bases sofrem hidrlise
alcalina (reao de saponificao), liberando glicerol e sais de cidos graxos (sabes),
como mostrado na Figura 2.
Figura 2 Hidrlise alcalina de um triacilglicerol.
Objetivos
Caracterizar as propriedades fsico-qumicas de triacilgliceris (estres de cidos
graxos); as reaes de hidrlise cida e alcalina (saponificao); o poder de sabes
solveis.
Procedimento
1. Solubilidade
Numere cinco tubos de ensaio e coloque 2,0 mL dos seguintes solventes: gua,
etanol, ter etlico, clorofrmio e acetona. Em seguida adicione 1,0 mL de leo vegetal a
cada tubo, agite-os. Verifique a solubilidades em cada tubo, agite-os. Verifique a
solubilidade em cada tubo e explique-as em termos fsico-qumicos.
2. Reao de saponificao (preparo de sabo)
Prepare a soluo alcolica de hidrxido de potssio a 20%, misturando 10,0 mL
da soluo aquosa de KOH a 40% e 10,0 mL de lcool etlico (soluo de potassa
alcolica) em um Erlenmeyer de 125 mL. Em seguida acrescente 5,0 mL de leo
vegetal e aquea o sistema em banho-maria fervente. Quando iniciar a fervura, faa
sucessivas retiradas de uma ou duas gotas do sistema, que devero ser acrescentadas a
tubos de ensaio contendo 2,0 mL de gua destilada, agite. Observe se h ou no a
formao de espuma. Explique e conclua.
Obs.: Reserve o contedo do Erlenmeyer para testes posteriores.
3. Separao de cidos graxos
Transfira 4,0 mL do contedo do Erlenmeyer (contendo sabo) para um tubo de
ensaio, acrescente um indicador de pH (2 gotas de fenolftalena). Em seguida coloque
gota a gota, sempre com agitao, HCl concentrado at a viragem do indicador (rseo
para incolor). Verifique a separao da mistura em duas fases.
Obs.: Reserve a soluo para o teste posterior (item 5).
4. Separao de sabo por salificao
Em um tubo de ensaio coloque 2,0 mL da soluo de sabo (item 2), adicione
10,0 mL de soluo saturada de cloreto de sdio (NaCl). Observe a separao do sabo.
Mostre atravs de reao o que ocorreu.
5. Ressaponificao
Transfira 4 gotas da soluo formada no experimento do item 3 para um tubo de
ensaio contendo 5,0 mL de gua destilada quente. Adicione gota a gota da soluo de
NaOH 1,0 mol/L at a solubilizao da parte oleosa. Agite o tubo e verifique a
formao da espuma. Explique a reao qumica ocorrida, o produto que se forma e o
mecanismo da reao.
Obs.: Reserve a soluo para o teste posterior (item 6).
6. Formao de sabo insolveis
Na presena de ons divalentes, como Ca
2+
ou Mg
2+
, os sabes tendem a
precipitar formando sabes insolveis sem poder detergente (Figura 3).
Figura 3 Formao de um sabo insolvel.
Transfira 1,0 mL do contedo do tubo de ensaio da experincia anterior (item 5)
para outro tubo de ensaio. Adicione 1,0 mL de gua destilada e 4 gotas de CaCl
2
a 1%.
Observe e justifique os resultados.
PRTICA 11: NDICE DE SAPONIFICAO
Introduo
O ndice de saponificao o nmero de mg de hidrxido de potssio (KOH)
necessrio para saponificar 1 grama de gordura ou leo. A sua determinao tem
importncia devido a relao entre o ndice de saponificao e o comprimento da cadeia
dos resduos de cidos graxos. Trs molculas de KOH so necessrias para neutralizar
3 cidos graxos liberados pela hidrlise dos triacilgliceris, no importando o tamanho
da cadeia dos cidos graxos. O ndice de saponificao correspondente a uma dada
massa de lipdios varia inversamente com a massa molar dos resduos de cidos graxos.
Os lipdios possuem duas fraes a saponificvel e a insaponificvel. A frao
insaponificvel constituda pelas vitaminas lipossolveis, pr-vitaminas, esteroides e
outros compostos.
Objetivos
Determinao do ndice de saponificao de leos vegetais comerciais.
Procedimento
O ndice de saponificao expresso em mg de KOH necessrio para neutralizar
os cidos graxos de 1g de gordura ou leo.
Em um Erlenmeyer de 250 mL rigorosamente limpo e seco pesar cerca de 1
grama de lipdio. Em seguida adicionar 25 mL de KOH alcolica. Levar o sistema ao
banho-maria fervente por 30 minutos. Retirar do banho e titular ainda quente com HCl
1,5 mol.L
-1
usando 2 gotas de fenolftalena como indicador.
Realizar um prova em branco usando 25 mL de KOH alcolica aquecido (cerca
de 5 minutos) e titular com HCl 0,5 mol.L
-1
, usando a fenolftalena como indicador.
Clculo
IS = (V
B
V
A
) x 28,05 / m
V
B
= volume do HCl gasto na titulao do branco em mL
V
A
= volume do HCl gasto na titulao da amostra em mL
m = massa da amostra em grama
Obs.: Como o ndice de saponificao expresso em mg de KOH, a frmula j contm
as transformaes do volume e da massa.
Produto ndice de saponificao
leo de soja 189-195
leo de milho 187-193
leo de girassol 188-194
leo de amendoim 188-195
leo de arroz 181-189
leo de algodo 189-198
Azeite de oliva 186-196
Azeite de dend 195-205
Gordura de coco 250-264
Gordura de leite 219-234
Vous aimerez peut-être aussi
- Aula - 16 - Quimica Geral C - QUI003 - 1 - 2022Document42 pagesAula - 16 - Quimica Geral C - QUI003 - 1 - 2022TiagoPas encore d'évaluation
- Bioquimica 1Document2 pagesBioquimica 1Felipe HiroPas encore d'évaluation
- 1Document1 page1Evelyn Alves Nunes SimonettiPas encore d'évaluation
- SonasolDocument11 pagesSonasolBriMariaPas encore d'évaluation
- Revestimentos para Ferramenta de Corte - Vinícius Mendonça Franco CançadoDocument13 pagesRevestimentos para Ferramenta de Corte - Vinícius Mendonça Franco CançadoVinícius MendonçaPas encore d'évaluation
- Prova 2 S25 2 Semestre 2021Document1 pageProva 2 S25 2 Semestre 2021ВЯЕИОPas encore d'évaluation
- Variações CronobiológicasDocument26 pagesVariações CronobiológicasLyslie Maron RibeiroPas encore d'évaluation
- Uc2 - Aula 7 - ArgiloterapiaDocument27 pagesUc2 - Aula 7 - ArgiloterapiaJeova SamuelPas encore d'évaluation
- Catalogo Epi Mrs TerceirizadasDocument36 pagesCatalogo Epi Mrs TerceirizadasIgor Vernetti AzambujaPas encore d'évaluation
- Relatório - 1Document14 pagesRelatório - 1lucas ronieryPas encore d'évaluation
- Apostila Inspeção de MotoresDocument58 pagesApostila Inspeção de MotoresLucas Silva100% (1)
- Lista de Exercicios 5 - Lic. QuimicaDocument3 pagesLista de Exercicios 5 - Lic. QuimicaAbebePas encore d'évaluation
- Capitulo 5 - Ciclos de Multiplos EstagiosDocument12 pagesCapitulo 5 - Ciclos de Multiplos EstagiosBruno Henrique HoinschyPas encore d'évaluation
- Tratamento Termico SuperficiaisDocument96 pagesTratamento Termico SuperficiaisGustavoSilva100% (1)
- Quimica Ambiental 3anoDocument6 pagesQuimica Ambiental 3anoJay PaulinhaPas encore d'évaluation
- Apostila Analise de Risco CetesbDocument237 pagesApostila Analise de Risco CetesbMaurílio Donizetti100% (1)
- Aula Suspensões SuzanaDocument22 pagesAula Suspensões SuzanaSuzana BenderPas encore d'évaluation
- Cinética Química - IntroduçãoDocument34 pagesCinética Química - IntroduçãoEdson Miranda MarquesPas encore d'évaluation
- Sabão Do Professor Luiz PauloDocument63 pagesSabão Do Professor Luiz PauloLilia Fernandes Vasconcelos100% (3)
- Tabela Recomendacao CaminhaoDocument1 pageTabela Recomendacao CaminhaoMarília MeneguzzoPas encore d'évaluation
- Tudo Se Transforma - Reações Químicas Os Primórdios: O Início Da QuímicaDocument16 pagesTudo Se Transforma - Reações Químicas Os Primórdios: O Início Da Químicafrancisco gomes100% (1)
- Apostila Física IDocument21 pagesApostila Física Ilviviane986Pas encore d'évaluation
- Pureza e RendimentoDocument1 pagePureza e RendimentoEdilson JuniorPas encore d'évaluation
- Transformação Dos MetaisDocument118 pagesTransformação Dos MetaisVanderson Soares de Araujo100% (1)
- Capítulo 12 - Nitrogênio e FósforoDocument18 pagesCapítulo 12 - Nitrogênio e FósforoThiago SilvaPas encore d'évaluation
- Quais Os Conceitos Importantes NR-20Document4 pagesQuais Os Conceitos Importantes NR-20vivaldoms144Pas encore d'évaluation
- LIVRO IEC Corrosão em Instalações Metálicas Enterradas Ou SubmersasDocument211 pagesLIVRO IEC Corrosão em Instalações Metálicas Enterradas Ou Submersasvitoripolo75% (4)
- Determinação de Acidez em AlimentosDocument2 pagesDeterminação de Acidez em AlimentosWanderson CândidoPas encore d'évaluation
- Quimica Relatorio ExperiementalDocument9 pagesQuimica Relatorio ExperiementalFernando Silva MonteiroPas encore d'évaluation
- Preparo de Água CloradaDocument2 pagesPreparo de Água CloradaJoemar Mendes Rego100% (1)