Académique Documents
Professionnel Documents
Culture Documents
Ligações Químicas (Resumo)
Transféré par
RayssaAnndradeTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ligações Químicas (Resumo)
Transféré par
RayssaAnndradeDroits d'auteur :
Formats disponibles
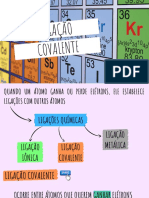
LIGAES QUMICAS
(FICHA RESUMO)
Se dois tomos se combinam entre si, dizemos que foi estabelecida entre eles uma LIGAO
QUMICA. Os eltrons mais externos (da ltima camada) do tomo so os responsveis pela ocorrncia
da ligao qumica.
Para ocorrer uma ligao qumica necessrio que os tomos percam ou ganhem eltrons, ou,
ento, compartilhem os eltrons de sua ltima camada.
Na maioria das ligaes, os tomos ligantes possuem distribuio eletrnica semelhante de um
gs nobre, isto , apenas o nvel K, completo, ou, 8 eltrons em sua ltima camada. Esta idia foi
desenvolvida pelos cientistas Kossel e Lewis e ficou conhecida como TEORIA ou REGRA DO OCTETO.
LIGAO INICA ou ELETROVALENTE: Esta ligao ocorre devido ATRAO ELETROSTTICA
entre ons de cargas opostas. Na ligao inica os tomos ligantes apresentam uma grande diferena de
eletronegatividade, isto , um METAL e o outro AMETAL.
EX:
UMA REGRA PRTICA : Para compostos inicos poderemos usar na obteno da frmula final o
seguinte esquema geral:
+x
-y
Ay
Bx
CARACTERISTICAS DOS COMPOSTOS IONICOS: Os compostos inicos apresentam um conjunto de
caractersticas que podem ser explicadas em virtude das ligaes inicas, que so foras eletrostticas
existentes entre os ons.
Formao de cristais: Um Cristal Inico um slido isolante formado por ons positivos e ons negativos,
que se atraem com fora eletrosttica. O exemplo mais simples o cristal de NaCl, onde o on de Na+
(esferas pequenas) e on de Cl- (esferas grandes) atraem-se eletrostaticamente para formar o cristal.
Um cristal ideal tem seus ons distribudos periodicamente, formando a rede cristalina, e por isso so
freqentemente encontrados na natureza com belas formas externas, que refletem a sua estrutura
microscpica.
LIGAO COVALENTE OU MOLECULAR: A principal caracterstica desta ligao o compartilhamento
(formao de pares) de eltrons entre os dois tomos ligantes. Os tomos que participam da ligao
covalente so AMETAIS, SEMIMETAIS e o HIDROGNIO. Os pares de eltrons compartilhados so
contados para os dois tomos ligantes. quando cada um dos tomos ligantes contribui com um eltron
para a formao do par.
Consideremos, como exemplo, a unio entre dois tomos do ELEMENTO HIDROGNIO (H) para formar a
molcula da substncia SIMPLES HIDROGNIO (H2).
Consideremos, como outro exemplo, a unio entre dois tomos do ELEMENTO HIDROGNIO e um
tomo do ELEMENTO OXIGNIO para formar a substncia COMPOSTA GUA (H2O)
LIGAO COVALENTE DATIVA: Se apenas um dos tomos contribuir com os dois eltrons do par, a
ligao ser COVALENTE DATIVA ou COORDENADA. A ligao dativa indicada por uma seta que sai
do tomo que cede os eltrons chegando no tomo que recebe estes eltrons, atravs do
compartilhamento.
Vamos mostrar a ligao DATIVA, inicialmente, na molcula do dixido de enxofre (SO2), onde os tomos
de oxignio e enxofre possuem 6 eltrons na camada de valncia.
LIGAES METLICAS: Este tipo de ligao entre metais no pode
ser explicada nem pela ligao covalente nem pela inica,
configurando-se como um tipo especfico e diferenciado de ligao
entre tomos. Na ligao metlica, os eltrons mais externos, por se
encontrarem muito distantes do ncleo, movimentam-se livremente,
formando um mar de eltrons dentro do retculo cristalino. Em outras
palavras, os metais so formados por um aglomerado de ons ctions
mergulhados em uma nuvem ou mar de eltrons.
Propriedades dos metais:
- Alta condutividade eltrica e trmica;
- Alta maleabilidade e alta ductibilidade;
- Altos pontos de fuso e ebulio;
- Bilho metlico (com exceo do cobre e do ouro, que tm cor
avermelhada e dourada, respectivamente).
*Os metais so encontrados na natureza no estado slido, com exceo do
mercrio, que encontrado no estado lquido;
**Poucos so os metais encontrados puros na natureza, entre eles esto o ouro, a prata, a platina e o bismuto. Os
demais so encontrados em forma de compostos, sendo os mais comuns os xidos. O metal ferro, por exemplo,
retirado do minrio de ferro hematita, que uma combinao com oxignio.
***Ateno: os metais s conduzem eletrecidade se estiverem no estado slido ou lquido (metal fundido).
LIGAS METLICAS: Os metais tambm podem unir-se entre ou si ou a outros elementos, formando
misturas slidas homogneas (ou solues) chamadas de ligas metlicas. Essas ligas so muito mais
utilizadas do que os metais puros, pois possuem caractersticas que estes no tm. O ouro, por exemplo,
muito malevel, ao adicionar cobre ele fica mais resistente e pode ser utilizado na fabricao de jias.
Exemplos de ligas metlicas:
- Ao comum: liga de ferro e carbono. Por ter maior resistncia trao, muito usado em construes, pontes,
fogo, geladeira.
- Ao inoxidvel: liga de ferro, carbono, crmo e nquel. Como no inferruja (no oxida), usado em talheres, foges,
pias, peas de carro, vages de metr.
- Bronze: liga de cobre e estanho. normalmente usado em esttuas e sinos.
- Lato: liga de cobre e zinco. Usado em armas e torneiras.
- Ouro 18 quilates: liga de ouro e cobre. Usado para fabricao de jias.
- Amlgama dental: liga de mercrio, prata e estanho. Usado em obturaes.
FORAS INTERMOLECULARES
As foras intermoleculares so foras de atrao que ocorrem entre as molculas, mantendo-as
unidas, e so bem mais fracas, quando comparadas s foras intramoleculares (ligao inica e
covalente), encontradas entre ons e tomos, que formam a substncia. As molculas de uma substncia
slida ou lquida se mantm unidas atravs da atrao existente entre elas. Quanto maior for a fora de
atrao maior ser a coeso entre as molculas. Isso ocasionar um aumento nos pontos de fuso e
ebulio da substncia. As molculas dos gases praticamente no exercem foras de atrao entre si. Por
isso os gases apresentam baixo ponto de ebulio e extrema facilidade de se expandir. So divididas em
3 partes:
Dipolo permanente - Dipolo permanente: Atrao entre molculas polares. Os dipolos atraem-se
pelos polos opostos (positivo-negativo).
Dipolo induzido - Dipolo induzido: Tambm chamada Fora de London, uma atrao que
ocorre entre molculas apolares, essa fora mais fraca que a do tipo dipolo permanente - dipolo
permanente. Logo, as substncias que apresentam esse tipo de ligao apresentam menor ponto
de fuso e ebulio.
Ligaes de hidrognio: Tambm conhecidas como pontes de hidrognio, so um caso especial
da atrao entre dipolos permanentes. As ligaes de hidrognio so atraes intermoleculares
anormalmente intensas e ocorrem entre molculas que apresentam ligaes entre hidrognio e
tomos muito eletronegativos (F, O, N). As ligaes de hidrognio so atraes muito fortes e
contribuem de modo decisivo na ligao intermolecular , o que explica os pontos de ebulio
normalmente altos de molculas como H2O, NH3 e HF.
Vous aimerez peut-être aussi
- Trabalho - Ligações QuímicasDocument25 pagesTrabalho - Ligações QuímicascarolineaugustaPas encore d'évaluation
- Ligacoes QuimicasDocument23 pagesLigacoes Quimicasailtongospel8167Pas encore d'évaluation
- Ligação CovalenteDocument12 pagesLigação CovalentelfdmrPas encore d'évaluation
- 2 - Ligação Covalente (Lewis e Propriedades Das Ligações) PDFDocument30 pages2 - Ligação Covalente (Lewis e Propriedades Das Ligações) PDFJullyPas encore d'évaluation
- Ligacoes QuimicasDocument4 pagesLigacoes QuimicasGiovanne BritoPas encore d'évaluation
- Apostila Ligações Químicas - (Comentada)Document8 pagesApostila Ligações Químicas - (Comentada)Maurício Monteiro JúniorPas encore d'évaluation
- Estrutura Atômica-Aula 1 - Química Geral.Document39 pagesEstrutura Atômica-Aula 1 - Química Geral.Amy AdamsPas encore d'évaluation
- Ligação CovalenteDocument3 pagesLigação CovalentetrigemeasPas encore d'évaluation
- Propriedades Gerais Da MatériaDocument6 pagesPropriedades Gerais Da MatériaNathaniel RossiPas encore d'évaluation
- Aula 3 - LigaçãoquimicaDocument65 pagesAula 3 - LigaçãoquimicaLeonardo MacielPas encore d'évaluation
- Ligações Químicas - Profº Agamenon RobertoDocument14 pagesLigações Químicas - Profº Agamenon Robertocb_penatrujillo0% (1)
- Ligações Químicas - Iônica e CovalenteDocument3 pagesLigações Químicas - Iônica e CovalenteJerusa FreitasPas encore d'évaluation
- Química 1°termo EJA PDFDocument6 pagesQuímica 1°termo EJA PDFAimara Marzolla Gutierres MachadoPas encore d'évaluation
- Lista de Exercícios - PolímerosDocument5 pagesLista de Exercícios - Polímerosalexchacal100% (1)
- Tabela PeriódicaDocument1 pageTabela PeriódicaSAYZINxl100% (1)
- 9º Ano - Ligação IônicaDocument15 pages9º Ano - Ligação IônicaMichelle OliveiraPas encore d'évaluation
- História Da Quimica Orgânica e Nomenclatura HidrocarbonetosDocument9 pagesHistória Da Quimica Orgânica e Nomenclatura HidrocarbonetosVanessa SchenegoskiPas encore d'évaluation
- CICLOS BIOGEOQUÍMICOS e Sucessão EcologicaDocument5 pagesCICLOS BIOGEOQUÍMICOS e Sucessão EcologicaSebastião Lopes100% (2)
- Lista de Exercícios Bacteria e ArchaeaDocument1 pageLista de Exercícios Bacteria e ArchaeaRoseane AlvesPas encore d'évaluation
- (AULA 01) Introdução À Química OrgânicaDocument7 pages(AULA 01) Introdução À Química OrgânicaJonathan Araújo100% (1)
- Substâncias e Misturas (Nota de Aula e Exercícios)Document5 pagesSubstâncias e Misturas (Nota de Aula e Exercícios)Sidney Christ100% (1)
- 16-Ligações IônicasDocument3 pages16-Ligações Iônicasnv77vnmPas encore d'évaluation
- Aula 06 Classificacao PeriodicaDocument10 pagesAula 06 Classificacao PeriodicaresolvidosPas encore d'évaluation
- Ligações Quimica 2 - A GraçaDocument2 pagesLigações Quimica 2 - A GraçaPetrustn50% (2)
- Ex. Quimica Do CotidianoDocument2 pagesEx. Quimica Do CotidianoIzabelaMendes100% (1)
- Modelos Atomicos Fatecie - 9 AnoDocument1 pageModelos Atomicos Fatecie - 9 AnoPedro RibeiroPas encore d'évaluation
- Conteúdo de Quimica No Ensino MedioDocument3 pagesConteúdo de Quimica No Ensino MedioGraziano Souza OliveiraPas encore d'évaluation
- Lista 1 Modelos AtomicosDocument5 pagesLista 1 Modelos AtomicosjaspersamuPas encore d'évaluation
- Matéria e Suas PropriedadesDocument22 pagesMatéria e Suas PropriedadesgabriellasssilvaPas encore d'évaluation
- Atividades-Biologia I-Respiração CelularDocument7 pagesAtividades-Biologia I-Respiração CelularGabrielly Gonçalves100% (1)
- 02 - Química Orgânica - Postulados de KekuléDocument2 pages02 - Química Orgânica - Postulados de KekuléWalber ReisPas encore d'évaluation
- Reações QuímicasDocument3 pagesReações QuímicasLaura LopesPas encore d'évaluation
- Avaliação Sobre Modelos Atômicos Epropriedades Fisiscas e QuimicasDocument8 pagesAvaliação Sobre Modelos Atômicos Epropriedades Fisiscas e QuimicasGéssica RamosPas encore d'évaluation
- Biologia Desequilibrios Ambientais FacilDocument9 pagesBiologia Desequilibrios Ambientais FacilAlvaro NevesPas encore d'évaluation
- EXERCÍCIO de FIXAÇÃO - Modelos Atomicos 01Document2 pagesEXERCÍCIO de FIXAÇÃO - Modelos Atomicos 01Jhonny LazaroPas encore d'évaluation
- Metabolismo Energetico - Mapa MentalDocument1 pageMetabolismo Energetico - Mapa Mentaljuliano.bach100% (1)
- Isomeria Espacial - Isomeria GeométricaDocument4 pagesIsomeria Espacial - Isomeria GeométricaAlda ErnestinaPas encore d'évaluation
- Avaliação InvertebradosDocument2 pagesAvaliação InvertebradosCíntia LimaPas encore d'évaluation
- Aula 01 - REAÇÕES QUÍMICASDocument4 pagesAula 01 - REAÇÕES QUÍMICASLuciana Sant'AnnaPas encore d'évaluation
- Velocidade Média de Uma ReaçãoDocument34 pagesVelocidade Média de Uma ReaçãoDébora Alvim0% (1)
- Cinética QuímicaDocument29 pagesCinética QuímicaProfessoraGianiPas encore d'évaluation
- Exercícios Número Atômico e MassaDocument5 pagesExercícios Número Atômico e MassaRenata ToledoPas encore d'évaluation
- Exercícios TermoquímicaDocument4 pagesExercícios TermoquímicaHoo FijiPas encore d'évaluation
- Lista Plantao Ciencias Do 7 Ano 2 Bimestre 19-3-14Document5 pagesLista Plantao Ciencias Do 7 Ano 2 Bimestre 19-3-14Ricardo AraujoPas encore d'évaluation
- Constituintes Básicos Dos Seres VivosDocument9 pagesConstituintes Básicos Dos Seres VivosOlga Igrejas CruzPas encore d'évaluation
- CH 1 - Introdução e MembranaDocument38 pagesCH 1 - Introdução e MembranaMaxwell M. RibeiroPas encore d'évaluation
- Atomistica EXERCICIOSDocument18 pagesAtomistica EXERCICIOSMario LuizPas encore d'évaluation
- Estrutura AtomicaDocument11 pagesEstrutura AtomicaBruno Matassoli BragaPas encore d'évaluation
- QUÍMICA - Apostila de Modelos AtômicosDocument5 pagesQUÍMICA - Apostila de Modelos AtômicosRtyu IuytPas encore d'évaluation
- Cinética Química 2015Document52 pagesCinética Química 2015RomeuComastriAbdalaPas encore d'évaluation
- Atividades Sobre Ligações QuímicasDocument3 pagesAtividades Sobre Ligações QuímicasCHIARA CRISTINA MARAFON CORREIAPas encore d'évaluation
- Exercícios de Ligações Químicas e Suas PropriedadesDocument3 pagesExercícios de Ligações Químicas e Suas PropriedadesMIRIAM FEITOSAPas encore d'évaluation
- Aula 1 - Modelos AtômicosDocument30 pagesAula 1 - Modelos Atômicosaugusto cesar januarioPas encore d'évaluation
- Exercicios Introducao A Biologia Metodo CientificoDocument5 pagesExercicios Introducao A Biologia Metodo CientificoLeidimar LustosaPas encore d'évaluation
- Apostila Completa de MetrologiaDocument94 pagesApostila Completa de Metrologiaaguiark510100% (7)
- Volume MolarDocument1 pageVolume MolarDarlan SilvaPas encore d'évaluation
- Aula ERROS TRATAMENTOS DADOS PDFDocument45 pagesAula ERROS TRATAMENTOS DADOS PDFLucas PereiraPas encore d'évaluation
- 0187-Química Geral PráticaDocument5 pages0187-Química Geral PráticaJuliana Mantovani de MarcoPas encore d'évaluation
- Aula 1 - Perspectiva Histórica Do Estudo Dos NutrientesDocument31 pagesAula 1 - Perspectiva Histórica Do Estudo Dos NutrientesFernanda Maria Vital OliveiraPas encore d'évaluation
- Termoquímica: Trocas de Energia CalorDocument17 pagesTermoquímica: Trocas de Energia Caloreng civil Paulo Vitor MedeirosPas encore d'évaluation
- Carefree - FISPQDocument13 pagesCarefree - FISPQMurilo Pucineli50% (2)
- Trocadores de CalorDocument17 pagesTrocadores de CalorDouglas RamosPas encore d'évaluation
- Estudo Do Fabrico e Da Degradação de Azulejos Portugueses HistóricosDocument252 pagesEstudo Do Fabrico e Da Degradação de Azulejos Portugueses HistóricosCesarPas encore d'évaluation
- Caderno de Questões Química - Ciclo IDocument45 pagesCaderno de Questões Química - Ciclo ISabrina MaraPas encore d'évaluation
- Prod 739Document2 pagesProd 739AlejandroAvilaPas encore d'évaluation
- Resumo FotoquímicaDocument8 pagesResumo FotoquímicaGeorge LuisPas encore d'évaluation
- FA Nº4 - 7ano - 19 20Document8 pagesFA Nº4 - 7ano - 19 20Cristina RodriguesPas encore d'évaluation
- Aula - 1 - Introducao A Química AnalíticaDocument32 pagesAula - 1 - Introducao A Química AnalíticaPatrícia VieiraPas encore d'évaluation
- ForjamentoDocument61 pagesForjamentoWilliam CastroPas encore d'évaluation
- Luz Pulsada EscritoDocument9 pagesLuz Pulsada EscritoBia PeronPas encore d'évaluation
- Leos Essenciais - Wintergreen - Wintergreen - 15ml - 60203932Document1 pageLeos Essenciais - Wintergreen - Wintergreen - 15ml - 60203932Brina EstecaPas encore d'évaluation
- A Origem Dos Nomes e Símbolos Dos Elementos QuímicosDocument3 pagesA Origem Dos Nomes e Símbolos Dos Elementos QuímicosLourival FariasPas encore d'évaluation
- 68684ebd-f28f-4ee6-ae36-13b4eeb0bd21Document260 pages68684ebd-f28f-4ee6-ae36-13b4eeb0bd21Davi Marciano100% (2)
- Catalogo Split v21 Manaus OnepageDocument4 pagesCatalogo Split v21 Manaus OnepagemessiaslgPas encore d'évaluation
- 05 Folhas Calculo PMV PPDDocument19 pages05 Folhas Calculo PMV PPDruibandeiraPas encore d'évaluation
- Manual Alta Vazao StratemaDocument34 pagesManual Alta Vazao StratemaLuiz Claudio Moura Combat100% (2)
- Espectroscopia RamanDocument19 pagesEspectroscopia RamanDiego MontesPas encore d'évaluation
- Catalogo Defeitos em Injetores Common RailDocument57 pagesCatalogo Defeitos em Injetores Common Railmanuel1251589% (9)
- Pe Ex - Revisao.av2 Ciencias 9ano 1tri PDFDocument4 pagesPe Ex - Revisao.av2 Ciencias 9ano 1tri PDFAdeptus XiaoPas encore d'évaluation
- 2019-05 Bula PDFDocument12 pages2019-05 Bula PDFThiago CostaPas encore d'évaluation
- Mananejo de Solução NutritivaDocument119 pagesMananejo de Solução NutritivaFábio PedroPas encore d'évaluation
- Manual Materias+Técnicas Tradicionais Assentamento AzulejosDocument38 pagesManual Materias+Técnicas Tradicionais Assentamento AzulejosvitorcscostaPas encore d'évaluation
- Química 10º AnoDocument5 pagesQuímica 10º AnoMatildePas encore d'évaluation