Académique Documents
Professionnel Documents
Culture Documents
Bioquimica de Las Proteinas
Transféré par
Ana Maria CalderaCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Bioquimica de Las Proteinas
Transféré par
Ana Maria CalderaDroits d'auteur :
Formats disponibles
BIOQUIMICA DE LAS PROTEINAS
2. ProtenasSon polmeros formados por monmeros llamados
aminocidos.Hay 20 aminocidos en la naturaleza, que se combinan
para formar miles de protenas (muchos grupos funcionales: alcoholes,
tioles, carboxiamidas, etc.)Son las macromolculas ms verstiles de los
seres vivos.
4. Cada protena tiene: Una estructura funcional lgica y propia. Ciertas
caractersticas comunes a las dems protenas.
5. Aminocidos Rompiendo los enlaces peptdicos que ligan los
aminocidos ingeridos,stos pueden serabsorbidos por el intestinohasta
la sangre yreconvertidos en tejido.
6. AminocidosExisten en la naturaleza aproximadamente unos300
aminocidos diferentes, pero solo 20 de ellosson de importancia al
encontrarse en la formacinde las molculas de protena de todas las
formasde vida: vegetal, animal o microbiana. Estos sonsintetizados a
partir de precursores ms sencilloso absorbidos como nutrientes.
7. AminocidosDe los 20 aminocidos que componen las protenas, ocho
se consideran esenciales es decir: como el cuerpo no puede sintetizarlos,
deben ser tomados ya listos a travs de los alimentos. Si estos
aminocidos esenciales no estn presentes al mismo tiempo y en
proporciones especficas, los otros aa, no pueden utilizarse para
construir las protenas.
9. ESTEREOQUMICA DE LOS AMINOCIDOSLos aa son estructuras
tetradricasISMEROSBioqumica Stryer, Berg y Tymoczko Ed. Revert,
S.A. 2003
10. La estructura tridimensional es de crucial importancia para la
funcinRepresentacin:a) Tridimensionalb) En perspectivaBioqumica
Mathews, van Holde y Ahern Addison Wesley 2002
11. CLASIFICACIN DE LOS AMINOCIDOS11
12. 12ALIFTICOSNO POLARESAROMTICOSPOLARES SIN CARGACON
GRUPOS CIDOSaaCON N BSICOPOLARES CON CARGA
13. CADENAS LATERALES DE LOS AAALIFTICOS (Gli, Ala, Val, Leu, Ileu,
Pro)AROMTICOS (Phe, Tyr, Trp)GRUPOS OH, S (Ser, Treo, Cys,
Met)BSICOS (His, Arg, Lys)CIDOS Y SUS AMIDAS (Asp, Glu, Apn, Gln)AA
MODIFICADOS4-hidroxiprolinad-hidroxilisinaAA NO PROTEICOSAc. gaminobutricoD-Ala, D-Glu
14. AMINOCIDOS ALIFTICOSEl ms pequeoFlexibilidad estr.
Hidrofobicidad(interior de prot.)Dificulta el plegamientoBioqumica
Mathews, van Holde y Ahern Addison Wesley 2002
15. AMINOCIDOS AROMTICOS Ligeramente hidrfobos Interacciones
hidrofbicasPuentes de HidrgenoActividad
EnzimticaHidrfoboAbsorben la luz en el UV (280 nm)Bioqumica
Mathews, van Holde y Ahern Addison Wesley 2002
16. AMINOCIDOS CON OH O SCadenas dbilmente polares (algo
hidrfilos)Pueden formar puentes de H con el aguaDos cys pueden
formar un puente o enlace disulfuroBioqumica Mathews, van Holde y
Ahern Addison Wesley 2002
17. AMINOCIDOS BSICOSEl menos bsicoCat. Enzimt. (H+)Carga + a
pH fisiolgicoMuy polares, en la superficie de protenas
18. AMINOCIDOS CIDOS Y SUS AMIDASCarga - a pH fisiolgicoPolares,
cadena lateral sin cargaHidrfilos, en la superficie de
protenasBioqumica Mathews, van Holde y Ahern Addison Wesley
2002
19. AA NO PROTEICOSD-Ala, D-GluOH4-OH prolinaAc. gaminobutrico+H3N-CH2-CH2-CH2-COO-OH( )2L-HomoserinaL-OrnitinadhidroxilisinaAA MODIFICADOSBioqumica Mathews, van Holde y Ahern.
Addison Wesley 2002
20. Valina (Val) Leucina (Leu) Treonina (Thr) Lisina (Lys) Triptfano(Trp)
Histidina (His) Fenilalanina (Phe) Isoleucina (Ile) Arginina (Arg)
(Requerida en nios y tal vez ancianos) Metionina (Met) Aminoacidos
esenciales
21. Alanina (Ala) Prolina (Pro) Glicina (Gly) Serina (Ser) Cistena (Cys)
Asparagina (Asn) Glutamina (Gln) Tirosina (Tyr) cido asprtico (Asp)
cido glutmico (Glu) Aminoacidos sintetizados por el cuerpo
22. PROPIEDADES DE LOS AMINOCIDOS22
23. Caractersticas cido-Base de los AminocidosLos grupos -COOH y
-NH2 de los aminocidos son capaces de ionizarse (al igual que los
grupos-R cidos y bsicos de los aminocidos). Como resultado de su
capacidad de ionizacin las siguientes reacciones de equilibrio inico
pueden ser escritas:pK1 R-COOH <> R-COO + H+cidopK2 R-NH3+
<> R-NH2 + H+Bsico
24. Las reacciones de equilibrio, segn lo escrito arriba, demuestran que
los aminocidos contienen por lo menos dos grupos cidos dbiles. Sin
embargo, el grupo carboxilo es un cido ms fuerte que el grupo amino.
A pH fisiolgico (alrededor 7.4) el grupo carboxilo no estar protonado y
el grupo amino protonado. Un aminocido con un grupo-R no ionizable
sera elctricamente neutro a este pH. Esta especie se llama un
zwitterion.
26. Como los cidos orgnicos tpicos, la fuerza cida de los grupos
carboxilos, amino y grupos-R ionizables en los aminocidos se pueden
definir por la constante de disociacin, Ka o ms comnmente el
logaritmo negativo de Ka, la pKa. La carga neta (la suma algebraica de
todos los grupos con carga presentes) de cualquier aminocido, pptido
o protena, depender del pH del ambiente acuoso circundante. Cuando
el pH de una solucin de aminocido o protenas cambia la carga neta de
los aminocidos tambin cambiar. Este fenmeno se puede observar
durante la titulacin de cualquier aminocido o protena. Cuando la
carga neta de un aminocido o de una protena es cero el pH ser
equivalente al punto isoelctrico:pi.
27. A pH cido: prevalece la especie con carga +A pH bsico: prevalece
la especie con carga Hay un valor de pH para el cul la carga de la
especie es cero. (zwitterin)pI= pK1 + pK2para un aa neutro2Punto
isoelctrico: valor de pH al cul la carga neta del aminocido es
cero.27Punto isoelctrico
28. PPTIDOS
29. Polmeros de aminocidos de PM menor a 6000 daltons ( <50
aa)Dipptido: 2 aaTripptido: 3 aaTetrapptido: 4 aaPentapptido: 5
aaExtremo N-terminal: comienzo de la cadenaExtremo C-terminal: fin de
la cadena
30. Se nombran desde el extremo N-terminal al C-terminal, usando la
terminacin il, excepto para el ltimo aa.Ej: ser-asp-tyr-lis-ala-cysserilaspartil-tirosil-lisil-alanil-cystenaNOMENCLATURA
31. EJEMPLOS:OCITOCINA: hormona que estimula la contraccin del
tero.GLUCAGN: hormona que tiene acciones contrarias a la
Insulina.ANTIBITICOSGLUTATIN: glu-cys-gli, participa en reacciones
Redox de la clula.PEPTIDOS
32. PROTEINAS
33. DEFINICINBiopolmeros de aminocidos de mas de 6000daltons,
indispensables para la procesos vitalesde los seres vivos.Estn formadas
por C, H, O, N y S.
35. PROPIEDADES CIDOS-BASE: punto isoelctrico.SOLUBILIDAD:Forman
dispersiones en aguaEfecto del pH: hace variar la carga.Efecto de las
sales:Baja [ ]: aumenta la solubilidadAlta [ ]: disminuye la
solubilidadEfecto de solventes poco polares: disminuye la
solubilidad.PROPIEDADES DE LAS PROTEINAS
36. ESTRUCTURA TRIDIMENSIONAL DE LAS PROTENAS
37. Las protenas tienen 4 niveles de organizacin:ESTRUCTURA
PRIMARIAESTRUCTURA SECUNDARIAESTRUCTURA
TERCIARIAESTRUCTURA CUATERNARIA
38. ESTRUCTURA PRIMARIAHace referencia a:La identidad de
aminocidos.La secuencia de aminocidos.La cantidad de
aminocidos.La variacin en un solo aa hace que cambie su funcin
biolgica.Los aa se unen por UNIONES PEPTDICAS.
39. Interaccines entre aa que se encuentran prximos en la cadena.La
cadena no es lineal, adopta formas en el espacio.Los aa interaccionan
por puentes H.Tipos de estructuras secundarias:HLICE ALFAHOJA
PLEGADA BETAAL AZAR.ESTRUCTURASECUNDARIA
40. HELICE ALFALos grupos R de los aa se orientan hacia el exterior.Se
forman puentes de H entre el C=O de un aa y el NH- de otro que se
encuentra a 4 lugares.Hay 3.6 aa por vuelta.Ej: queratina.
41. HOJA PLEGADA BETALos grupos R se orientan hacia arriba y abajo
alternativamente.Se establecen puentes H entre C=O y NH- de aa que se
encuentran en segmentos diferentes de la cadena.Ej. Fibrona (seda)
42. ESTRUCTURA TERCIARIAUna cadena con estructura secundaria
adquiere una determinada dispocin en el espacio por interacciones
entre aa que se encuentran en sitios alejados de la cadena.Protenas
globulares: se pliegan como un ovillo.Protenas fibrosas: tiene aspecto
alargado.Ej: mioglobina
43. ESTRUCTURA TERCIARIA
44. ESTRUCTURA CUATERNARIASurge de la asociacin de varias cadenas
con estructuras terciarias.Intervienen las mismas interacciones que en la
estructura terciaria.
Las inmunoglobulinas son glicoproteinas que actuan como anticuerpos. Pueden
encontrarse circulando en sangre, en las secreciones o unidas a la superficie de
las membranas de los linfocitos B.
Las inmunoglobulinas se producen como respuesta a la deteccion de moleculas
extranhas en nuestro cuerpo. Estas moleculas extranas que desencadenan la
produccion de anticuerpos se denominan antigenos.
Las inmunoglobulinas circulantes aparecen en una electroforesis del plasma
formando parte de la fraccion de las proteinas plasmaticas de las gamma
globulinas.
Vous aimerez peut-être aussi
- PsicofarmacologíaDocument42 pagesPsicofarmacologíaAna Maria CalderaPas encore d'évaluation
- Primary:documents/clase 10 Lactante MenorDocument12 pagesPrimary:documents/clase 10 Lactante MenorAna Maria CalderaPas encore d'évaluation
- Trastornos de La PersonalidadDocument16 pagesTrastornos de La PersonalidadAna Maria CalderaPas encore d'évaluation
- Valores Normales de LaboratorioDocument8 pagesValores Normales de Laboratoriojoserodrr100% (1)
- Semiologia Respiratoria en PediatriaDocument8 pagesSemiologia Respiratoria en PediatriaCristina Zavaleta Calderon100% (1)
- Complicaciones GeneralesDocument1 pageComplicaciones GeneralesAna Maria CalderaPas encore d'évaluation
- Abscesos HepáticosDocument1 pageAbscesos HepáticosAna Maria CalderaPas encore d'évaluation
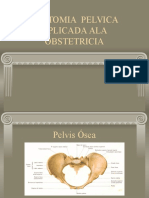
- DR Moya Anatomia PelvicaDocument23 pagesDR Moya Anatomia PelvicaJess Mtz RPas encore d'évaluation
- PAtogenosDocument6 pagesPAtogenosAna Maria CalderaPas encore d'évaluation
- 1207664938.evaluación de La Pelvis MaternaDocument14 pages1207664938.evaluación de La Pelvis MaternajacksamyPas encore d'évaluation
- Anatomia de La Pelvis y PelvimetriaDocument2 pagesAnatomia de La Pelvis y PelvimetriaAngel ReyesPas encore d'évaluation
- Métodos de Abstinencia PeriódicaDocument7 pagesMétodos de Abstinencia PeriódicaAna Maria CalderaPas encore d'évaluation
- PelvisDocument14 pagesPelvisRoggerSolanoPas encore d'évaluation
- PAtogenosDocument6 pagesPAtogenosAna Maria CalderaPas encore d'évaluation
- El Niño EscolarDocument8 pagesEl Niño EscolarAna Maria CalderaPas encore d'évaluation
- Enfermedades Eruptivas de La Infancia Seminario.Document5 pagesEnfermedades Eruptivas de La Infancia Seminario.Ana Maria CalderaPas encore d'évaluation
- Cambios en La Pubertad y AdolescenciaDocument5 pagesCambios en La Pubertad y AdolescenciaEleazarEmilioEmanuelTayMoraesPas encore d'évaluation
- 23 36Document14 pages23 36Zarys Galicia CanacascoPas encore d'évaluation
- Certificados IntegradosDocument4 pagesCertificados IntegradosAna Maria CalderaPas encore d'évaluation
- Consenso Sovetorax 2008Document98 pagesConsenso Sovetorax 2008Oscar Milano PalaciosPas encore d'évaluation
- Clinica Pediatrica IDocument34 pagesClinica Pediatrica IJaime EmilioPas encore d'évaluation
- El Niño PreescolarDocument18 pagesEl Niño PreescolarAna Maria CalderaPas encore d'évaluation
- Solicitud BECA Diplomado ANUVDocument1 pageSolicitud BECA Diplomado ANUVAna Maria CalderaPas encore d'évaluation
- 1 Apuntes..Document189 pages1 Apuntes..Caco MarciusPas encore d'évaluation
- Tarea 12 Laboratorio Clinico 13 NazaretDocument2 pagesTarea 12 Laboratorio Clinico 13 NazaretGIOMER EDISSON SANDOVAL SUCLUPE100% (1)
- Sesion de Aprendizaje Estructura de La CelulaDocument13 pagesSesion de Aprendizaje Estructura de La CelulaHeather Davis100% (1)
- Taller de Ciencias Grado TerceroDocument11 pagesTaller de Ciencias Grado Tercerodeicy carvajalPas encore d'évaluation
- Producción de Inoculante de Fijadores de N2Document7 pagesProducción de Inoculante de Fijadores de N2Linda PrincesaPas encore d'évaluation
- BRI Guía de Investigación Recombinación o Funciones Alternas de Anticuerpos Pablo PeraltaDocument3 pagesBRI Guía de Investigación Recombinación o Funciones Alternas de Anticuerpos Pablo PeraltaAbel CamachoPas encore d'évaluation
- Agua Hexagonal VPDocument10 pagesAgua Hexagonal VPJose Manuel Ruiz Ahumada100% (2)
- Reguladores de Crecimiento para Generar Raíces (Díaz) PDFDocument52 pagesReguladores de Crecimiento para Generar Raíces (Díaz) PDFAlexander Alvarez MolinaPas encore d'évaluation
- Clase 1 ChacinadosDocument36 pagesClase 1 ChacinadosMarcelo BoyéPas encore d'évaluation
- Anatomía HumanaDocument4 pagesAnatomía HumanaQuironXPas encore d'évaluation
- Como Hacer Semillas de Marihuana FeminizadasDocument8 pagesComo Hacer Semillas de Marihuana FeminizadasJeremias PalmeroPas encore d'évaluation
- Monsanto - Preguntas Frecuentes Acerca Del Glifosato y Los Herbicidas Agrícolas RoundupDocument4 pagesMonsanto - Preguntas Frecuentes Acerca Del Glifosato y Los Herbicidas Agrícolas RoundupVivian GaitanPas encore d'évaluation
- Fisiologia Vegetal GerminacionDocument35 pagesFisiologia Vegetal GerminacionStefany Fiorella Tarazona AlejandroPas encore d'évaluation
- Grado 5: ¿Cómo Se Reproducen Los Seres Vivos?Document23 pagesGrado 5: ¿Cómo Se Reproducen Los Seres Vivos?Alba Julibeth MelgarejoPas encore d'évaluation
- Flujograma BiologiaDocument3 pagesFlujograma BiologiaJesús JacksonPas encore d'évaluation
- Tesis Nivel de Conocimiento Del Vih Sida Finalizada 2 ModificadaDocument105 pagesTesis Nivel de Conocimiento Del Vih Sida Finalizada 2 ModificadaMaritzel RochaPas encore d'évaluation
- S274Prueba Paternidad Informe ResultadosDocument6 pagesS274Prueba Paternidad Informe ResultadosMaLeAlvaradoPas encore d'évaluation
- Wuolah-Free-Test Bloque I Biotecnología Microbiana ImprimirDocument6 pagesWuolah-Free-Test Bloque I Biotecnología Microbiana ImprimirPablo Castellanos ArtigaPas encore d'évaluation
- Bioelementos PrimariosDocument5 pagesBioelementos PrimariosyimiPas encore d'évaluation
- Glosario GeneticaDocument3 pagesGlosario GeneticaBellony PeroggoPas encore d'évaluation
- Guia de Refuerzo de Microorganismo de Septimo BasicoDocument3 pagesGuia de Refuerzo de Microorganismo de Septimo BasicoCah Vic67% (3)
- Informe Síndrome de PatauDocument6 pagesInforme Síndrome de PatauDome CunalataPas encore d'évaluation
- Beta OxidacionDocument38 pagesBeta OxidacionPaloma Gordillo RiveraPas encore d'évaluation
- LLave Cerradura EnzimasDocument2 pagesLLave Cerradura EnzimasAndyPas encore d'évaluation
- La Metritis BovinaDocument101 pagesLa Metritis BovinaJorge Luis Quispe100% (1)
- Biología 4Document2 pagesBiología 4Paul GonzalezPas encore d'évaluation
- Guía N°1 AlimentosDocument1 pageGuía N°1 Alimentos0gendou0Pas encore d'évaluation
- Transpiración de PlantasDocument3 pagesTranspiración de Plantasjba_ertPas encore d'évaluation
- 2do Lapso de Parasitología.Document23 pages2do Lapso de Parasitología.Andreina Claret ParedesPas encore d'évaluation
- Capacidad de CargaDocument5 pagesCapacidad de CargalucasPas encore d'évaluation