Académique Documents
Professionnel Documents
Culture Documents
08 Espectrofotometría
Transféré par
Qf Jhon Donado0 évaluation0% ont trouvé ce document utile (0 vote)
39 vues8 pagesinforme
Titre original
08_ESPECTROFOTOMETRÍA
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentinforme
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
39 vues8 pages08 Espectrofotometría
Transféré par
Qf Jhon Donadoinforme
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 8
8.
Espectrofometra: Espectros de absorcin y
cuantificacin colorimtrica de biomolculas
1
Nieves Abril Daz , J. Antonio
Brcena Ruiz , 1
1
Emilio Fernndez Reyes
, Aurora Galvn Cejudo
,
1
1
Jess Jorrn Novo , Jos Peinado Peinado ,
1
2
Fermn Toribio Melndez-Valds , Isaac Tnez Fiana
Departamento de Bioqumica y Biologa Molecular,
1
Campus Universitario de Rabanales, Edificio Severo Ochoa, 14071-Crdoba,
2
Facultad de Medicina, Avda. Menndez Pidal s/n, 14004-Crdoba.
RESUMEN
La espectrofotometra UV-visible es una tcnica analtica que permite
determinar la concentracin de un compuesto en solucin. Se basa en
que las molculas absorben las radiaciones electromagnticas y a su vez
que la cantidad de luz absorbida depende de forma lineal de la
concentracin. Para hacer este tipo de medidas se emplea un
espectrofotmetro, en el que se puede seleccionar la longitud de onda de
la luz que pasa por una solucin y medir la cantidad de luz absorbida por
la misma.
En esta prctica se darn a conocer las caractersticas generales y
conceptos relacionados con la espectrofotometra. A continuacin y tras
la explicacin del funcionamiento del espectrofotmetro se harn
espectros de absorcin con el fin de determinar la longitud de onda
donde la muestra presenta la mxima absorcin, y tras realizar las
correspondientes
rectas
de
calibrado
se
cuantificarn
las
concentraciones de distintas biomolculas.
Palabras clave : Absorbancia; transmitancia; colorimetra; cromforo;
espectro; rectas de calibrado.
Abreviaturas empleadas. A: Absorbancia; 4-AP: 4-Aminoantipirina; FMN:
flavin mononucletido; FMNH 2: forma reducida del flavin mononucletido; I:
intensidad de luz; N-NEDA: N-Naftol-1-etilendiamino; p-NP: p-nitrofenol; POD:
Peroxidasa; T: transmitancia; UV: luz ultravioleta.
1. INTRODUCCIN Y OBJETIVOS
El estudio a nivel bioqumico de cualquier biomolcula requiere la utilizacin
de tcnicas analticas que permitan su determinacin cualitativa y cuantitativa,
as como su caracterizacin fsico-qumica y biolgica. Uno de los mtodos
ms sencillos, accesibles, tiles y utilizados es la espectroscopa, en general, y
la espectroscopa ultravioleta-visible, en particular. Se pueden identificar y
cuantificar biomolculas en solucin y en muestras biolgicas, con el empleo
de reactivos especficos que reaccionan con el compuesto a analizar y forman
un producto coloreado que permite detectarlo en muestras complejas.
El fundamento de la espectroscopa se debe a la capacidad de las molculas
para absorber radiaciones, entre ellas las radiaciones dentro del espectro UVvisible. Las longitudes de onda de las radiaciones que una molcula puede
absorber y la eficiencia con la que se absorben dependen de la estructura
atmica y de las condiciones del medio (pH, temperatura, fuerza inica,
constante dielctrica), por lo que dicha tcnica constituye un valioso
instrumento para la determinacin y caracterizacin de biomolculas.
Las molculas pueden absorber energa luminosa y almacenarla en forma
de energa interna. Esto permite poner en funcionamiento ciclos vitales como la
fotosntesis en plantas y bacterias. Cuando la luz (considerada como energa)
es absorbida por una molcula se origina un salto desde un estado energtico
basal o fundamental, E1, a un estado de mayor energa (estado excitado), E 2. Y
slo se absorber la energa que permita el salto al estado excitado. Cada
molcula tiene una serie de estados excitados (o bandas) que la distingue del
resto de molculas. Como consecuencia, la absorcin que a distintas
longitudes de onda presenta una molcula -esto es, su espectro de absorcinconstituye una sea de identidad de la misma. Por ltimo, la molcula en forma
excitada libera la energa absorbida hasta el estado energtico fundamental.
Figura 1. Diagrama de niveles de energa en
una molcula. La absorcin de energa luminosa
hace que la molcula pase desde un
E -E =h
2
estado fundamental (E1) a otro excitado (E2). Posteriormente la molcula
relaja su energa mediante distintos mecanismos
(vibracin, rotacin, etc.)
En espectroscopa el trmino luz no slo se aplica a la forma visible de
radiacin electromagntica, sino tambin a las formas UV e IR, que son
invisibles. En espectofotometra de absorbancia se utilizan las regiones del
ultravioleta (UV cercano, de 195-400 nm) y el visible (400-780 nm).
Luz visible
Longitud de onda (metros)
Rayos gama
Rayos X
Frecuencia (hertz) energa
(electrn-voltios)
ultravioleta
infrarrojo
microondas
La regin UV se define como el rango de longitudes de onda de 195 a 400
nm. Es una regin de energa muy alta. Provoca dao al ojo humano as como
quemadura comn. Los compuestos con dobles enlaces aislados, triples
enlaces, enlaces peptdicos, sistemas aromticos, grupos carbonilos y otros
heterotomos tienen su mxima absorbancia en la regin UV, por lo que sta
es muy importante para la determinacin cualitativa y cuantitativa de
compuestos orgnicos. Diversos factores -como pH, concentracin de sal y el
disolvente- que alteran la carga de las molculas, provocan desplazamientos
de los espectros UV.
La fuente de radiacin ultravioleta es una lmpara de deuterio.
En la regin visible apreciamos el color visible de una solucin y que
corresponde a las longitudes de onda de luz que transmite, no que absorbe. El
color que absorbe es el complementario del color que transmite.
Por tanto, para realizar mediciones de absorcin es necesario utilizar la
longitud de onda en la que absorbe luz la solucin coloreada.
La fuente de radiacin visible suele ser una lmpara de tungsteno y no
proporciona suficiente energa por debajo de 320 nm.
longitud de onda
aproximada
390 - 435
435 - 490
490 - 580
580 - 595
595 - 650
650 - 780
color de luz que se
absorbe
Violeta
Azul
Verde
Amarillo
Naranja
Rojo
color de luz que se
refleja o ve
Amarillo verdoso
Amarillo
Rojo
Azul
Azul verdoso
Verde azulado
1.1. Transmitancia y Absorbancia
Cuando un rayo de luz de una determinada longitud de onda
de intensidad Io incide perpendicularmente sobre una disolucin
de un compuesto qumico que absorbe luz o cromforo, el
compuesto absorber una parte de la radiacin incidente (I a) y
dejar pasar el resto (It), de forma que se cumple: Io = Ia + It
Ia
Io
It
La transmitancia (T) de una sustancia en solucin es la relacin entre la
cantidad de luz transmitida que llega al detector una vez que ha atravesado la
muestra, It, y la cantidad de luz que incidi sobre ella, I o, y se representa
normalmente en tanto por ciento: % T = It/Io x 100
La transmitancia nos da una medida fsica de la relacin de intensidad
incidente y transmitida al pasar por la muestra. La relacin entre %T y la
concentracin no es lineal, pero asume una relacin logartmica inversa.
La absorbancia (A) es un concepto ms relacionado con la muestra puesto
que nos indica la cantidad de luz absorbida por la misma, y se define como el
logaritmo de 1/T, en consecuencia: A = log 1/T = -log T = -log It/ Io.
Cuando la intensidad incidente y transmitida son iguales (Io = It), la
transmitancia es del 100% e indica que la muestra no absorbe a una
determinada longitud de onda, y entonces A vale log 1 = 0.
La cantidad de luz absorbida depender de la distancia que atraviesa la luz a
travs de la solucin del cromforo y de la concentracin de ste.
1.2. Ley de Lambert-Beer
Esta ley expresa la relacin entre absorbancia de luz monocromtica (de
longitud de onda fija) y concentracin de un cromforo en solucin:
A = log I/Io = cl
La absorbancia de una solucin es directamente proporcional a su
concentracin a mayor nmero de molculas mayor interaccin de la luz con
ellas-; tambin depende de la distancia que recorre la luz por la solucin a
igual concentracin, cuanto mayor distancia recorre la luz por la muestra ms
molculas se encontrar-; y por ltimo, depende de , una constante de
proporcionalidad -denominada coeficiente de extincin- que es especfica de
cada cromforo. Como A es adimensional, las dimensiones de dependen de
las de c y l. La segunda magnitud (l) se expresa siempre en cm mientras que la
primera (c) se hace, siempre que sea posible, en M, con lo que las dimensiones
-1
-1
de resultan ser M cm . Este coeficiente as expresado, en trminos de
unidades de concentracin molar (o un submltiplo apropiado), se denomina
coeficiente de extincin molar (M). Cuando, por desconocerse el peso
molecular del soluto, la concentracin de la disolucin se expresa en otras
-1
unidades distintas de M, por ejemplo gL , las dimensiones de resultan ser
-1
-1
distintas, por ejemplo g Lcm , y al coeficiente as expresado se denomina
coeficiente de extincin especfico (s).
La ley de Lambert-Beer se cumple para soluciones diluidas; para valores de
c altos, vara con la concentracin, debido a fenmenos de dispersin de la
luz, agregacin de molculas, cambios del medio, etc.
1.3. Instrumentacin para la medicin de absorbancias de la luz visible y
ultravioleta: espectrofotmetro UV-visible
La medicin de absorbancia de la luz por las molculas se realiza en unos
aparatos llamados espectrofotmetros. Aunque pueden variar en diseo, en
especial con la incorporacin de ordenadores para el anlisis de datos, todos
los espectrofotmetros constan, segn se indica en la figura, de:
1. Una fuente de energa radiante: lmpara de deuterio y tungsteno.
2. Un monocromador para la seleccin de radiaciones de una determinada
longitud de onda: filtros, prismas, redes de difraccin.
3. Un compartimento donde se aloja un recipiente transparente (cubetas o tubos)
que contenga la muestra Pueden ser de vidrio, cuarzo o plstico transparente.
Para medir en UV se deben usar las de cuarzo o slice fundido, porque el vidrio
no transmite la radiacin UV.
4. Un detector de luz y un amplificador convertidor de las seales luminosas en
seales elctricas.
5. Un registrador o sistema de lectura de datos.
Des
de
el
punto de vista operativo, el
primer paso es seleccionar la
fuente de luz y longitud
de onda a la que se va a
el valor de cero mediante el
ajuste del mando, de forma que
la intensidad incidente y
transmitida sean iguales (Io =
It), y por tanto la absorbancia es
cero. A continuacin se pone en
la celdilla la cubeta con la
muestra y se lee la absorbancia
de sta.
Clorofila a
Clorofila b
loroplasto
Carotenoides
pigmentos
Absorcin de los
realizar
la
medida
. Hay
espectr
ofotm
etros
de un
solo
haz
(con
una
sola
celdilla
para
alojar
la
cubeta
con la
muestr
a) y de
doble
haz
(con
dos
celdilla
s para
dos
cubeta
s); en
nuestro
caso
se
trabaja
r con
los de
un solo
haz.
Se
mide
primer
o
la
absorb
ancia
del
disolve
nte
(conoci
do
como
blanco)
y
al
que se
le
asigna
Longitud de onda (nm)
Espectros
de
absorcin
de
tres
pigmentos
fotosintticos
cloroplastdicos.
Observar que un compuesto
puede tener ms de un pico
de absorcin (max).
No obstante, hay una gran cantidad de factores que originan variaciones en
los valores de max y M, entre los que se incluye el pH, la polaridad del solvente o
molculas vecinas y la orientacin de los cromforos vecinos; y cada uno
afecta de forma particular. Por ejemplo, variaciones originadas por cambios de
pH son debidas al efecto de ste sobre la ionizacin del compuesto. A
continuacin se muestran como ejemplo los espectros de absorcin de HNTS
(un reactivo empleado para la determinacin de especies oxidantes) y
comprobndose que por espectrotometra se puede seguir el efecto que ejercen
el pH y los oxidantes.
Efecto del pH en la absorcin de HNTS.
Espectros 1 y 2 en medio cido (mximo
de absorcin a 370 nm); espectros 3 y 4
en medio bsico (mximo a 410 nm).
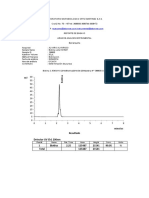
1.5 Curvas de calibrado
Desplazamiento del mximo de absorcin y
descenso de absorbancia cuando el HNTS
se incuba con H2O2 a distintos tiempos (0,
5, 10 y 15 minutos).
Para obtener una curva de calibrado de un compuesto se preparan
soluciones de diferentes concentraciones del mismo, determinndose para
cada una de ellas el valor de absorbancia a max. Estos valores de absorbancia
se representan en el eje de abscisas (eje de x) y los de concentracin en el eje
de ordenadas (eje de y). Se observar que, a bajas concentraciones, el
aumento de concentracin se corresponde con un incremento lineal en la
absorbancia (zona de cumplimiento de la ley de Lambert-Beer). A
concentraciones altas la linealidad se pierde y se observa que la lnea se
aplana, por lo que las medidas son poco fiables.
La representacin de Lambert-Beer, A = cl, nos permitir calcular el valor
del coeficiente de extincin molar, que corresponde a la pendiente de la recta.
1.6. Objetivos
Espectos de absorcin
Se van a realizar espectros de absorcin de distintas sustancias para
determinar su max y comprobar que un cambio en la estructura de la molcula,
por ejemplo su reduccin, supone una modificacin en su espectro.
Ley de Lambert-Beer
Se aplicar la ley de Lambert-Beer y tras hacer una recta de calibrado para
dos sustancias, se calcular grficamente el valor de los correspondientes
coeficientes de extincin molar.
Determinaciones colorimtricas especficas de compuestos
Se aplicarn reacciones especficas para la determinacin colorimtrica de
sustancias.
2. LISTADO DEL MATERIAL NECESARIO
2.1.
Material de uso general
Espectrofotmetro.
Agitador de tubos de
ensayo. Balanza.
pHmetro.
Tijeras
2.2. Material para cada grupo
Gradillas con tubos de ensayo.
Juego de pipetas (0.5, 1.0, 2.0, 5.0, 10.0 y 25.0 ml).
Prepipetas (dos juegos).
Probetas (100 y 250 ml).
Vasos de precipitado (100 y 500 ml).
Frasco lavador con agua destilada.
Recipientes para muestras biolgicas de 50 ml.
Papel de filtro.
Papel de parafilm.
Rotulador para vidrio.
Pipetas Pasteur de plstico (cuatro).
Guantes de latex.
Cubetas de plstico para medir en el espectrofotmetro.
2.3. Reactivos
Espectos de absorcin
Solucin de p-nitrofenol 0,20 mM en agua
destilada. Solucin de NaOH 0,50 N.
Solucin de p-nitrofenol de concentracin desconocida.
Solucin de flavn mononucletido (FMN) 0,25 M en agua
destilada. Ditionito sdico.
Determinacin colorimtrica de glucosa y nitrito mediante reacciones
especficas
Glucosa Glucosa
oxidasa
Peroxidasa
Fenol
4 amino-antipirina
Tampn fosfato
Nitrito potsico
Sulfanilamida
Dicloruro de N-naftol-1etilendiamino cido clorhdrico
Vous aimerez peut-être aussi
- Admd-Df-007 - Jefe de Control de CalidadDocument1 pageAdmd-Df-007 - Jefe de Control de CalidadQf Jhon DonadoPas encore d'évaluation
- PCGC-NG-015 - Procedimiento de Control de Cambios en El Sistema de Gestión de CalidadDocument4 pagesPCGC-NG-015 - Procedimiento de Control de Cambios en El Sistema de Gestión de CalidadQf Jhon DonadoPas encore d'évaluation
- PCGC-NG-003 - Atención de Quejas y Reclamos, Sugerencias y FelicitacionesDocument8 pagesPCGC-NG-003 - Atención de Quejas y Reclamos, Sugerencias y FelicitacionesQf Jhon DonadoPas encore d'évaluation
- PCGC-NG-011 - Gestión Del Riesgo para La CalidadDocument9 pagesPCGC-NG-011 - Gestión Del Riesgo para La CalidadQf Jhon DonadoPas encore d'évaluation
- PCGC-NG-004 - Desarrollo de Auditorías y AutoinspeccionesDocument4 pagesPCGC-NG-004 - Desarrollo de Auditorías y AutoinspeccionesQf Jhon DonadoPas encore d'évaluation
- Admd-Df-001 - Gerente GeneralDocument10 pagesAdmd-Df-001 - Gerente GeneralQf Jhon DonadoPas encore d'évaluation
- Admd-Df-010 - Analista de Control de CalidadDocument1 pageAdmd-Df-010 - Analista de Control de CalidadQf Jhon DonadoPas encore d'évaluation
- PCGC-NG-013 - Flujo Del Proceso de ProducciónDocument8 pagesPCGC-NG-013 - Flujo Del Proceso de ProducciónQf Jhon DonadoPas encore d'évaluation
- El Culpable Escondido de La Feminización de Su PróstataDocument5 pagesEl Culpable Escondido de La Feminización de Su PróstataQf Jhon DonadoPas encore d'évaluation
- Ptcc-Ne-D002 - Protocolo de Estabilidad de Algodón Absorbente2Document11 pagesPtcc-Ne-D002 - Protocolo de Estabilidad de Algodón Absorbente2Qf Jhon DonadoPas encore d'évaluation
- PCGC-NG-017 - Normas Técnicas y Legales Que Deben Cumplir Los Medicamentos Homeopáticos Magistrales y OficinalesDocument9 pagesPCGC-NG-017 - Normas Técnicas y Legales Que Deben Cumplir Los Medicamentos Homeopáticos Magistrales y OficinalesQf Jhon DonadoPas encore d'évaluation
- TecnicA Chilena Pra Determinar Minerales Por AADocument4 pagesTecnicA Chilena Pra Determinar Minerales Por AAElsa BurbanoPas encore d'évaluation
- Fisiologia Del Aparto Reproductor Masculino PDFDocument26 pagesFisiologia Del Aparto Reproductor Masculino PDFPepe Flores GarciaPas encore d'évaluation
- Micro 2Document8 pagesMicro 2Qf Jhon DonadoPas encore d'évaluation
- F T GlucidexDocument3 pagesF T GlucidexQf Jhon DonadoPas encore d'évaluation
- Micro 2Document8 pagesMicro 2Qf Jhon DonadoPas encore d'évaluation
- Micro 2Document8 pagesMicro 2Qf Jhon DonadoPas encore d'évaluation
- 32 Anexo-19 PDFDocument6 pages32 Anexo-19 PDFQf Jhon DonadoPas encore d'évaluation
- Monografia GuaifenesinaDocument3 pagesMonografia GuaifenesinaQf Jhon DonadoPas encore d'évaluation
- Micro 2Document8 pagesMicro 2Qf Jhon DonadoPas encore d'évaluation
- anexo20PIC PDFDocument29 pagesanexo20PIC PDFLucia Rodriguez AguilarPas encore d'évaluation
- CXS - 212s - Codex El Azzucar PDFDocument5 pagesCXS - 212s - Codex El Azzucar PDFcariali12Pas encore d'évaluation
- Programa de Capaitacion en BPMDocument3 pagesPrograma de Capaitacion en BPMQf Jhon DonadoPas encore d'évaluation
- F T GlucidexDocument3 pagesF T GlucidexQf Jhon DonadoPas encore d'évaluation
- Residuo de IncineraciónDocument2 pagesResiduo de IncineraciónQf Jhon DonadoPas encore d'évaluation
- Reportes MicrobiologicoDocument2 pagesReportes MicrobiologicoQf Jhon DonadoPas encore d'évaluation
- Perdida Por SecadoDocument2 pagesPerdida Por SecadoQf Jhon DonadoPas encore d'évaluation
- Valoracion HPLC Pureza CromatograficaDocument3 pagesValoracion HPLC Pureza CromatograficaQf Jhon DonadoPas encore d'évaluation
- Valoracion HPLCDocument3 pagesValoracion HPLCQf Jhon DonadoPas encore d'évaluation
- Rotación EspecificaDocument2 pagesRotación EspecificaQf Jhon DonadoPas encore d'évaluation
- Taller Historia y Percepcion Del Color 9ºDocument3 pagesTaller Historia y Percepcion Del Color 9ºcodinbos culturalPas encore d'évaluation
- Selectores de RadiacionDocument7 pagesSelectores de RadiacionMiguel ZuñigaPas encore d'évaluation
- Tomo I Unidad 4 - FotometríaDocument31 pagesTomo I Unidad 4 - FotometríaAntonellaPas encore d'évaluation
- 04 - Difracción Rendija y RejillaDocument7 pages04 - Difracción Rendija y RejillaRom Kno SanPas encore d'évaluation
- Apuntes MF0696 UF1458Document27 pagesApuntes MF0696 UF1458Francisco Valdés Ramos100% (1)
- TAREADocument6 pagesTAREAMarisol Andrade MendezPas encore d'évaluation
- Guía La LuzDocument12 pagesGuía La LuzCartas Myl Chillan CartasPas encore d'évaluation
- Radioacion NO Ionizante...Document41 pagesRadioacion NO Ionizante...Carolina Sierra RodriguezPas encore d'évaluation
- Metodos CuantitativosDocument73 pagesMetodos CuantitativosJuan Jaime TAIPE RODRIGUEZPas encore d'évaluation
- Proyecto Ordenado PabloDocument235 pagesProyecto Ordenado Pablorodrigo mamani apazaPas encore d'évaluation
- Manual de PolinizacionDocument58 pagesManual de PolinizacionJesus TovarPas encore d'évaluation
- Examen 1 Liquidos PenetrantesDocument21 pagesExamen 1 Liquidos Penetrantesregina camacho100% (1)
- 2008 Propiedades Del PapelDocument42 pages2008 Propiedades Del PapelAntonio PeñaretePas encore d'évaluation
- 9.relajación Psicológica o Con CromoterapiaDocument5 pages9.relajación Psicológica o Con CromoterapiaRene AugustoPas encore d'évaluation
- La Luz - FisicaDocument8 pagesLa Luz - FisicaKevin Gómez LópezPas encore d'évaluation
- Ejercicios Fibras Opticas Nº1 PDFDocument1 pageEjercicios Fibras Opticas Nº1 PDFFrancisco MejiaPas encore d'évaluation
- Practica 2 - FotocolorimetriaDocument14 pagesPractica 2 - FotocolorimetriaErnesto_Villeg_3165Pas encore d'évaluation
- Entregable Final Procesos 2Document42 pagesEntregable Final Procesos 2Josepmir Cardenas macedoPas encore d'évaluation
- Comunicado Cumplimiento HorarioDocument27 pagesComunicado Cumplimiento HorarioCarolina Cortes BonillaPas encore d'évaluation
- Quiroa Muñoz - Fiis - 2020 PDFDocument161 pagesQuiroa Muñoz - Fiis - 2020 PDFLUCAS MORETO BRYAN JAIMEPas encore d'évaluation
- Energia ElectromagneticaDocument15 pagesEnergia Electromagneticajuan jódansePas encore d'évaluation
- Examen Parcial Espectrometria 21-IDocument4 pagesExamen Parcial Espectrometria 21-IGerman Yamhil Meza RamirezPas encore d'évaluation
- Visión MesópicaDocument5 pagesVisión MesópicaSuhkiPas encore d'évaluation
- Investigación Del Oro Macro y Nano. CompletodocxDocument23 pagesInvestigación Del Oro Macro y Nano. CompletodocxbelacnvPas encore d'évaluation
- Cromoterapia PDFDocument43 pagesCromoterapia PDFajardinera75% (4)
- Cumarinas ResultadosDocument3 pagesCumarinas Resultadosyamily888Pas encore d'évaluation
- TFM 382Document89 pagesTFM 382juan guamanPas encore d'évaluation
- EspectrofotometríaDocument12 pagesEspectrofotometríaAbel Christian Marca Pineda100% (1)
- Fis - U4 - Oa - 08 Emision, Absorcion y Dispersion de La Radiacion ElectromagneticaDocument4 pagesFis - U4 - Oa - 08 Emision, Absorcion y Dispersion de La Radiacion ElectromagneticaMariPas encore d'évaluation
- Actividad 3Document6 pagesActividad 3SantiagoPas encore d'évaluation