Académique Documents
Professionnel Documents
Culture Documents
Informe Enzimas
Transféré par
Sindy Alvarez CalleTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Informe Enzimas
Transféré par
Sindy Alvarez CalleDroits d'auteur :
Formats disponibles
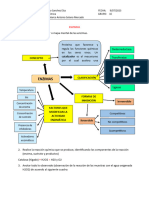
ACCIN ENZIMTICA.
PRACTICA # 5
RESUMEN
Las estructuras que forman el cuerpo de los seres vivos se construyen mediante reacciones
qumicas. Son tambin reacciones qumicas las que fabrican las molculas que forman esas
estructuras; y reacciones qumicas son las que, en ltimo trmino, dan lugar a las funciones
que todo ser vivo realiza. Las enzimas son las encargadas de dirigir esa variedad de
reacciones: hacen que ocurra la reaccin necesaria en el lugar adecuado y en el momento
preciso.
PALABRAS CLAVES: Enzimas, sustratos, temperatura, actividad enzimatica, catalasa.
1. OBJETIVOS.
Poner de manifiesto la presencia de la
enzima catalasa en tejidos animales y
vegetales.
Comprobar la accin de la
temperatura sobre la actividad de las
enzimas.
Comprobar la accin hidroltica de la
amilasa.
2. INTRODUCCIN
Las enzimas son protenas globulares
responsables de la mayor parte de la
actividad qumica de los organismos
vivos. Actan como catalizadores, que
son sustancias que aceleran las reacciones
qumicas sin ser destruidas o alteradas
durante el proceso. Las enzimas son
extremadamente eficientes y se pueden
utilizar una y otra vez repetidamente. Una
enzima puede catalizar miles de
reacciones en cada segundo.
En esta prctica el objetivo fue el de
identificar y observar la actividad
enzimtica en diferentes soluciones. La
amilasa, una enzima hidrolitica, tiene la
funcin de digerir el glucgeno y el
almidn para formar azcares simples
como la glucosa y se produce
principalmente en las glndulas salivares.
La renina es producida en forma de
prorrenina inactivo. Despus del consumo
de la leche, el cido clorhdrico en el
presente jugo gstrico en el estmago
activa prorrenina y la convierte en su
forma activa, la renina.
Muchos organismos pueden descomponer
el perxido de hidrgeno (H2O2) por la
accin de las enzimas. En la prctica se
estudi el funcionamiento de la catalasa.
Esta enzima est presente en casi todas
las
clulas
aerbicas
y
acta
descomponiendo perxido de hidrgeno
(agua oxigenada) en agua y oxgeno.
3. MARCO TEORICO
Las enzimas son molculas de naturaleza
proteica
que catalizan reacciones
qumicas,
siempre
que
sean
termodinmicamente posibles debido a
que las enzimas son selectivas con sus
sustratos y su velocidad, Una enzima hace
que una reaccin qumica que es
energticamente posible se conviertan en
molculas
diferentes
denominadas
productos. Crece slo con algunas
reacciones que el conjunto de enzimas
sintetizadas en una clula determina el
tipo de metabolismo que tendr cada
clula. En su estructura globular las
enzimas, se entrelazan y se pliegan una o
ms cadenas polipeptdicas, que aportan
un pequeo grupo de aminocidos para
formar el sitio activo, o lugar donde se
adhiere el sustrato, y donde se realiza la
reaccin.
Una enzima y un sustrato no llegan a
adherirse si sus formas no encajan con
exactitud. Este hecho asegura que la
enzima no participa en reacciones
equivocadas.
La enzima misma no se ve afectada por la
reaccin.
Cuando
los productos se
liberan, la enzima vuelve a unirse con un
nuevo sustrato.
Muchas enzimas han sido designadas
aadiendo el sufijo -asa al nombre del
Sustrato, es decir, la molcula sobre la
cul ejerce su actividad cataltica. Por
ejemplo la ureasa cataliza la hidrlisis de
la urea, y la arginasa cataliza la hidrlisis
de la arginina. Otras enzimas han recibido
su nombre en funcin del tipo de reaccin
que catalizan; as la Gliceraldehdo-3fosfato-deshidrogenasa cataliza la
deshidrogenacin
(oxidacin)
del
Gliceraldehdo-3-fosfato
a
3fosfoglicerato. Incluso algunas se
conocen de hace mucho tiempo y
mantienen
su
nombre,
sin
dar
informacin alguna del sustrato o la
reaccin que catalizan (tripsina).
No obstante, existe una clasificacin
sistemtica de las enzimas que las divide
en 6 grandes grupos, cada uno de los
cuales se divide a su vez en subclases:
1: Oxido-reductasas (reacciones de
xido-reduccin)
2: Transferasas (transfieren grupos
funcionales)
3: Hidrolasas (reacciones de hidrlisis),
4: Liasas (reacciones de adicin a los
dobles enlaces)
5:
Isomerasas
(reacciones
de
isomerizacin)
6: Ligasas (formacin de enlaces con
consumo de ATP).
A cada enzima se le asigna un nmero
con cuatro dgitos. Los tres primeros
indican la clase, subclase y sub-subclase,
respectivamente, y el ltimo es un
nmero de orden.
4. MATERIALES
Tubos de ensayo
Pinzas para tubos de ensayo
Solucin de almidn al 1%
Saliva
Solucin de lugol
Reactivo de Benedict
Pastillas de cuajo(renina)
cido clorhdrico al 10% y
concentrado
30 ml de leche
Zanahoria
Gotero
Pipetas de 5 ml
Pera de succin
Guantes quirrgicos
Cinta de enmascarar
Papa
Agua oxigenada (perxido de
hidrogeno)
Trozo de hgado
Hojas de afeitar
5. ANALISIS Y DISCUSION
RESULTADOS
DE
Mediante esta experiencia, vimos la
actividad de la enzima, la amilasa o
ptialina, presente en la saliva.
Esta
enzima
acta
sobre
el
polisacrido almidn, hidrolizando el
enlace O-glicosdico, por lo que el
almidn se terminar por transformar en
unidades de glucosa.
Tubo #1.
Hay una degradacin de almidn, en el
cual se encuentran vestigios de almidn,
esto significa que la encima logro romper
el enlace alfa 1,4-glucosidico.
Esto se evidencio al observar los tubos y
notar que el color azul
fue
desapareciendo (al calentarlo).
La
enzima
sufri
una
leve
desnaturalizacin, hay 0,5% de azucares
reductores.
PRUEBA DE LA PAPA, HIGADO Y
ZANAHORIA.
La enzima se desnaturalizo por efecto del
alto calentamiento.
6. PREGUNTAS
COMPLEMENTARIAS
Tubo #2.
Se obtuvo un color verde amarillento,
significa que la encima se encuentra en un
porcentaje de 0,5 a 1% lo que enfatiza
que la enzima an no est trabajando de
manera ptima.
Tubo #3.
La enzima degrado el grupo almidn.
Tubo #4.
1) Qu cambios puede sufrir, en
relacin a la estructura qumica y el
nmero inicial de molculas, el
sustrato y la enzima en una reaccin
qumica?
RTA. El nmero de enzimas permanece
constante. Lo que hace la enzima es
acelerar la velocidad en que el sustrato se
vuelve producto, as q el sustrato
disminuye (hasta llegar a un equilibrio, es
decir, la concentracin de S y de P es
invariable con el tiempo). Las enzimas
pueden sufrir cambios en su estructura y
as ser inactivadas, perdiendo su funcin,
pero esto es propio de la naturaleza
enzimtica,
algunas
podrn
ser
inactivadas con sales, otras con calor,
incluso por otras enzimas etc.
2) Si usted hace reaccionar la amilasa
con el almidn y espera hasta que
termine
la
reaccin.
cmo
comprobara que la enzima no ha
sufrido alteracin cataltica?
RTA: mediante la prueba de Benedict el
cual nos indica la presencia de azucares
reductores
en la muestra. Tambin
podemos observar que la enzima no
produce cambios solo acelera el proceso
enzimtico.
3) Relacione los siguientes conceptos en
un prrafo de no ms de diez
renglones:
enzima
alostrica,
interaccin alostrica y efector
alostrico.
RTA: La interaccin alostrica consiste
en el cambio estructural de una protena,
es decir, sus receptores cambiaran. Las
enzimas alostericas poseen dos sitios
activos, en el primero se unir un sustrato
determinado, mientras en el segundo o
tambin conocido como sitio alostrico se
unir un efector alostrico el cual
producir un cambio en la protena,
llevndonos a una regulacin de la
actividad de esta.
4) Cite cinco ejemplos de enzimas con
sus sustratos respectivos.
R T A : Hexoquinosa - Glucosa,
Quinasa - fosfatos de ATP,
catalasa-perxido de hidrgeno,
Lactato deshidrogenasa - cido lctico,
homogentinato
dioxigenasa
-cido
homogentisico.
7. CONCLUSIONES
En esta prctica se logr todos los
objetivos propuesto, pues se observ
como ciertos factores alteran la accin
enzimtica, por ejemplo La catalasa
trabaja a un pH y a una temperatura
determinada, pasados estos umbrales la
encima va perdiendo su mxima
actividad, incluso sobrepasados los
umbrales, se desnaturaliza, igual ocurre
con la amilasa y la renina. En la amilasa
se observ que cuando se calentaba la
mezcla de almidn con saliva se perda
el color azul que identifica la presencia
del carbohidrato mencionado. Con la
renina no se realiz el procedimiento.
8. REFERENCIAS
BIBLIOGRFICAS
1. Audesirk T. Audesirk T. Biologa. 4ta.
Edic. Mxico, Prentice Hall. 1996.
2. Gerald Karp. Biologa Celular. 3era.
Edic. Mxico, MACGRAWHILL. 1998.
3. Bretsher, M.S. The Molecules of the
Cell Membrane. Scientific American,
Octubre, 1985.
Vous aimerez peut-être aussi
- Tarea No8 BioquimicaDocument6 pagesTarea No8 BioquimicaDaNiel MorenoPas encore d'évaluation
- Actividad Enzimatica de La Catalasa LaboratorioDocument15 pagesActividad Enzimatica de La Catalasa Laboratorioanderson0% (1)
- Actividad enzimática y factoresDocument15 pagesActividad enzimática y factoresDaniel Abanto TorresPas encore d'évaluation
- 1 Estequiometria de La Fermentacion Enzimatica y Microbiana PrimeroDocument54 pages1 Estequiometria de La Fermentacion Enzimatica y Microbiana PrimeroVladimir Lisber Mucha Mendoza100% (1)
- Ensayos enzimáticos: Efecto de la temperatura y pH en la actividad de la catalasa y la amilasaDocument8 pagesEnsayos enzimáticos: Efecto de la temperatura y pH en la actividad de la catalasa y la amilasaRonnyMaqueraPas encore d'évaluation
- Bitacora 4 Enzimas Biologia CelularDocument8 pagesBitacora 4 Enzimas Biologia CelularCortés Ramos Yessica SurikeyPas encore d'évaluation
- Practica Reconocimiento de Enzimas 6Document9 pagesPractica Reconocimiento de Enzimas 6Leonardo Francisco Sanchez GuerreroPas encore d'évaluation
- Catalisis EnzimaticaDocument13 pagesCatalisis EnzimaticaDiana Spitia GuerreroPas encore d'évaluation
- Exposición EnzimasDocument5 pagesExposición EnzimasMARÍA JOSÉ JIMÉNEZ RAMÍREZPas encore d'évaluation
- ENZIMASDocument18 pagesENZIMASjuan blanquicetPas encore d'évaluation
- Reconocimiento de EnzimasDocument16 pagesReconocimiento de EnzimasKarencita Rivera Soliz0% (1)
- Reconocimiento de Enzimas CorreccionDocument14 pagesReconocimiento de Enzimas CorreccionMariana Ospina CadenaPas encore d'évaluation
- Las Enzimas PDFDocument9 pagesLas Enzimas PDFTriny VilladiegoPas encore d'évaluation
- Enzimas catalizan reaccionesDocument5 pagesEnzimas catalizan reaccionesJessenia MaciasPas encore d'évaluation
- Bioquimica Tema PDFDocument20 pagesBioquimica Tema PDFLouise Clemente DoroteoPas encore d'évaluation
- 34 Article 4Document72 pages34 Article 4Kevin M. MoyaPas encore d'évaluation
- Determinacion de La Actividad EnzimaticaDocument10 pagesDeterminacion de La Actividad EnzimaticaLUIS ERLIS OLIVARES PALMAPas encore d'évaluation
- Pruebas para La Determinacion de La Velocidad Enzimatica de La CatalasaDocument4 pagesPruebas para La Determinacion de La Velocidad Enzimatica de La CatalasaGiovanni Castillo MaldonadoPas encore d'évaluation
- Practica #2 BioquimicaDocument5 pagesPractica #2 BioquimicaRodoPandaPas encore d'évaluation
- EnzimasDocument10 pagesEnzimasvidita btsPas encore d'évaluation
- Cuestionario - Arias CabrejosDocument5 pagesCuestionario - Arias CabrejosFátima Arias CabrejosPas encore d'évaluation
- Practica de Accion EnzimaticaDocument8 pagesPractica de Accion EnzimaticaMichaelZhelmiCaEsPas encore d'évaluation
- Enzimas Bioquímica 2Document10 pagesEnzimas Bioquímica 2carlos sebastian bastidas londonoPas encore d'évaluation
- Folleto Exposicion Catalisis EnzimaticaDocument3 pagesFolleto Exposicion Catalisis EnzimaticaJohan CortesPas encore d'évaluation
- Actividad enzimática: Factores que influyen en la catalasaDocument9 pagesActividad enzimática: Factores que influyen en la catalasaLuiisa PerezPas encore d'évaluation
- Arreglado para ImprimirDocument31 pagesArreglado para ImprimirMilton Cesar Rodrigo TantaleanPas encore d'évaluation
- Informe EnzimasDocument4 pagesInforme EnzimasElzy PeredoPas encore d'évaluation
- Biología 3° Curso Plan EspecíficoDocument8 pagesBiología 3° Curso Plan EspecíficoScarlet GrekrovPas encore d'évaluation
- Enzimas PDFDocument10 pagesEnzimas PDFLeo Alvarado FarroPas encore d'évaluation
- Actividad EnzimáticaDocument11 pagesActividad EnzimáticaVale Avendaño TamaraPas encore d'évaluation
- Guia - Enzimas PDFDocument8 pagesGuia - Enzimas PDFAdrián GpPas encore d'évaluation
- Identificacion de EnzimasDocument5 pagesIdentificacion de EnzimasChani Vasquez GrandezPas encore d'évaluation
- Sanmartin Enzimas 3a AgronomiaDocument8 pagesSanmartin Enzimas 3a AgronomiaJOSUE TADEO SANMARTIN JUMBOPas encore d'évaluation
- Preguntas Sobre EnzimasDocument3 pagesPreguntas Sobre EnzimasyuriPas encore d'évaluation
- Alimentos ReactivosDocument6 pagesAlimentos ReactivosEnrique MarkezPas encore d'évaluation
- Actividad Enzimática de La CatalasaDocument10 pagesActividad Enzimática de La Catalasaalfredo andaluzPas encore d'évaluation
- ReporteFinal P4 BrendaJimenezDocument7 pagesReporteFinal P4 BrendaJimenezjustbreenPas encore d'évaluation
- Investigacion #6 Funcion y Clasificacion de EnzimasDocument6 pagesInvestigacion #6 Funcion y Clasificacion de EnzimasJessica LaraPas encore d'évaluation
- 1610323 B Informe Lab Bioq 2023 1 Práctica 5 Actividad enzimática en la digestiónDocument9 pages1610323 B Informe Lab Bioq 2023 1 Práctica 5 Actividad enzimática en la digestiónYeiner BautistaPas encore d'évaluation
- 5 Laboratorio BiologíaDocument37 pages5 Laboratorio BiologíaAndré MillonesPas encore d'évaluation
- Practica Enzimas 1Document5 pagesPractica Enzimas 1Spartan JohnPas encore d'évaluation
- Laboratorio N 9Document20 pagesLaboratorio N 9Lean Solano MendozaPas encore d'évaluation
- Practica #4 EnzimasDocument8 pagesPractica #4 EnzimasrossioPas encore d'évaluation
- EnzimasDocument11 pagesEnzimasLuisFe TorresPas encore d'évaluation
- Tratado Sobre Las EnzimasDocument20 pagesTratado Sobre Las EnzimasLeonardo FernandezPas encore d'évaluation
- Práctica de Enzimas - Bioquímica 1Document9 pagesPráctica de Enzimas - Bioquímica 1Carmen BonillaPas encore d'évaluation
- Actividad - Enzimática Informe 2Document9 pagesActividad - Enzimática Informe 2ERIKA BELÉN RIVERA CHICAIZAPas encore d'évaluation
- Enzimas: catalizadores de reacciones químicasDocument29 pagesEnzimas: catalizadores de reacciones químicasANDERSON ARAGON CARVAJALPas encore d'évaluation
- Lab 2Document14 pagesLab 2arely Hernandez quechulpaPas encore d'évaluation
- 2 Bioquimica Texto Paralelo 1Document8 pages2 Bioquimica Texto Paralelo 1Santos PalenciaPas encore d'évaluation
- Pre Informe Lab 5Document4 pagesPre Informe Lab 5Santiago VillaPas encore d'évaluation
- BIOLOGIADocument12 pagesBIOLOGIAYanixa Vivar MauricioPas encore d'évaluation
- Enzimas Marco TeoricoDocument4 pagesEnzimas Marco TeoricoHenrry Maldonado SedanoPas encore d'évaluation
- EnzimasDocument5 pagesEnzimasJessica LaraPas encore d'évaluation
- ENZIMASDocument39 pagesENZIMASvladir palominoPas encore d'évaluation
- Definición de Enzima y EstructuraDocument10 pagesDefinición de Enzima y EstructuraImnova TecPas encore d'évaluation
- ENZIMASDocument25 pagesENZIMASBRiAnKo AlKaTrAzPas encore d'évaluation
- Complejo EnzimaticoDocument6 pagesComplejo EnzimaticoCHRISTIAN OMAR MAXI ANDIAPas encore d'évaluation
- Decreto 4320Document9 pagesDecreto 4320Leydi Yulieth CastiblancoPas encore d'évaluation
- Info - 6Document14 pagesInfo - 6animex toda la vidaPas encore d'évaluation
- Tesis (Respuesta Biologica de Pollos Parrilleros Alimentados Con Zeolita NaturalDocument25 pagesTesis (Respuesta Biologica de Pollos Parrilleros Alimentados Con Zeolita NaturalÔger Ernesto D. Aguila SotoPas encore d'évaluation
- Power Point Tercera Clase 2020Document32 pagesPower Point Tercera Clase 2020felipe ortega miranda100% (1)
- Resumen Niñez y Adolescencia DB PDFDocument40 pagesResumen Niñez y Adolescencia DB PDFJonathan RiquelmePas encore d'évaluation
- Mordida Cruzada AnteriorDocument3 pagesMordida Cruzada Anteriorkudum33Pas encore d'évaluation
- Contaminación Ambiental de GuatemalaDocument6 pagesContaminación Ambiental de GuatemalaEsteban SPPas encore d'évaluation
- EXHIBICIONDocument9 pagesEXHIBICIONCarlos Pineda100% (1)
- BuenaSaludConEjercicioFisicoDocument1 pageBuenaSaludConEjercicioFisicoVERA FAVIOPas encore d'évaluation
- Proyecto Investigacion de Mercados Parte 1Document38 pagesProyecto Investigacion de Mercados Parte 1Jhonatan Carvajal QuiñonesPas encore d'évaluation
- Solucionario Semestral Intensivo Boletin N°2Document21 pagesSolucionario Semestral Intensivo Boletin N°2usuarioichPas encore d'évaluation
- Guia Manejo de PonedorasDocument21 pagesGuia Manejo de PonedorasDilmer AgudeloPas encore d'évaluation
- Resumen SaludDocument45 pagesResumen SaludCynthia ScottiPas encore d'évaluation
- Resuemnliquidos y ElectrolitosDocument18 pagesResuemnliquidos y ElectrolitosKarinaQuirozPas encore d'évaluation
- La Sexualidad en RomaDocument5 pagesLa Sexualidad en RomaMaría Paula Gonzales100% (1)
- Ensayo Padre Rico, Padre PobreDocument12 pagesEnsayo Padre Rico, Padre PobreSantajmnz100% (1)
- 4 - Modelo de Ficha Técnica - 1Document3 pages4 - Modelo de Ficha Técnica - 1Benites Atoxe WPas encore d'évaluation
- Triptico Adulto MayorDocument2 pagesTriptico Adulto MayorLi ToblerPas encore d'évaluation
- Biografía - Rosales - Oscar - 3E DDocument2 pagesBiografía - Rosales - Oscar - 3E Doscar rosalesPas encore d'évaluation
- Procedimiento Realización de Exámenes OcupacionalesDocument26 pagesProcedimiento Realización de Exámenes Ocupacionalesalejandra GironPas encore d'évaluation
- Almohadón de Plumas (Completo) PDFDocument1 pageAlmohadón de Plumas (Completo) PDFJuan Pablo Mendoza VelasquezPas encore d'évaluation
- SacariferosDocument9 pagesSacariferosDepartamento de Fitotecnia0% (2)
- Serie BlancaDocument14 pagesSerie BlancaTon SalmonPas encore d'évaluation
- PedsQL-4.0-Core-All AU4.0 spa-ES Wellbeing 7añosDocument2 pagesPedsQL-4.0-Core-All AU4.0 spa-ES Wellbeing 7añosKarina AndradePas encore d'évaluation
- ListaDocument17 pagesListaArnaldo GuerreroPas encore d'évaluation
- 1 Ensayo Probeta en AceiteDocument7 pages1 Ensayo Probeta en AceiteElizabeth RendonPas encore d'évaluation
- T9 - SelladoresDocument7 pagesT9 - SelladoresTeresa OchavoPas encore d'évaluation
- Instrumentos de Laboratorio de QuímicaDocument10 pagesInstrumentos de Laboratorio de QuímicaElkinMartínezPas encore d'évaluation
- Induccion SSTDocument29 pagesInduccion SSTemmanuelPas encore d'évaluation
- Formato ARODocument5 pagesFormato AROAlejandro BravoPas encore d'évaluation
- Manejo Conductual en El Aula. XimenaDocument27 pagesManejo Conductual en El Aula. XimenaXimena Covarrubias VarasPas encore d'évaluation