Académique Documents
Professionnel Documents
Culture Documents
Informe N°03 Dureza-Del-Agua
Transféré par
Ericka Anais Arellano AcuñaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Informe N°03 Dureza-Del-Agua
Transféré par
Ericka Anais Arellano AcuñaDroits d'auteur :
Formats disponibles
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
DUREZA TOTAL DEL AGUA
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
Universidad nacional del santa
Facultad de ingeniera
Escuela Acadmico
profesional de agroindustria
Informe N03
DUREZA TOTAL DEL AGUA
Curso:
INGENIERA AMBIENTAL
Docente:
DANIEL SNCHEZ VACA
Integrantes:
ARELLANO ACUA ERICKA ANAIS
201112029
ROJAS ZAVALETA IRVIN ALEXANDER
201112013
TAMARIZ ALVARADO SAIRA NATALY
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
I.
INTRODUCCION
La dureza del agua es uno de los parmetros qumicos ms importantes a la hora
de calificar la calidad de un agua.
La dureza del agua se puede defi nir como la concentracin total de iones calcio y
de iones magnesio (Ca2+ y Mg2+), los dos cationes divalentes ms habituales en un
agua natural, podramos escribir, simplemente:
Dureza (M) = [Ca2+] + [Mg2+]
Es muy frecuente qu e esta dureza se determine o se indique como masa de
carbonato clcico en miligramos por cada litro de disolucin, es decir, mg CaCO3/L.
Significa esto que todo el calcio presente en un agua dura proviene de carbonato
clcico? No, solo que, por convenio, suele tratarse como si as fuera; es ms, se
considera como si todo el calcio estuviese en forma de carbonato clcio y el
magnesio tambin fuese carbonato clcico.
La presencia de bicarbonatos en el agua hace que, cuando se calienta el agua
dura, se formen precipitados de carbonato clcico que dan lugar a las
llamadas costras calcreas,
Este carbonato clcico lo conocemos muy a menudo como cal. Algunos productos
de limpieza prometen acabar con los restos de cal, aunque normalmente los
mismos son consecuencia de la reaccin del calcio con el jabn. Pero no es solo un
problema de limpieza, sino que si se produce el depsito slido en entornos
industriales, puede llevar a la ocurrencia de costosas averas en calderas, torres de
enfriamiento y otros equipos. Estas costras calcreas se pueden eliminar
provocando la reaccin qumica inversa es decir, que forme nuevamente calcio
soluble y bicarbonato. Esto se puede lograr, por ejemplo, aadiendo un exceso
de dixido de carbono o un cido dbil.
En el mbito domstico, el agua dura causa tambin efectos indeseables como
la acumulacin en calderas, cafeteras, conductos de agua y calentadores, y hace
que sea necesario utilizar una mayor cantidad de jabn y de detergente. En el caso
de los jabones, que son carboxilatos de metales alcalinos procedentes de cidos
grasos, con largas cadenas carbonadas, el calcio reacciona directamente con el
jabn formando grumos insolubles, Lo que hace que se destruyan las propiedades
surfactantes del jabn y su capacidad para formar espumas y puede causar, por
ejemplo, que necesitemos mayor cantidad de ste para conseguir la misma
espuma.
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
En el caso de los detergentes, a
jabones, no hay una reaccin
ni del magnesio con los mismos,
una interferencia que
hace
aguas
blandas
para,
por
ropa. Cuanto ms dura es un
cantidad
de
detergente que
cada lavado. Como ejemplo, la
procedente de un detergente,
la cantidad a usar en funcin de
agua.
II.
III.
diferencia de los
directa del calcio
pero
s
deseables
las
ejemplo, lavar la
agua mayor es la
gastaremos
en
siguiente imagen,
que
indica
la dureza
del
OBJETIVOS
Determinar y comparar la dureza total en muestras de agua provenientes de
diferentes puntos.
Conocer y aplicar la metodologa para evaluar dureza total en muestras de
agua.
MARCO TEORICO
3.1. CONCEPTO:
Se define la dureza total del agua como la cantidad de sales de elementos
alcalino-trreos (berilio, magnesio, calcio, estroncio, bario y radio) presentes en el
agua y que normalmente se asocia a la formacin de incrustaciones calcreras. Si
bien el conc epto de dureza incluye diversos elementos, en la prctica, la dureza de
un agua se corresponde nicamente con la cantidad de calcio y magnesio
existentes.
En este sentido destaca la importancia del
magnesio
en
la
formacin
de
incrustaciones
calcreas
ya
que
habitualmente se tiende a asociar las
incrustaciones (cal) nicamente con el
calcio presente en el agua y generalmente
todas las incrustaciones estn constituidas
por sales tanto de calcio como de magnesio.
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
3.2. CAUSAS
La presencia de sales de magnesio y calcio en el agua depende fundamentalmente
de las formaciones geolgicas atravesadas por el agua de forma previa a su
captacin. Las aguas subterrneas que atraviesan acuferos carbonatados (calizas)
son las que presentan mayor dureza y dichos acuferos estn formados por
carbonatos de calcio y magnesio.
Las aguas subterrneas procedentes de acuferos con composicin eminentemente
silicatada (p.e. gra nitos) dan lugar a un agua blanda, es decir, con cantidades muy
bajas de sales de calcio y magnesio.
3.3. TIPOS DE DUREZA
En el proceso de formacin de las
calcreas intervienen las sales de
que
se
asocian
con
iones
este motivo se definen tres valores
la dureza:
incrustaciones
calcio y magnesio
bicarbonatos; por
relacionados con
DUREZA TOTAL
Es la concentracin total de calcio y magnesio presentes en el agua. No nos
proporciona en s misma ninguna informacin sobre el carcter incrustante
del agua ya que no contempla la concentracin de los iones bicarbonato
presentes.
DUREZA TEMPORAL:
Es la parte de la dureza total que puede incrustar y corresponde a la cantidad
de calcio y magnesio que puede asociarse con iones bicarbonato. Su
determinacin analtica corresponde al contenido en bicarbonatos presentes
en el agua y como mximo es igual a la dureza total del agua.
DUREZA PERMANENTE
Corresponde a la cantidad de calcio y magnesio restante que se asocia con
los otros iones, como cloruros, sulfatos, nitratos...etc. Es la diferencia entre la
dureza total y la dureza temporal y en general en las condiciones de trabajo
normales no produce incrustaciones.
3.4. UNIDADES DE DUREZA
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
Las concentraciones de calcio y magnesio deben expresarse en una unidad comn
para poderse sumar, ya que no produce la misma incrustacin 1 gramo de calcio
que 1 gramo de magnesio. Para ello se utiliza la expresin qumica expresado
como CaCO3 (carbonato clcico) o expresado como OCa (xido clcico).
La dureza de un agua se expresa generalmente en grados franceses (f) aunque
tambin pueden utilizarse los grados alemanes (d) segn las siguientes frmulas:
La forma
ms comn de medida de la
dureza
de las aguas es por titulacin
con EDTA. Este agente quelante permite valorar conjuntamente el Ca y el Mg (a
pH=10) o solo el Ca (a pH=12), por los complejos que forma con dichos cationes.
3.5. EQUIVALENCIAS
Debido a que generalmente, la dureza del agua se expresa en Miligramos de
carbonato clcico (CaCO3), se tienen las siguientes equivalencias:
mg CaCO3/l o ppm de CaCO3
Miligramos de carbonato clcico (CaCO3) en un litro de agua; esto es
equivalente a ppm de CaCO3.
Grado alemn (Deutsche Hrte, dH)
Equivale a 17,9 mg CaCO3/l de agua.
Grado americano
Equivale a 17,2 mg CaCO3/l de agua.
Grado francs (fH)
Equivale a 10,0 mg CaCO3/l de agua.
Grado ingls (eH) o grado Clark
Equivale a 14,3 mg CaCO3/l de agua.
3.6. CLASIFICACION DEL AGUA DURA
De acuerdo a la concentracin de carbonatos contenidos en el agua, sta puede
clasificarse en niveles de dureza, la siguiente tabla indica las cantidades de sales.
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
Tipos de agua
mg
/l
fH
dH
eH
Agua blanda
1
7
1.
7
0.9
5
1.1
9
Agua levemente
dura
6
0
6.
0
3.3
5
4.2
0
Agua
moderadamente
dura
1
20
12
.0
6.7
0
8.3
9
Agua dura
1
80
18
.0
10.
05
12.
59
Agua muy dura
>1
80
>18
.0
>10.
05
>12.
59
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
4. MATERIALES
4.1. INSTRUMENTOS
Vasos de precipitado
Pipetas
Pera de succin
Matraz Erlenmeyer
Probeta
espatula
pizeta
fiolas (250 ml)
4.2. REACTIVOS
Solucin EDTA
CaCO3 (carbonato de calcio)
HCl (acido cloridico)
NH4Cl (cloruro de amonio)
NH3 (amoniaco)
MgCl2 (cloruro de magnesio)
ENT (Negro de Eriocromo T)
4.3. EQUIPOS
Balanza analtica
Campana extractora de gases
Equipo de titulacin
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
5. PROCEDIMIENTO EXPERIMENTAL
PREPARACION Y VALORACION DEL EDTA
Se prepar una solucin a 0.01M en 250 ml (0.250 Lt), para ello se determin
mediante la siguiente formula:
n moles EDTA
M=
vol . de solucion (VS)
peso (W )
PM
M=
vol . de solucion (VS)
W =M x PM x VS
W =0.01 x 372.24 x 0.250
W =
En
la
balanza
analtica,
Pesar
0.9306
gr
de
solucin EDTA y
agregar a una fiola
0.9306 gr
Aforar con agua
destilada y agitar
hasta
homogenizar
PREPARACION DE UNA SOLUCION DE CaCO3 0.1%
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
%masa/volumen=
masa soluto (gr )=
masa soluto ( g )
x 100
vol . de disol . ( ml )
(%masa /vol )(vol . disol .)
100
masa soluto ( gr )=0.025 gr
Agregar 3 ml de HCl 1M para eliminar el CO2 (efervescencia), de tal manera que el CaCO3 se diluya por com
Pesar
0.1 gr de CaCO3DE LA SOLUCION BUFER
PREPARACION
Aforar con agua destilada
Agregar 20 ml de agua destilada y disolver
Mezclar y aforar en fiola de 100 ml
Agregar 57ml NH3
Pesar 6.8 gr de NH4Cl
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
VALORACION DE EDTA
Tomar 25 ml de la solucin patrn (CaCO3 0.1%)
Agregar 2 gotas de MgCl2
Agregar una pizca de ENT (indicador para determinar dureza)
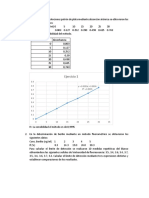
6. RESULTADOS
Los gastos obtenidos en la titilacin para la valoracin del EDTA, fueron los
siguientes:
GASTO
CONFIABILI
DAD
La
titilacin
se
realizar
1
22.4
por triplicado hasta obtener un
2
35.5
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
3
M=
35.6
W Ca CO
V gasto ( ) x 100 mM
3
GASTO
1
2
22.4
35.5
35.6
CONFIABILI
DAD
M
------------0.025
M=
=0.007042
0.0355 x 100 mM
M=
0.025
=0.007032
0.0356 x 100 mM
PROMEDIO
M = 0.007037
Frmula para determinar la dureza de las muestras de agua
DurezaTotal ppmCaC O =
3
1000 x FC xgasto(EDTA )
V ( muestra)
7. DISCUSIONES
ROJAS (2002)La muestra de agua que contiene los iones calcio y magnesio se le
aade el buffer de PH 10, posteriormente, se le agrega el indicador eriocromo
negro T (ENT), que hace que se forme un complejo de color prpura, enseguida se
procede a titular con EDTA (sal disdica) hasta la aparicin de un color azl .
Reacciones:
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
Ca2+ + Mg2+
Ca2+ + Mg2+
+ Buffer --------->
+ ENT ----------->[Ca-Mg--ENT] complejo prpura
[Ca-Mg--ENT] + EDTA ------------->[Ca-Mg--EDTA] + ENT color azl
Tal cmo se observ en la prctica realizada, aqu se explica claramente la
reaccin que ocurre al titular el EDTA, se logr ver efectivamente l cambio a
color prpura al agregar ENT, el cual es un indicador cuando se desea determinar
dureza de agua, asimismo se observ el cambio a color azul.
Es comn clasificar las aguas segn su dureza total desde aguas blandas o muy
blandas hasta aguas duras o muy duras. Segn la fuente que se consulte se pueden
encontrar clasificaciones muy diferentes entre s, estando la discrepancia entre ellas en
el intervalo de concentraciones de carbonato de calcio asignado a cada tipo de agua.
Veamos unos ejemplos para ilustrar esta discrepancia. La siguiente tabla muestra una
clasificacin de las aguas naturales segn su dureza total, clasificacin que aparece,
por ejemplo, en Wikipedia (que cita como fuente al Estudio Geolgico de los Estados
Unidos).
Tabla 1: clasificacion del agua segun wikipedia
Una buena parte de las aguas corrientes y aguas naturales minerales se englobaran
dentro de las aguas duras o muy duras segn la clasificacin establecida en la tabla 1.
Por otra parte, la tabla 2 muestra la clasificacin que aparece en el texto de F. Muoz
Soria dedicado al anlisis de una gran cantidad de aguas del mundo,
Tabla 2: clasificacion del agua segun Muos Soria
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
Finalmente, un trmino medio en cuanto a los valores extremos dados en las dos
clasificaciones anteriores es el que aparece en la tabla 3, perteneciente al Centro de
Estudios Hidrogrficos y Experimentacin de Obras Pblicas (CEDEX)
Tabla 3: clasificacion del agua segun CEDEX
Uno de los principales inconvenientes de la utilizacin de un agua dura para la industria
es la formacin de slidos o costras en las tuberas o circuitos de las mquinas, sobre
todo cuando circula como agua caliente, con el consiguiente inconveniente de la
obstruccin de la tubera y reduccin de la eficacia de la transferencia de calor. Tambin,
como se ha dicho, el agua dura baja mucho el rendimiento de los detergentes
dificultando su labor de limpieza. En cuanto al consumo humano, no se teme que el agua
dura sea perjudicial para la salud, pero tiene un sabor ligeramente ms amargo que el
agua blanda. Por otra parte, el agua dura es beneficiosa en agua de riego ya que los
iones alcalinotrreos tienden a formar agregados (flocular) con las partculas coloidales
del suelo aumentando la permeabilidad del suelo al agua.
8. CONCLUSIONES
o Se logr conocer parte de la metodologa para evaluar la dureza del agua, es
decir, preparacin de la solucin EDTA y la respectiva titulacin, en la cual se
observ el cambio de color de prpura a azul, as como determinacin de la
Molaridad de la solucin.
o A pesar de no lograr determinar la dureza de las diferentes muestras de agua, se
logr conocer las causas y los parmetros para clasificarla como agua blanda,
ligeramente dura, dura, etc.
UNIVERSIDAD NACIONAL DEL SANTA
INGENIERIA AGROINDUSTRIAL
o Se logr conocer la importancia de evaluar la dureza en el agua, ya que para la
industria es de gran inters; debido a las prdidas e ineficacia que puede
ocasionar en las tuberas y equipos, por ejemplo, disminuir la transferencia de
calor.
9. BIBLIOGRAFIA
o American Society for testing and Materials. Annual book of Standards /1994 /
Determinacin de dureza en agua. Metodo ASTM D 1126-92
o Standard methods for the examinatin of water and waste water publicado por la
APHA. Determinacin de Dureza en agua Mtodo 2340 C, 1995
o RODIER, J. Anlisis de Aguas: aguas naturales, aguas residuales, agua de mar.
Barcelona: Omega, 1981.
o Standard Methods for the Examination of Water and Wastewater. 21th edition.
American Public Health Association. Washington, DC. 2005.
o AYRES, Gilbert. Anlisis qumico cuantitativo. 2 ed. Mxico: Harla, 1970.
o ROJAS,J.A. Calidad del agua. Bogot: Escuela de Ingeniera, 2002
Vous aimerez peut-être aussi
- Ejercicios de GravimetríaDocument1 pageEjercicios de Gravimetríaernest0% (2)
- Practica N°1 Disolucion de Muestras SolidasDocument13 pagesPractica N°1 Disolucion de Muestras SolidasRosember Romero AcuñaPas encore d'évaluation
- Ejercicios Tercer ParcialDocument7 pagesEjercicios Tercer ParcialCamila Jackelyne ApazaPas encore d'évaluation
- Determinación de La Dureza Del AguaDocument12 pagesDeterminación de La Dureza Del AguaGiussepi Candiotti PortilloPas encore d'évaluation
- Práctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote TDocument5 pagesPráctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote Ttania pinargote0% (1)
- Determinación de Sulfatos Practica 1Document8 pagesDeterminación de Sulfatos Practica 1valkiraPas encore d'évaluation
- Laboratorio 3Document2 pagesLaboratorio 3Nicols Bustamante MolinaPas encore d'évaluation
- Laboratorio Nº9 - Valoración y Preparación EDTA 0.01000M - Nestor Sanchez AlfaroDocument10 pagesLaboratorio Nº9 - Valoración y Preparación EDTA 0.01000M - Nestor Sanchez AlfaroNéstor Juan Sánchez Alfaro0% (1)
- Determinación Gravimétrica Del AluminioDocument22 pagesDeterminación Gravimétrica Del AluminioErika Arone100% (1)
- Informe # 2 Solidos Formacion de Cristales..Document20 pagesInforme # 2 Solidos Formacion de Cristales..Ana Kairina Pineda PintoPas encore d'évaluation
- 9 Determinacion de Cloruros Mediante Los Metodos de Precipitacion Mohr y VolhardDocument3 pages9 Determinacion de Cloruros Mediante Los Metodos de Precipitacion Mohr y VolhardmarinagbelmontPas encore d'évaluation
- Informe3 - Determinación de Alcalinidad en AguaDocument10 pagesInforme3 - Determinación de Alcalinidad en AguaAbner ValdiviesoPas encore d'évaluation
- Analisis Volumétrico Por PrecipitaciónDocument12 pagesAnalisis Volumétrico Por Precipitaciónbrendads89100% (2)
- Determinación de Peróxido de HidrógenoDocument14 pagesDeterminación de Peróxido de HidrógenoRodrigo JimenezPas encore d'évaluation
- Determinación de Plomo en Minerales Por Espectroscopía de Absorción Atómica. Técnica de Patrón InternoDocument11 pagesDeterminación de Plomo en Minerales Por Espectroscopía de Absorción Atómica. Técnica de Patrón InternoGrisel Meza InfantesPas encore d'évaluation
- Práctica No 2 Determinación Gravimetrica de Cloruros PorDocument10 pagesPráctica No 2 Determinación Gravimetrica de Cloruros PorNicole Osuna100% (1)
- Marcha Analitica PDFDocument9 pagesMarcha Analitica PDFCarloXs Xs MglPas encore d'évaluation
- Informe 5 - Determinacion de Acidez en Diferentes MuestrasDocument4 pagesInforme 5 - Determinacion de Acidez en Diferentes Muestrasleidy carolina peña ardilaPas encore d'évaluation
- Explicación Procedimiento YodometríaDocument6 pagesExplicación Procedimiento YodometríaJulio Otarola Jimenez100% (2)
- Tarea 9 - Teoria - PotenciometríaDocument13 pagesTarea 9 - Teoria - PotenciometríaGUEVARA BERNARDO ARIANEPas encore d'évaluation
- Titulaciones ArgentométricasDocument4 pagesTitulaciones Argentométricasnata fallaPas encore d'évaluation
- Resutados y AnalisisDocument4 pagesResutados y Analisismauricio pinedaPas encore d'évaluation
- INFORME 1 - Determinacion de Dureza Total Del AguaDocument18 pagesINFORME 1 - Determinacion de Dureza Total Del AguaAdrian Vergara100% (1)
- Determinación de Hierro en AguaDocument4 pagesDeterminación de Hierro en AguaMarthaPas encore d'évaluation
- DicromatometríaDocument10 pagesDicromatometríaGuillermo ArreolaPas encore d'évaluation
- Probl. BeerDocument15 pagesProbl. BeerFelipe B Mendoza100% (1)
- Informe Analítica II Volumetría de Neutralización Mezcla de AlcalisDocument6 pagesInforme Analítica II Volumetría de Neutralización Mezcla de AlcalisUa dekuu LopezPas encore d'évaluation
- Determinacion de Oxido de CalcioDocument82 pagesDeterminacion de Oxido de CalcioGregorio Coasaca100% (1)
- Volumetria Con Formacion de ComplejosDocument4 pagesVolumetria Con Formacion de Complejosandres chamorro95% (20)
- Problemario de GravimetríaDocument2 pagesProblemario de GravimetríaAlexia Yazbetk Mejía Cruz100% (2)
- Informe 1 - Cromatografia en PapelDocument5 pagesInforme 1 - Cromatografia en PapelAlejandro QuilcaPas encore d'évaluation
- Lab. #1 - Determinación Del Error Relativo de La Concentración Del Manganeso Como Permanganato de PotasioDocument23 pagesLab. #1 - Determinación Del Error Relativo de La Concentración Del Manganeso Como Permanganato de PotasioGean HalanoccaPas encore d'évaluation
- Práctica 6: Determinación de Ni en Una Muestra Comercial Por Gravimetría.Document18 pagesPráctica 6: Determinación de Ni en Una Muestra Comercial Por Gravimetría.Enrique DelgadoPas encore d'évaluation
- Análisis de Dureza Total Por Titulación Con EDTADocument10 pagesAnálisis de Dureza Total Por Titulación Con EDTADiana Laura Bautista MontejoPas encore d'évaluation
- Equilibrios HeterogéneosDocument3 pagesEquilibrios HeterogéneosArmando MoraPas encore d'évaluation
- Laboratorio Nº4 Presion de VaporDocument14 pagesLaboratorio Nº4 Presion de VaporAnonymous YffYJEdPas encore d'évaluation
- Preguntas.. OrganicaDocument3 pagesPreguntas.. Organicayaquelin50% (2)
- Metodo de Rast 2Document6 pagesMetodo de Rast 2Mendoza EiraPas encore d'évaluation
- Cuestionario Volumetria de PrecipitacionDocument1 pageCuestionario Volumetria de PrecipitacionKmiloPas encore d'évaluation
- Informe 4Document15 pagesInforme 4Karla Patricia Rosas DelgadoPas encore d'évaluation
- Informe de Fisicoquimica - Presion de VaporDocument22 pagesInforme de Fisicoquimica - Presion de VaporMelissaPas encore d'évaluation
- Preguntas Reporte de Laboratorio #5 - 6Document1 pagePreguntas Reporte de Laboratorio #5 - 6Matius RSPas encore d'évaluation
- A Ejercicios Volumetría Acido BaseDocument3 pagesA Ejercicios Volumetría Acido BaseRubenCarGoPas encore d'évaluation
- Ejercicio 1y 2 de CurvasDocument2 pagesEjercicio 1y 2 de CurvasNatasha VargasPas encore d'évaluation
- Reporte Sistema Ternario Acido Acetico Cloroformo y AguaDocument5 pagesReporte Sistema Ternario Acido Acetico Cloroformo y AguaFelipe Vilches0% (1)
- Meta 1.7.GarciaAndreaDocument2 pagesMeta 1.7.GarciaAndreaandrea munguiaPas encore d'évaluation
- LABORATORIO #2 - Equipo 1 - Determinación Potenciométrica Del Pka Del Ácido AcéticoDocument15 pagesLABORATORIO #2 - Equipo 1 - Determinación Potenciométrica Del Pka Del Ácido AcéticoRENATO JAIR COSTA MINGAPas encore d'évaluation
- VolumetríasDocument4 pagesVolumetríasAngie CampoverdePas encore d'évaluation
- Informe 4 ANALITICADocument14 pagesInforme 4 ANALITICAWalter Salazar SandiPas encore d'évaluation
- Análisis GravimétricoDocument25 pagesAnálisis GravimétricomigueltiPas encore d'évaluation
- Metodo de DumasDocument11 pagesMetodo de DumasRafael Punchin100% (1)
- Volumetria RedoxDocument10 pagesVolumetria RedoxSofia Avila0% (1)
- FiquiDocument29 pagesFiquiPercy Kenyo Ayala ObregonPas encore d'évaluation
- PermanganometriaDocument3 pagesPermanganometriaAlejandra CorsiPas encore d'évaluation
- Tarea5 - Espectroscopía Sin LlamaDocument5 pagesTarea5 - Espectroscopía Sin LlamaFernando jose Villegas ariasPas encore d'évaluation
- COMPLEXOMETRÍADocument8 pagesCOMPLEXOMETRÍAhernando guerrero100% (3)
- Práctica 3 - 3Document6 pagesPráctica 3 - 3Zabala DanielPas encore d'évaluation
- Informe Analisis Metodo de VolhardDocument9 pagesInforme Analisis Metodo de Volhardjhon esteban rodriguezPas encore d'évaluation
- Agua de MarDocument7 pagesAgua de MarJose Luis Torres Ventura100% (1)
- Volumetría de Formación de ComplejosDocument6 pagesVolumetría de Formación de ComplejosRafael Ricardo GarciaPas encore d'évaluation
- 1 CV Jorge Guadalupe Mendoza LeonDocument5 pages1 CV Jorge Guadalupe Mendoza LeonWilsonMamaniQuispePas encore d'évaluation
- Somme Final (Control de Cierre)Document39 pagesSomme Final (Control de Cierre)Weisenhober Aguilar PeñaPas encore d'évaluation
- Monografia de Teorias de La MotivacionDocument14 pagesMonografia de Teorias de La MotivacionEricka Anais Arellano AcuñaPas encore d'évaluation
- ESparragoDocument10 pagesESparragoEricka Anais Arellano AcuñaPas encore d'évaluation
- Laboratorio #05 Bombas 2013Document41 pagesLaboratorio #05 Bombas 2013Ericka Anais Arellano AcuñaPas encore d'évaluation
- Diseño ExperimentalDocument2 pagesDiseño ExperimentalEricka Anais Arellano AcuñaPas encore d'évaluation
- PSICROMETRIADocument43 pagesPSICROMETRIAXavier Jaimes100% (12)
- Estudio Del WaccDocument19 pagesEstudio Del WaccEricka Anais Arellano AcuñaPas encore d'évaluation
- ANOVA MultifactorialDocument20 pagesANOVA MultifactorialLaura Cortés AcostaPas encore d'évaluation
- Digestibilidad 2015Document46 pagesDigestibilidad 2015Ericka Anais Arellano AcuñaPas encore d'évaluation
- Transferecia de Calor 31Document30 pagesTransferecia de Calor 31Ericka Anais Arellano AcuñaPas encore d'évaluation
- 1-Fundamentos MS LucasDocument51 pages1-Fundamentos MS LucasEricka Anais Arellano AcuñaPas encore d'évaluation
- Yogur y Helados de YogurDocument43 pagesYogur y Helados de YogurJarchacker RiosPas encore d'évaluation
- Yogur y Helados de YogurDocument43 pagesYogur y Helados de YogurJarchacker RiosPas encore d'évaluation
- Practica de Análisis de RegresiónDocument2 pagesPractica de Análisis de RegresiónEricka Anais Arellano AcuñaPas encore d'évaluation
- 04 Problemas HumidificacionDocument5 pages04 Problemas HumidificacionDaniela Soto0% (2)
- Carta Psicrométrica PDFDocument1 pageCarta Psicrométrica PDFIrvin Alexander Rojas Zavaleta44% (9)
- Balance de EnergíaDocument137 pagesBalance de EnergíaEricka Anais Arellano Acuña100% (1)
- Libro 1Document8 pagesLibro 1Ericka Anais Arellano AcuñaPas encore d'évaluation
- PLAN DE MEJORA FORTIDENT FinalDocument25 pagesPLAN DE MEJORA FORTIDENT FinalARNULFO REYES MUŃOZPas encore d'évaluation
- Puertos y Terminales Pesqueras 21Document17 pagesPuertos y Terminales Pesqueras 21Edwin Antonio Ortiz FalconPas encore d'évaluation
- Acerca de La Entrevista ClinicaDocument9 pagesAcerca de La Entrevista ClinicaFelipe FernandezPas encore d'évaluation
- Memoria de Calculo Puente PucaraDocument22 pagesMemoria de Calculo Puente PucaraJose Antonio Paredes VeraPas encore d'évaluation
- Zookeeper UpRunningDocument18 pagesZookeeper UpRunningrazasuperiorPas encore d'évaluation
- Trastorno Del Espectro AutistaDocument8 pagesTrastorno Del Espectro AutistaCata EtcheverryPas encore d'évaluation
- Politica de CTI 2017 2030-ParaguayDocument34 pagesPolitica de CTI 2017 2030-Paraguayidelin.molinasPas encore d'évaluation
- Catalogo 2022Document28 pagesCatalogo 2022Yuldor GutierrezPas encore d'évaluation
- Estatica de La Particula-1Document10 pagesEstatica de La Particula-1jl salliPas encore d'évaluation
- Autoriz Judicial Disponer Bs Viaje MenorDocument6 pagesAutoriz Judicial Disponer Bs Viaje MenoreduardoPas encore d'évaluation
- Examen6toGrado1erTrimestre2019 20MEEPDocument13 pagesExamen6toGrado1erTrimestre2019 20MEEPSheryl RojasPas encore d'évaluation
- Modelo STEAMDocument1 pageModelo STEAMEduardo GEPas encore d'évaluation
- Instructivo Con Documentos-3Document13 pagesInstructivo Con Documentos-3GAITAN MEZA CATALINAPas encore d'évaluation
- Formato RadicadoDocument9 pagesFormato RadicadoEdimer CañonPas encore d'évaluation
- Manual de Partes Tnt600i ProvisionalDocument92 pagesManual de Partes Tnt600i ProvisionalTapia Acuña BairoPas encore d'évaluation
- Auditoria de Desempeño OrdenadoDocument35 pagesAuditoria de Desempeño OrdenadoAURIS SOTOMAYOR EDITH ALIDAPas encore d'évaluation
- Tabla Contaminantes Químicos Karina IñiguezDocument3 pagesTabla Contaminantes Químicos Karina IñiguezKarina IñiguezPas encore d'évaluation
- Sesión 07 - Algoritmos VoracesDocument69 pagesSesión 07 - Algoritmos VoracesCristian Suazo ApolinarioPas encore d'évaluation
- Niif Seccion 22Document4 pagesNiif Seccion 22Gloria Milena DIAZ ROZO50% (2)
- El Lenguaje Es Una Herramienta de Comunicación para AprenderDocument3 pagesEl Lenguaje Es Una Herramienta de Comunicación para AprendernoraPas encore d'évaluation
- Caracteristicas de La Industria QuimicaDocument22 pagesCaracteristicas de La Industria Quimicaprincesslove521_4165Pas encore d'évaluation
- Tarea Lección 2 Resumen AnaliticoDocument10 pagesTarea Lección 2 Resumen Analiticojaime perezPas encore d'évaluation
- DD072 Herramientas Inform Ticas de Gesti N de ProyectosDocument4 pagesDD072 Herramientas Inform Ticas de Gesti N de Proyectosalvaro villamizarPas encore d'évaluation
- GST (Vo) 006Document1 pageGST (Vo) 006Leonel BerlinPas encore d'évaluation
- David Pedro R - Sociologia JuridicaDocument293 pagesDavid Pedro R - Sociologia JuridicaderechorumusPas encore d'évaluation
- Accion Decisiva Tarea 1 A La 10Document110 pagesAccion Decisiva Tarea 1 A La 10RAFAEL ALFONSO HERNANDEZ GARCIAPas encore d'évaluation
- Lectura ComprensivaDocument4 pagesLectura Comprensivamiguel0% (1)
- "Renta Chingón Tu Airbnb o Uno Ajeno" - Con Estos 5 Sencillos Pasos.Document6 pages"Renta Chingón Tu Airbnb o Uno Ajeno" - Con Estos 5 Sencillos Pasos.Lucia del AngelPas encore d'évaluation
- Producto Acádemico 3Document3 pagesProducto Acádemico 3GENRRY ALDAZABAL PORTILLAPas encore d'évaluation
- DABOTEWBPD2WDocument14 pagesDABOTEWBPD2Wvideoric8867Pas encore d'évaluation