Académique Documents
Professionnel Documents
Culture Documents
Gases Ideales
Transféré par
Andrea CastellanosDescription originale:
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Gases Ideales
Transféré par
Andrea CastellanosDroits d'auteur :
Formats disponibles
Andrea Guillermina Castellanos Landa
13300054- Termodinmica I
Tarea 6. Investigacin GASES REALES.
Definicin.
Un gas real se define como un gas con un
comportamiento termodinmico que no
sigue la ecuacin de estado de los gases
ideales.
Un gas ideal es un gas terico compuesto
de un conjunto de partculas puntuales con
desplazamiento
aleatorio
que
no
interactan entre s. El concepto de gas
ideal es til porque el mismo se comporta
segn la ley de los gases ideales,
una ecuacin de estado simplificada, y que
puede ser analizada mediante la mecnica estadstica.
Diferencias:
Para un gas ideal la variable "z" siempre vale uno, en cambio para un gas real,
"z" tiene que valer diferente que uno.
La ecuacin de estado para un gas ideal, prescinde de la variable "z" ya que
esta para un gas ideal, vale uno. Y para un gas real, ya que esta variable tiene
que ser diferente de uno, as que la formula queda de esta forma: pV=znRT.
La ecuacin de van der Waals se diferencia de las de los gases ideales por la
presencia de dos trminos de correccin; uno corrige el volumen, el otro
modifica la presin.
Los gases reales, a presiones y temperaturas cercanas a las ambientales,
actan como gases ideales.
GAS REAL.
El comportamiento de una sustancia real es muy complejo. sta puede
experimentar lo que se denomina un cambio de fase o cambio de estado.
Cuando a una sustancia se le suministra o extrae una cierta cantidad de calor, a
nivel microscpico las interacciones entre sus molculas cambian y, dependiendo
de su estado termodinmico, puede encontrarse en estado slido, lquido o vapor,
o en una combinacin de estos estados.
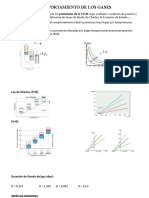
Las isotermas de un gas real tienen una forma ms compleja que las isotermas de
un gas ideal (hiprbolas), ya que deben dar cuenta de los cambios de fase que
puede experimentar.
Se han representado en la grfica las denominadas isotermas de Andrews. Dichas
isotermas fueron medidas experimentalmente, y representan la presin en funcin
Andrea Guillermina Castellanos Landa
13300054- Termodinmica I
del
volumen
temperaturas.
distintas
La isoterma representada en rojo se
denomina isoterma crtica (y su
temperatura, la temperatura crtica).
Esta
isoterma
separa
dos
comportamientos:
cuando
una
sustancia se encuentra a una
temperatura
superior
a
su
temperatura crtica, siempre est en
estado gaseoso, por muy alta que
sea la presin. Por el contrario,
cuando est a una temperatura
inferior a la crtica, puede estar en
estado slido, lquido o vapor (en la
grfica
se
han
representado
solamente las zonas de lquido y vapor).
Los puntos representados con las letras A y B corresponden respectivamente a los
estados denominados vapor saturado y lquido saturado. Ambos estn sobre una
curva (representada en lnea punteada) denominada curva de saturacin. Por
debajo de ella, todos los estados son una mezcla de lquido y vapor.
En la grfica tambin se observa que la zona de las isotermas que se encuentra
por debajo de la curva de saturacin es una recta horizontal. Por tanto, cuando el
cambio de fase lquido - vapor se produce a presin constante, se produce
tambin a temperatura constante.
Para que una sustancia cambie de fase, es necesario suminstrale o extraerle una
cierta cantidad de calor. Si el cambio de fase se produce a presin constante, este
calor no se traduce en un incremento de temperatura, y se denomina calor latente.
Ecuacin de estado de van der Waals
No existe una nica ecuacin de estado que describa el comportamiento de todas
las sustancias reales para todas las condiciones de presin y temperatura. A lo
largo del tiempo se han propuesto distintas ecuaciones de estado, siendo la ms
sencilla la de van der Waals, por la que recibi el premio Nobel de Fsica en 1910.
La ecuacin de van der Waals es una modificacin de la ecuacin de estado de un
gas ideal en la que se tiene en cuenta tanto el volumen de las molculas como las
interacciones entre ellas. Tiene la forma:
Andrea Guillermina Castellanos Landa
13300054- Termodinmica I
Las constantes a y b son caractersticos de cada gas y se obtienen a partir de los
datos de la presin, Pc, volumen Vc y la temperatura Tc crtica. El punto crtico es
un punto de inflexin de la isoterma Tc en el diagrama P-V de modo que se
cumple que:
De estas dos ecuaciones obtenemos, el volumen Vc y la temperatura Tc crtica.
Vc=3nbTc=8a27Rb
Sustituyendo Vc y Tc en la ecuacin de van der Waals obtenemos la presin
crtica, Pc,
Pc=a27b2
Andrea Guillermina Castellanos Landa
13300054- Termodinmica I
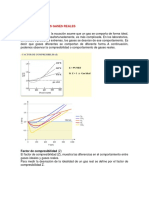
Factor de compresibilidad.
El Factor de compresibilidad (Z) se define como la razn entre el volumen
molar de un gas real (Vreal) y el correspondiente volumen de un gas ideal
(Videal),
Y se utiliza para comparar el comportamiento de un gas real respecto al
establecido por la ecuacin de los Gases Ideales. Partiendo de esta definicin y
recordando que
Sustituyendo en la definicin de Z:
Andrea Guillermina Castellanos Landa
13300054- Termodinmica I
Por lo tanto:
Es decir Z representa un factor de correccin para la ecuacin de los gases
ideales. Con base en esto se encuentra tres tipos de comportamiento distintos:
Z = 1, comportamiento de Gas Ideal. (altas temperaturas y bajas presiones).
Z > 1, gases como el Hidrgeno y Nen, difcilmente compresibles (altas
temperaturas y presiones).
Z < 1, gases como el O2, Argn y CH4, fcilmente compresibles (bajas
temperaturas y altas presiones).
Ecuacin de Redlich-Kwong
Esta ecuacin de origen semiemprico, al igual que la ecuacin de Van der Waals,
predice tres races para el volumen. La expresin de esta ecuacin es:
donde a y b son las constantes de Redlich-Kwong [5].
Al imponer la condicin de que la isoterma presenta una inflexin en el punto
crtico, es posible expresar a y b en funcin de la presin y temperatura crtica
(similar a lo realizado con la ecuacin de Van der Waals). Entonces los valores de
las constantes son [6]:
El factor de compresibilidad crtico para esta ecuacin tiene un valor de 0,333 y
por lo tanto no es muy exacta cerca del punto crtico; adems como slo posee
Andrea Guillermina Castellanos Landa
13300054- Termodinmica I
dos parmetros no representa ntegramente la zona bifsica. Sin embargo, es
mucho ms exacta que la ecuacin de Van der Waals y da buenos resultados a
presiones altas y temperaturas sobre la temperatura crtica, llegando a ser tan
precisa como la ecuacin de ocho parmetros. Por lo tanto esta ecuacin es muy
til, ya que combina la simplicidad de una ecuacin de dos parmetros con un
alto grado de exactitud.
Bibliografa:
Ley de los gases reales | La Gua de
Qumica http://quimica.laguia2000.com/leyes-quimicas/ley-de-losgases-reales#ixzz3osMFMJzQ
https://es.wikipedia.org/wiki/Gas_ideal
http://www.monografias.com/trabajos/gasesreales/gasesreales.sht
ml#ixzz3osPd25hS
http://acer.forestales.upm.es/basicas/udfisica/asignaturas/fisica/ter
mo1p/gasreal.html
http://html.rincondelvago.com/ecuaciones-de-estado-entermodinamica.html
Vous aimerez peut-être aussi
- Cómo Son Las Leyes de Vander WalsDocument3 pagesCómo Son Las Leyes de Vander WalsUziel CayllahuaPas encore d'évaluation
- Gases RealesDocument3 pagesGases RealesDiianiitha BaEzaPas encore d'évaluation
- Tarea 4Document5 pagesTarea 4Angel GabrielPas encore d'évaluation
- Term0dinamica GasesDocument6 pagesTerm0dinamica GasesYojhan YandelPas encore d'évaluation
- Gases RealesDocument3 pagesGases RealesSmith LazoPas encore d'évaluation
- Termodinamica, GasesDocument89 pagesTermodinamica, GaseskeilerPas encore d'évaluation
- Gases RealesDocument26 pagesGases RealesYiruma Monte de JupiterPas encore d'évaluation
- Ecuación de Estado de Gases RealesDocument2 pagesEcuación de Estado de Gases RealesBryan FariasPas encore d'évaluation
- Segundo Trabajo de TermodinamicaDocument18 pagesSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaPas encore d'évaluation
- Ecuación de Estado Del Gas IdealDocument3 pagesEcuación de Estado Del Gas IdealLisandro FloresPas encore d'évaluation
- Mecanica de Fluidos Ecuacion de EstadoDocument3 pagesMecanica de Fluidos Ecuacion de EstadoAngelica Carolina Vasquez YepezPas encore d'évaluation
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesERIKA LOZADA RUSSELPas encore d'évaluation
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesElsa Marzana SanizoPas encore d'évaluation
- Gas Ideal-Gas RealDocument7 pagesGas Ideal-Gas RealJessi Cam-Eli100% (1)
- Term Odin Á MicaDocument18 pagesTerm Odin Á MicaJose Pineda RamirezPas encore d'évaluation
- IntroIQ Clase 17 y 18Document27 pagesIntroIQ Clase 17 y 18AR QuímicaPas encore d'évaluation
- Gases Reales PresentacionDocument48 pagesGases Reales PresentacionEdwinPas encore d'évaluation
- Gases RealesDocument7 pagesGases RealesPablo Elias Suarez RoaPas encore d'évaluation
- Quimica General IDocument18 pagesQuimica General ISofía Alvarez HernandezPas encore d'évaluation
- 4.-Modelo Matemático de Redlich-Kwong: R Constante de Los Gases (8.31451 J/mol K)Document4 pages4.-Modelo Matemático de Redlich-Kwong: R Constante de Los Gases (8.31451 J/mol K)Katherine JacayPas encore d'évaluation
- Ecuación de Estado para Gases RealesDocument13 pagesEcuación de Estado para Gases RealesCristian Ccaso MamaniPas encore d'évaluation
- Gases Ideales y RealesDocument6 pagesGases Ideales y RealesjosePas encore d'évaluation
- Expo Grupo 1Document33 pagesExpo Grupo 1Christian AcostaPas encore d'évaluation
- Ecuaciones de EstadoDocument10 pagesEcuaciones de EstadoMiguel Angel PalominoPas encore d'évaluation
- Ley de Gases IdealesDocument18 pagesLey de Gases IdealesJear ArenasPas encore d'évaluation
- Ley de Los Gases RealesDocument2 pagesLey de Los Gases RealesDaleska C. GalarzaPas encore d'évaluation
- Asignación Final de Termodinamica IIDocument8 pagesAsignación Final de Termodinamica IILiz RoncalloPas encore d'évaluation
- Modelo Matemático Del Gas RealDocument4 pagesModelo Matemático Del Gas RealLuna Sherezadee ASPas encore d'évaluation
- Proceso de Sustancias RealesDocument22 pagesProceso de Sustancias RealesJair OñatePas encore d'évaluation
- Unidad III 3.1 3.2 Mecanica de Fluidos y TermodinamicaDocument5 pagesUnidad III 3.1 3.2 Mecanica de Fluidos y Termodinamicaoliverio cruzPas encore d'évaluation
- Gases RealesDocument6 pagesGases RealesRenato EspinosaPas encore d'évaluation
- Termodinamica II Tarea 1Document6 pagesTermodinamica II Tarea 1Alvaro Wara SuárezPas encore d'évaluation
- Gases Reales y Ecuacion de EstadoDocument3 pagesGases Reales y Ecuacion de EstadoAlberto Elera SubiñasPas encore d'évaluation
- Gases Reales y Ecuación de Van Der WaalsDocument9 pagesGases Reales y Ecuación de Van Der WaalsCamila PachecoPas encore d'évaluation
- Ecuaciones de Estado para Gases No IdealesDocument29 pagesEcuaciones de Estado para Gases No IdealesFernando LópezPas encore d'évaluation
- Gases RealesDocument14 pagesGases RealesJim Tico GutiérrezPas encore d'évaluation
- Diferencias Entre Gas Real e IdealDocument7 pagesDiferencias Entre Gas Real e IdealRosmery Orellana Nina100% (2)
- Ley de Los Gases IdealesDocument9 pagesLey de Los Gases IdealesJean MartínezPas encore d'évaluation
- Trabajo de Fisicoquimica 2Document15 pagesTrabajo de Fisicoquimica 2Sayuri Elena Petro MaceaPas encore d'évaluation
- Ecuaciones de Estado Del Gas IdealDocument30 pagesEcuaciones de Estado Del Gas IdealSneider CastañedaPas encore d'évaluation
- Ecuaciones de Estado para Gases RealesDocument25 pagesEcuaciones de Estado para Gases RealesKEVIN ARNOLDO PEREZ RIVASPas encore d'évaluation
- Tabla de ConversionesDocument7 pagesTabla de ConversionesGonzalo Perez0% (1)
- Propiedades Moleculares de La MateriaDocument5 pagesPropiedades Moleculares de La MateriaSulmira BarjaPas encore d'évaluation
- GasesDocument31 pagesGasesGivion WeaverPas encore d'évaluation
- Ecuación de Estado de Un Gas IdealDocument3 pagesEcuación de Estado de Un Gas IdealJipson Uresto100% (1)
- Clase 32-Periodo I-Fisicoquimica IDocument8 pagesClase 32-Periodo I-Fisicoquimica IEdwin VasquezPas encore d'évaluation
- Gases Reales 20-IiDocument5 pagesGases Reales 20-IiDanny Palma AyalaPas encore d'évaluation
- Gases Ideales y Gases RealesDocument32 pagesGases Ideales y Gases RealesRoxana Oliden RodríguezPas encore d'évaluation
- Ecuacion de Estado - TermodinamicaDocument3 pagesEcuacion de Estado - TermodinamicaReynaldo José Blanco SparksPas encore d'évaluation
- Ecuación de EstadoDocument15 pagesEcuación de EstadoJhan Carlos QPas encore d'évaluation
- Clase 5Document34 pagesClase 5Miguel AngelPas encore d'évaluation
- Estado GaseosoDocument5 pagesEstado GaseosoKevinPas encore d'évaluation
- Gases Reales IdealesDocument13 pagesGases Reales IdealesMelania Garcia ArnezPas encore d'évaluation
- Cap 6 GasesDocument42 pagesCap 6 GasesIngenieriaAlimentosPas encore d'évaluation
- Fisica II Preguntas AsignadasDocument10 pagesFisica II Preguntas AsignadasJonathan MercadoPas encore d'évaluation
- Ley de CharlesDocument15 pagesLey de CharlesOmar PerezPas encore d'évaluation
- GASES IDEALES Y REALES Presion SeudoreducidaDocument7 pagesGASES IDEALES Y REALES Presion SeudoreducidaJinson SantanaPas encore d'évaluation
- Ecuacion de Estado Cap 1Document4 pagesEcuacion de Estado Cap 1Jose ChPas encore d'évaluation
- Gases Reales e IdealesDocument14 pagesGases Reales e IdealesGeorges EskandarPas encore d'évaluation
- PresentacionDocument24 pagesPresentacionAndrea CastellanosPas encore d'évaluation
- Convertidores Dc-Ac Con Carga ResistivaDocument21 pagesConvertidores Dc-Ac Con Carga ResistivaAndrea CastellanosPas encore d'évaluation
- Circulacion de AguaDocument19 pagesCirculacion de AguaAndrea CastellanosPas encore d'évaluation
- Horno de TunelDocument11 pagesHorno de TunelAndrea Castellanos100% (1)
- Practica 1 Opams Configuracion BasicaDocument9 pagesPractica 1 Opams Configuracion BasicaAndrea CastellanosPas encore d'évaluation
- Tarea Sintesis Inorganica 1 2020Document4 pagesTarea Sintesis Inorganica 1 2020irvin aguirre floresPas encore d'évaluation
- Sensores y TransmisoresDocument23 pagesSensores y TransmisoresErick Saúl TorresPas encore d'évaluation
- Ernest RutherfordDocument3 pagesErnest RutherfordceskolarPas encore d'évaluation
- Cobre BlistersDocument3 pagesCobre BlistersAlexsandro Rodriguez FuentesPas encore d'évaluation
- Autobronceadores PDFDocument5 pagesAutobronceadores PDFHéctor De CassoPas encore d'évaluation
- Diferencias Y Similitudes Entre Potencial Graduado Y Potencias de AcciónDocument15 pagesDiferencias Y Similitudes Entre Potencial Graduado Y Potencias de Acciónflopii melloPas encore d'évaluation
- Practica #03 PUNTO DE FUSION 3Document7 pagesPractica #03 PUNTO DE FUSION 3Alesandro DuartePas encore d'évaluation
- Instructivos TP - Instalaciones Térmicas y de Gas Individuales y CentralizadasDocument19 pagesInstructivos TP - Instalaciones Térmicas y de Gas Individuales y CentralizadasFacundo Martinez100% (2)
- Informe de La Obtención de Dibenzalacetona ReporteDocument4 pagesInforme de La Obtención de Dibenzalacetona ReporteAdrian Bermudez LoeraPas encore d'évaluation
- Determinacion de Zinc en Una Muestra de Pila SecaDocument13 pagesDeterminacion de Zinc en Una Muestra de Pila SecaJohann Albert Arroyo RojasPas encore d'évaluation
- Tema de Exposicion BIOLOGIADocument2 pagesTema de Exposicion BIOLOGIAJAIRO FLORESPas encore d'évaluation
- Clase 6Document30 pagesClase 6Jesus Manuel Yallerco VenegasPas encore d'évaluation
- Proyecto de Control de Calidad de AireDocument34 pagesProyecto de Control de Calidad de AirePaolyz QPas encore d'évaluation
- Cuestionario Solidificación Ingeniería de Materiales IDocument3 pagesCuestionario Solidificación Ingeniería de Materiales IrubenPas encore d'évaluation
- Paso 5 - Laboratorio de Farmacotecnia - Yenny Andrade - Gupo 67Document20 pagesPaso 5 - Laboratorio de Farmacotecnia - Yenny Andrade - Gupo 67Angii BenavidesPas encore d'évaluation
- Semana 7 - Carbon Activado N ADocument36 pagesSemana 7 - Carbon Activado N AJadhira RamirezPas encore d'évaluation
- AaaaaaaaaaaaDocument134 pagesAaaaaaaaaaaaHENRY HUACCAYCACHACC CAJAMARCAPas encore d'évaluation
- Módulo Iv-Ptar-ImprimirDocument90 pagesMódulo Iv-Ptar-ImprimirArias Espinoza Natalia100% (1)
- Guia Bioquimica IiDocument85 pagesGuia Bioquimica IiARIEL TAIPEPas encore d'évaluation
- Preguntas Del Examen Integrador - Giselle MontenegroDocument20 pagesPreguntas Del Examen Integrador - Giselle Montenegromicaela.tapiaPas encore d'évaluation
- Diagrama de Proceso y de Equipos-PenicilinaDocument2 pagesDiagrama de Proceso y de Equipos-PenicilinaCarlos Alberto Abaunza CamachoPas encore d'évaluation
- Informe de Practica 4 CromatografiaDocument14 pagesInforme de Practica 4 CromatografiaDavid BurbanoPas encore d'évaluation
- Ts 5000Document192 pagesTs 5000Jonathan Aguilera GonzálezPas encore d'évaluation
- Clase 11 PDFDocument26 pagesClase 11 PDFMoises TordoyaPas encore d'évaluation
- PRAC.#1 Reacciones de Reconocimientos de CarbohidratosDocument4 pagesPRAC.#1 Reacciones de Reconocimientos de CarbohidratosGLORIA MARGARITA GUERRERO REYPas encore d'évaluation
- Introduccion Al Metabolismo Tema 12Document5 pagesIntroduccion Al Metabolismo Tema 12Oriana Lopez100% (1)
- 6°quimicaDocument3 pages6°quimicaOdair PradaPas encore d'évaluation
- Practica 2Document3 pagesPractica 2MILLER GANDHY REA SALASPas encore d'évaluation
- Quimica 6Document8 pagesQuimica 6Andres Castro FuentesPas encore d'évaluation
- Amalgamas Dentales (Exposicion)Document29 pagesAmalgamas Dentales (Exposicion)Daniel MartínezPas encore d'évaluation