Académique Documents
Professionnel Documents
Culture Documents
Combustion 1
Transféré par
YoussefCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Combustion 1
Transféré par
YoussefDroits d'auteur :
Formats disponibles
Application du premier Principe aux combustions
A - Introduction :
1) Quest-ce quune combustion ?
La combustion dsigne une raction chimique au cours de laquelle il y a oxydation complte ou
partielle dun corps (*).
Les ractions doxydation sont, en gnral, exothermiques (elles dgagent de la chaleur) ; le
terme combustion sapplique aux cas o la raction est suffisamment rapide pour quelle
se matrialise par une flamme, des tincelles, etc .
(*) Cette espce chimique, totalement ou partiellement oxyde, est appele combustible ou
carburant ; lespce oxydante est le comburant .
Exemple : La corrosion du fer , en atmosphre humide est une raction doxydation : le dioxygne et
leau sont les oxydants, le fer est oxyd MAIS cette raction, bien quexothermique, se produit si
lentement quon ne parle pas de combustion !
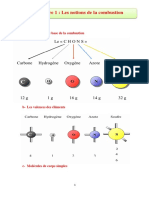
2) Quelques exemples de combustibles :
Le combustible qui peut tre solide, liquide ou gazeux, est, le plus souvent, compos de carbone et
dhydrogne. Les lments oxygne, azote sont souvent prsents galement. Les matires minrales
incombustibles se retrouvent dans les cendres.
Exemples de combustibles : essence, mthane, propane, paraffine, alcool, .
Le comburant usuel est, le plus souvent, le dioxygne contenu dans lair mais pas toujours !
Les bilans chimiques ci-dessous, sont des bilans de combustions : le comburant est mis entre crochets,
dans chaque cas.
CH 4 ( g ) + [ 2 O 2 ( g ) ]
CO 2 ( g ) + 2 H 2O ( g )
3 [ Cl 2 ( g ) ] + 2 Fe ( s )
2 FeCl 3 ( s )
2 Mg ( s ) + [ CO 2 ( g ) ]
2 MgO ( s ) + C ( s )
3) Combustion complte ou incomplte :
On parle de combustion complte quand loxydation des lments chimiques du combustible
est mene son terme.
Llment chimique carbone est entirement oxyd en dioxyde de carbone
( CO 2 ) .
Llment chimique hydrogne est entirement oxyd en eau ( H 2 O ) .
etc
Page 1
document propos sur le site Sciences Physiques en BTS : http://nicole.cortial.net
Exemple : Pour un hydrocarbure ( C x H y ) , la combustion complte se traduit par bilan suivant :
C xH y + ( x +
y
)O2
4
x CO 2 +
y
H 2O
2
Par contre, la combustion incomplte dun hydrocarbure, peut donner un mlange de monoxyde de
carbone ( CO ) ( DANGER ! ), de dioxyde de carbone, deau, de carbone, de dihydrogne, ...
Remarque : Combustion stchiomtrique
Dans ce cas idal, le combustible et le comburant sont mlangs et ragissent dans les proportions
stchiomtriques.
B - Application du premier principe la thermochimie :
1) Gnralits :
Les ractions chimiques sont, le plus souvent, effectues, soit volume constant, soit pression
constante.
combustions volume constant (isochores) :
Dans une telle volution, il ny a pas de travail chang entre le systme et lextrieur, et lon a :
Q v = U = U 2 U 1
combustions pression constante (isobares).
Dans une telle volution, on a :
Q p = H = H 2 H 1
Dans ces deux cas, la chaleur mise en jeu ne dpend que de ltat initial et de ltat final (U et H
sont des fonctions dtat).
Par la suite, nous nous limiterons aux ractions de combustions pression constante car, dans la
plupart des cas, la diffrence entre Q v et Q p est ngligeable.
2) Enthalpie standard de formation :
Lnergie interne, comme lenthalpie nest dfinie qu une constante additive prs ; aussi choisit-on
des conditions arbitraires de temprature et de pression pour lesquelles on attribue par convention,
une enthalpie nulle certains corps (le plus souvent il sagit de corps forms dune seule sorte
datomes).
On choisit, le plus souvent, pour cet tat de rfrence, les conditions standards (pression
atmosphrique normale) et une temprature de 25 C .
Dans ces conditions, lenthalpie standard de formation dun corps est dfinie comme la diffrence
entre lenthalpie standard du corps et lenthalpie standard des substances lmentaires partir
desquelles il est form.
f H 0
Conditions standards
Cette enthalpie peut tre dtermine par des mesures ou par des calculs faisant appel la
thermodynamique statistique.
Des tables donnent les enthalpies standards de formation de diverses substances.
Page 2
document propos sur le site Sciences Physiques en BTS : http://nicole.cortial.net
Exemples : On note f H 0 ( X ) lenthalpie standard de formation de lespce chimique X.
A la temprature T = 298 K , on a :
Espces chimiques
O 2(g )
CO 2 ( g )
C H 3 CO O H ( l )
H 2 O (l)
N 2(g )
C ( graphite )
f H 0 (en kJ . mol 1 )
- 393,5
- 487,0
- 285,0
3) Chaleurs de raction dans les conditions standards :
Soit la raction : a 1 A 1 + a 2 A 2 + ........
a ' 1 A ' 1 + a ' 2 A ' 2 + .... + Q p
Si les produits et les ractifs sont pris dans ltat standard, la chaleur de raction Q p est appele
enthalpie standard de la raction ; on la note r H 0 .
Q p = rH 0 =
a ' i f H0 ( A ' i )
a i f H 0(A i )
Loi de Hess
Exemple 1:
A laide des donnes ci-dessus, dterminer lenthalpie standard de la raction de combustion de
lacide thanoque en prsence dun excs de dioxygne.
Vrifier que la raction est exothermique.
Solution : quation-bilan de la raction :
C H 3 C O O H ( l ) + 2 O 2 ( g ) 2 CO 2 ( g ) + 2 H 2 O ( l )
Rq : Bien rflchir ltat physique des corps (liquide, solide, gazeux) dans les conditions standards !
Q p = r H 0 = 2 f H 0 ( H 2 O ( l ) ) + 2 f H 0 ( CO 2 ( g ) ) 2 f H 0 ( O 2 ( g ) ) f H 0 ( CH 3COOH ( l ) )
Application numrique : Q p = r H 0 = 2 ( 285 ) + 2 ( 393,5 ) 2 ( 487 ) = 871 kJ . mol 1
Exemple 2 :
Dterminer, laide des donnes ci-dessous, la chaleur dgage par la combustion complte dune
mole de mthane, dans les conditions standards et 25 C .
Remarque : En ramenant les produits de la combustion 25 C , il y a condensation de leau !
Espces chimiques
f H 0 (en kJ . mol 1 )
O 2(g )
CO 2 ( g )
H 2 O (l)
CH 4 ( g )
- 393,5
- 285,0
- 74,8
Solution : quation-bilan de la raction :
CH 4
+ 2 O 2 (g)
(g)
CO 2 ( g ) + 2 H 2 O ( l )
r H 0 = f H 0 ( CO 2 ( l ) ) + 2 f H 0 ( H 2O ( l ) ) 2 f H 0 ( O 2 ( g ) ) f H 0 ( CH 4 ( g ) )
Page 3
document propos sur le site Sciences Physiques en BTS : http://nicole.cortial.net
Application numrique : r H 0 = ( 393,5 ) + 2 ( 285 ) ( 74,8 ) = 888,7 kJ . mol 1
Remarque importante : Comment calculer une chaleur de raction une temprature diffrente de
298 K (cette temprature est celle laquelle les enthalpies de formation sont donnes, le plus
souvent) ?
Lenthalpie est une fonction dtat de sorte que sa variation ne dpend pas du cycle de
transformations choisi entre ltat initial et ltat final. Dans la pratique, il faudra donc trouver une
suite de transformations qui sadapte bien aux donnes du texte.
Exemple 3 :
Connaissant la chaleur de raction du mthane T 0 = 298 K et les capacits calorifiques
molaires des ractifs et des produits forms, exprimer la chaleur dgage par la combustion
complte dune mole de mthane, dans les conditions standards (pression gale 1 bar) et
T = 273 K .
1 mole de mthane
+
2 moles de dioxygne
273 K
1 mole de dioxyde de carbone
+
2 moles de vapeur deau
273 K
r H (T)?
H 1 Echauffement
isobare
H2
1 mole de mthane
+
2 moles de dioxygne
298 K
r H (T 0)
Refroidissement
isobare
1 mole de dioxyde de carbone
+
2 moles de vapeur deau
298 K
On crit, alors : r H ( T ) = H 1 + r H ( T 0 ) + H 2 avec :
298 K
H 1 =
C p ( CH 4 ( g ) ) dT
298 K
C p ( O 2 ( g ) ) dT
+ 2
273 K
chauffement isobare
273 K
273 K
que lon crit aussi : H 1 =
273 K
C p ( CH 4 ( g ) ) dT 2
298 K
273 K
H 2 =
C p ( CO 2 ( g ) ) dT
298 K
C p ( O 2 ( g ) ) dT
298 K
273 K
+ 2
C p ( H 2O ( g ) ) dT
refroidissement isobare
298 K
Ce rsultat se gnralise toute raction :
T
r H ( T ) = r H ( T0 ) +
produits T 0
forms
C p dT
C p dT
ractifs T 0
Page 4
document propos sur le site Sciences Physiques en BTS : http://nicole.cortial.net
Vous aimerez peut-être aussi
- Réussir Le Nouveau TOEICDocument92 pagesRéussir Le Nouveau TOEICayassahScribd100% (2)
- TP Extraction Solide LiquideDocument4 pagesTP Extraction Solide LiquideYoussef71% (7)
- Analyse Des Risques - FFO - 241011Document38 pagesAnalyse Des Risques - FFO - 241011YoussefPas encore d'évaluation
- THERMIQUEDocument70 pagesTHERMIQUEYassine Lemsyeh100% (2)
- Examen Combustion M1EN 2021Document2 pagesExamen Combustion M1EN 2021Khaled ChaibPas encore d'évaluation
- Série de TD N°2 Final PDFDocument2 pagesSérie de TD N°2 Final PDFAbderrahmane100% (1)
- Formation ÉvacuationDocument48 pagesFormation ÉvacuationYoussef100% (1)
- Economie D'énergie Sur La Production de VapeurDocument121 pagesEconomie D'énergie Sur La Production de Vapeurrania rejebPas encore d'évaluation
- 1-Fonction Machine Frigorifique Partie1 8Document60 pages1-Fonction Machine Frigorifique Partie1 8Boubaker YoussefPas encore d'évaluation
- TD I Introduction Aux Machines ThermiquesDocument3 pagesTD I Introduction Aux Machines ThermiquesAmih Shkf33% (3)
- Examen Thermodynamique Appliquée 2018 - PrincipaleDocument6 pagesExamen Thermodynamique Appliquée 2018 - PrincipaleMayssem SouidPas encore d'évaluation
- Code Du Travail Au MarocDocument187 pagesCode Du Travail Au MarocSAKSIK100% (50)
- Combustion - Chap 2 PDFDocument18 pagesCombustion - Chap 2 PDFAlekhya100% (2)
- CHAPITRE 2 - Généralités Sur La CombustionDocument23 pagesCHAPITRE 2 - Généralités Sur La CombustionSamuel DotouPas encore d'évaluation
- Cours Iup Me Echangeurthermique 2Document80 pagesCours Iup Me Echangeurthermique 2ridhajamel50% (2)
- Fiche de Poste Ressuage Par ImmersionDocument2 pagesFiche de Poste Ressuage Par ImmersionYoussefPas encore d'évaluation
- Procedure Gestion DechetsDocument7 pagesProcedure Gestion DechetsaminaPas encore d'évaluation
- CombustionDocument28 pagesCombustionHoucem Eddine MechriPas encore d'évaluation
- TSP1SP3Ch14T15-enonces Exos p365 A 373 PDFDocument6 pagesTSP1SP3Ch14T15-enonces Exos p365 A 373 PDFAhmed MobarkiPas encore d'évaluation
- COURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFDocument36 pagesCOURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFKone Ousmane100% (1)
- Le DégazageDocument11 pagesLe Dégazagekhelalfa karimaPas encore d'évaluation
- TP5 Analytique 3émé AnnéeDocument10 pagesTP5 Analytique 3émé AnnéeLïnâ ExØtîc DõlĽPas encore d'évaluation
- Présentation Youness NASSIR - 1er Poste ApprenantDocument46 pagesPrésentation Youness NASSIR - 1er Poste ApprenantYoussef100% (1)
- ISO-14001 2015 Upgrade Checklist (French)Document35 pagesISO-14001 2015 Upgrade Checklist (French)YoussefPas encore d'évaluation
- Web Combustions ExDocument7 pagesWeb Combustions ExJawad HamritiPas encore d'évaluation
- BTS CIRA 04 1er PrincipeDocument3 pagesBTS CIRA 04 1er PrincipekhaPas encore d'évaluation
- Thermochimie 2020-1Document3 pagesThermochimie 2020-1Salima SouhilaPas encore d'évaluation
- Ostwald Exercices PDFDocument9 pagesOstwald Exercices PDFoverdose500Pas encore d'évaluation
- Notions Combustibles Exercices Enonces PDFDocument8 pagesNotions Combustibles Exercices Enonces PDFHoussam HaddaniPas encore d'évaluation
- TD N°1 CombustionDocument4 pagesTD N°1 CombustionPaul Julbin NJOCK100% (1)
- Combustion ExoDocument2 pagesCombustion ExoSimo El AzaarPas encore d'évaluation
- Exo Transfert Thermique-ConvertiDocument5 pagesExo Transfert Thermique-ConvertiFerahtia HindPas encore d'évaluation
- PDF Cours Principe de La CombustionDocument3 pagesPDF Cours Principe de La CombustionAhmed GHATTAB100% (1)
- TD de Echangeurs Thermiques 22-23-L2ME-IUADocument3 pagesTD de Echangeurs Thermiques 22-23-L2ME-IUAYannick NougbelePas encore d'évaluation
- Examen Transfert de Chaleur1Document1 pageExamen Transfert de Chaleur1bensouiciPas encore d'évaluation
- Examen de Synthèse S2 L3 GP Procédés CryogéniquesDocument3 pagesExamen de Synthèse S2 L3 GP Procédés CryogéniquesNardjes Ben100% (1)
- Ex 13 STS1 ElectrothermieDocument22 pagesEx 13 STS1 Electrothermiehissein ousmanPas encore d'évaluation
- Printing Combustion Et ChaudièreDocument1 pagePrinting Combustion Et ChaudièreSirineJamoussiPas encore d'évaluation
- µ = 10 ρ = 1000 kg/m λ = 0,64 W/m.°CDocument2 pagesµ = 10 ρ = 1000 kg/m λ = 0,64 W/m.°COussama Oussamq100% (1)
- td28 th7 cm7Document2 pagestd28 th7 cm7Nawel KrumpfPas encore d'évaluation
- ThermodynamiqueDocument146 pagesThermodynamiqueahmedPas encore d'évaluation
- Cours Energetique Devoirs Examen SherbrookeUniversityDocument41 pagesCours Energetique Devoirs Examen SherbrookeUniversityMohamednjahi OmriPas encore d'évaluation
- Calcul Echangeur de ChaleurDocument6 pagesCalcul Echangeur de ChaleurFatima Yahia100% (1)
- Cours ElectrothermieDocument17 pagesCours ElectrothermieHassan Guenzaouz100% (1)
- Etude de Cas - CombustionDocument2 pagesEtude de Cas - CombustionDroidy Space100% (1)
- Exo échangeur-IIDocument4 pagesExo échangeur-IISaid KhePas encore d'évaluation
- Travaux Diriges de Froid S2Document2 pagesTravaux Diriges de Froid S2Mustapha Elmaghraoui100% (1)
- Suite 2 Chapitre 1 CombustionDocument3 pagesSuite 2 Chapitre 1 CombustionJerusalem AbrahamPas encore d'évaluation
- Syllabus Fours Et Chaudières PDFDocument1 pageSyllabus Fours Et Chaudières PDFBeichaPas encore d'évaluation
- Analyse ExergétiqueDocument16 pagesAnalyse ExergétiqueKdr Khair-EddinePas encore d'évaluation
- Exercices - EnoncésDocument9 pagesExercices - EnoncésSaadi Badis100% (1)
- TD 2 Biomasse 2021 2022Document2 pagesTD 2 Biomasse 2021 2022ToufikPas encore d'évaluation
- Solution - TD3 - Modelisation de La Combustion Dans Les MoteursDocument2 pagesSolution - TD3 - Modelisation de La Combustion Dans Les Moteurshousam100% (1)
- Serie 3 PDFDocument4 pagesSerie 3 PDFAbdelilah ElmahsaniPas encore d'évaluation
- TF06 Conduction 08Document2 pagesTF06 Conduction 08Andres Marchese0% (1)
- Chapitre I Rappels Et Notions Fondamentales de La CombustionDocument9 pagesChapitre I Rappels Et Notions Fondamentales de La CombustionÀzïz LAPas encore d'évaluation
- Phys Chim 2001Document8 pagesPhys Chim 2001Issam NajibPas encore d'évaluation
- 09 Combustion Exerc6Document5 pages09 Combustion Exerc6KHAOULA AJLANEPas encore d'évaluation
- DynSystCompl2 (Ailettes)Document11 pagesDynSystCompl2 (Ailettes)adamareej703Pas encore d'évaluation
- Echangeur de ChaleurDocument17 pagesEchangeur de ChaleuraliPas encore d'évaluation
- Rendement D'un Four1Document2 pagesRendement D'un Four1Hamza OuniPas encore d'évaluation
- Série N°4 - ThermochimieDocument2 pagesSérie N°4 - ThermochimieVonimaharavo Rasoanasoloniaina100% (2)
- TP Echangeur de ChaleurDocument7 pagesTP Echangeur de ChaleurMassi Boum100% (1)
- Série N 3 Calcul FoursDocument1 pageSérie N 3 Calcul FoursYasmine HasnaouiPas encore d'évaluation
- Travaux Dirigées Echangeur de ChaleurDocument6 pagesTravaux Dirigées Echangeur de ChaleurOumayma Hdioud100% (1)
- Série de TD N° 02: Machines Thermiques Chapitre 02: Machines À Cycles Réceptrice Exercice 01Document1 pageSérie de TD N° 02: Machines Thermiques Chapitre 02: Machines À Cycles Réceptrice Exercice 01Ahmed Ayoub OsmaniPas encore d'évaluation
- 17.2 - Exercices - Stockage - Mecanique - Gravitaire 20210329Document5 pages17.2 - Exercices - Stockage - Mecanique - Gravitaire 20210329Ahmed GHATTAB100% (1)
- TD 2 2020Document4 pagesTD 2 2020Ralf Wolwerine0% (2)
- Echangeur de Chaleur Par RayonnementDocument7 pagesEchangeur de Chaleur Par RayonnementBichou DerresPas encore d'évaluation
- Devoir SDocument3 pagesDevoir SMourad MatmourPas encore d'évaluation
- Chaudières Industrielles MI GChimique Mai 2018Document60 pagesChaudières Industrielles MI GChimique Mai 2018Amine RedouanePas encore d'évaluation
- VLE Agents ChimiquesDocument6 pagesVLE Agents ChimiquesYoussefPas encore d'évaluation
- 03 PRI Process JLDocument30 pages03 PRI Process JLYoussefPas encore d'évaluation
- ANNEX 1 - Module Signalation Du RisqueDocument1 pageANNEX 1 - Module Signalation Du RisqueYoussefPas encore d'évaluation
- BrochureDocument2 pagesBrochureYoussefPas encore d'évaluation
- Présentation Du ProjetDocument1 pagePrésentation Du ProjetYoussefPas encore d'évaluation
- Fds-Socosurf A 1806 (P61806a)Document11 pagesFds-Socosurf A 1806 (P61806a)YoussefPas encore d'évaluation
- 6Document34 pages6YoussefPas encore d'évaluation
- Lean 6sigmaDocument2 pagesLean 6sigmaYoussefPas encore d'évaluation
- Calcul Du Bilan Thermique Mensuel D'un Bâtiment: LESOSAIDocument19 pagesCalcul Du Bilan Thermique Mensuel D'un Bâtiment: LESOSAIYoussefPas encore d'évaluation
- N1 FR 0715Document11 pagesN1 FR 0715YoussefPas encore d'évaluation
- Outils D'évaluation Des PerformancesDocument22 pagesOutils D'évaluation Des PerformancesYoussefPas encore d'évaluation
- 101 Idees ÉCONOMIES D'ÉNERGIEDocument16 pages101 Idees ÉCONOMIES D'ÉNERGIEHassan Gc Bessaha100% (1)
- Procédure MEKDocument4 pagesProcédure MEKYoussefPas encore d'évaluation
- Demande de RéservationDocument1 pageDemande de RéservationYoussefPas encore d'évaluation
- OFPPT-02-02 (Partie 01)Document63 pagesOFPPT-02-02 (Partie 01)YoussefPas encore d'évaluation
- Rapport 1er Poste ApprenantDocument91 pagesRapport 1er Poste ApprenantYoussef100% (1)
- QualitéDocument61 pagesQualitéMeriem Elb100% (3)
- Synthèse 1er Poste ApprenantDocument3 pagesSynthèse 1er Poste ApprenantYoussefPas encore d'évaluation
- Spectro RMN Rabat AgdalDocument26 pagesSpectro RMN Rabat AgdalYoussefPas encore d'évaluation
- 2TP CalorimètreDocument4 pages2TP CalorimètreYoussef50% (2)
- Gaz Naturel LiquéfiéDocument9 pagesGaz Naturel Liquéfiéshahin Tamouzadeh100% (1)
- Hydrogène LiquideDocument12 pagesHydrogène Liquidealexy dufilsPas encore d'évaluation
- ch9 Temps Evolution Chimique2Document5 pagesch9 Temps Evolution Chimique2mohamedPas encore d'évaluation
- FioulDocument6 pagesFioulmadadi moradPas encore d'évaluation
- Cours AlcenesDocument11 pagesCours AlcenesAssan SanogoPas encore d'évaluation
- Cours Thermochimie de La Combustion-Neila MhiriDocument7 pagesCours Thermochimie de La Combustion-Neila MhiriYossri Sallem100% (1)
- Correction La Plongée Sous Marine Brevet Serie Générale Polynésie 2022Document2 pagesCorrection La Plongée Sous Marine Brevet Serie Générale Polynésie 2022Ma RyPas encore d'évaluation
- 2004 Maroc Correction Pile Electrolyse CuivreDocument2 pages2004 Maroc Correction Pile Electrolyse Cuivredjoudi mouradPas encore d'évaluation
- Thermo - Exercices Corrigés PDFDocument88 pagesThermo - Exercices Corrigés PDFayoub oubeddaPas encore d'évaluation
- Printing Combustion Et ChaudièreDocument1 pagePrinting Combustion Et ChaudièreSirineJamoussiPas encore d'évaluation
- Vitesse Reaction Chimie Partie 2Document8 pagesVitesse Reaction Chimie Partie 2Noémie MacenoPas encore d'évaluation
- Cinétique 2017 CatalyseDocument30 pagesCinétique 2017 CatalysedderuizgzPas encore d'évaluation
- Oraux Thermochimie 2040-2041Document4 pagesOraux Thermochimie 2040-2041Amine KabbajPas encore d'évaluation
- AclcenesDocument25 pagesAclcenesSamba BarhamPas encore d'évaluation
- Mémoires Fin Génie Des ProcédésDocument2 pagesMémoires Fin Génie Des ProcédésAimen D BouzidPas encore d'évaluation
- CHAPITREIVdistillationDocument14 pagesCHAPITREIVdistillationSavana BellaPas encore d'évaluation
- Combustion Des Matières Organiques Prof - Elhabib (WWW - Pc1.ma)Document2 pagesCombustion Des Matières Organiques Prof - Elhabib (WWW - Pc1.ma)Agnaou MohamedPas encore d'évaluation
- Chimisorption - ExDocument4 pagesChimisorption - Exskouri houdaPas encore d'évaluation
- Intro HydratesDocument58 pagesIntro HydratesAyoub Magroud0% (1)
- CC 2' - 4 S1 2éme Année FRDocument1 pageCC 2' - 4 S1 2éme Année FRIkram Bouyaoum100% (1)
- 03 Alimentation CarburationDocument20 pages03 Alimentation CarburationJJPas encore d'évaluation
- Sécheurs Par Adsorption Régénération Avec Chaleur Type - MWEDocument2 pagesSécheurs Par Adsorption Régénération Avec Chaleur Type - MWEsav.bellignatPas encore d'évaluation
- Controle 3 - 3 S1 2AC InterDocument2 pagesControle 3 - 3 S1 2AC InterSanae ZwinaPas encore d'évaluation
- ISF Cellule: SP C2: Alcanes Année Scolaire 2021/2022 Classe: 1S2Document2 pagesISF Cellule: SP C2: Alcanes Année Scolaire 2021/2022 Classe: 1S2Papa DiagnePas encore d'évaluation
- Craquage Catalytique Des ProduitsDocument106 pagesCraquage Catalytique Des ProduitsAbassyacoubou75% (4)
- Fiche Technique H2Document7 pagesFiche Technique H2abd elheq zeguerrouPas encore d'évaluation