Académique Documents
Professionnel Documents
Culture Documents
Marchaanaliticadecationes
Transféré par
Bryan UnTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Marchaanaliticadecationes
Transféré par
Bryan UnDroits d'auteur :
Formats disponibles
MARCHA SISTEMTICA
SEPARACIN E IDENTIFICACIN DE CATIONES
Carolina Vesga H.; Luis F. Pedroza G.
Universidad del Atlntico
Facultad de Ciencias Bsicas
Programa de Qumica
Qumica Analtica
Resumen
La separacin de diferentes grupos inicos se puede llevar a cabo por medio de reacciones
qumicas selectivas, reacciones especficas, reacciones que involucren una o unas especies
determinadas de iones. En la prctica se realizaran procesos de separacin de cationes
mediante marcha analtica sistemtica, haciendo que estas especies, las cuales existen en
solucin, reaccionen con un reactivo especfico, dando diferentes seales de reaccin, tales
como cambios de coloracin, precipitados, entre otros. Se realizan reacciones selectivas y
especficas, identificando cada tipo de reaccin y el equilibrio presente en estas.
OBJETIVOS
En el proceso de precipitacin y separacin de los diferentes grupos de cationes,
aplicar la marcha sistemtica.
Mediante el uso de reacciones selectivas, separar los diferentes grupos de cationes
de la solucin
Mediante el uso de reacciones especficas, identificar los diferentes cationes
individuales
DISCUSIN
En la prctica se analizaron e identificaron 3 grupos de iones, para los cuales se obtienen
las siguientes reacciones en cada proceso de separacin e identificacin.
GRUPO I (Ag+, Hg22+ y Bi3+)
Al Grupo 1 de cationes se aade NH4Cl
4Cl- + Hg22+ + Ag+ + Bi3+ == BiOCl + AgCl + Hg2Cl2
[1]
Reacciones Especficas y Selectivas
Qumica Analtica
A [1] se aade NH3
BiOCl + AgCl + Hg2Cl2+ 5NH3 == [Ag(NH3)2]+ + [Hg(NH2)]+ + [BiO(NH3)2]+ + 4Cl- +
Hg
[2]
A [2] se aade HNO3, se realiza calentamiento
3Hg + 8H+ + 8NO3- == 3Hg+ + 3NO3- + 2NO + 4H2O
[3]
Confirmacin del mercurio (I), formacin de amalgama Cu - Hg
2Hg(NO3) + Cu == Cu(NO3)2 + 2Hg
[4]
Identificacin del Bismuto (III)
BiOCl + 2HCl +SC(NH2)2 == [Bi(SC(NH2)2)]3+ + 3Cl-
[5]
Identificacin del ion Plata (I)
[Ag(NH3)2]+Cl- + KI == AgI + KCl + 2NH3
[6]
Confirmacin del ion Plata (I)
[Ag(NH3)2]+Cl- + 2HNO3 == 2NH4+ +AgCl + 2NO3-
[7]
GRUPO II (Al3+, Bi3+, Fe3+ y Hg2+)
Adicin del NH3 concentrado al grupo II de cationes.
NH3 + H2O == OH- + NH4+
[8]
A pesar de la gran concentracin del amoniaco aadido, al mezclarse con la solucin de las
sales entra en procesos una reaccin cido base con el agua que diluye las sales que aportan
los diferentes iones.
Al3+ + 3OH- == Al(OH)3
[9]
Bi3+ + 3OH- == Bi(OH)3
[10]
Hg2+ + 2NH3 == Hg(NH3)+Cl- + NH4+ + Cl-
[11]
Fe3+ + 3OH- == Fe(OH)3
[12]
Adicin NaOH
Al(OH)3 + NaOH == NaAl(OH)4
[13]
Se aade CH3COOH
NaAl(OH)4 + CH3COOH == Al(OH)2(CH3COO) + H2O + NaOH
[14]
Reacciones Especficas y Selectivas
Qumica Analtica
Identificacin de Aluminio (III)
Al3+ + H5C15H5O7 == [A1H4CI5H507]2+
[15]
Estructura Qumica de la Morina
H5C15H5O7
Estructura Qumica del complejo MorinaAluminio [A1H4CI5H507] 2+
Confirmacin del ion Aluminio (III)
Al(OH)4- + NH3 + CH3OOH + ALUMINON == Al(OH)3 + Otras especies en solucin
[16]
[16]
Aluminn
Adicin HNO3 con el fin de diluir el precipitado.
Prueba para el Mercurio (II). Formacin de Amalgama
Hg(NO3)2 + Cu == Cu(NO3)2 + Hg
[17]
Confirmacin del Mercurio (II)
3Hg2+ + 2SnCl2 + 6Cl- == Hg2Cl2 + 2SnCl4 + Hg
Prueba para el Bismuto (III)
3
[18]
Reacciones Especficas y Selectivas
Qumica Analtica
Bi3+ + 3SC(NH2)2 == [Bi(SC(NH2)2)3]3+
[19]
Prueba para el Hierro (III)
3SCN- + Fe3+ == Fe(SCN)3
[20]
Confirmacin del Hierro (III)
4Fe3+ + 3[Fe(CN)6]4- == Fe[Fe(CN)6]3
[21]
GRUPO III (Ba2+, Ca2+, Mg2+ y Zn2+)
Adicin K2HPO4
Mg2+ + 6HPO42- + 2NH3 + 3Ca2+ + 3Ba2+ + Zn2+ == MgNH4PO4 + Ba3(PO4)2 +
Ca3(PO4)2 + ZnNH4PO4 + 4H+
[22]
Adicin CH3COOH
CH3COOH == CH3COO- + H+
Zn2+ + H+ + NH3 + HPO42- == ZnNH4PO4
[23]
Solvatacin con HCl
Identificacin del Zinc (II)
2Zn2+ + 2K+ + 2[Fe(CN)6]3- == Zn2K2[Fe(CN)6]
[24]
Confirmacin del Zinc
[Hg(NCS)4]2- + Zn2+ == Zn[Hg(NCS)4]
[25]
Identificacin del Bario (II)
Ba2+ + (NH4)2SO4 == BaSO4 + 2NH4+
[26]
Confirmacin del Bario (II)
BaSO4 + CrO42- == BaCrO4 + SO42-
[27]
Identificacin del Calcio
Ca2+ + MUREXIDA == Ca+MUREXIDA- + NH4+ (Formacin de Complejo en medio
amoniacal)
[28]
Reacciones Especficas y Selectivas
Qumica Analtica
Murexida
Separacin iones Mg2+ y Ca2+
Mg2+ + Ca2+ + (NH4)2C2O4 == CaC2O4 + 2NH4+ + Mg2+
[29]
Confirmacin del Calcio
CaC2O4 + HCl == CaCl + HC2O4
[30]
Identificacin del Magnesio
Mg2+ + 2NaOH == Mg(OH)2 + 2Na+
[31]
Confirmacin del Magnesio con Amarillo de Titan
Mg2+ + 2NaOH == Mg(OH)2 + 2Na+
[32]
IDENTIFICACION DE REACCIONES SELECTIVAS Y ESPECFICAS
Pautas para el entendimiento de la tabla de identificacin:
[] Precipitacin.
[] Solvatacin de precipitados.
[] Cambio en el color de la solucin.
[] Prueba de la llama.
[] Reaccin exotrmica.
[] Cambio en la coloracin del cobre.
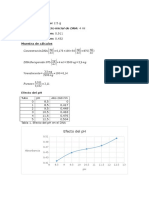
Tabla 1. Identificacin de reacciones selectivas y especficas.
R. Selectiva
Reaccin Especifica
Reaccin
Reactivo Seal de
Iones
de grupo Reaccin Involucrados
1
NH4Cl
[]
Blanco
Seal de
Reaccin
Ion
involucrado
Equilibrio
Qumico
Ag+, Hg22+ y
Bi3+
Eq. de
Solubilidad
[]
Gris
Hg22+
Eq. de
Complejos
Reacciones Especficas y Selectivas
Qumica Analtica
[]
Eq. Redox
[]
Gris
Brillante
Hg22+
Eq. Redox
[] Amarilla
Bi3+
Eq. de
Complejos
[] Amarillo
Claro
Ag+
Eq. de
Solubilidad
[]
Blanco
Ag+
Eq. de
Solubilidad
Eq. AcidoBase
Al3+
Bi3+
Hg2+
Fe3+
10
NH3
11
[]
Blanco
Rojo
Pardo
12
13
[]
Incolora
Al3+
Eq. de
Complejos
14
[]
Al3+
Eq. de
Complejos
Al3+
Eq. de
Complejos
15
[]
Fluorescencia
Verde
16
[]
Rojo
Al3+
Eq. de
Solubilidad
[]
Rosa
Plateado
Hg2+
Eq. Redox
17
Reacciones Especficas y Selectivas
Qumica Analtica
[]
Blanco
Sedoso
[]
Amarillo
Fuerte
[]
Rojo
Sangre
[]
Azul
Oscuro
Hg2+
Eq. Redox
Bi3+
Eq. de
Complejos
Fe3+
Eq. AcidoBase
Fe3+
Eq. de
Solubilidad
Eq. de
Solubilidad
[]
Blanco
Zn2+
Eq. de
Solubilidad
[]
Avellana
Zn2+
Eq. de
Solubilidad
[]
Violeta
Zn2+
Eq. de
Solubilidad
26
[]
Blanco
Ba2+
Eq. de
Solubilidad
27
[]
Amarillo
Ba2+
Eq. de
Solubilidad
28
[]
Naranja
Ca2+
Eq. de
Complejos
29
[]
Ca2+
Eq. de
Solubilidad
30
[]
Ladrillo
Ca2+
31
[]
Azul
Mg2+
Eq. de
Solubilidad
32
[]
Amarillo
Mg2+
Eq. de
Solubilidad
18
19
20
21
22
K2HPO4
[]
Blanco
Ba2+, Ca2+,
Mg2+ y Zn2+
23
24
25
Reacciones Especficas y Selectivas
Qumica Analtica
CONCLUSIONES
Mediante una secuencia lgica de reacciones se puede identificar y separar diferentes tipos
de compuestos, en este caso diferentes cationes, ya sea por grupos, por medio de una
reaccin selectiva, en la cual se ve involucrado un compuesto general o un reactivo de
grupo, siendo que este solo reaccionara con cierto tipo de iones, o de manera especfica, es
decir identificando uno a uno cada tipo de catin.
En esta prctica se reconocen tres tipos de reactivos de grupo: NH4Cl (Para el 1 Grupo de
Cationes), NH3 (Para el 2 Grupo) y K2HPO4 (Para el 3 Grupo). Adems se realizan
diversas reacciones selectivas, separando, identificando y confirmando, determinado catin
de una solucin.
REFERENCIAS
[*]
CURSO DE QUMICA ANALTICA. Anlisis Cualitativo. A. Kreshkov, A.
Yaroslvtsev. Editorial Mir
Vous aimerez peut-être aussi
- Perfiles de Los Kits de CataDocument4 pagesPerfiles de Los Kits de CataBryan UnPas encore d'évaluation
- Apuntes para Exposición de Catálisis HeterogéneaDocument2 pagesApuntes para Exposición de Catálisis HeterogéneaBryan UnPas encore d'évaluation
- Biosíntesis de Fungimetabolitos LecturaDocument8 pagesBiosíntesis de Fungimetabolitos LecturaBryan UnPas encore d'évaluation
- 9028 34250 1 PBDocument17 pages9028 34250 1 PBBryan UnPas encore d'évaluation
- Parcial 2 Espectroscopia 2016-1Document2 pagesParcial 2 Espectroscopia 2016-1Bryan UnPas encore d'évaluation
- Gráficos de Segunda DerivadaDocument31 pagesGráficos de Segunda DerivadaBryan UnPas encore d'évaluation
- Conductividad F PDFDocument12 pagesConductividad F PDFSergio Rivadeneyra AntoPas encore d'évaluation
- Guia ClorofilaDocument4 pagesGuia ClorofilaBryan Un50% (2)
- Taller Nutrición Autótrofa 2Document4 pagesTaller Nutrición Autótrofa 2Bryan UnPas encore d'évaluation
- Libro 1Document22 pagesLibro 1Bryan UnPas encore d'évaluation
- Balance Excel 2Document15 pagesBalance Excel 2Bryan UnPas encore d'évaluation
- TripsinaDocument3 pagesTripsinaBryan UnPas encore d'évaluation
- Datos de Extracción de DNADocument6 pagesDatos de Extracción de DNABryan UnPas encore d'évaluation
- Parcial 2 Espectroscopia 2016-1Document2 pagesParcial 2 Espectroscopia 2016-1Bryan UnPas encore d'évaluation
- Ficha Técnica Del DuraznoDocument3 pagesFicha Técnica Del DuraznoBryan Un50% (2)
- Plan de vigilancia de 2 años para SWUDocument1 pagePlan de vigilancia de 2 años para SWUJuan Villanueva Zamora0% (1)
- 5 formas y claves para diseñar la propuesta de valor de tu empresaDocument15 pages5 formas y claves para diseñar la propuesta de valor de tu empresaMariia CastrillónPas encore d'évaluation
- Perfiles de CargoDocument17 pagesPerfiles de CargoBarbara Miranda CardenasPas encore d'évaluation
- Obras Por Impuestos-Jaime Luis Vilca Vargas PDFDocument32 pagesObras Por Impuestos-Jaime Luis Vilca Vargas PDFJaime Luis Vilca VargasPas encore d'évaluation
- Curriculum Arquitecta Paola GianiniDocument4 pagesCurriculum Arquitecta Paola GianinihgianiniPas encore d'évaluation
- Saucedo Cabrera IsneldaDocument11 pagesSaucedo Cabrera IsneldaIsnelda Saucedo CabreraPas encore d'évaluation
- Perfil Del VendedorDocument25 pagesPerfil Del Vendedorwendy merino mezaPas encore d'évaluation
- NAP 2-0-0.4 Ed2+M1 - PasosSuperioresDocument19 pagesNAP 2-0-0.4 Ed2+M1 - PasosSuperioresguyuyuPas encore d'évaluation
- Manual Del TransitarioDocument34 pagesManual Del Transitariodaviddome100% (2)
- Taller - Unidad 3 - Contabilidad 2Document3 pagesTaller - Unidad 3 - Contabilidad 2RADIOTERAPIA OCBP0% (1)
- ECT Costa Rica PresentacionDocument27 pagesECT Costa Rica PresentacionRudy BerriosPas encore d'évaluation
- Plan Mkt EstructuraDocument2 pagesPlan Mkt EstructuraMichael ApsPas encore d'évaluation
- Formato Bitacora Del AprendizDocument3 pagesFormato Bitacora Del AprendizFrancia Hernandez100% (1)
- Informes Sunat ProvisionDocument4 pagesInformes Sunat ProvisionCharly Hittokiri No YumePas encore d'évaluation
- Real Madrid Analisis FODADocument39 pagesReal Madrid Analisis FODAPedro Lopez Ceja75% (4)
- Práctica de La UreaDocument23 pagesPráctica de La Ureacristian100% (2)
- Certificado Existencia Eden Alonso Juridica PDFDocument3 pagesCertificado Existencia Eden Alonso Juridica PDFEdwin Benitez VasquezPas encore d'évaluation
- ListadoDocument68 pagesListadoAri NarvaezPas encore d'évaluation
- Costos ocultos mala calidadDocument3 pagesCostos ocultos mala calidadPriscilla SalazarPas encore d'évaluation
- Curso de Marketing para El Salón MODAlité - Revista de Peluquería Belleza y PeiDocument10 pagesCurso de Marketing para El Salón MODAlité - Revista de Peluquería Belleza y PeifparilloPas encore d'évaluation
- Estudios Críticos Sobre El ModernismoDocument8 pagesEstudios Críticos Sobre El ModernismoJosé Alfredo Huali Acho0% (1)
- Analisis de Decisiones TecDocument2 pagesAnalisis de Decisiones TecMaestros En LineaPas encore d'évaluation
- Preguntas ImecDocument14 pagesPreguntas ImecPablo Herrera CarboPas encore d'évaluation
- CA3. Inversión en CDTDocument7 pagesCA3. Inversión en CDTJulio CesarPas encore d'évaluation
- Consideraciones Economicas en El Diseño de Componentes ManufacturadosDocument13 pagesConsideraciones Economicas en El Diseño de Componentes ManufacturadosRenzo Morales NuñezPas encore d'évaluation
- Purificación B-Naftol cristalizaciónDocument3 pagesPurificación B-Naftol cristalizaciónHector Jesus Roca LoaizaPas encore d'évaluation
- Consumo en MexicoDocument17 pagesConsumo en MexicoEdimar VeigaPas encore d'évaluation
- Checklist para El Cierre ContableDocument9 pagesChecklist para El Cierre ContableYulis MauryPas encore d'évaluation
- METODO PROMEDIO PONDERADODocument2 pagesMETODO PROMEDIO PONDERADORaff VilamPas encore d'évaluation
- Costos de acreditación y servicios de laboratorios bajo NMX-EC-17025Document12 pagesCostos de acreditación y servicios de laboratorios bajo NMX-EC-17025Joan AlarcónPas encore d'évaluation