Académique Documents
Professionnel Documents
Culture Documents
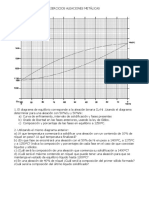
6 Calculos Estequiometricos
Transféré par
altar13Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
6 Calculos Estequiometricos
Transféré par
altar13Droits d'auteur :
Formats disponibles
UNIDADES TECNOLGICAS DE SANTANDER
GUA DE ESTUDIO No.6
IDENTIFICACIN
UNIDAD ACADMICA: DEPARTAMENTO DE CIENCIAS BSICAS
ASIGNATURA: QUMICA INORGNICA
UNIDAD TEMTICA
CLCULOS ESTEQUIOMTRICOS EN REACCIONES QUMICAS
COMPETENCIA
Explicar los tipos de reacciones
qumicas y efectuar clculos
estequiomtricos que involucren
relaciones de masa, volumen en
reacciones
qumicas
balanceadas.
RESULTADOS DE APRENDIZAJE
Identifica los tipos de reacciones qumicas que se llevan a cabo
en la formacin de compuestos qumicos de su entorno.
Balancea reacciones qumicas por diferentes mtodos teniendo
en cuenta la transformacin de la materia y las proporciones
definidas en las cuales se lleva a cabo una reaccin qumica.
Realiza clculos estequiomtricos para cuantificar la eficiencia
de una reaccin qumica, e identificar el reactivo lmite y los
reactivos en exceso.
ACTIVIDADES DE APRENDIZAJE
1. La combustin completa del butano (C4H10) se efecta como sigue:
2C4H10(l) + 13 O2(g) 8CO2(g) + 10 H2O(l)
a)Cuntas moles de O2 son necesarias para quemar 10.0 moles de butano?
b) cuando se queman 10.0 g de butano, cuntos gramos de O2 se necesitan?
2. El alcohol del gasohol arde de acuerdo con la ecuacin siguiente:
C2H5OH(1) + 3O2(g) 2CO2(g) + 3H2O(1)
a)Cuntas moles de CO2 se producen cuando se queman 5.0 moles de C2H5OH?
b) Cuntos gramos de CO2 se producen cuando se queman 5.0 g de C2H5OH?
3. La efervescencia que se produce cuando una tableta de Alka Seltzer se disuelve en
agua se debe a la reaccin entre el bicarbonato de sodio (NaHCO3), y el cido ctrico,
(H3C6H5O7); la reaccin es la siguiente:
3NaHCO3(ac) + H3C6H5O7(ac) 3CO2(g) + 3H2O(l) + Na3C6H5O7(ac)
Cuntos gramos de CO2 se producen cuando reaccionan 810 g de NaHCO3 con 589 g de cido?
4. El nitrgeno (N2), se combina con el hidrgeno (H2), para formar amonaco (NH3).
a). Plantee la ecuacin qumica que represente la reaccin descrita.
b) Cuntas molculas de hidrgeno se necesitarn para reaccionar con 200 molculas de nitrgeno?
5. La cal (CaO) se disuelve en el cido muritico (HCl) para formar cloruro de calcio (CaCl2) y agua. a).
Plantee la ecuacin qumica que represente la reaccin descrita
b). Cuntos moles de HCl se necesitarn para disolver 8,8 moles de CaO?
6. En la siguiente reaccin, a partir de 10.0 moles de NH3
NH3 + O2 NO + H2O
a) Cuntos moles de O2 se necesitan
b) Cuntos moles de NO se producen
c) cuntos moles de H2O se producen?
VERSIN: 1
FECHA: II -2011
UNIDADES TECNOLGICAS DE SANTANDER
GUA DE ESTUDIO No.6
7. Hallar la masa de cloro que se combinar con 4.77 g de hidrgeno para formar
cloruro de hidrgeno, de acuerdo a la siguiente reaccin
H2 + Cl2 2HCl
8. Qu masa de ClO2 se necesita para producir 8.36 kg de HClO3 segn la siguiente reaccin?
2ClO2 + H2O ClO3 + HClO2
9. La formula qumica del cido actico es CH3COOH. (el vinagre es una solucin diluida de cido
actico). El cido actico puro es inflamable, de manera que si se queman 315 gramos de cido actico,
cuntos gramos de CO2 y H2O se producirn?
10. En la combustin del ejemplo anterior Cuntos gramos de CO2 se habran producido a partir de
35.0 g de cido actico y 17.0g de O2? Identifique el reactivo limitante.
11. La fermentacin es un proceso bastante conocido en la produccin de alcohol etlico (C 2H5OH), a
partir de glucosa (C6H1206) obteniendo como subproducto CO2. Si se fermentan 500,4 g de glucosa,
cual es la mxima cantidad de alcohol que se obtendr. Exprese la respuesta en gramos y en litros.
Densidad del alcohol etlico 0,789 g/ml.
C6H1206
C2H5OH + CO2
12. El sulfato de amonio (NH4)2SO4, se obtiene a partir de la reaccin entre el amnico NH3 y cido
sulfrico H2SO4. Cuantos kilogramos de amoniaco se necesitan para producir 1.0 x
Kg de sulfato de
amonio.
EVALUACIN
A continuacin encontrars unos ejercicios tipo parcial.
1. El silicato de sodio Na2SiO3, reacciona del modo siguiente:
Na2SiO3(s) + 8HF(ac) H2SiF6(ac) + 2NaF(ac) + 3H2O(g)
a) Cuntas moles de HF se requieren para disolver 2.50 moles de Na2SiO3?
b) Cuntos gramos de NaF se forman cuando 5.00 moles de HF reaccionan?
c) Cuntos gramos de Na2SiO3 se pueden disolver por 5.00g de HF?
2. El cohete secundario reutilizable del transbordador espacial de BUA utiliza una mezcla de Al y
perclorato de amonio NH4ClO4 como combustible. La reaccin entre
estas sustancias es la siguiente:
3Al(s) + 3NH4ClO4(s) Al2O3(s) + AlCl3(s) + 3NO(g) + 6H2O(g)
Qu masa de perclorato de amonio se debe utilizar en la mezcla de combustible por
cada kilogramo de aluminio?
3. Qu masas de cloruro de cobalto(II) (CoCl2) y cido fluorhdrico (HF) se necesitan para preparar
12.0 moles de fluoruro de cobalto(II) (CoF2) segn la siguiente reaccin?
CoCl2 + 2HF CoF2 + 2HCl
VERSIN: 1
FECHA: II -2011
UNIDADES TECNOLGICAS DE SANTANDER
GUA DE ESTUDIO No.6
4. Se deja reaccionar 32.0 g de metano (CH4) con exceso de oxgeno (O2) para formar CO2 y agua.
Escribir la ecuacin balanceada para esta reaccin. Qu masa de oxgeno reaccionar?
5. Se hace reaccionar 48.0 g de propano (C3H8) con exceso de oxgeno (O2) para formar CO2 y agua.
Escribir la ecuacin balanceada para esta reaccin. Qu masa de oxgeno reaccionar?
6. Cuntos gramos de NH3 pueden prepararse de 85,5 gramos de N2 y 17,3 gramos de H2? La
reaccin es la siguiente:
N2 + 3H2 2NH3
7. Las siguientes reacciones forman parte del proceso industrial de obtencin de cido ntrico (HNO 3).
Que masa en gramos de amoniaco (NH3) se requiere para producir 1 tonelada de cido ntirico.
Suponga un rendimiento del 80% en cada uno de los pasos. (1 tonelada = 2000 libras. 1 libra = 453,6 g)
NH3(g) + O2(g) NO(g) + H2O(l)
NO(g) + O2(g) NO2(g)
NO2(g) + H20(l) HNO3 + HNO2
8. La reaccin entre aluminio y xido de hierro(III) (Fe2O3) puede producir temperaturas cercanas a los
3000C, lo que se utiliza para soldar metales:
2Al + Fe2O3 Al2O3 + 2Fe
En un proceso se hicieron reaccionar 124 g de Al con 601 g de Fe 2O3. a) Calclese la masa en gramos
de xido de aluminio Al2O3 que se formar. b) Cunto del reactivo en exceso qued sin reaccionar al
final de la reaccin?
9. En la industria, el vanadio metlico, que se utiliza en aleaciones con acero, se puede obtener por la
reaccin del xido de vanadio (V) (V2O5) con calcio, a temperatura elevada:
5Ca+ V2O5 5CaO + 2V
Durante un proceso determinado 1,54 x 103 g de V2O5 reaccionan con 1,96 x 103 g de Ca. a) Calcule el
rendimiento terico de Vanadio. b) Calcule el porcentaje del rendimiento si se obtienen 803 g de
Vanadio.
BIBLIOGRAFA
CHANG, Raymond. QUIMICA, Editorial: Mc Graw Hill, CODIGO 540.7 Ch456q
CHANG, Raymond. PRINCIPIOS ESCENCIALES DE QUIMICA GENERAL, Editorial: Mc Graw Hill, CODIGO
540.7 Ch456p
UMLAND, Jean. QUIMICA GENERAL, Editorial Thomson, CODIGO: 540U58q
VERSIN: 1
FECHA: II -2011
Vous aimerez peut-être aussi
- Informe Tornillo de PotenciaDocument9 pagesInforme Tornillo de Potenciadiego vargasPas encore d'évaluation
- Imperfecciones en Las Uniones SoldadasDocument4 pagesImperfecciones en Las Uniones SoldadasJunior Machuca MedinaPas encore d'évaluation
- Muelles y ResortesDocument60 pagesMuelles y ResortesMCano8921Pas encore d'évaluation
- 2P I Ejercicios PreguntasDocument11 pages2P I Ejercicios PreguntasJuan Carlos Meneses VasquezPas encore d'évaluation
- Proceso de CompresionDocument7 pagesProceso de CompresionDaniel Flores CruzPas encore d'évaluation
- Van Der WaalsDocument9 pagesVan Der WaalsJose Luis Martinez LopezPas encore d'évaluation
- Sebas M - Tercer Parcial Parte Practica - Ci-2021Document2 pagesSebas M - Tercer Parcial Parte Practica - Ci-2021Sebas MPas encore d'évaluation
- Circuitos CA PDFDocument9 pagesCircuitos CA PDFBrayan iscalaPas encore d'évaluation
- Aleta PiramidalDocument4 pagesAleta PiramidalMarvin Mendez GonzalesPas encore d'évaluation
- Informe Procesos de FabricacionDocument6 pagesInforme Procesos de FabricacionBrad WernerPas encore d'évaluation
- Ensayo de Mci AlternativosDocument4 pagesEnsayo de Mci AlternativosgspampaPas encore d'évaluation
- Diseño Avanzado Practica #7Document10 pagesDiseño Avanzado Practica #7Karina SanchezPas encore d'évaluation
- E986 - E15 Mediciones Básicas Con Cintas ExtensometricasDocument14 pagesE986 - E15 Mediciones Básicas Con Cintas ExtensometricasCristian Andrés Pacó MoyaPas encore d'évaluation
- Características de Las Plaquitas InsertablesDocument3 pagesCaracterísticas de Las Plaquitas InsertablesIrving Melgar AldamaPas encore d'évaluation
- Examen # 1 PDFDocument3 pagesExamen # 1 PDFJonathanJ.CastilloPas encore d'évaluation
- ElectrotecniaDocument24 pagesElectrotecniatony marinPas encore d'évaluation
- Corrosion A Alta Temperatura 2011Document61 pagesCorrosion A Alta Temperatura 2011Jose Luis Lopez RomanPas encore d'évaluation
- Separata N 09 Transformaciones de Fase en Los MetalesDocument13 pagesSeparata N 09 Transformaciones de Fase en Los MetalesLeonardo de la Serna100% (1)
- Evaluacion de La Resistencia A Fatiga de Aceros de Medio y Bajo Carbono PDFDocument7 pagesEvaluacion de La Resistencia A Fatiga de Aceros de Medio y Bajo Carbono PDFEdwing JulianPas encore d'évaluation
- Laboratorio 2 HPOTDocument5 pagesLaboratorio 2 HPOTAndrea GuzmanPas encore d'évaluation
- Informe 4 - Afilado de Herramienta de CorteDocument7 pagesInforme 4 - Afilado de Herramienta de CorteERNESTO RAUL QUISPE CALDERONPas encore d'évaluation
- Jitorres - Diseño Hidraulico Rodete BombaDocument32 pagesJitorres - Diseño Hidraulico Rodete BombaFerney Gutierrez TorresPas encore d'évaluation
- Informe de EmbragueDocument8 pagesInforme de EmbragueChristian Tuarez CruzPas encore d'évaluation
- Tarea 1 Ciencia e Ingeniería de MaterialesDocument2 pagesTarea 1 Ciencia e Ingeniería de MaterialesJonathan Enrique Galindo MendozaPas encore d'évaluation
- Problemas ALEACIONES METÁLICASDocument17 pagesProblemas ALEACIONES METÁLICASkoko10000Pas encore d'évaluation
- Ejercicios de Solidos RigidosDocument33 pagesEjercicios de Solidos RigidosRosario RevillaPas encore d'évaluation
- Teoría de MaquinasDocument10 pagesTeoría de MaquinasGiss CorreaPas encore d'évaluation
- Problemas Resueltos Motores de Combustion InternaDocument9 pagesProblemas Resueltos Motores de Combustion InternaEdwin MachacaPas encore d'évaluation
- Proyecto Flecha Pacheco GuerreroDocument25 pagesProyecto Flecha Pacheco GuerreroIvan Marcelo TapiaPas encore d'évaluation
- TP 10Document26 pagesTP 10Maxi Salas Correa LopezPas encore d'évaluation
- Analisis de Gases y AguaDocument14 pagesAnalisis de Gases y AguaAnthony Perez RiveraPas encore d'évaluation
- Ensayo de Tracción de Una Probeta Plana Mediante La Maquina Unirversal de EnsayoDocument14 pagesEnsayo de Tracción de Una Probeta Plana Mediante La Maquina Unirversal de EnsayoAlex VelardePas encore d'évaluation
- Sistemas de Transmisión MecánicaDocument27 pagesSistemas de Transmisión MecánicaEduardo Alex Eugenio MendezPas encore d'évaluation
- Cementación o Carburización Del AceroDocument7 pagesCementación o Carburización Del AceroAndrea Alid PalacioPas encore d'évaluation
- Practica FCM2013 CPBDocument57 pagesPractica FCM2013 CPBCapebeta100% (2)
- Práctica Equilibrio Estático y Elasticidad PDFDocument2 pagesPráctica Equilibrio Estático y Elasticidad PDFAlf LancasterPas encore d'évaluation
- DiBrico MollerachDocument29 pagesDiBrico MollerachMijhael FernandezPas encore d'évaluation
- TERCER PARCIAL DINAMICA Uis 2020Document2 pagesTERCER PARCIAL DINAMICA Uis 2020Chi WiPas encore d'évaluation
- Practica Tornillo PotenciaDocument4 pagesPractica Tornillo PotenciaRobercito Sauca100% (1)
- 6Document7 pages6Eddy Mn XpwPas encore d'évaluation
- TRABAJO-FINAL - Tecnica de Diseño-De-EjesDocument11 pagesTRABAJO-FINAL - Tecnica de Diseño-De-EjesWillian LaguaPas encore d'évaluation
- Resortes UNTDocument17 pagesResortes UNTAnthony Quiroz LeonPas encore d'évaluation
- Engranajes AGMADocument30 pagesEngranajes AGMAyocelyn andrea ConchaPas encore d'évaluation
- Principio General de La SoldaduraDocument4 pagesPrincipio General de La Soldaduraandres reyesPas encore d'évaluation
- Problema11.48 Cuarta EdicionDocument4 pagesProblema11.48 Cuarta Edicionmiguel carrasco100% (1)
- El LaminadoDocument26 pagesEl LaminadodavidpenaherreraPas encore d'évaluation
- Resortes HelicoidalesDocument23 pagesResortes HelicoidalesIngeniero Victor HernándezPas encore d'évaluation
- Laboratorio 46Document9 pagesLaboratorio 46Oscar Saldaña0% (1)
- DobladoDocument6 pagesDobladoSalvadorPas encore d'évaluation
- MT PTP 2019Document21 pagesMT PTP 2019Nicolás ArroyoPas encore d'évaluation
- Clase IV MCI Otto 1.2Document26 pagesClase IV MCI Otto 1.2Garcia Asmad JhonnPas encore d'évaluation
- 2 Esfuerzo DeformacionDocument23 pages2 Esfuerzo DeformacionLuchito CtPas encore d'évaluation
- Rubrica de Fluidos 2017Document29 pagesRubrica de Fluidos 2017Edgar Caceres CaceresPas encore d'évaluation
- Informe Bejarano Laminado Trefilado ForjaDocument12 pagesInforme Bejarano Laminado Trefilado ForjaLenin EspinozaPas encore d'évaluation
- Laboratorio 4 - Fluidos (1) CorregidoDocument28 pagesLaboratorio 4 - Fluidos (1) CorregidoCarlos Bernardo Seclén YberosPas encore d'évaluation
- Construccion de La ResistenciaDocument6 pagesConstruccion de La Resistenciamedina edisonPas encore d'évaluation
- 6CALCULOSESTEQUIOMETRICOSDocument3 pages6CALCULOSESTEQUIOMETRICOSAmy Lee0% (1)
- TallerDocument4 pagesTallerximena ruizPas encore d'évaluation
- EstequiometriaDocument3 pagesEstequiometriafranco0% (2)
- BoletinVIH 27022017BDocument13 pagesBoletinVIH 27022017Baltar13Pas encore d'évaluation
- Serie FP Es PDFDocument24 pagesSerie FP Es PDFaltar13Pas encore d'évaluation
- Estadstica 4 MedioDocument5 pagesEstadstica 4 MedioBarriosAravenaPas encore d'évaluation
- Fórmulas y EjemplosDocument5 pagesFórmulas y Ejemplosaltar13Pas encore d'évaluation
- Documento 2Document2 pagesDocumento 2altar13Pas encore d'évaluation
- 05 Prueba Funcion CuadraticaDocument4 pages05 Prueba Funcion CuadraticaDiego Alejandro Canales Arenas100% (1)
- Educar Esencial - 2medio - NOVIEMBRE PDFDocument8 pagesEducar Esencial - 2medio - NOVIEMBRE PDFaltar13Pas encore d'évaluation
- Poblacion Migracion Interna 1997 2002 PDFDocument128 pagesPoblacion Migracion Interna 1997 2002 PDFaltar13Pas encore d'évaluation
- VIHDocument46 pagesVIHLeslie Alarcon MoreyraPas encore d'évaluation
- Lean Manufacturing ResumenDocument1 pageLean Manufacturing Resumenaltar13Pas encore d'évaluation
- Ecuaciones LogaritmicasDocument1 pageEcuaciones Logaritmicasaltar13Pas encore d'évaluation
- Guia Racionales Priemro MedioDocument2 pagesGuia Racionales Priemro Medioaltar13Pas encore d'évaluation
- Serie FP EsDocument24 pagesSerie FP Esaltar13Pas encore d'évaluation
- Balances de Materia y Energía 1ra Edicion Girontzas v. Reklaitis123Document336 pagesBalances de Materia y Energía 1ra Edicion Girontzas v. Reklaitis123Ivan Suarez100% (2)
- Balances de EnergiaDocument41 pagesBalances de Energiamelaurr100% (2)
- Matriz Foda Ejemplo y AplicacionDocument20 pagesMatriz Foda Ejemplo y Aplicacionangeldaniel7Pas encore d'évaluation
- Proctergamble 130904194005Document31 pagesProctergamble 130904194005Miriam FloresPas encore d'évaluation
- Balances de EnergiaDocument41 pagesBalances de Energiamelaurr100% (2)
- Tablas Del Agua S InternacionalDocument18 pagesTablas Del Agua S InternacionalIng En Azúcar AcariguaPas encore d'évaluation
- NM3 CircunferenciaDocument1 pageNM3 CircunferenciaNelson JopiaPas encore d'évaluation
- Guia de Ejercicios 2o Medio Geometria ProporcionalDocument8 pagesGuia de Ejercicios 2o Medio Geometria Proporcionalaltar13Pas encore d'évaluation
- Guia de Matemática 3 MedioDocument6 pagesGuia de Matemática 3 Medioaltar13Pas encore d'évaluation
- Geometria 4ºmedioDocument9 pagesGeometria 4ºmedioEduardo Andres Lorca CastilloPas encore d'évaluation
- Diferenciado Cuartos Medios A - B - CDocument2 pagesDiferenciado Cuartos Medios A - B - Caltar13Pas encore d'évaluation
- Geometria 4ºmedioDocument9 pagesGeometria 4ºmedioEduardo Andres Lorca CastilloPas encore d'évaluation
- Guia Transformaciones Isométrica (PRIMERO MEDIO)Document5 pagesGuia Transformaciones Isométrica (PRIMERO MEDIO)Alvaro CampusanoPas encore d'évaluation
- Control 2Document1 pageControl 2altar13Pas encore d'évaluation
- AcidosyBasesNaturales 2a ParteDocument4 pagesAcidosyBasesNaturales 2a ParteRenaissance Cerveza ArtesanalPas encore d'évaluation
- TraspasosDocument5 pagesTraspasosaltar13Pas encore d'évaluation
- TraspasosDocument5 pagesTraspasosaltar13Pas encore d'évaluation
- BioelementosDocument3 pagesBioelementosLuis Carlos BerlangaPas encore d'évaluation
- Caracterización de Aminas UnicaucaDocument5 pagesCaracterización de Aminas UnicaucaLIZETT SOFIA GARCIA MALDONADOPas encore d'évaluation
- PermeabilidadDocument8 pagesPermeabilidadKaremGordilloPas encore d'évaluation
- Acidos Carboxílicos PDFDocument5 pagesAcidos Carboxílicos PDFDiego GuayacanPas encore d'évaluation
- Determinacion Del Indice de PeroxidoDocument10 pagesDeterminacion Del Indice de PeroxidoJeimiLeePas encore d'évaluation
- Unidad 4 - Agua para Morteros y HormigonesDocument6 pagesUnidad 4 - Agua para Morteros y Hormigonesapi-3785964100% (4)
- Compuestos OxigenadosDocument12 pagesCompuestos OxigenadosYohitza Galviz De PradaPas encore d'évaluation
- Preinforme de Bioquimica - Paola Andrea Valderrama Capera.Document20 pagesPreinforme de Bioquimica - Paola Andrea Valderrama Capera.El Huerto de GetsemaniPas encore d'évaluation
- 7.síntesis de TGDocument68 pages7.síntesis de TGDanny Murphy Cahua NuñezPas encore d'évaluation
- Nomenclatura Stock de ÓxidosDocument5 pagesNomenclatura Stock de ÓxidosAlvaro Javier Santamaría ArrietaPas encore d'évaluation
- Cartografia Energetica Minera en VenezuelaDocument4 pagesCartografia Energetica Minera en VenezuelaHeidi Sequera100% (1)
- Mina Laris S. ADocument30 pagesMina Laris S. Arafael ugartePas encore d'évaluation
- Los Compuestos OrgánicosDocument2 pagesLos Compuestos OrgánicosNICOLAS CAMUDIVO PONCEPas encore d'évaluation
- Preinforme 6 - Química OrgánicaDocument23 pagesPreinforme 6 - Química OrgánicaCriadero San FransiscoPas encore d'évaluation
- Practica #5Document6 pagesPractica #5lucho galindo floresPas encore d'évaluation
- Regla de MezclaDocument2 pagesRegla de MezclaWilcer Cusquisiban De La CruzPas encore d'évaluation
- Clasificación de Los Hidrocarburos Según SPE, AAPGDocument14 pagesClasificación de Los Hidrocarburos Según SPE, AAPGalexander ceballosPas encore d'évaluation
- S05.s1. Tarea de Quimica Grupo 05Document2 pagesS05.s1. Tarea de Quimica Grupo 05Marianela VenturaPas encore d'évaluation
- Guía Laboratorio de Bioquímica No. 3 Identificación de LípidosDocument6 pagesGuía Laboratorio de Bioquímica No. 3 Identificación de LípidosDaniela Perez CruzPas encore d'évaluation
- Ealuacion de QuimicaDocument6 pagesEaluacion de QuimicawilliamPas encore d'évaluation
- Laboratorio de AlquinosDocument12 pagesLaboratorio de AlquinoserickitoelingPas encore d'évaluation
- Previo Reaccion Diels-AlderDocument3 pagesPrevio Reaccion Diels-AlderMariana JassoPas encore d'évaluation
- Determinación Del Óxido de Calcio en El Carbonato de CalcioDocument12 pagesDeterminación Del Óxido de Calcio en El Carbonato de CalcioYelts JanampaPas encore d'évaluation
- Catalogo Mavinsa PU 2020Document11 pagesCatalogo Mavinsa PU 2020Jose MartinPas encore d'évaluation
- Detergente LiquidoDocument6 pagesDetergente LiquidoLorena Sumoza RodriguezPas encore d'évaluation
- Sistema de Ejercicios Con Vista Al TCP 12mo GradoDocument4 pagesSistema de Ejercicios Con Vista Al TCP 12mo GradoIvan FernandezPas encore d'évaluation
- Solucionario de Los Problemas de Quimica IiDocument16 pagesSolucionario de Los Problemas de Quimica IiRenato ProleonPas encore d'évaluation
- Respel Car-2019Document59 pagesRespel Car-201921neokloPas encore d'évaluation
- Catalogo CosmeticoDocument4 pagesCatalogo CosmeticoEstebanCastellanosBorreroPas encore d'évaluation
- Examen de Ciencias Naturales Unidad 2 Clei 5.2 Funciones QuimicasDocument2 pagesExamen de Ciencias Naturales Unidad 2 Clei 5.2 Funciones QuimicasJorge Mario Mesa CanoPas encore d'évaluation