Académique Documents
Professionnel Documents
Culture Documents
Practica 2 Reactores
Transféré par
Jeniffer GonzálezTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Practica 2 Reactores
Transféré par
Jeniffer GonzálezDroits d'auteur :
Formats disponibles
Laboratorio de Cintica de Reactores Homogneos
INSTITUTO POLITCNICO
NACIONAL
Escuela Superior de Ingeniera
Qumica e Industrias Extractivas
Laboratorio de cintica y reactores homogneos
Prctica 2
Obtencin de la ecuacin de velocidad para la reaccin de
saponificacin del acetato de etilo, mediante el mtodo integral y
diferencial.
Grupo: 3IM51
Farias Lazaro Joel Ricardo
Gonzlez Alva Jeniffer Jocelyn
Uribe Beltran Alondra
Navarro Varela Montserrat
Profesor: Crdova Reyes Ivan Alejandro
Cd de Mxico a 20 de septiembre de 2016
Laboratorio de Cintica de Reactores Homogneos
Objetivos:
Aplicar en el tratamiento de datos experimentales los mtodos: integral y diferencial para la
dterminacin de:
a) El orden de reaccin
b) La constante de velocidad
c) El tiempo de vida media
Definir la exactitud y/o la aproximacin de cada mtodo, mediante la comparacin de los
resultados obtenidos con respecto a los datos tericos existentes.
Introduccin:
La reaccin de saponificacin de acetato de etilo con NaOH
C H 3 COOC H 2 C H 3 + NaOH C H 3 C H 2 OH +C H 3 COONa
puede considerarse como irreversible de segundo orden del tipo: A + B C + D siendo su velocidad
de reaccin representada dada por la expresin.
d C A d C B
=
=k C A C B
dt
dt
Si las concentraciones de ambos reactantes son iguales, es decir, CA=CB=C, separando variables e
integrando se obtiene:
C0
1=k C 0 t
C
En donde C0 es la concentracin inicial de reactante y k la constante cintica. A medida que
progresa la reaccin qumica, el consumo de iones OH- y la generacin de iones CH3COO- provoca
que la conductividad de la mezcla reaccionante vaya disminuyendo progresivamente con el tiempo.
Esto va a permitir seguir el curso de la reaccin por variacin de la conductividad de la disolucin con
el tiempo.
Para una reaccin qumica, el conocimiento de la velocidad de reaccin, es decir, de la variacin de
la concentracin de un reactivo o producto en funcin del tiempo, es de gran inters prctico pues
permite calcular bajo qu condiciones la reaccin evoluciona rpidamente para producir una elevada
cantidad de producto til, y el tiempo necesario para alcanzar un determinado rendimiento. Se
denomina reaccin elemental la que se efecta en un solo paso. La relacin entre la velocidad de
reaccin y la concentracin de los diferentes reactivos y productos aporta informacin til para
deducir las reacciones elementales que suceden a nivel molecular, as como la secuencia de dichas
reacciones llamada mecanismo de reaccin. La cintica qumica estudia y postula mecanismos de
reaccin basndose en valores experimentales de concentracin de reactivos y/o productos, tiempo,
Laboratorio de Cintica de Reactores Homogneos
temperatura, concentracin de catalizador, de electrolitos, etc. La velocidada de una reaccin
qumica se considera siempre como una cantidad positiva. Dada la reaccin:
a A + bB cC+ dD
velocidad v se define, a temperatura constante, como la variacin de la concentracin de cualquiera
de
v=
las
sustancias
intervinientes
en
funcin
del
tiempo:
1 dC A 1 dC B 1 d C c 1 d C D
=
=
=
a dt
b dt
C dt
d dt
siendo
C A ,C B , C c ,C D las concentraciones molares de las sustancias respectivas y a, b, c y d los
coeficientes estequiomtricos de la reaccin. La velocidad de reaccin es funcin de las
concentraciones de los reactivos y productos y puede expresarse segn la siguiente ecuacin:
V=
1 d C A
=K C C C c C D
a dt
siendo k la constante de velocidad de reaccin y a,b,g y d los rdenes de reaccin con respecto a A,
B, C y D respectivamente. El orden general de la reaccin (n) es la suma de los rdenes parciales de
cada reactivo:
n=+ + + La ecuacin de velocidad de reaccin se puede determinar
nicamente con medidas experimentales y no puede deducirse de la molecularidad de la ecuacin
qumica.
La ecuacin cintica representa la velocidad de reaccin y puede obtenerse, bien a partir de
consideraciones tericas o ser simplemente el resultado de un procedimiento emprico de ajuste de
datos experimentales. En cualquier caso, el valor de los coeficientes cinticos o constantes de
velocidad de dicha ecuacin solamente pueden determinarse por va experimental ya que en la
actualidad resultan inadecuados los modelos tericos de prediccin. La determinacin de la ecuacin
cintica suele realizarse mediante un procedimiento en dos etapas: primero se obtiene la variacin
de la velocidad con la concentracin a temperatura constante y despus la variacin de los
coeficientes cinticos con la temperatura. Los reactores discontinuos o por cargas suelen trabajar
isotrmicamente y a volumen constante. Debido a la fcil interpretacin de los resultados
experimentales obtenidos en estas condiciones de trabajo, este reactor es el dispositivo preferido
para la obtencin de datos cinticos en sistemas homogneos.
Estado del arte:
Hidrlisis alcalina
Laboratorio de Cintica de Reactores Homogneos
En la hidrlisis alcalina de los esteres, tambin conocida como saponificacin, estos reaccionan con
el hidrxido de sodio formando un carboxilato de sodio y un alcohol.
La reaccin de saponificacin del acetato de etilo con NaOH
La reaccin del acetato de etilo con el hidrxido sdico tiene lugar segn la siguiente
estequiometra:
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
y si llamamos:
CH3COOC2H5 A1 , NaOH A2 , CH3COONa A3 y C2H5OH A4
se puede escribir de la forma:
- A1 - A2 + A3 + A4 = 0
Como sucede en todas las reacciones entre steres y lcalis, el equilibrio est muy desplazado hacia
la derecha, y la velocidad a la que tiene lugar la reaccin es adecuada para poderla seguir en el
laboratorio sin necesidad de emplear tcnicas sofisticadas. Por esta razn suele ser una de las ms
utilizadas en el estudio del comportamiento de los reactores qumicos.
El mecanismo de la hidrlisis se explica por una accin nuclefila del grupo oxhidrilo sobre el ster,
segn el esquema:
es decir, una cintica compleja con formacin de productos intermedios que transcurre mediante
cinco etapas elementales. La expresin cintica que resultara de este mecanismo de reacciones de
equilibrio consecutivas sera bastante compleja.
No obstante, a concentraciones pequeas de reactantes, puede suponerse que la
Concentracin del complejo de adicin es muy baja, y las velocidades de las reacciones inversas son
Laboratorio de Cintica de Reactores Homogneos
despreciables frente a las de las reacciones directas. Por esta razn, puede admitirse, en primera
aproximacin, que la reaccin es irreversible y de segundo orden global, es decir, que la velocidad
de
reaccin depende nica y linealmente de las concentraciones de ster y lcali presentes:
en donde k, constante cintica de la reaccin, slo depende de la temperatura.
Anlisis de la cintica de la reaccin de saponificacin del acetato de etilo por conductimetra
Conforme transcurre la reaccin se produce una variacin de la conductividad de la disolucin
debido al cambio de los iones presentes en la mezcla reactante.
La conductividad de una disolucin de acetato de etilo es casi mil veces inferior a la de una
disolucin de sosa de la misma concentracin y a la misma temperatura. Es decir, podemos asociar
la variacin de la conductividad de la mezcla reactante a la desaparicin del hidrxido de sodio: al
disminuir la concentracin de dicho reactante disminuye la conductividad de la disolucin (K).
De esta forma, podemos determinar la concentracin de sosa en cada momento a partir de la
medida de la conductividad y de la ecuacin de calibrado del conductmetro a la temperatura de
operacin.
Por otra parte, la conductividad es una propiedad fsica muy dependiente de la temperatura.
Por ello se debe evitar gradientes de temperatura y procurar que la temperatura de reaccin
permanezca constante.
http://www.uv.es/idiqlab/labquimicos/documentos/RDTA.pdf
Parte experimental
Experimento
Reactivos:
Solucion de NaOH
HCl concetrado
Solucin de acetato de etilo
Laboratorio de Cintica de Reactores Homogneos
Material:
3 matraces Erlenmeyer
Bureta
Vaso de precipitados
Pipeta volumtrica
2 jeringas
Probeta
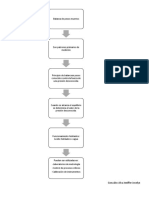
Diagrama de flujo
Preparar las siguientes soluciones:
*100 ml de solucin 0.03M de acetato
de etilo
*100 ml de solucin 0.03M de NaOH
*100 ml de solucin 0.02M de HCL
Reaccin de
Saponificaci
n del
Acetato de
Etilo.
*Agregar al reactor 50 ml de NaOH 0.03M e
inmediatamente tomar una alcuota de 10 ml.
*Arrancar el cronometro al momento que una gota
de NaOH toque a la solucin del reactor.
*pasar la alcuota a un matraz Erlenmeyer y titular
con HCL. Repetir este paso cada 3 min. , hasta 10
lecturas.
Valoracin
de
la
solucin de
HCL
Molaridad promedio:
*Aforar una bureta con HCL valorado.
*Medir 50 ml de acetato de etilo a 0.03M
para colocarlos en un vaso de
precipitados de 250 ml.
*Agregar 2 a 3 gotas de fenolftalena.
Tabla 2.2. Datos experimentales
Experimento
1
2
3
4
5
6
t (min)
0
3
6
9
12
15
Vol. HCl (ml) gastado en la titulacin
6.1
4.8
3.6
3.1
2.6
2.2
Concentracin de NaOH
(M)= C A
0.01159
0.00912
0.0068
0.0058
0.00494
0.00418
Laboratorio de Cintica de Reactores Homogneos
7
8
9
10
18
21
24
27
1.9
1.7
1.6
1.2
0.00361
0.00323
0.00304
0.00228
CLCULOS
M NaOH =
V HCl M HCl
V NaOH
M NaOH =
( 6.1 ml ) ( 0.019 M )
=0.01159 M
10 ml
M NaOH =
( 4.8 ml)(0.019 M )
=0.00912 M
10 ml
M NaOH =
( 3.6 ml)(0.019 M )
=0.0068 M
10 ml
M NaOH =
( 3.1ml)(0.019 M )
=0.0058 M
10 ml
M NaOH =
( 2.6 ml)(0.019 M )
=0.00494 M
10 ml
M NaOH =
( 2.2ml)(0.019 M )
=0.00418 M
10 ml
M NaOH =
( 1.9ml )(0.019 M )
=0.00361 M
10 ml
M NaOH =
( 1.7 ml)(0.019 M )
=0.00323 M
10 ml
M NaOH =
( 1.6 ml)(0.019 M )
=0.00304 M
10 ml
M NaOH =
( 1.2)(0.019 M )
=0.00228 M
10 ml
MTODO DIFERENCIAL
Tabla 2.3. Resultados del mtodo diferencial
t
C A =C NaOH
CA
C A
x=ln C A
0
3
6
9
0.01159
0.00912
0.0068
0.0058
-0.0024
-0.0022
-0.00095
-0.00095
3
3
3
3
0.01035
0.00798
0.00636
0.00541
-4.57
-4.83
-5.05
-5.21
y=
CA
T
-7.102
-7.182
-8.05
-8.05
Laboratorio de Cintica de Reactores Homogneos
12
15
18
21
24
27
0.00494
0.00418
0.00361
0.00323
0.00304
0.00228
-0.00076
-0.00057
-0.00038
-0.00019
-0.00076
---
3
3
3
3
3
---
0.0045
0.0038
0.0034
0.0031
0.0026
---
-5.39
-5.54
-5.67
-5.76
-5.92
---
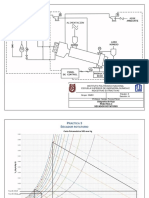
Grfica mtodo diferencial
-6
-5.8
-5.6
-5.4
-5.2
-5
-4.8
-4.6
-4.4
-4.2
-6
-4
-6.5
-7
f(x) = 1.5x - 0.26
-7.5
-8
-8.5
-9
-9.5
-10
Con base a tendencias
m=n=1.49
InK=-0.2573
mol 0.49
min1
L
K =0.7731
Modelo cintico
0.7731
( molL
0.49
min1 C1.49
NaOH
rA =
Sin tomar en cuenta los ltimos datos debido a errores de medicin
-8.28
-8.56
-8.97
-9.66
-8.28
---
Laboratorio de Cintica de Reactores Homogneos
Grfica mtodo diferencial
-6
-5.8
-5.6
-5.4
-5.2
f(x) = 1.96x + 2.07
-5
-4.8
-4.6
-4.4
-4.2
-6
-4
-6.5
-7
-7.5
-8
-8.5
-9
-9.5
-10
Con base a tendencias
m=n=1.96
InK=2.067
mol 0.96
min1
L
K =7.9
Modelo cintico
7.9
( molL
0.96
min1 C1.96
NaOH
rA =
MTODO INTEGRAL
Ecuacin
rA=k CCH
3COOC 2 H 5 C NaOH
Reaccin equimolar
rA=k C +
NaOH
n= +
rA=k C nNaOH
d C A
=k C nNaOH
dt
Laboratorio de Cintica de Reactores Homogneos
1x n
dx
X
1
k = n1
t CA 0 0
A
Tabla 2.4. Resultados del mtodo integral
t
0
3
6
9
12
15
18
21
24
27
t
0
3
6
9
12
15
18
21
24
27
CA
0.01159
0.00912
0.0068
0.0058
0.00494
0.00418
0.00361
0.00323
0.00304
0.00228
CA
0.01159
0.00912
0.0068
0.0058
0.00494
0.00418
0.00361
0.00323
0.00304
0.00228
n=0.4
--0.074
0.075
0.061
0.055
0.050
0.046
0.042
0.038
0.038
n=0.6
--0.076
0.079
0.065
0.060
0.055
0.051
0.047
0.043
0.044
n=0.8
--0.078
0.083
0.070
0.065
0.061
0.057
0.053
0.048
0.051
n=1
--0.232
0.164
0.125
0.109
0.098
0.09
0.082
0.074
0.077
n=1.2
--0.554
0.403
0.314
0.277
0.254
0.237
0.219
0.200
0.212
n=1.4
--1.32
0.995
0.789
0.710
0.664
0.629
0.590
0.542
0.596
n=1.6
--1.246
1.499
1.345
1.345
1.360
1.361
1.326
1.241
1.479
n=1.8
--3.115
3.868
3.530
3.605
3.718
3.789
3.746
3.532
4.376
n=2
--7.789
9.986
9.277
9.678
10.196
10.595
10.634
10.111
13.048
n=2.2
--19.478
25.804
24.413
26.046
28.057
29.752
30.335
29.098
39.207
n=2.4
--48.716
66.738
64.337
70.255
77.452
83.888
86.960
84.183
118.674
n=2.6
--121.868
172.761
169.799
189.927
214.478
237.470
250.447
244.783
361.707
n=1.5
--0.788
0.934
0.831
0.823
0.823
0.817
n=1.55
--0.991
1.183
1.057
1.052
1.058
1.054
n=1.6
--1.246
1.499
1.345
1.345
1.360
1.361
n=1.65
--1.567
1.900
1.712
1.721
1.748
1.757
n=1.7
--1.970
2.408
2.179
2.202
2.247
2.270
Iteraciones para n=1.6
t
0
3
6
9
12
15
18
CA
0.01159
0.00912
0.0068
0.0058
0.00494
0.00418
0.00361
Laboratorio de Cintica de Reactores Homogneos
21
24
27
0.00323
0.00304
0.00228
0.791
0.737
0.863
1.024
0.956
1.129
1.326
1.241
1.479
1.719
1.611
1.939
2.228
2.092
2.542
Con base a las tendencias
n=1.5
mol 0.5
1
min
L
K=0.823
Modelo cintico
0.823
( molL
0.5
min1 C 1.5
NaOH
rA=
Bibliografia:
https://www.edu.xunta.gal/centros/cafi/aulavirtual2/pluginfile.php/32439/mod_resource/content/0/S15
01072-LaboratorioReactoresQuimicos.pdf
http://www3.uclm.es/profesorado/giq/contenido/Tec_quimi/practicas_Tec_Quimi.pdf
http://www.uv.es/idiqlab/labquimicos/documentos/RDTA.pdf
Vous aimerez peut-être aussi
- Modelamiento y casos especiales de la cinética química heterogéneaD'EverandModelamiento y casos especiales de la cinética química heterogéneaÉvaluation : 3 sur 5 étoiles3/5 (1)
- Informe 1 LEM VIDocument19 pagesInforme 1 LEM VIcristian lopezPas encore d'évaluation
- Practica 4Document16 pagesPractica 4AliTha AyalaPas encore d'évaluation
- Pre Informe 4Document8 pagesPre Informe 4carlos balderramaPas encore d'évaluation
- Marco TeóricoDocument6 pagesMarco TeóricoRosario UreñaPas encore d'évaluation
- Laboratorio No. 7 - Cinética Química CatalíticaDocument3 pagesLaboratorio No. 7 - Cinética Química CatalíticaPaolita GonzalezPas encore d'évaluation
- Grupo 5 - Laboratorio Saponificación Acetáto de Etilo-Método Diferencial PDFDocument26 pagesGrupo 5 - Laboratorio Saponificación Acetáto de Etilo-Método Diferencial PDFLIBARDOPas encore d'évaluation
- Practica 10 Determinación Del Orden de ReacciónDocument7 pagesPractica 10 Determinación Del Orden de ReacciónIrvingPas encore d'évaluation
- Reactor Quimico Practica No. 3Document6 pagesReactor Quimico Practica No. 3Jordan Josue Torres100% (1)
- Lab6. - Cinética de Oxidación Del EtanolDocument8 pagesLab6. - Cinética de Oxidación Del EtanolRoberto Eduardo Quispe MamaniPas encore d'évaluation
- Descomposición Catalítica Del Peróxido de HidrogenoDocument20 pagesDescomposición Catalítica Del Peróxido de HidrogenoDana JuarezPas encore d'évaluation
- Reactor Batch: Cinética de Primer OrdenDocument14 pagesReactor Batch: Cinética de Primer OrdenArturo Romo Ramos0% (1)
- MARCO ANTONIO PANTALEON CORONA - Producto Integrador FinalDocument55 pagesMARCO ANTONIO PANTALEON CORONA - Producto Integrador FinalMarco PantaleonPas encore d'évaluation
- Reporte Practica 1 Lab ReactoresDocument20 pagesReporte Practica 1 Lab ReactoreslazaroPas encore d'évaluation
- Informe 1 Laboratorio PPQDocument11 pagesInforme 1 Laboratorio PPQConstanzaPérezMoralesPas encore d'évaluation
- Informe 4, Grupo 3Document19 pagesInforme 4, Grupo 3Adriana RosasPas encore d'évaluation
- Practica 4 Obtencion y Tratamiento de Datos CineticosDocument9 pagesPractica 4 Obtencion y Tratamiento de Datos CineticosAlvaro Parihuancollo EncinasPas encore d'évaluation
- Hidrolisis Del AcetatoDocument22 pagesHidrolisis Del Acetatokañamongui EsparciaPas encore d'évaluation
- Determinación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaDocument3 pagesDeterminación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaSebas Soto0% (1)
- Orden reacción hidrólisis acetato etiloDocument5 pagesOrden reacción hidrólisis acetato etiloJoaquin Durango60% (5)
- Labofiquim&IIDocument23 pagesLabofiquim&IISamuel Espinoza GarciaPas encore d'évaluation
- Introduccion SaponificacionDocument9 pagesIntroduccion Saponificaciondanodaniel32Pas encore d'évaluation
- Saponificacion de Acetato de Etilo Grupo 5Document15 pagesSaponificacion de Acetato de Etilo Grupo 5Vladimir Alex Caspa CopaPas encore d'évaluation
- Mec - SapoDocument11 pagesMec - SapoAndres PerezPas encore d'évaluation
- PRODUCCIÓN DE CO2 A PARTIR DE LA REACCIÓN DE HCL Y NaHCO3Document15 pagesPRODUCCIÓN DE CO2 A PARTIR DE LA REACCIÓN DE HCL Y NaHCO3Juan Luis Jaime Rodriguez100% (1)
- Yodinacion CetonaDocument6 pagesYodinacion CetonaemerengiPas encore d'évaluation
- ManualPracticasIngenieriaReactores PDFDocument28 pagesManualPracticasIngenieriaReactores PDFMitziPas encore d'évaluation
- Determinación constante velocidad hidrólisis acetato etilo HClDocument8 pagesDeterminación constante velocidad hidrólisis acetato etilo HClMoni BorregoPas encore d'évaluation
- Informe 6 Saponificacion Acetato de EtiloDocument14 pagesInforme 6 Saponificacion Acetato de EtiloNatashaA.CuencaSchillingPas encore d'évaluation
- Pract 4Document11 pagesPract 4Juan Diego Ricardez FloresPas encore d'évaluation
- Practica de Velocidad de ReaccionDocument12 pagesPractica de Velocidad de ReaccionJose Maria Quintas GironPas encore d'évaluation
- INVERSION DE LA SACAROZA G6MiDocument22 pagesINVERSION DE LA SACAROZA G6MiAntonio Zapata SolisPas encore d'évaluation
- TP Irqui I - Reactor Tanque Discontinuo - 2022Document2 pagesTP Irqui I - Reactor Tanque Discontinuo - 2022Juan DiderlePas encore d'évaluation
- Practica 4 ReactoresDocument6 pagesPractica 4 ReactoresAntonio Morales Zarate100% (2)
- P2 Liq IvDocument12 pagesP2 Liq IvRamon Caballero PalaciosPas encore d'évaluation
- Balance de Materia Con Reacción Química: Hidratación de Anhídrido AcéticoDocument9 pagesBalance de Materia Con Reacción Química: Hidratación de Anhídrido AcéticoFernando0% (1)
- Tanque AgitadoDocument17 pagesTanque AgitadoLuis BallenaPas encore d'évaluation
- Reaccion de Saponificacion Del Acetato de EtiloDocument8 pagesReaccion de Saponificacion Del Acetato de Etilojorge11da100% (1)
- Balance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoDocument9 pagesBalance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoANAHI ALVARADO TOLENETINOPas encore d'évaluation
- S1501072 LaboratorioReactoresQuimicosDocument42 pagesS1501072 LaboratorioReactoresQuimicosJhon DiazPas encore d'évaluation
- Prácticas #2 - FisicoquímicaDocument5 pagesPrácticas #2 - FisicoquímicamperezpirelaPas encore d'évaluation
- Cinética QuímicaDocument17 pagesCinética QuímicaAnonymous kBjvdERRQPas encore d'évaluation
- Cinética de saponificación del acetato de etiloDocument9 pagesCinética de saponificación del acetato de etiloLeydi Jhoana Garcia CardenasPas encore d'évaluation
- Explicación Experimento No. 2. Hidrólisis de Cloruro de Terc-ButiloDocument7 pagesExplicación Experimento No. 2. Hidrólisis de Cloruro de Terc-ButiloPAULINA PEREZ CAMPOSPas encore d'évaluation
- Informe4 Saponificacion Del Acetato de EtiloDocument9 pagesInforme4 Saponificacion Del Acetato de EtiloMencia Pinto MicaelaPas encore d'évaluation
- FísicoqxDocument11 pagesFísicoqxBlanca AmayaPas encore d'évaluation
- Laboratorio 7 Cinetica QuimicaDocument3 pagesLaboratorio 7 Cinetica QuimicaRenzoBenitesPas encore d'évaluation
- Descomposicion Del Peroxido de HidrogenoDocument11 pagesDescomposicion Del Peroxido de HidrogenoAzul_fqaazPas encore d'évaluation
- PREINFORME SaponificacionDocument9 pagesPREINFORME SaponificacionJennifer PiragautaPas encore d'évaluation
- Reporte 1. Equipo 4Document47 pagesReporte 1. Equipo 4Ivonne Del AngelPas encore d'évaluation
- Determinación de la cinética de reacción en un reactor batchDocument19 pagesDeterminación de la cinética de reacción en un reactor batchwerykybPas encore d'évaluation
- Practica 07. Seguimiento por fotocolorimetria de una reaccion quimicaDocument19 pagesPractica 07. Seguimiento por fotocolorimetria de una reaccion quimicamariauglyforeheadPas encore d'évaluation
- Informe-4-Saponificacion Del Acetato de Etilo Lab ReactoresDocument11 pagesInforme-4-Saponificacion Del Acetato de Etilo Lab ReactoresPameCMPas encore d'évaluation
- Informe-4-SAPONIFICACION DEL ACETATO DE ETILO LAB REACTORESDocument11 pagesInforme-4-SAPONIFICACION DEL ACETATO DE ETILO LAB REACTORESAliTha AyalaPas encore d'évaluation
- 10) Reactor Encamisado - v4mDocument9 pages10) Reactor Encamisado - v4mGuillermo FerrerPas encore d'évaluation
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadD'EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadPas encore d'évaluation
- Termodinámica clásica. Protocolos experimentales sobre primera y segunda leyes, y sobre potenciales selectosD'EverandTermodinámica clásica. Protocolos experimentales sobre primera y segunda leyes, y sobre potenciales selectosPas encore d'évaluation
- EstapsicoDocument16 pagesEstapsicoJeniffer GonzálezPas encore d'évaluation
- Termopares y receptor eléctrico IPNDocument3 pagesTermopares y receptor eléctrico IPNJeniffer GonzálezPas encore d'évaluation
- Instituto Politécnico NacionalDocument1 pageInstituto Politécnico NacionalJeniffer GonzálezPas encore d'évaluation
- Instituto Politécnico NacionalDocument6 pagesInstituto Politécnico NacionalJeniffer GonzálezPas encore d'évaluation
- Practica 4 Placa de OrificioDocument3 pagesPractica 4 Placa de OrificioJeniffer GonzálezPas encore d'évaluation
- Practica 3 Secador RotatorioDocument9 pagesPractica 3 Secador RotatorioJeniffer GonzálezPas encore d'évaluation
- Proceso de Elaboración de LevadurasDocument7 pagesProceso de Elaboración de LevadurasJeniffer GonzálezPas encore d'évaluation
- Evaporación Triple EfectoDocument10 pagesEvaporación Triple EfectoJeniffer GonzálezPas encore d'évaluation
- Evaporación Múltiple EfectoDocument6 pagesEvaporación Múltiple EfectoJeniffer GonzálezPas encore d'évaluation
- Practica 3 Secador RotatorioDocument9 pagesPractica 3 Secador RotatorioJeniffer GonzálezPas encore d'évaluation
- Practica 3 Diagrama y GraficaDocument2 pagesPractica 3 Diagrama y GraficaJeniffer GonzálezPas encore d'évaluation
- Diagrama de Las Practicas 678Document1 pageDiagrama de Las Practicas 678Jeniffer GonzálezPas encore d'évaluation
- Proceso de Elaboración de LevadurasDocument7 pagesProceso de Elaboración de LevadurasJeniffer GonzálezPas encore d'évaluation
- NORMADocument20 pagesNORMAJeniffer GonzálezPas encore d'évaluation
- NORMADocument20 pagesNORMAJeniffer GonzálezPas encore d'évaluation
- Evaporador simple efecto: presión vapor, temperaturas, masas y eficienciasDocument4 pagesEvaporador simple efecto: presión vapor, temperaturas, masas y eficienciasJeniffer GonzálezPas encore d'évaluation
- Bases de DiseñoDocument9 pagesBases de DiseñoJeniffer GonzálezPas encore d'évaluation
- Practica 7 CRONTOLADOR PROPORCIONALDocument4 pagesPractica 7 CRONTOLADOR PROPORCIONALJeniffer GonzálezPas encore d'évaluation
- Tecnologia de Alimentos 2Document31 pagesTecnologia de Alimentos 2Jeniffer GonzálezPas encore d'évaluation
- Historia y Evolución Del CoachingDocument28 pagesHistoria y Evolución Del CoachingJeniffer GonzálezPas encore d'évaluation
- Secador de CharolasDocument2 pagesSecador de CharolasJeniffer GonzálezPas encore d'évaluation
- Introduccion Papa y ManzanaDocument3 pagesIntroduccion Papa y ManzanaJeniffer GonzálezPas encore d'évaluation
- Ionización Electrónica-FragmentaciónDocument1 pageIonización Electrónica-FragmentaciónJeniffer GonzálezPas encore d'évaluation
- Diagrama DescriptivoDocument1 pageDiagrama DescriptivoJeniffer GonzálezPas encore d'évaluation
- Diagrama Pesos MuertosDocument2 pagesDiagrama Pesos MuertosJeniffer GonzálezPas encore d'évaluation
- INTEGRACIÓN NUMÉRICA Metodo Del TrapecioDocument2 pagesINTEGRACIÓN NUMÉRICA Metodo Del TrapecioJeniffer GonzálezPas encore d'évaluation
- Practica SerpentinDocument1 pagePractica SerpentinJeniffer GonzálezPas encore d'évaluation
- Practica Condensador HorizontalDocument13 pagesPractica Condensador HorizontalJeniffer GonzálezPas encore d'évaluation
- Transferencia de Calor. Práctica 1Document6 pagesTransferencia de Calor. Práctica 1Jeniffer GonzálezPas encore d'évaluation
- Datos Practica 4Document1 pageDatos Practica 4Jeniffer GonzálezPas encore d'évaluation
- Actividad4 Procesoindustriale CHDocument16 pagesActividad4 Procesoindustriale CHAlfredo CoronadoPas encore d'évaluation
- Formas Farmacéuticas y Vías de AdministraciónDocument64 pagesFormas Farmacéuticas y Vías de AdministraciónLuiiz YtsPas encore d'évaluation
- ESTERILIZACIÓN POR MÉTODOS FÍSICOS Brat AcuacheDocument6 pagesESTERILIZACIÓN POR MÉTODOS FÍSICOS Brat AcuacheBrat AcuachePas encore d'évaluation
- Plan de vida personal y equilibrioDocument23 pagesPlan de vida personal y equilibrioMILENA HERNANDEZ AMAYAPas encore d'évaluation
- Tarjeta Emergencia Varsol PolitecnicoDocument4 pagesTarjeta Emergencia Varsol PolitecnicoSofiaPas encore d'évaluation
- Flip Flop SRDocument2 pagesFlip Flop SRLeoPas encore d'évaluation
- Introducción Historia de La Fitopatología 2017Document36 pagesIntroducción Historia de La Fitopatología 2017Lophophora930% (1)
- Metodo BickDocument19 pagesMetodo BickPsic.Inf. Sara Esparza CastañedaPas encore d'évaluation
- Curso Propedéutico UNIBE Sesión 3Document84 pagesCurso Propedéutico UNIBE Sesión 3Elda Leticia Andrade AcuñaPas encore d'évaluation
- Modelo Registro Productos FitosanitariosDocument5 pagesModelo Registro Productos FitosanitariosCultivo del AlmendroPas encore d'évaluation
- Resumen de La Dieta WWDocument33 pagesResumen de La Dieta WWMarta Perpiñán0% (1)
- Iiee-Metrados - (20.12.2021) Rev 01Document4 pagesIiee-Metrados - (20.12.2021) Rev 01Christiano RodriguezPas encore d'évaluation
- Matriz de Riesgo ESCALONA 2022.Document7 pagesMatriz de Riesgo ESCALONA 2022.Bernardo MenesesPas encore d'évaluation
- Cuestionario Reforzamiento U2Document5 pagesCuestionario Reforzamiento U2Cristian MoraPas encore d'évaluation
- GIA20Document98 pagesGIA20Rebeca VargasPas encore d'évaluation
- Nº51. - Niveles de Investigación y Tipos de InvestigaciónDocument98 pagesNº51. - Niveles de Investigación y Tipos de InvestigaciónCesar AraujoPas encore d'évaluation
- Preguntas de III Parcial de QQ-OO Con Respuestas. v.2Document7 pagesPreguntas de III Parcial de QQ-OO Con Respuestas. v.2huribibiPas encore d'évaluation
- Como Se Desarrolla o Formula La InvestigaciónDocument4 pagesComo Se Desarrolla o Formula La Investigaciónmayra rodasPas encore d'évaluation
- Policarbolxilato de Zinc WordDocument9 pagesPolicarbolxilato de Zinc WordKatia Vásquez ChávezPas encore d'évaluation
- Tema 1: FG MM RDocument9 pagesTema 1: FG MM Rpol alcidosPas encore d'évaluation
- Rodillos Saris Cycle OpsDocument6 pagesRodillos Saris Cycle OpsgfernandezvPas encore d'évaluation
- Practica 4 Ley de HessDocument2 pagesPractica 4 Ley de HessAnyi Vanessa Muñoz CampoPas encore d'évaluation
- CostosDocument8 pagesCostosCarlos NaranjoPas encore d'évaluation
- Proyecto OlmosDocument5 pagesProyecto OlmosFrancisco Montoya RiosPas encore d'évaluation
- Patogenicidad y Virulencia de Crithidia Mellificae y Lotmaria Passim y Nueva Descripción Del Morfotipo HaptomonaDocument286 pagesPatogenicidad y Virulencia de Crithidia Mellificae y Lotmaria Passim y Nueva Descripción Del Morfotipo HaptomonaSergio B.Pas encore d'évaluation
- Artucio Montevideo y La Arq ModernaDocument30 pagesArtucio Montevideo y La Arq ModernaOvidio SantosPas encore d'évaluation
- Informe 5 - PorosidadDocument9 pagesInforme 5 - PorosidadEdwin Cirilo ChaucaPas encore d'évaluation
- FichaQuirurgicaCaninaFelinaDocument3 pagesFichaQuirurgicaCaninaFelinaMauricio Hinojosa JemioPas encore d'évaluation
- Semana 2: Egiptología (Egyptology)Document182 pagesSemana 2: Egiptología (Egyptology)jeycy1002Pas encore d'évaluation