Académique Documents
Professionnel Documents
Culture Documents
Calculos Evaporacion Flash PDF
Transféré par
Mariia Martinezz AguiilarDescription originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Calculos Evaporacion Flash PDF
Transféré par
Mariia Martinezz AguiilarDroits d'auteur :
Formats disponibles
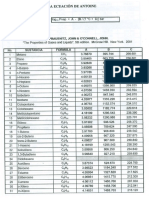
520
CAP!lVLO
12.
EVL a presiones bajas y moderadas
Ihbla 12.1: Resultados de los clculos de T BURBUJA a 1 (atm) para el
sistema Ir-Hexano/Ehnol/Metilciclopentano(MCP)/enceno
Especie k
12.6
Xi
n-Hexano( 1)
Etanol( 2)
MCP( 3)
Benceno( 4)
0.162
0.068
0.656
0.114
T(calculada)
= 334.82 K
yi(calc)
ydexp)
rt /( atm)
@i
0.139
0.279
0.500
0.082
0.140
0.274
0.503
0.083
0.797
0.498
0.725
0.547
0.993
0.999
0.990
0.983
T(exp) = 334.85 K
Yi
1.073
8.241
1.042
1.289
Iteraciones = 4
Clculos de evaporacin instantnea
Una aplicacin importante del EVL es el clculo de evaporacin instantnea. El
nombre se origin por el hecho de que un lquido, a una presin igual o mayor que
su presin en el punto de burbuja se evapora instantneamente o se evapora
parcialmente cuando la presin se reduce por abajo de la presin del punto de
burbuja, produciendo un sistema de dos fases de vapor y lquido en equilibrio. Aqu
consideramos slo la evaporacin instantnea e T, la cual se refiere a cualquier
clculo de las cantidades y composiciones de las fases de vapor y de lquido que
conforman el sistema de dos fases en equilibrio, a T, P y composicingeneral conocidas. Esto plantea un problema conocido,a determinar sobre la base del teorema
de Duhem, porque dos variables independientes (T y P) se especifican para un
sistema de composicin general fija, esto es, un sistema formado a partir de masas
dadas de especies qumicas no reactivas.
Considrese un sistema que contiene un mol de especie qumica no reaccionante
con la composicin general representada por el conjunto de fracciones mol {Zi}.
Sean L los moles de lquido con las fracciones mol {zi}, y sean Y los moles de
vapor, con las fracciones mol {yi}. Las ecuaciones de balance de material son
Zj = Xj13 + yi V
(i = 1,2, . . .> N)
Si es escoge eliminar L? de estas ecuaciones, se tiene
Zi =Xi(l- V) + YiV
(i = 1,2, . . . >iv)
(12.23)
Una medida conveniente de la tendencia de una especie qumica dada a la
particin de s misma, preferencialmente entre las fases lquida y de vapor, es la
relacin de equilibrio Ki, definida como
(12.24)
12.6
Clculos
de
evaporacin
instantnea
521
A menudo, esta magnitud se llama sencillamente valor K. Aunque no aporta nada
a nuestro conocimiento termodinmico del EVL, sirve como medida de la ligereza de una especie constituyente, esto es, de su tendencia a concentrarse en la fase
de vapor. Cuando Ki es mayor a la unidad, la especie i se concentra en la fase de
vapor; cuando es menor, se concentra en la fase lquida y se considera como un
constituyente pesado. Adems, el uso de los valores K significa una conveniencia
en el clculo, lo que permite la eliminacin de un conjunto de fracciones mal, {yi}
o {xii), en favor del otro.
As, en la ecuacin (12.23) se sustituye xi = yi/Ki, y se resuelve para yi:
ZiKi
(i = 1,2, . . . > IV)
yi = 1 + V(K, - 1)
(12.25)
Dado que xi = YJKi, una ecuacin alernativa es
zi
(i = 1,2, . . . >Iv)
xi = 1+ V(K, - 1)
Como ambos conjuntr,s de fracciones mol deben sumar la unidad, Cixi = Ciyi = 1.
As, si se suma la ecuacin (12.25) para todas las especies y se resta la unidad de
esta suma, la diferencia PY debe ser cero; esto es,
(12.27)
i 1+ V(K, - 1)
Un tratamiento similar de la ecuacin (12.26) produce la diferencia Fz, la cual
tambin debe ser cero:
E3, = c
i 1 + V(K, - 1)
-l=O
La solucin al problema de evaporacin instantnea E: T se obtiene cuando se
encuentra que un valor de V hace que la funcin FY o la Fz sean igual a cero. No
obstante, una funcin ms conveniente para usarla en un procedimiento de solucin general9 es la diferencia FY - Fz = F:
zi(Ki - 1)
0
F=c
i 1+ V( Ki - 1 ) =
H. H. Rachford, Jr. y J. D. Rice, J. Petral. Tec/wzoZ.,
3, octubre, 1952.
val.
4 (lo), seccin 1,
(12.29)
p.
19, y seccin 2, p.
CAPflVL.0 12.
522
1 r-l Calcule P BURBUJA
1
1
1
i
COXI
EVL
a presiones bajas y moderadas
(Xi} = {si}.
I
I
I
d
No
Estime {yi), {W, l.
I
Evale {Ki) por la ec. (12.32).
Evale Fy WWpor
las ecs. (12.29) y (12.30).
Encuentre Vpor el mtodo de Newton.
Evale {y}
por
la ec. (12.26) y {yi)
por
yi = Ki G.
Evale {r;}, {Q;}.
Figura
12.18:
Diagrama de bloques para un clculo de evaporacin instantnea E: l!
La ventaja de esta funcin se evidencia a partir de su derivada:
z,(lq - 1)
dF
z=- c
i [l+ V(Ki - l)]
(12.30)
Dado que dF/d V siempre es negativo, la relacin F contra Ves monotnica, y esto
hace que el mtodo de Newton (apndice H) sea un procedimiento de iteracin
rpidamente convergente, muy adecuado para la resolucin de V. La ecuacin (H.l)
para la iteracin ensima se convierte aqu en
F
$$ AV=O
(12.31)
12.6
Clculos
de
evaporacin
instantnea
523
endondeAV= V,+I-V~,JY(W~V) se encuentran por medio de las ecuaciones
(12.29) y (12.30). En estas ecuaciones, los valores K provienen de la ecuacin
(12.1)
escrita como
Ki = J&
= Yi<
Xi
(i = 1, 2, . . . >hq
QiP
(12.32)
en donde ~~ est dada por la ecuacin (12.2). Los valores K contienen toda la
informacin termodinmica, y se relacionan en una forma compleja con T P, {yi}
y {xi}. Como se est resolviendo para {yi} y {zi}, el clculo de la evaporacin
instantnea e T requiere inevitablemente iteracin.
Un esquema general para la resolucin se muestra en el diagrama de bloque
de la figura 12.18. La informacin dada es leda y almacenada. Como no se conoce
con anterioridad si el sistema a las T, P y composicin establecidas es, en efecto,
una mezcla de lquido saturado y vapor saturado, y no totalmente lquid0 0 totalmente vapor, se hacen clculos preliminares para establecer la naturaleza del sistema. A las T y composicin general dadas, el sistema existe como un vapor
sobrecalentado si su presin es menor que la presin del punto de roco Pmo. Por
otro lado, existe como un lquido subenfriado si su presin es mayor que la presin
del punto de burbuja Pbu&,uja. Slo para presiones entre P,, y Pb"&ja el sistema
es una mezcla en equilibrio de vapor y lquido. Por consiguiente, se determina Pmo
mediante un clculo de P ROCIO (figura 12.13), a la T dada y para {yi} = {zi}, y
P burbuja mediante un clculo de P BURBUJA (figura 12.12), a la T dada y para
{xi} = {zi}. El clculo de evaporacin instantnea c T se realiza slo si la presin
dda, P, queda entre Pm& y Pburb"ja; Si ste es el caso, entonces se utilizan los
resultados de los clculos de P RPCIO y P BURBUJA preliminares para tener
estimaciones iniciales de {yi), {$i) y y Para el punto de roco, V = 1, y se han
calculado los valores de Proco, x,roeo Y q$,roco; para el punto ae hrbuja, V = 0, y se
han calculado los valores de Pburbyja, Yi,burbuja y #i,burbuja. El procedimiento ms
sencillo es la interpolacin entre los valores del punto de roco y el punto de burbuja en relacin con la posicin de P entre Pro& y Pbu&uja:
Yi
- Yzpxo
Yi,burbuja
- Yi,mo
V-l
p - ~ro,,
o-1 = Pburbuja - P&,
v =
Phorbuja
- P
pbwbuj, - p-w<,
Con estos valores iniciales de las 3/i y las & los valores iniciales de Ki se
pueden calcular con la ecuacin (12.32). Se puede disponer de los valores de PF
y 4 a partir de los clculos preliminares de P ROCIO y P BURBUJA. Las
CAPTULO 12.
524
EVL
a presiones bajas y moderadas
ecuaciones (12.29) y (12.30) proporcionan ahora los valores de F y dF/dVpara el
mtodo de Newton, como se representa mediante la ecuacin (12.31). La aplicacin repetida de esta ecuacin lleva al valor de Vpara el cual se satisface la ecuacin
(12.29) por las actuales estimaciones de las Ki. Los clculos restantes sirven para
dar nuevas estimaciones de 3/i y @i a partir de las cuales se vuelve a evaluar Ki.
Esta secuencia de etapas (una iteracin externa) se repite hasta que no haya cambio significativo en los resultados de una iteracin a la siguiente. Despus de la
primera iteracin externa, los valores de V y (dF/dV) utilizados para iniciar el
mtodo de Newton (una iteracin interna) son los valores calculados ms recientemente. Una vez que se ha establecido un valor de V, se calculan los valores de xi por
la ecuacin (12.26) y los valores de yi se dan mediante yi = K&. La naturaleza de
estos clculos se ilustra bien por medio del ejemplo siguiente, en donde la ley de
Raoult da las relaciones de EVL.
Ejemplo 12.3 El sistema acetona(l)/acetonitrilo(2)/nitrometano(3),
a 80C y 110
kPa, tiene la composicin general21 = 0.45,~ = 0.35, ~3 = 0.20. Suponiendo que la
ley de Raoult es apropiada para este sistema, determine 1, V, {xi} y {yi}.
SOLUCIN
Las presiones de vapor de las especies puras a 80C son
p, = 195.75
ea = 97.84
PSat = 50.32 kPa
Primero, se hacen los clculos de P BURBUJA con {zi} = {xi} para determinar
Cuando se aplica la ley de Raout, la ecuacin (12.11) se convierte en
P burbuja.
Numricamente,
Pbu&uja
= (0.45)(195.75)
+ (0.35)(97.84)
+ (0.20)(50.32)
= 132.40 kPa
Segundo, se hace un clculo de P ROCO con {si} = {yi} para determinar Pmco.
Para la ley de Raoult, la ecuacin (12.12) se escribe
P rlxo =
1
YJP, + yJE2 + y,/E3
Al sustituir los valores numricos, se tiene
P roco = 101.52 kPa
Como la presin que se da queda entre
y Poco, el sistema est en la regin de
dos fases y, por lo tanto, se procede al clculo de evaporacin instantnea.
Pburbuja
Debido a que se aplica la ley de Raoult, aqu la ecuacin (12.32) se convierte en
Ki = cat /P, de donde
525
12.6 Ctihlos de evaporacin instantnea
K = 195.75
___ = 1.7795
1
110
En forma similar,
Kz = 0.8895
K3 = 0.4575
La sustitucin de valores conocidos en la ecuacin (12.27) da
(0.45)(1.7795) + (0.35)(0.8895) + (0.20)(0.4575) = 1
1 + 0.7795v
1- 0.1105v
1 - 0.5425V
(4
La resolucin para V, por ensayo, produce
V = 0.7364 mol
de donde
L= l - V = 0.2636mol
Queda claro en la ecuacin (12.25) que cada trmino al lado izquierdo de la ecuacin
(A) es un valor de y+ Por consiguiente, se encuentra que yr = 0.5087, yz = 0.3389
y y3 = 0.1524. Entonces, a partir de la ecuacin (12.24),
0.5087
Yl = 0.2859
x1 = z= 1.7795
De modo similar,
x2 = 0.3810
x3
= 0.3331
Obviamente, &yi = &xi = 1. El procedimiento de este ejemplo es vlido, sin importar el nmero de especies que estn presentes.
Los clculos de
nentes, hechos sin las
se llevan a cabo con
12.18. La tabla 12.2
evaporacin instantnea para los sistemas de multicompoconsideraciones de simplificacin inherentes a la ley de Raoult,
facilidad en una computadora, como se explica en la figura
muestra los resultados de un clculo de evaporacin instan-
tnea E: T completo para el sistema n-hexano( l)/etanol(2)/metilciclopentano(3)/
benceno( 4). ste es el mismo sistema para el cual se present el clculo de T BUR
BU JA (tabla 12. l), y aqu se utilizan las mismas correlaciones y valores de los
parmetros. Las P y T dadas son 1 (atm) y 334.15 K. Las fracciones mol generales para el sistema {zi} se enlistan en la tabla junto con los valores calculados de
las fracciones mol de la fase lquida y de la fase de vapor, as como los valores K. La
fraccin molar del sistema que es vapor se encuentra aqu como V = 0.8166.
526
CAPTULO 12.
EVL.
a presiones bajas y moderadas
%bla 12.2: Resultados de un calculo de evaporacin instantanea E: T, a 1
(atm) yo 334.15 K, para n-Hexano/Etanol/Metilciclopentano(MCP)/eno
Especies(i)
n-Hexano( 1)
Etanol@)
MCP(3)
Benceno( 4)
P = l(atm)
zi
0.250
0.400
0.200
0.150
Xi
0.160
0.569
0.129
0.142
yi
0.270
0.362
0.216
0.152
Ki
1.694
0.636
1.668
1.070
T = 334.15 K Y= 0.8166
12.7 Sistemas soluto(l)/disolvente(2)
El mtodo gama& para clculos de EVL, como se presenta en la seccin 12.4,
presupone el conocimiento de la presin de vapor de cada una de las especies a la
temperatura de inters. Aqu se consideran sistemas binarios para los cuales la
especie 1, designada el soluto, es inestable a la temperatura del sistema o es
superctitica, esto es, la temperatura del sistema excede su temperatura crtica. Por
consiguiente, su presin de vapor no se puede medir, y su fugacidad fr, como lquido puro a la temperatura del sistema, no se puede calcular por medio de la ecuacin
(10.41).
Aunque las ecuaciones (12.1) y (12.2) se pueden aplicar ala especie 2, designada el disolvente, no son aplicables al soluto y se requiere de un mtodo alternativo. En la figura 12.19 se presenta una grfica tpica de la fugacidad de la fase
lquida del soluto, jI contra su fraccin mol x1 a temperatura constante. Esta
figura difiere de la figura ll.3 en que la curva que representa sI no se extiende
todo el camino hastaxr = 1. As, la posicin defr, la fugacidad de la fase lquida de
la especie pura 1, no se ha establecido, y la lnea que representa la regla de Lewis/
Banda11 no se puede dibujar. La lnea tangente al origen, que representa la ley de
Henry (seccin 1 1 . 1 ), proporciona informacin alternativa. Recurdese que la pendiente de la lnea tangente es la constante de Henry, definida por la ecuacin (11.2).
As,
(12.33)
La constante de Henry es una funcin fuertemente dependiente de la temperatura, pero slo depende dbilmente de la presin. A pesar de ello, ntese que la definicin de kr es para la temperatura Ta la presin de EVL, paraxI+ 0, es decir, la
presin del vapor del disolvente puro PT.
El coeficiente de actividad del soluto a dilucin infinita es
Vous aimerez peut-être aussi
- Ingeniería química. Soluciones a los problemas del tomo ID'EverandIngeniería química. Soluciones a los problemas del tomo IPas encore d'évaluation
- Cálculos de Flash (Ideal y No Ideal)Document9 pagesCálculos de Flash (Ideal y No Ideal)Mario Edgar Cordero SánchezPas encore d'évaluation
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Tarea9 ExamenDocument13 pagesTarea9 ExamenIvtGuzmAnPas encore d'évaluation
- Calculos Evaporacion Flash PDFDocument7 pagesCalculos Evaporacion Flash PDFCristofer Sebastian Bustos ColladoPas encore d'évaluation
- Estimación de Propiedades TermodinámicasDocument45 pagesEstimación de Propiedades TermodinámicasJulieth PaolaPas encore d'évaluation
- Ejercicios de Integrales y Ecuaciones Integrales-DiferencialesD'EverandEjercicios de Integrales y Ecuaciones Integrales-DiferencialesPas encore d'évaluation
- Ejercicios Primer PeríodoDocument5 pagesEjercicios Primer PeríodoAndrea VillaPas encore d'évaluation
- Psicometría. Principios básicos y protocolos experimentales diversosD'EverandPsicometría. Principios básicos y protocolos experimentales diversosPas encore d'évaluation
- 2016 BiotecDocument23 pages2016 BiotecChemistPas encore d'évaluation
- Introducción A La Termodinamica 2Document250 pagesIntroducción A La Termodinamica 2cualquieraquesea100% (1)
- EVL Nomogramas de Priester PDFDocument5 pagesEVL Nomogramas de Priester PDFMariia Martinezz AguiilarPas encore d'évaluation
- Gases Reales - Uso de Ecuaciones de Estado PDFDocument6 pagesGases Reales - Uso de Ecuaciones de Estado PDFGeraldine D. FernándezPas encore d'évaluation
- Trabajo de Termo Propiedades ResidualesDocument25 pagesTrabajo de Termo Propiedades ResidualesLuis Gamero50% (2)
- Constante de FugacidadDocument9 pagesConstante de FugacidadSara CristinaPas encore d'évaluation
- Artículo Peng-RobinsonDocument8 pagesArtículo Peng-RobinsonF5LucasPas encore d'évaluation
- Fugacidady Su UtilidadDocument19 pagesFugacidady Su UtilidadMontserrath Moraga MorenoPas encore d'évaluation
- Primera Ley de La TermodinámicaDocument12 pagesPrimera Ley de La TermodinámicaRenato Saavedra0% (1)
- Difusion Masica-16-26 PDFDocument11 pagesDifusion Masica-16-26 PDFJorge AlbertoPas encore d'évaluation
- Laboratorio: Leyes de Los Gases IdealesDocument6 pagesLaboratorio: Leyes de Los Gases Idealesluis preslePas encore d'évaluation
- Unidad. 1Document78 pagesUnidad. 1erick sanchezPas encore d'évaluation
- Unidad 1Document30 pagesUnidad 1Axel Dullak Angeloni100% (1)
- T2. FMF-HidrostaticaDocument35 pagesT2. FMF-HidrostaticaPablino BenitezPas encore d'évaluation
- CompresoresDocument44 pagesCompresoresjuan davidPas encore d'évaluation
- Informe 2 Presi N de VaporDocument11 pagesInforme 2 Presi N de VaporLeidy Daniela Garzon PuentesPas encore d'évaluation
- Ecuaciones de Estado para Gases IdealesDocument12 pagesEcuaciones de Estado para Gases IdealesAnabel BeltránPas encore d'évaluation
- Operaciones de Tranferencia de Masa: DestilacionDocument36 pagesOperaciones de Tranferencia de Masa: DestilacionCarlos AguilarPas encore d'évaluation
- Trabajo de Fisicoquimica 2Document15 pagesTrabajo de Fisicoquimica 2Sayuri Elena Petro MaceaPas encore d'évaluation
- Informe Flahs IsotermicoDocument8 pagesInforme Flahs Isotermicopaoduran22Pas encore d'évaluation
- Presión de VaporDocument16 pagesPresión de VaporFelix ToquicaPas encore d'évaluation
- Termodinamica Del Aire HumedoDocument20 pagesTermodinamica Del Aire HumedoJesus ParadaPas encore d'évaluation
- 2.4determinacion de La Ecuacion Que Representa La Entrada de Agua en El YacimientoDocument9 pages2.4determinacion de La Ecuacion Que Representa La Entrada de Agua en El YacimientoolyvitssPas encore d'évaluation
- Ecuaciones de Puntos de Vapor en LiquidosDocument9 pagesEcuaciones de Puntos de Vapor en LiquidosRobert VillavicencioPas encore d'évaluation
- Determinación Del Calor de Vaporizacion de Un LíquidoDocument9 pagesDeterminación Del Calor de Vaporizacion de Un LíquidoCarlos David Ramos RosalesPas encore d'évaluation
- R 63490Document4 pagesR 63490vdlg2107Pas encore d'évaluation
- Clase4 5VIRTFQIDocument40 pagesClase4 5VIRTFQIRichard Antony Alva RuizPas encore d'évaluation
- TermodinámicaDocument6 pagesTermodinámicaEduardo Herrera GuzmánPas encore d'évaluation
- TermoDocument18 pagesTermoohuarcaya23Pas encore d'évaluation
- Manual de Fisicoquimica I Parte 2Document28 pagesManual de Fisicoquimica I Parte 2alexia9cortesPas encore d'évaluation
- DesilaciónDocument4 pagesDesilaciónCarlos Rodrigo Hernández PérezPas encore d'évaluation
- Enfriamiento de Una EsferaDocument4 pagesEnfriamiento de Una EsferaMauricio PerezPas encore d'évaluation
- Calculo Del Coeficiente de FugacidadDocument19 pagesCalculo Del Coeficiente de FugacidadHarold Amador100% (2)
- Reporte de InvestigaciónDocument9 pagesReporte de InvestigaciónAby GeårPas encore d'évaluation
- Preinforme Relacion de Calores EspecificosDocument12 pagesPreinforme Relacion de Calores EspecificosEdgar Moreno GonzalezPas encore d'évaluation
- Flujo ComprensibleDocument36 pagesFlujo ComprensibleOmar Medina CallePas encore d'évaluation
- Ecuaciones de Transporte de HidrocarburoDocument10 pagesEcuaciones de Transporte de HidrocarburowilberalexiscPas encore d'évaluation
- Enunciado Ayudantía 5Document8 pagesEnunciado Ayudantía 5Rafaela PizarroPas encore d'évaluation
- Trabajo de Ec de EstadoDocument30 pagesTrabajo de Ec de Estadorichard2890Pas encore d'évaluation
- Ecuaciones Fundamentales de La Termodinámica 2013-2 PDFDocument8 pagesEcuaciones Fundamentales de La Termodinámica 2013-2 PDFLuis Santos SuárezPas encore d'évaluation
- UNIDAD EquilibrioDocument26 pagesUNIDAD EquilibrioChristina Lynn Roger's GrossPas encore d'évaluation
- CALORIMETRIADocument7 pagesCALORIMETRIAGamaliel Espinosa ZRPas encore d'évaluation
- Resume de AlgoDocument3 pagesResume de AlgoMarco Ochoa GarciaPas encore d'évaluation
- Unidad6 2020 Parte1Document11 pagesUnidad6 2020 Parte1Antonella BogadoPas encore d'évaluation
- R 11Document13 pagesR 11Damian PlascenciaPas encore d'évaluation
- Ley de Boyle-Sebastián GonzalesDocument8 pagesLey de Boyle-Sebastián GonzalesSantiago100% (1)
- Ley de RaoultDocument5 pagesLey de RaoultOscar Daniel MoralesPas encore d'évaluation
- Lista de Ejercicios TermodinamicaDocument63 pagesLista de Ejercicios TermodinamicaJenry Andy Tapia GutierrezPas encore d'évaluation
- 8 - CompresoresDocument44 pages8 - Compresoreslivemoka100% (2)
- ¿Cuáles Son Los Gases de Efecto Invernadero ¿CTI PDFDocument4 pages¿Cuáles Son Los Gases de Efecto Invernadero ¿CTI PDFMariia Martinezz AguiilarPas encore d'évaluation
- Cálculos de EVLDocument4 pagesCálculos de EVLJorgeReyesPas encore d'évaluation
- Coeficientes de La Correlación de Lee Kesler PDFDocument4 pagesCoeficientes de La Correlación de Lee Kesler PDFMariia Martinezz AguiilarPas encore d'évaluation
- Problemas de Fugacidad PDFDocument1 pageProblemas de Fugacidad PDFMariia Martinezz AguiilarPas encore d'évaluation
- EVL Nomogramas de Priester PDFDocument5 pagesEVL Nomogramas de Priester PDFMariia Martinezz AguiilarPas encore d'évaluation
- Tablas Termodinámicas Smith - Van NessDocument9 pagesTablas Termodinámicas Smith - Van NessMariia Martinezz Aguiilar0% (1)
- Coeficientes de La Correlación de Lee Kesler PDFDocument4 pagesCoeficientes de La Correlación de Lee Kesler PDFMariia Martinezz AguiilarPas encore d'évaluation
- WORLDROCKMUSICK - Discografia Completa de Guns N' RosesDocument11 pagesWORLDROCKMUSICK - Discografia Completa de Guns N' RosesMariia Martinezz Aguiilar100% (1)
- Constantes de AntoineDocument3 pagesConstantes de AntoineMariia Martinezz AguiilarPas encore d'évaluation
- Bosquejo Del MetodoDocument2 pagesBosquejo Del MetodoMariia Martinezz AguiilarPas encore d'évaluation
- Planificacion de Pensamiento MatematicoDocument5 pagesPlanificacion de Pensamiento MatematicoBrito SayPas encore d'évaluation
- Calidad Fase 3Document142 pagesCalidad Fase 3Karla Mogrovejo CalachauinPas encore d'évaluation
- Ensayo de TorsionDocument8 pagesEnsayo de TorsionJorgeyVanessa Rodriguez MejiaPas encore d'évaluation
- Estructura de Visual BasicDocument11 pagesEstructura de Visual BasicDaniel alejandro castro agudeloPas encore d'évaluation
- FILOSOFOSDocument5 pagesFILOSOFOSSandrita Gale100% (1)
- Archivos ÍndicesDocument7 pagesArchivos ÍndicesneriovfPas encore d'évaluation
- FICHA de EVALUACION Material - Densidad de La RectaDocument2 pagesFICHA de EVALUACION Material - Densidad de La Rectaadrian malafayPas encore d'évaluation
- Modelo de TransporteDocument39 pagesModelo de TransportejosePas encore d'évaluation
- Corporación Politécnico Costa Atlántica: Acción1 Acción2 - . AcciónnDocument15 pagesCorporación Politécnico Costa Atlántica: Acción1 Acción2 - . AcciónnTaty Fernández0% (1)
- Informe Laboratorio Flexsim Grupo 2-4pm Carlos Alfredo Gutierrez ZuluagaDocument9 pagesInforme Laboratorio Flexsim Grupo 2-4pm Carlos Alfredo Gutierrez ZuluagaJUAN SEBASTIAN VARGAS QUINTEROPas encore d'évaluation
- 05 - Ejemplo Formato IFACDocument6 pages05 - Ejemplo Formato IFAClalita2604Pas encore d'évaluation
- Calculo de Espectro de Pseudo Ultimo para YoutubeDocument5 pagesCalculo de Espectro de Pseudo Ultimo para YoutubeJunior Herrera VillarPas encore d'évaluation
- Sesion 06Document7 pagesSesion 06julio cesar valdez cardenasPas encore d'évaluation
- Enriquez - El Docente - InvestigadorDocument26 pagesEnriquez - El Docente - InvestigadorNorma PappaletteraPas encore d'évaluation
- U2A2 MartinezB GabrielaB MAFIDocument8 pagesU2A2 MartinezB GabrielaB MAFIGabriela Berenice MartinezPas encore d'évaluation
- Logica MatematicaDocument37 pagesLogica MatematicaGalo YambayPas encore d'évaluation
- Estadística Inferencial TallerDocument3 pagesEstadística Inferencial Tallerasesoria contablePas encore d'évaluation
- Modelos Matemáticos P Toma de DecisionesDocument27 pagesModelos Matemáticos P Toma de DecisionesCaa Turismo UaemexPas encore d'évaluation
- Procesamiento de AlimentosDocument322 pagesProcesamiento de AlimentosYuMdza100% (1)
- Aprendo Probabilidades - 5°Document16 pagesAprendo Probabilidades - 5°justofloresPas encore d'évaluation
- Diseño E-ABR - Fundamento CálculoDocument5 pagesDiseño E-ABR - Fundamento CálculoKevin PerezPas encore d'évaluation
- Diapositivas Sobre Tesis Acerca de Russell, Fil de Lenguaje.Document45 pagesDiapositivas Sobre Tesis Acerca de Russell, Fil de Lenguaje.milagro pinedaPas encore d'évaluation
- Acordes Aug y Dim PDFDocument3 pagesAcordes Aug y Dim PDFCarolina HoyosPas encore d'évaluation
- Constante Michaelis MentelDocument3 pagesConstante Michaelis MentelAnniee FelizPas encore d'évaluation
- 17 Prueba de Hipótesis - Media y ProporciónDocument15 pages17 Prueba de Hipótesis - Media y ProporciónXina Obeso AltamiranoPas encore d'évaluation
- Vega Diana Examen 3Document150 pagesVega Diana Examen 3Diana VegaPas encore d'évaluation
- LOGICADocument134 pagesLOGICALenin Alfaro Vidal50% (2)
- Fundamentos-Del-Calculo - Ruben Flores EspinozaDocument266 pagesFundamentos-Del-Calculo - Ruben Flores EspinozaVega R JosePas encore d'évaluation
- Funciones Hiperbólicas InversasDocument6 pagesFunciones Hiperbólicas InversasJose TitoPas encore d'évaluation
- Modelo Atómico (Materia)Document20 pagesModelo Atómico (Materia)Gonzalo Ramírez NegretePas encore d'évaluation