Académique Documents
Professionnel Documents
Culture Documents
Resumen Capitulo 3 Termodinámica PDF
Transféré par
Orlando Salvador0 évaluation0% ont trouvé ce document utile (0 vote)
56 vues2 pagesEste documento trata sobre conceptos básicos de termodinámica. Explica que una sustancia pura tiene una composición química fija, y describe las fases de vapor sobrecalentado, líquido comprimido y vapor/líquido saturado. También cubre conceptos como calidad, punto crítico, ecuación de estado de gas ideal y factor de compresibilidad.
Description originale:
Titre original
Resumen-Capitulo-3-Termodinámica.pdf
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentEste documento trata sobre conceptos básicos de termodinámica. Explica que una sustancia pura tiene una composición química fija, y describe las fases de vapor sobrecalentado, líquido comprimido y vapor/líquido saturado. También cubre conceptos como calidad, punto crítico, ecuación de estado de gas ideal y factor de compresibilidad.
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
56 vues2 pagesResumen Capitulo 3 Termodinámica PDF
Transféré par
Orlando SalvadorEste documento trata sobre conceptos básicos de termodinámica. Explica que una sustancia pura tiene una composición química fija, y describe las fases de vapor sobrecalentado, líquido comprimido y vapor/líquido saturado. También cubre conceptos como calidad, punto crítico, ecuación de estado de gas ideal y factor de compresibilidad.
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
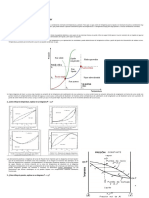
Capitulo 3 Termodinmica
Zalazar Vidal Rolando
Se le conoce como sustancia pura a una sustancia que tiene una
composicion quimica fija en cuaquier parte, es decir que si se hace un
muestreo en cualquiera de sus diferentes partes su composicion no
cambiara.
Tambien se le conoce como vapor sobrecalentado a una sustancia que no
est a punto de condesarse, esto se da en la fase gaseosa.
En la fase lquida, una sustancia que no est a punto de evaporarse se
llama lquido comprimido o lquido subenfriado.
Durante un proceso de cambio de fase, la temperatura y la presin de una
sustancia pura son propiedades dependientes. A una determinada
presin, una sustancia cambia de fase a una temperatura fija, llamada
temperatura de saturacin.
Del mismo modo, a una temperatura especificada, la presin a la cual una
sustancia cambia de fase se llama presin de saturacin.
Durante un proceso de ebullicin, tanto la fase lquida como la fase de
vapor coexisten en equilibrio, y bajo esta condicin el lquido y el vapor se
llaman lquido saturado y vapor saturado.
En una mezcla saturada lquido-vapor (vapor hmedo), la fraccin de
masa del vapor se llama calidad y se expresa como:
=
La calidad tiene valores entre 0 (lquido saturado) y 1 (vapor saturado),
pero no tiene significado en las regiones de lquido comprimido o vapor
sobrecalentado. En la regin de vapor hmedo, el valor promedio de
cualquier propiedad intensiva y se determina a partir de
= ! + !"
El estado ms all del cual no hay proceso de vaporizacin aparente se
llama punto crtico. A presiones supercrticas, una sustancia se expande
de modo gradual y uniforme de la fase lquida a la de vapor. Las tres fases
de una sustancia coexisten en equilibrio en estados que se hallan a lo
largo de la lnea triple, caracterizada por temperatura y presin de la
lnea triple.
Cualquier relacin entre la presin, temperatura y volumen especfico de
una sustancia se llama ecuacin de estado, y la ms simple y mejor
conocida es la ecuacin de estado de gas ideal, dada como
=
Donde R es la constante del gas.
Los gases reales exhiben comportamiento de gas ideal a presiones
relativamente bajas y temperaturas altas.
La desviacin del comportamiento de gas ideal se tiene en cuenta de
modo apropiado al usar el factor de compresibilidad Z, definido como:
=
Vous aimerez peut-être aussi
- Psicometría. Principios básicos y protocolos experimentales diversosD'EverandPsicometría. Principios básicos y protocolos experimentales diversosPas encore d'évaluation
- Resumen Cap 3 CengelDocument3 pagesResumen Cap 3 CengelEduardo Alanis VazquezPas encore d'évaluation
- Tema II: Sustancia PuraDocument7 pagesTema II: Sustancia PuraDana Natasha ScheideggerPas encore d'évaluation
- Apunte 6 "Procesos de Separación Por Transferencia de Calor Secado"Document21 pagesApunte 6 "Procesos de Separación Por Transferencia de Calor Secado"cRISTIANPas encore d'évaluation
- Sustancia PuraDocument20 pagesSustancia PuraLimas ramirez José AntonioPas encore d'évaluation
- Sustancias PurasDocument6 pagesSustancias PurasJesús MartínezPas encore d'évaluation
- Diagramas de Propiedades para Procesos de Cambio de FaseDocument4 pagesDiagramas de Propiedades para Procesos de Cambio de Faseernith david corrales fernandezPas encore d'évaluation
- Tema 6 OU3Document16 pagesTema 6 OU3Sebastián Varga SchwindtPas encore d'évaluation
- Conceptos 2-TermodinamicaDocument10 pagesConceptos 2-TermodinamicaDavid alonso SilvaPas encore d'évaluation
- TTC T1 ResumenDocument2 pagesTTC T1 ResumenPol MadoPas encore d'évaluation
- Practica 1 de Termodinamica de FasesDocument18 pagesPractica 1 de Termodinamica de FasesAlberto Arteaga100% (1)
- 2-Sustancia-Pura-Resumen 2Document44 pages2-Sustancia-Pura-Resumen 2Michelle LunaPas encore d'évaluation
- Informe Final Liquido - VaporDocument8 pagesInforme Final Liquido - VaporMauricio Alejandro PadillaPas encore d'évaluation
- Termodinamica Clase 10 +Document8 pagesTermodinamica Clase 10 +yeimer zabaletaPas encore d'évaluation
- Un III - Sustancias PurasDocument31 pagesUn III - Sustancias PurasRaul Gerardo PerezPas encore d'évaluation
- Guía de Estudio - Parte 3Document33 pagesGuía de Estudio - Parte 3Juan Jay CasalPas encore d'évaluation
- Tarea 3 Resumen de La Unidad 2Document8 pagesTarea 3 Resumen de La Unidad 2fabian vazquez santanaPas encore d'évaluation
- Propiedades de Las Sustancias PurasDocument25 pagesPropiedades de Las Sustancias PurasrubenPas encore d'évaluation
- Sustancia PurasDocument14 pagesSustancia PurasRossy CarPas encore d'évaluation
- Gas IdealDocument3 pagesGas IdealHugo BarredaPas encore d'évaluation
- Teoria Cinetica de Los GasesDocument39 pagesTeoria Cinetica de Los GasesEstanislao Aqquepucho SolisPas encore d'évaluation
- Tema 3 Propiedades de Una Sustancia PuraDocument29 pagesTema 3 Propiedades de Una Sustancia Puradiana gPas encore d'évaluation
- 15 de Julio de 2022 Balances de Materia y EnergíaDocument22 pages15 de Julio de 2022 Balances de Materia y EnergíaCristopher Ariel LopezPas encore d'évaluation
- Regla de Las Fases de GibbsDocument5 pagesRegla de Las Fases de GibbsVianey LunaPas encore d'évaluation
- Resumen Capitulo 3 Cengel 8 EdicionDocument13 pagesResumen Capitulo 3 Cengel 8 EdicionpepepepePas encore d'évaluation
- Fisico QuimicaDocument17 pagesFisico QuimicaGianfranco Yucra RojasPas encore d'évaluation
- 02 Sustancia Pura 2024Document28 pages02 Sustancia Pura 2024JEARCAMPPas encore d'évaluation
- Comportamiento de Los Gases Reales en Reservorios de Gas NaturalDocument24 pagesComportamiento de Los Gases Reales en Reservorios de Gas NaturalMARIBEL QUISPE AMBROCIOPas encore d'évaluation
- Sustancias PurasDocument32 pagesSustancias Purasangel carmona hernandezPas encore d'évaluation
- CAP 2 ESTADO LIQUIDO. Parte 1 Licuefacción de Gases y Estado Crítico.Document17 pagesCAP 2 ESTADO LIQUIDO. Parte 1 Licuefacción de Gases y Estado Crítico.Jhamil CondePas encore d'évaluation
- Material de Estudio - IIM504Document237 pagesMaterial de Estudio - IIM504pedroPas encore d'évaluation
- Teoria Practica 1Document2 pagesTeoria Practica 1Carlos MontúfarPas encore d'évaluation
- Disoluciones Clausius ClapeyronDocument30 pagesDisoluciones Clausius ClapeyronArdila Alber80% (5)
- Ecuación de Estado Del Gas IdealDocument3 pagesEcuación de Estado Del Gas IdealLisandro FloresPas encore d'évaluation
- Termodinamica Unalm 2022 I Clase 2Document14 pagesTermodinamica Unalm 2022 I Clase 2Max GutierrezPas encore d'évaluation
- Propiedades de Las Sustancias PurasDocument50 pagesPropiedades de Las Sustancias PurasJorge Eliseo Campos FloresPas encore d'évaluation
- Presion y Temperatura CriticaDocument4 pagesPresion y Temperatura CriticaIvan RobledoPas encore d'évaluation
- CICLOHEXANODocument6 pagesCICLOHEXANOEduardo Flores MancillaPas encore d'évaluation
- Diferencia Entre Gas y VaporDocument8 pagesDiferencia Entre Gas y VaporJosé TorrezPas encore d'évaluation
- 02 Sustancia PuraDocument26 pages02 Sustancia PuraAdolfo TorresPas encore d'évaluation
- Diagrama TDocument8 pagesDiagrama TLissette CastilloPas encore d'évaluation
- Ensayo de Termodinámica 112-135Document5 pagesEnsayo de Termodinámica 112-135damianPas encore d'évaluation
- Definición y Propiedades de Sustancias Puras y Gases IdealesDocument7 pagesDefinición y Propiedades de Sustancias Puras y Gases IdealesreinaldoPas encore d'évaluation
- Presentación2 UNIDADES PDFDocument33 pagesPresentación2 UNIDADES PDFNaysha Condori SurcoPas encore d'évaluation
- Sustancias PurasDocument30 pagesSustancias PurasivonnePas encore d'évaluation
- Propiedades de Sustancias Puras. Grupo 13.Document46 pagesPropiedades de Sustancias Puras. Grupo 13.Maria Del Cielo Inturias QuispePas encore d'évaluation
- AsdasDocument13 pagesAsdasCristhyan Willy Raa TorresPas encore d'évaluation
- Módulo 2.1. Sustancias Puras y GasesDocument42 pagesMódulo 2.1. Sustancias Puras y GasesJocelyn Grisel García GonzálezPas encore d'évaluation
- Unidad II - Propiedades de Sustancias PurasDocument36 pagesUnidad II - Propiedades de Sustancias PurasDamaso KaoPas encore d'évaluation
- Tablas de PropiedadesDocument43 pagesTablas de PropiedadesLeShugaPas encore d'évaluation
- Refrigeración Semana 2Document47 pagesRefrigeración Semana 2Adriana MendozaPas encore d'évaluation
- Propiedades Termodinámicas de Las Sustancias PurasDocument5 pagesPropiedades Termodinámicas de Las Sustancias PurasHugo Sanchez HuertaPas encore d'évaluation
- 3 Propiedades de Las Sustancias Puras y Ecuaciones de EstadoDocument20 pages3 Propiedades de Las Sustancias Puras y Ecuaciones de EstadoAldo CisnerosPas encore d'évaluation
- Sustancia Pura Capitulo 3Document7 pagesSustancia Pura Capitulo 3jj9703614Pas encore d'évaluation
- Comprobación 7Document1 pageComprobación 7her21743Pas encore d'évaluation
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesD'EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesPas encore d'évaluation
- LIVE Script-Practica 2Document2 pagesLIVE Script-Practica 2Maria Fernanda SandovalPas encore d'évaluation
- Informe de Radiocomunicaciones Sobre Propagacion de Ondas de Radiofrecuencias en Las Capas AtmosfericasDocument4 pagesInforme de Radiocomunicaciones Sobre Propagacion de Ondas de Radiofrecuencias en Las Capas AtmosfericasRomario Rodriguez100% (1)
- Las Cuatro Etapas Del Desarrollo CognitivoDocument3 pagesLas Cuatro Etapas Del Desarrollo CognitivodemiPas encore d'évaluation
- PC01 - Mecanica de Fluidos 13990Document3 pagesPC01 - Mecanica de Fluidos 13990Harold AranaPas encore d'évaluation
- Ejercicio 1 de Calculo Ii de Rober Huanca CondoriDocument10 pagesEjercicio 1 de Calculo Ii de Rober Huanca CondoriKevin Rbr HuancaPas encore d'évaluation
- Practica 3Document1 pagePractica 3Efrain PorcoPas encore d'évaluation
- PROCESOS DE DEFORMACION - Procesos de ManufacturaDocument20 pagesPROCESOS DE DEFORMACION - Procesos de ManufacturaJose GalavizPas encore d'évaluation
- Escala Pain DetectDocument5 pagesEscala Pain DetectAC Jorge100% (1)
- Marco Navarro Maldonado Control 3Document7 pagesMarco Navarro Maldonado Control 3alexPas encore d'évaluation
- Solar Photovoltaic (072 163) .En - EsDocument93 pagesSolar Photovoltaic (072 163) .En - EsantonioPas encore d'évaluation
- NTP 072Document12 pagesNTP 072Roberto MartínezPas encore d'évaluation
- Aspa 1.3Document6 pagesAspa 1.3Karla Marcos IxtepanPas encore d'évaluation
- Laboratorio de DestilaciónDocument20 pagesLaboratorio de DestilaciónDiego Meléndez MolinaPas encore d'évaluation
- Seguidor de LineaDocument13 pagesSeguidor de LineaKevin Alejandro100% (1)
- Presentacion Final ISO 10360 2 2010 EARDocument39 pagesPresentacion Final ISO 10360 2 2010 EARgenrryPas encore d'évaluation
- Guia Concerniente A FuncionesDocument7 pagesGuia Concerniente A FuncionesIsaac DiazPas encore d'évaluation
- Tension Superficial Informe de Laboratoriodocx - CompressDocument6 pagesTension Superficial Informe de Laboratoriodocx - CompressVelasquez Camacho Rosa AliciaPas encore d'évaluation
- Doble Integral en SmathDocument10 pagesDoble Integral en SmathEdwin RodriguezPas encore d'évaluation
- 6.3. - Partículas Magneticas (TKNIKA)Document108 pages6.3. - Partículas Magneticas (TKNIKA)Jéssica MaríaPas encore d'évaluation
- Cap X Clasificaciones de PlieguesDocument43 pagesCap X Clasificaciones de PlieguesBrayam Urquizo AraujoPas encore d'évaluation
- Estibina y BiotitaDocument5 pagesEstibina y BiotitamarcoPas encore d'évaluation
- Guía para La Caracterización de Resíduo Sólidos y Determinación Del Porcentaje de Humedad de Residuos SolidosDocument16 pagesGuía para La Caracterización de Resíduo Sólidos y Determinación Del Porcentaje de Humedad de Residuos SolidosJaider DiazPas encore d'évaluation
- Tesis Máquina Universal de EnsayosDocument93 pagesTesis Máquina Universal de EnsayosJesus Baez Zapata100% (1)
- 40 - Manual Usuario - Monitor Fetal Edan F9Document72 pages40 - Manual Usuario - Monitor Fetal Edan F9pirihuey1234Pas encore d'évaluation
- CPF81DDocument69 pagesCPF81DAdrián Toledo CamposPas encore d'évaluation
- Estribo en Voladizo ExamenDocument50 pagesEstribo en Voladizo ExamenLuizz CIPas encore d'évaluation
- Diagnostico de Falla Bombas de PaletaDocument7 pagesDiagnostico de Falla Bombas de PaletaDouglas CarrascoPas encore d'évaluation
- El Agente de Cambio OrganizacionalDocument9 pagesEl Agente de Cambio OrganizacionalmariPas encore d'évaluation
- SalesDocument5 pagesSalesTaisha ClioPas encore d'évaluation