Académique Documents
Professionnel Documents
Culture Documents
9ex 2014 Formula de Lewis Construcao
Transféré par
Eldmara SantosDescription originale:
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
9ex 2014 Formula de Lewis Construcao
Transféré par
Eldmara SantosDroits d'auteur :
Formats disponibles
1
Lista de exerccios Frmula de Lewis-Elementos estruturais de
Qumica -1 sem.2014
Aparecida Cayoco I.Ponzoni
Frmulas de Lewis (eletron-ponto) simbolizam a espcie qumica (ion ou
molcula) com todos os eletrons de valncia ou seja alm dos eletrons de ligao,
os eletrons desemparelhados. As frmulas de Lewis so frmulas estruturais
expandidas ( onde um trao representa um par de eltrons de ligao ) em que so
mostrados tambm os eletrons desemparelhados. Nestas frmulas o n de
eletrons da molcula a soma do n de eletrons de valncia dos tomos que a
constitue.
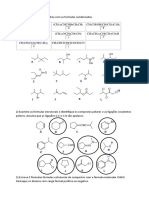
1)D o n de eletrons que devero tomar parte na frmula de Lewis dos compostos com
as seguintes frmulas estruturais condensadas:
a) H2 NN H2 , b) OCCl2 , c) HONO , d)HOSO3H , e) CH3CHO,
f) CH3COOH , g) CH3CH 2 OH, h) CH3COCl , i) XeF4 j) C Cl 4
2)Escreva as frmula de Lewis para os compostos do exerccio anterior, para tal necessrio:
a) Determinar o n total de eletrons de valncia. Para exemplificar usaremos o nitrito de metila
(CH3NO2), que possui 24 eletrons, b) Escrever o esqueleto estrutural da molcula usando dois
eletrons de valncia para formar cada ligao do esqueleto molecular. Cada trao representa
ento um par de eletrons. De modo geral, o tomo de menor eletronegatividade o central
Ligam-se os tomos multicovalentes entre si e depois completa-se a sua valncia normal
ligando-se os tomos univalentes (H, Cl, I e F). (Se o n de tomos univalentes insuficiente
para completar a valncia ser necessrio o uso de ligaes multiplas ou aneis). c) Conte o n
de eletrons utilizados no esqueleto estrutural (ex. na obs 1), subtraia esse n do n total de
eletrons da molcula. O resultado ser o n de eletrons no compartilhados, que devero ser
colocados. aos pares, tentando satisfazer o octeto ou dueto, (no caso do hidrognio) do
tomo. Quando o n de eletrons insuficiente a ordem para colocar esses eletrons em ordem
decrescente de eletronegatividade ou seja ou o elem/ mais eletronegativo recebe os eletrons em
primeiro lugar ( olhe ex. na obs 2.) d) Usar pares de eletrons no compartilhadode de tomos
adjacentes para formar ligaes duplas ( ou tripla) pois todos os tomos devem completar o
octeto ( ex. na obs 3) , o N est com apenas 6 eletrons, neste caso dois eletrons do oxignio da
direita devem passar a fazer uma dupla ligao com o N. e) O oxignio passa a fazer uma
dupla ligao com o N ( obs. 4). Esta estrutura a melhor
( mais estvel)estrutura de Lewis, todos tomos esto com octeto ou dueto completo em sua
camada de valncia. Outras estruturas podem ser escritas mas sero de maior energia, por ex.
na obs 5, onde os tomos tem octeto/dueto completos mas possuem carga formal ( separao de
cargas).
2
Obs. 1) Para o nitrito de metila (CH3NO2/ CH3ONO), cujo esqueleto estrutural est
desenhado abaixo foram usados 12 eletrons compartilhados. O n total de eletrons so 24
portanto restam 12 eletrons a serem colocados.
Ob.1 Obs. 2
H H
H C O N O H C O N O
H H
12 eletrons compartilhados - 12 eletrons no compartilhados colocados em ordem decrescente de
eletronegatividade.
- Os eletrons so primeiram/ colocados nos oxignios
( mais eletronegativos ) e ento no nitrognio.
Obs. 3 Obs.4
H
H
H C O N O
H C O N O H
H O oxignio passa a fazer uma dupla ligao com o N.
O N est com apenas 6 eletrons
Obs. 5 :
H
+
H C O N O
H
3) Escreva a frmula de Lewis para o cido ntrico /HONO2 , cido nitroso/ HONO e nitro metano/
CH3NO2, Utilizando o mesmo procedimento passo a passo, usado para escrever a frmula de
Lewis para o nitrito de metila do item anterior.
A regra do octeto e excees.
1) Os elementos do 2 perodo (C, N, O e F), nunca devem ter mais do que 8 eletrons.
2) Exceo regra do octeto: a) Elementos do grupo II e III que tem menos do que 8 eletrons a ex. do boro,
b) H com 2 eletrons,
c)Elementos do 3 perodo e superiores como enxofre, fsforo, xennio so elementos que podem expandir a
camada de valncia e podem acomodar mais de 8 eletrons.
c ) Os radicais que tem n impar de eletrons, portanto pelo menos um de seus tomos no ter o octeto
completo a ex. do radical metila (CH3. ) d ) Os birradicais que possuem dois eletrons desemparelhados a ex.
de .CH2 (CH2)3 CH2.
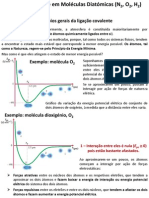
Outro exemplo o oxignio O2 que tem propriedade paramagntica sendo um dirradical
O O
Nota: o modelo de Lewis no d conta de explicar o O2 com sua propriedade paramagntica.
O O
A estrutura mais plausvel usando estrutura de Lewis seria que no explica essa
propriedade.
3
4) O n de eletrons envolvidos na frmula de Lewis de um ion a soma do n de eletrons de
valncia dos tomos que constituem o ion mais um eletron a cada carga negativa do nion e
menos um eletron a cada carga positiva do ction.
D o n de eletrons que devero tomar parte na frmula de Lewis dos seguintes ions:
a) OH , b) H3 O , c) NO2 , d) NO3 , e) H3CCOO , f) BH4 , g) CH3 , h) NH4 i) Al Cl4
5)Escreva as frmula de Lewis para os ions do exerccio anterior.
6)Escreva as frmulas de Lewis para as seguintes molculas : C2H6 , C2H4 , C2H2 , CH4 O ,
CH2O ,CH2O2 ,CH5N e CH3SH .
Obs. a)Utilize as indicaes do exerccio n 2 b)Com apenas um ou dois carbonos,
anis so impossveis, entretanto com esse ndice de deficincia de hidrognio ligaes
mltiplas podem ocorrer.
7) O n de ligaes tipicamente formadas por um determinado elemento ou seja a sua
valncia pode ser determinada subtraindo de 8 o n do grupo qual pertence o elemento.
Utilizando a tabela peridica indique as valncias dos seguintes tomos quando ligados
aos seus hidrognios.
a) O b) S c) Cl d) C e)Si f) P g) Ge h) Br i)N j) Se
8) Escreva as estruturas de Lewis para as seguintes espcie qumicas:
a)O2 , b) O3 , c) O2 2 , d) O2
9) Escreva as estruturas de Lewis para as seguintes espcie qumicas:
a)SO2 , b) SO3 , c) SO3 2 , d) SO42
10) Um par de molculas de NO2 pode combinar para formar N2O4
2 NO2 (g) N2O4 (g)
Use as estruturas de Lewis para explicar porque.
11) Quais dos seguintes compostos so exceo a regra do octeto de Lewis?
a) CO2 , b) BeF2, c) SF4 , d) SO3,
12) Quais dos seguintes compostos so exceo a regra do octeto de Lewis?
a) BeF3 , b)H2CO, c) XeF4 , d) IF3
13) Uma das razes para se escrever as estruturas de Lewis para determinar se um ion
ou molcula pode agir como base (base de Lewis) Bases invariavelmente tem um ou
mais pares de eletrons no compartilhados. Quais dos seguintes ions ou molculas que
podem agir como bases?
a) OH , b) O2 c) CO3 , d) Br , e) NH3
14) Quais dos seguintes ions ou molculas no podem agir como bases?
a) H2 S b) NH4+ c) AlCl3 d) CH3 e) NH2
Vous aimerez peut-être aussi
- Oficina Lauro SodreDocument28 pagesOficina Lauro Sodreneyzanata5043Pas encore d'évaluation
- Lista de Exercícios - P1Document7 pagesLista de Exercícios - P1malhenasmPas encore d'évaluation
- QG 2Document60 pagesQG 2Ana CarolinaPas encore d'évaluation
- Teoria Da Ligação QuímicaDocument72 pagesTeoria Da Ligação QuímicaStefany SpalenzaPas encore d'évaluation
- A Ligação CovalenteDocument10 pagesA Ligação CovalenteGeilson SilvaPas encore d'évaluation
- Estrutura MolecularDocument336 pagesEstrutura MolecularwarleyPas encore d'évaluation
- Estrutura de Lewis - 2012 - 2 PDFDocument21 pagesEstrutura de Lewis - 2012 - 2 PDFLilian PaesPas encore d'évaluation
- Ligações Químicas 1Document29 pagesLigações Químicas 1CâmeraPas encore d'évaluation
- Ligações QuímicasDocument63 pagesLigações QuímicaswilliamPas encore d'évaluation
- Aula 11 Ligações CovalentesDocument35 pagesAula 11 Ligações CovalentespriscielensilvestrePas encore d'évaluation
- RessonânciaDocument33 pagesRessonânciaLeandro Diniz100% (1)
- Ligacoes Quimicas2Document52 pagesLigacoes Quimicas2JOSE DINIZ DOS SANTOS JUNIORPas encore d'évaluation
- Fu2.8 (EE) - U2-Propriedades e Transformações Da Matéria - CCDocument54 pagesFu2.8 (EE) - U2-Propriedades e Transformações Da Matéria - CCiolaPas encore d'évaluation
- Casos Particulares de Ligações Covalentes e ExceçõesDocument12 pagesCasos Particulares de Ligações Covalentes e ExceçõesMariana FerreiraPas encore d'évaluation
- Ligações Químicas DefinitivaDocument60 pagesLigações Químicas DefinitivaLayzza Tardin da Silva SoffnerPas encore d'évaluation
- QO1 - Aula 2 - Representações MolecularesDocument22 pagesQO1 - Aula 2 - Representações MolecularesLarissa MascarenhasPas encore d'évaluation
- 06-03 - Ligações Químicas - Ligação CovalenteDocument12 pages06-03 - Ligações Químicas - Ligação CovalenteThais DantasPas encore d'évaluation
- Ligacao CovalenteDocument12 pagesLigacao CovalenterodrigomenegazgoularPas encore d'évaluation
- Lewis Cargas Formais e VseprDocument23 pagesLewis Cargas Formais e VseprGustavo Silva De Paiva PereiraPas encore d'évaluation
- Aula - 4 - Ligações Químicas e GeometriaDocument65 pagesAula - 4 - Ligações Químicas e GeometriaLucas FreitasPas encore d'évaluation
- Material Complementar Unidade 4 Quimica Organica Lig Quim HibridizacaoDocument28 pagesMaterial Complementar Unidade 4 Quimica Organica Lig Quim HibridizacaoepambarbaPas encore d'évaluation
- Ligações QuímicasDocument19 pagesLigações QuímicasTatianyPas encore d'évaluation
- Equações QuímicasDocument28 pagesEquações QuímicasGleisonPas encore d'évaluation
- Ligacao CovalenteDocument5 pagesLigacao CovalenteCezar_CavalcantePas encore d'évaluation
- Ligação Covalente Parte I PDFDocument92 pagesLigação Covalente Parte I PDFigor santosPas encore d'évaluation
- 09 - Ligações Químicas FINALDocument47 pages09 - Ligações Químicas FINALprofnonocmmPas encore d'évaluation
- Quimica COMPLEXOS - Parte - 1Document24 pagesQuimica COMPLEXOS - Parte - 1Daniel Morais Vieira CruzPas encore d'évaluation
- Alunos Revisao Polaridade e Geom MolecularDocument22 pagesAlunos Revisao Polaridade e Geom Molecularkimtete290296Pas encore d'évaluation
- Aula 2 - Conceitos - BasicosDocument21 pagesAula 2 - Conceitos - BasicosGabriela Rodrigues dos SantosPas encore d'évaluation
- Exercícios Extras Estruturas ResolvidosDocument4 pagesExercícios Extras Estruturas ResolvidosjlopesscridbPas encore d'évaluation
- Roteiro de Estudo - Ligação Covalente 25 de Ago. 2021Document4 pagesRoteiro de Estudo - Ligação Covalente 25 de Ago. 2021Romario Silva SilvaPas encore d'évaluation
- Apostila Ligação QuímicaDocument8 pagesApostila Ligação Químicaerickcarmo725Pas encore d'évaluation
- Aula 6 - Ligações Covalentes, Geometria e PolaridadeDocument51 pagesAula 6 - Ligações Covalentes, Geometria e PolaridadeGiovana CarvalhoPas encore d'évaluation
- Moléculas Na Troposfera IDocument14 pagesMoléculas Na Troposfera IpccsimoesPas encore d'évaluation
- 12Q Compostos de CoordenacaoDocument56 pages12Q Compostos de CoordenacaoMarília PachecoPas encore d'évaluation
- Aula3ligações Químicas QGDocument69 pagesAula3ligações Químicas QGErika BuzeliPas encore d'évaluation
- Aula 3 - F.M. - Quimica - Roberto Mazzei - Ligacoes InteratomicasDocument13 pagesAula 3 - F.M. - Quimica - Roberto Mazzei - Ligacoes InteratomicasThiago SantosPas encore d'évaluation
- Alfa - Módulo 12Document28 pagesAlfa - Módulo 12PedroPas encore d'évaluation
- Capítulo 1 - Átomos, Moléculas e Ligações QuímicasDocument168 pagesCapítulo 1 - Átomos, Moléculas e Ligações QuímicasMatheus Henrique Barbosa OliveiraPas encore d'évaluation
- Estrutura de Lewis, Formas de Representação e Interações Intermoleculares Aula 2Document45 pagesEstrutura de Lewis, Formas de Representação e Interações Intermoleculares Aula 2Lédice NhatavePas encore d'évaluation
- Ligação Covalente DativaDocument5 pagesLigação Covalente DativaHugo AraujoPas encore d'évaluation
- Aula+6+-+Ligações+Quimicas Fabiana+AlmeidaDocument49 pagesAula+6+-+Ligações+Quimicas Fabiana+AlmeidaBené JúniorPas encore d'évaluation
- Aula 01 - Estrutura Eletrônica e LigaçãoDocument26 pagesAula 01 - Estrutura Eletrônica e LigaçãoevelyPas encore d'évaluation
- Cálculos Com A Lei de ProustDocument36 pagesCálculos Com A Lei de ProustPedro Luiz Cezar CamposPas encore d'évaluation
- Aula 5 - Ligao Covalente IIDocument13 pagesAula 5 - Ligao Covalente IILucas AndradePas encore d'évaluation
- Aula 2 Ligações QuimicasDocument16 pagesAula 2 Ligações QuimicasJanaina Rigotti KubiszeskiPas encore d'évaluation
- Teste Q2.1 N.º 1 - V1 10-3 CorrDocument5 pagesTeste Q2.1 N.º 1 - V1 10-3 CorrBia100% (2)
- ICT 517 - Revisão para 1a ProvaDocument12 pagesICT 517 - Revisão para 1a ProvaVictor LopesPas encore d'évaluation
- Escola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaDocument92 pagesEscola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaMerlohnPas encore d'évaluation
- Ligação QuimicaDocument7 pagesLigação QuimicaJoao MAchadoPas encore d'évaluation
- Unid 1Document21 pagesUnid 1danniamatosPas encore d'évaluation
- Ligações Covalentes - Estruturas de Lewis e Carga FormalDocument29 pagesLigações Covalentes - Estruturas de Lewis e Carga FormalAurora BorealPas encore d'évaluation
- Ligações QuímicasDocument7 pagesLigações QuímicasLobato PauloPas encore d'évaluation
- CAPITULO 1.qmcorDocument78 pagesCAPITULO 1.qmcorAgustín SilesPas encore d'évaluation
- Ligações QuímicasDocument45 pagesLigações QuímicasAlexandre de JesusPas encore d'évaluation
- Matéria Ligações GeometriaDocument18 pagesMatéria Ligações GeometriaPaula SantosPas encore d'évaluation
- Aula - 4 - Geometria Molecular e Forças IntermolecularesDocument29 pagesAula - 4 - Geometria Molecular e Forças Intermolecularesra280421Pas encore d'évaluation
- Ligação Covalente Coordenada Ou DativaDocument28 pagesLigação Covalente Coordenada Ou DativaIsa SilvaPas encore d'évaluation
- Aula 03 Geom, Polar e ForçDocument29 pagesAula 03 Geom, Polar e ForçLussandra Marquez MeneghelPas encore d'évaluation
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasD'EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasÉvaluation : 5 sur 5 étoiles5/5 (1)
- Apostila Química Orgânica: Carbono, Dienos E AromáticosD'EverandApostila Química Orgânica: Carbono, Dienos E AromáticosPas encore d'évaluation
- 12Q Metais Energia-ReticularDocument10 pages12Q Metais Energia-ReticularMarília PachecoPas encore d'évaluation
- Aula 1 3°taDocument30 pagesAula 1 3°taIvie Soares GarridoPas encore d'évaluation
- Slide HibridizaçãoDocument10 pagesSlide HibridizaçãoJuliane MirandaPas encore d'évaluation
- Hibridação Do CarbonoDocument4 pagesHibridação Do CarbonojuandiegomaiaPas encore d'évaluation
- Ácidos e Bases Duros e MolesDocument21 pagesÁcidos e Bases Duros e MolesBruno Poleto0% (1)
- Aula 09 - Tabela Periódica e Configuração EletrônicaDocument59 pagesAula 09 - Tabela Periódica e Configuração EletrônicaJoabel FreirePas encore d'évaluation
- Química 04 Ligações QuímicasDocument2 pagesQuímica 04 Ligações QuímicasJonathan AraujoPas encore d'évaluation
- Aula 3 - LigaçãoquimicaDocument65 pagesAula 3 - LigaçãoquimicaLeonardo MacielPas encore d'évaluation
- Lista de Exercícios 1Document2 pagesLista de Exercícios 1Leonardo ZammarPas encore d'évaluation
- Exercícios Extras Estruturas ResolvidosDocument4 pagesExercícios Extras Estruturas ResolvidosjlopesscridbPas encore d'évaluation
- Revisão 9 Ano Ligações QuímicasDocument2 pagesRevisão 9 Ano Ligações QuímicasThabatta Mattos100% (1)
- Geometria MolecularDocument4 pagesGeometria MolecularemyllekPas encore d'évaluation
- Química OrgânicaDocument136 pagesQuímica OrgânicaRick ManoelPas encore d'évaluation
- Lista 07-Grupo 17 Com Tabela P.redDocument8 pagesLista 07-Grupo 17 Com Tabela P.redJaine BeatrizPas encore d'évaluation
- Orbitais Atômicos e HibridizaçãoDocument37 pagesOrbitais Atômicos e HibridizaçãofmbacelarPas encore d'évaluation
- Apostila Ligações Químicas 2Document2 pagesApostila Ligações Químicas 2Nayara GomesPas encore d'évaluation
- Lig. CovalenteDocument21 pagesLig. CovalentebibiPas encore d'évaluation
- Lista 2 PDFDocument4 pagesLista 2 PDFJoaog123Pas encore d'évaluation
- Ligação Covalente Parte I PDFDocument92 pagesLigação Covalente Parte I PDFigor santosPas encore d'évaluation
- Ime-Ita Gabarito Fisica Vol 2 PDFDocument9 pagesIme-Ita Gabarito Fisica Vol 2 PDFCarlos VanePas encore d'évaluation
- 1ºano P2Document3 pages1ºano P2rsantini4Pas encore d'évaluation
- Material Complementar Unidade 4 Quimica Organica Lig Quim HibridizacaoDocument28 pagesMaterial Complementar Unidade 4 Quimica Organica Lig Quim HibridizacaoepambarbaPas encore d'évaluation
- Diagrama de Linus PaulingDocument1 pageDiagrama de Linus PaulingNélida Abreu Marques0% (1)
- Atividades Primeira TurmaDocument7 pagesAtividades Primeira TurmaDaniel ArrudaPas encore d'évaluation
- CFisicaDocument2 pagesCFisicaHenrique Medeiros0% (1)
- PIRATA11Document6 pagesPIRATA11rejane silva100% (1)
- Parte 2 - Valencia HibridaoDocument19 pagesParte 2 - Valencia HibridaoAnonymous UYDJtUnPas encore d'évaluation
- Capítulo 2 qg111Document16 pagesCapítulo 2 qg111Marcelo FilhoPas encore d'évaluation
- REENSINO Lig QuimicasDocument1 pageREENSINO Lig Quimicaslopesqui1766Pas encore d'évaluation