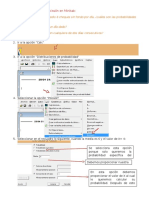
Académique Documents
Professionnel Documents
Culture Documents
Fuerzas Intermoleculares
Transféré par
Sahid Molina0 évaluation0% ont trouvé ce document utile (0 vote)
11 vues4 pagesFUERZAS INTERMOLECULARES
Titre original
FUERZAS INTERMOLECULARES
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentFUERZAS INTERMOLECULARES
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
11 vues4 pagesFuerzas Intermoleculares
Transféré par
Sahid MolinaFUERZAS INTERMOLECULARES
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 4
11.2 Fuerzas intermoleculares
Las fuerzas intermoleculares son fuerzas de atraccion entre las moléculas. Estas fuer-
2as son las responsables del comportamiento no ideal de los gases, descrito en el capitu-
lo 5, Ejercen atin més influencia en las fases condensadas de la materia, es decir, en los
liquidos y los s6lidos. A medida que baja la temperatura de un gas disminuye la energia
cinética promedio de sus moléculas. Asi, a una temperatura suficientemente baja, las
moléculas ya no tienen la energfa necesaria para liberarse de la atraccién de las molécu-
las vecinas. En este momento, las moléculas se agregan y forman pequefias gotas de
liquido. Fsta transicién de la fase gaseosa a la fase Iiquida se conoce como condensa-
cién.
A diferencia de las fuerzas intermoleculares, las fuerzas intramoleculares mantie-
nen juntos a los dtomos de una molécula. (En el enlace quimico, que se estudid en Jos
capitulos 9 y 10, participan fuerzas intramoleculares.) Estas fuerzas estabilizan a las
moléculas individuales, en tanto que las fuerzas intermoleculares son las principales
responsables de las propiedades macroscépicas de la materia (por ejemplo, punto de
fusion y punto de ebullicién).
Las fuerzas intermoleculares suelen ser m4s débiles que las intramoleculares; por
ello, se necesita menos energfa para evaporar un l{quido que para romper los enlaces de
sus moléculas. Por ejemplo, para evaporar 1 mol de agua en su punto de ebullicién son
suficientes alrededor de 41 kJ de energia; en cambio, para romper los dos enlaces O—H
en | mol de moléculas de agua es necesario aplicar unos 930 kJ de energfa. En general,
los puntos de ebullicién de las sustancias reflejan la magnitud de las fuerzas inter-
moleculares que actiian entre las moléculas. En el punto de ebullicién se debe suminis-
trar suficiente energia para vencer las fuerzas de atraccién entre las moléculas a fin de
que entren a la fase de vapor. Si se precisa mds energfa para separar las moléculas de la
sustancia A que de la sustancia B es porque las moléculas de A estén unidas por fuerzas
intermoleculares més fuertes, por tanto, el punto de ebullicién de A ser mayor que el de
B. El mismo principio se aplica también al punto de fusién de las sustancias. Por lo
general, los puntos de fusién de las sustancias aumentan con la intensidad de las fuerzas
intermoleculares.
Para comprender las propiedades de la materia condensada es necesario entender
los diferentes tipos de fuerzas intermoleculares. Las fuerzas dipolo-dipolo, dipolo-dipolo
inducido y las fuerzas de dispersion integran lo que los quimicos denominan fuerzas de
van der Waals, nombradas asf en reconocimiento al fisico holandés Johannes van der
Waals (véase la seccién 5.8). Los iones y dipolos se atraen entre si mediante fuerzas
electrostéticas conocidas como fuerzas ion-dipolo, que no son fuerzas de van der Waals.
El enlace de hidrégeno es un tipo de interaccién dipolo-dipolo particularmente fuerte.
Dado que s6lo unos pocos elementos participan en la formacién del enlace de hidrégeno,
€ste se trata como una categorfa aparte. Segtin la fase de una sustancia, la naturaleza
de los enlaces quimicos y los tipos de elementos que la componen, en la atraccién to-
tal entre las moléculas pueden actuar distintos tipos de interacciones, como se verd en
seguida.
Fuerzas intermoleculares: definiciér
La presencia de fases condensadas, liquides y sélidos, prueba la existencia de
las fuerzas intermoleculares. En estas fases las moélculas que caracterizan la
sustancia se atraen con mayor © menor intensidad (sélido © liquido) para
fomar el colectivo correspondiente.
© Las fuerzas intramoleculares son las que hacen que se formen las moléculas
con una determinada composicién y mantengan unidos sus dtomos
© Las fuerzas intermoleculares son las que se producen entre la unidad mas
pequefia que caracteriza la sustancia, generalmente moléculas. Son las
responsables de las propiedades macréscopicas de esa sustancia: punto de
fusién, ebullicién,
© Excepciones: (a) gases nobles: las fuerzas entre dtomos no forman moléculas
sino que son responsables de las propiedades macroscépicas de los gases
nobles. (b) sélicos iGnicos: se forman redes cristalinas con cationes y aniones
que interaccionan més alld de sus primeros vecinos (fuerzas interiénicas)
[aire ear ens en ene rs
© Por lo general las fuerzas intermoleculares son mucho més débiles que las
intramoleculares. Se suele necesitar menos energia para evaporar un liquid
© fundir un sélido que para romper alguno de los enlaces de las moléculas
que lo forman,
© Por ejemplo para evaporar un mol de agua en su punto de ebullicién se
necesitan 41 kJ/mol, mientras que para romper los enlaces H-O son
necesarios 930 kJ/mol.
Sustancia_mm (g/mol) _ Pto fusién
Ne 20 -248°C
No 28 -210°C
co 28 205°C
H20 18 orc
LiF 26 +848°C
Fuerzas intermoleculares: tratamiento general
© Simplificamos la densidad electrénica de las moléculas por su
comportamiento a largas distancias (asintético): desarrollo multipolar.
2 Los multipolos tienen la misma forma y componentes que los orbitales de un
tomo. Comienzan en cero, y se incrementan de unidad en unidad, con varias
componentes para cada uno: carga (I=0:una componente, m=0), dipolo
(l=Ltres componentes, m=-1,0,1), cuadrupolo (l=2, 5 componentes),
© Este desarrollo es vilido si se estudia cémo se comporta la molécula a largas
distancias.
@ Interaceién © 3, Sy, (— 14+! Qy, Q,/rh tert
© la suma refleja la interaccién entre: carga(nube 1)-carga(nube 2),
carga(1)-dipolo(2), carga(1)-cuadripolo(2), ..... dipolo(1)-carga(2).
dipolo(1)-dipolo(2), dipolo(1)-cuadripolo(2), ..., cuadrupolo(1)-carga(2)
© Las interacciones estabilizantes o atractivas son negativas y las
desestabilizantes o repulsivas son positivas.
Peeeeniee et hein e niet sme te
2 Los multipolos Q decaen con I, con lo que a mayor orden de los multipoles,
+b mayor, menor seré la interaccién. También conforme aumente r, la
distancia entre las moléculas, la interaccién seré menor.
BA 7r=10A
ate
carga-carga 00 20 1a
carga-dipolo Oo 1 02 0.04
carga-dipolo inducido 0 1 0.03 0.002
dipolo-dipolo 1 1 0.02 0.003
dipolo-dipolo inducido 1 10,0005 _ 0.000008
@ Multipolos inducidos: aparecen cuando el entorno perturba la densidad
electronica de la molécula
@ Las interacciones entre los dipolos inducidos pueden ser mayores que las
interacciones entre multipolos permanentes de orden mayor.
© La magnitud polarizabilidad mide la mayor o menor fécilidad con que un
Stomo adquiere un momento dipolar inducido.
© Las moléculas formadas con dtomes pesados (ntimero de clectrones alto)
tienen mas fluctuaciones en la nube de carga (son mds polarizables) ya que
sus electrones externos estan menos atraidos per el nticleo que las de dtomos
ligeros,
Interac
‘carga-carga
carga-dipolo
dipolo-dipolo
dipole-dipole inducido:
dipolos Inducidos
© Otro factor importante en la polarizabilidad de la molécula es su forma
geometrias alargadas frente a esféricas facilitan la presencia de dipolos
inducidos,
Vous aimerez peut-être aussi
- Muestreo Estratificado, Aleatorio Simple y SistematicoDocument5 pagesMuestreo Estratificado, Aleatorio Simple y SistematicoSahid MolinaPas encore d'évaluation
- Distribución HipergeometricaDocument2 pagesDistribución HipergeometricaSahid MolinaPas encore d'évaluation
- Calcular La Distribución de Poissón en MinitabDocument2 pagesCalcular La Distribución de Poissón en MinitabSahid Molina100% (1)
- El Muestreo Por ConglomeradosDocument6 pagesEl Muestreo Por ConglomeradosSahid MolinaPas encore d'évaluation