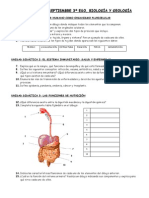
Académique Documents
Professionnel Documents
Culture Documents
BIOQUIMICA
Transféré par
Angelly Ortega0 évaluation0% ont trouvé ce document utile (0 vote)
17 vues3 pagesDESCRIPCION
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDESCRIPCION
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
17 vues3 pagesBIOQUIMICA
Transféré par
Angelly OrtegaDESCRIPCION
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 3
1.
Para comprender el proceso enzimtico el sustrato (S) y la enzima (E) se unen y
forman un complejo enzima-sustrato (ES). Una vez formado el complejo ES, este o
bien se disocia en enzima ms el sustrato o se transforma el sustrato en producto
formado el complejo enzima-producto (EP), que se disocia para dar enzima (E) ms
producto (P), dicho de otra manera, en condiciones de altas de [S], todos los
sitios activos de la enzima se encontrarn saturados y, por Vmx tanto, la
velocidad de reaccin alcanza su Vmx. En las enzimas que presentan este
comportamiento se asume la existencia de un complejo (ES) intermediario,
As, al combinarse la enzima (E) con el sustrato (S) se forma rpidamente el
complejo (ES), con una constante de velocidad k1. En ese momento, el
complejo ES puede:
Formar el producto (P) y regenerar el enzima (E), con una
constante de velocidad k3, en una reaccin mucho ms lenta que
la anterior, por lo que es la etapa limitante de la reaccin.
O disociarse de nuevo, generando nuevamente Ecuacin de E y S,
con una constante de velocidad k2. V0 = Vmx[S] Michaelis-
Menten Km+[S]
Segn este modelo, la velocidad (V0) de una reaccin catalizada
enzimticamente ser: V0 = k3[ES] Si se hace que la V0 = Vmx Como el
valor [ES] no es fcil de obtener, ser necesario una expresin equivalente, con
valores conocidos, Km = [S] obtenidos por el desarrollo matemtico o la
ecuacin de Michaelis-Menten
ENZIMAS
Los enzimas, en cuanto que protenas, presentan todos los rasgos estructurales
y propiedades qumicas que caracterizan a esta notable clase de biomolculas.
En efecto, se ha podido comprobar que los enzimas pierden su actividad
cataltica cuando sufren desnaturalizacin por efecto de los mismos agentes
que afectan a las dems protenas; la conformacin tridimensional nativa
intacta de la protena enzimtica resulta indispensable para que sta
desempee su funcin. Adems, las enzimas, al igual que otras muchas clases
de protenas, presentan un centro activo a travs del cual interactan con la(s)
molcula(s) de ligando, que en este caso recibe(n) el nombre de sustrato(s),
mediante un acoplamiento espacial (las superficies moleculares de ambos
tienen formas complementarias) y qumico (grupos funcionales
complementarios del enzima y el (los) sustrato(s) establecen diferentes tipos
de interacciones dbiles entre s). Tanto la actividad cataltica como el elevado
grado de especificidad qumica que presentan los enzimas residen en esta
interaccin especfica entre el enzima y su sustrato.
SITIO ACTIVO: El lugar de unin de un substrato a una enzima y donde se da la
reaccin de catlisis se denomina centro activo. En el centro activo encuentra
restos de aminocidos con sustituyentes funcionales para la catlisis de un
sustrato.
COMPLEJO ENZIMA-SUSTRATO (Fedra o enzima-sustrato) es la estructura
que se forma de la unin de una enzima con su sustrato (la molcula sobre la
que acta la enzima).
2. Significado Biolgico de Km (Constante de Michaelis), el conocimiento de las
velocidades de reaccin enzimtica tiene importancia biolgica e industrial, en
los organismos vivos, el equilibrio fisiolgico es el resultado de un perfecto
acoplamiento de las velocidades de reaccin y la deteccin de cualquier
desajuste es un sntoma patolgico, en la industria, el uso de enzimas es cada
vez ms frecuente y el conocimiento de su cintica es indispensable para el
diseo de procesos.
Si una reaccin enzimtica se repite varias veces, con una cantidad constante
de enzima y con cantidades crecientes de sustrato, donde se mide la velocidad
inicial, la curva obtenida ser la que se muestra en la Fig. 1, esta curva es
asinttica, en su primer tramo tiene una cintica de primer orden y en el tramo
horizontal una de orden cero, esto indica que con concentraciones bajas de
sustrato la enzima no est saturada y a concentraciones altas la velocidad de
reaccin ya no depende del sustrato y alcanza una velocidad mxima. Si la
concentracin de la enzima aumenta en presencia de un exceso de sustrato, la
Velocidad aumenta linealmente
Fig.1 Expresin grafica de la Km
En conclusin la Km tambin indica la afinidad que posee la enzima por el
sustrato, siendo sta mayor, cuanto menor es la Km. Cuanto menor sea la Km
menor ser la cantidad de sustrato necesaria para alcanzar la mitad de la
velocidad mxima, por lo que mayor ser la afinidad del enzima hacia ese
sustrato.
3. ETAPAS DEL PROCESO ENZIMATICO
La constante de Michaelis (Km) indica la concentracin de sustrato a la cul la
velocidad de reaccin es la mitad de la velocidad mxima. Este parmetro es
independiente de la concentracin de enzima, y es caracterstico de cada enzima segn
el sustrato utilizado. La Km tambin indica la afinidad que posee la enzima por el
sustrato, siendo sta mayor, cuanto menor es la Km. Cuanto menor sea la Km menor
ser la cantidad de sustrato necesaria para alcanzar la mitad de la velocidad mxima,
por lo que mayor ser la afinidad del enzima hacia ese sustrato.
Vous aimerez peut-être aussi
- La Primera Vía BioquímicaDocument4 pagesLa Primera Vía BioquímicaAngelly OrtegaPas encore d'évaluation
- Problemas Bienergética. Potenciales de RedoxDocument2 pagesProblemas Bienergética. Potenciales de RedoxAngelly OrtegaPas encore d'évaluation
- Problemas Bienergetica. 2019Document3 pagesProblemas Bienergetica. 2019Angelly OrtegaPas encore d'évaluation
- 2 DDE - Diseño de Superficies de RespuestaDocument15 pages2 DDE - Diseño de Superficies de Respuestaratagrande777Pas encore d'évaluation
- Factorial Tres FactoresDocument10 pagesFactorial Tres FactoresMario Guzman RoldanPas encore d'évaluation
- Fragmentacion CineolDocument2 pagesFragmentacion CineolAngelly OrtegaPas encore d'évaluation
- Diseño de Experimentos 2Document19 pagesDiseño de Experimentos 2Angelly OrtegaPas encore d'évaluation
- AntiepilépticoDocument1 pageAntiepilépticoAngelly OrtegaPas encore d'évaluation
- Ae Ecualipto 2 AiDocument1 pageAe Ecualipto 2 AiAngelly OrtegaPas encore d'évaluation
- Taller para ParcialDocument11 pagesTaller para ParcialAngelly OrtegaPas encore d'évaluation
- Taller MultifacDocument14 pagesTaller MultifacAngelly OrtegaPas encore d'évaluation
- AntiepilépticoDocument1 pageAntiepilépticoAngelly OrtegaPas encore d'évaluation
- Taller MultifacDocument14 pagesTaller MultifacAngelly OrtegaPas encore d'évaluation
- Comparacion de Varias Muestras PDFDocument29 pagesComparacion de Varias Muestras PDFAngelly OrtegaPas encore d'évaluation
- FrasesDocument1 pageFrasesAngelly OrtegaPas encore d'évaluation
- Acido AdipcoDocument1 pageAcido AdipcoAngelly OrtegaPas encore d'évaluation
- FrasesDocument1 pageFrasesAngelly OrtegaPas encore d'évaluation
- AlquilaciónDocument1 pageAlquilaciónAngelly OrtegaPas encore d'évaluation
- Sintesis de Ciclohexeno TeoDocument35 pagesSintesis de Ciclohexeno Teorossannie13Pas encore d'évaluation
- AlquilaciónDocument1 pageAlquilaciónAngelly OrtegaPas encore d'évaluation
- Grupos Dadores Por ResonanciaDocument1 pageGrupos Dadores Por ResonanciaAngelly OrtegaPas encore d'évaluation
- Curva de Titulación de GlicinaDocument2 pagesCurva de Titulación de GlicinaAngelly OrtegaPas encore d'évaluation
- COLOQUIO #9 y 10Document11 pagesCOLOQUIO #9 y 10Fernando TabaresPas encore d'évaluation
- 246 1151 4 PB PDFDocument8 pages246 1151 4 PB PDFAngelly OrtegaPas encore d'évaluation
- Cómo Tener Un Buen Habito de EstudioDocument3 pagesCómo Tener Un Buen Habito de EstudioAngelly OrtegaPas encore d'évaluation
- Nitro Ben CenoDocument1 pageNitro Ben CenoAngelly OrtegaPas encore d'évaluation
- 4 4 Masas3Document34 pages4 4 Masas3German CarlePas encore d'évaluation
- TuyyomiDocument1 pageTuyyomiAngelly OrtegaPas encore d'évaluation
- 246 1151 4 PB PDFDocument8 pages246 1151 4 PB PDFAngelly OrtegaPas encore d'évaluation
- Grupo SanguíneoDocument9 pagesGrupo SanguíneoZuly Yamilet ValentinPas encore d'évaluation
- Biología Boletín 18 Pre 2a B 5 Reinos Monera Protista FungiDocument8 pagesBiología Boletín 18 Pre 2a B 5 Reinos Monera Protista FungiFernando ChiaraPas encore d'évaluation
- Los OrganelosDocument3 pagesLos OrganelosFrankHQPas encore d'évaluation
- Agar Cuenta EstándarDocument9 pagesAgar Cuenta EstándarLuis Enrique Duran RosasPas encore d'évaluation
- Guión Práctica 1 - BQES 2016 Upm BiotecnologíaDocument5 pagesGuión Práctica 1 - BQES 2016 Upm BiotecnologíaChaimah Yanati Mohamed MohamedPas encore d'évaluation
- Guia de Estudio P62 Malla AjusteDocument9 pagesGuia de Estudio P62 Malla AjusteSilvio Nicolas VicuñaPas encore d'évaluation
- Grupo #7-Genero Corynebacterium y ListeriaDocument44 pagesGrupo #7-Genero Corynebacterium y ListeriaMaryCarmenSantillanPas encore d'évaluation
- ATEROGENESISDocument14 pagesATEROGENESISLiz Matamoros MezaPas encore d'évaluation
- Factores Que Afectan Los Requisitos Nutricionales de Un IndividuoDocument1 pageFactores Que Afectan Los Requisitos Nutricionales de Un IndividuoWalter ChumpitazPas encore d'évaluation
- Diccionario Biología MolecularDocument22 pagesDiccionario Biología MolecularHeffer Rueda EspinosaPas encore d'évaluation
- Cintura EscapularDocument73 pagesCintura EscapularBreak DerulsPas encore d'évaluation
- Inventario de Aves de La UnpDocument6 pagesInventario de Aves de La UnpEDUARDO MARTIN LOPEZ CORDOVAPas encore d'évaluation
- 262 Historia ClinicaDocument3 pages262 Historia ClinicaDavid Mamani CardenasPas encore d'évaluation
- Ensayo Ciclo CelularDocument2 pagesEnsayo Ciclo CelularHéctor Morales PoncePas encore d'évaluation
- Psicología Médica - Ramón de La FuenteDocument505 pagesPsicología Médica - Ramón de La FuenteNathanael100% (8)
- Practicas Con Lista de Cotejo y Guias 3ro C Galindo Cardoso Kevin DavidDocument20 pagesPracticas Con Lista de Cotejo y Guias 3ro C Galindo Cardoso Kevin DavidKevin David Galindo CardosoPas encore d'évaluation
- CEF Bases Biologicas y Fisiologicas Del Entrenamiento Clase 2 EjercitacionDocument4 pagesCEF Bases Biologicas y Fisiologicas Del Entrenamiento Clase 2 EjercitacionJuan AlonsoPas encore d'évaluation
- La Vida de La Flora y Fauna en El MarDocument58 pagesLa Vida de La Flora y Fauna en El MarMaríaFernanda VasquezPas encore d'évaluation
- Informe de Grupo SanguineoDocument7 pagesInforme de Grupo SanguineoMireya yanapa reynosoPas encore d'évaluation
- Botanica - Agricultura - Tesis - Identificación de Hongos Micorrízicos - Cultivo de LechugaDocument137 pagesBotanica - Agricultura - Tesis - Identificación de Hongos Micorrízicos - Cultivo de Lechugafreda183202Pas encore d'évaluation
- CarboxisomasDocument5 pagesCarboxisomasCatalina HerreraPas encore d'évaluation
- Biologia PDFDocument6 pagesBiologia PDFRafa RuizPas encore d'évaluation
- Preguntas y Respuestas de ProbioticXL 6.1.2017Document5 pagesPreguntas y Respuestas de ProbioticXL 6.1.2017Roosevelito MaitrePas encore d'évaluation
- Evaluación Formativa #1 CienciasDocument2 pagesEvaluación Formativa #1 CienciasVivianaPas encore d'évaluation
- Hematoma de Muñón Uterino en Una PerraDocument4 pagesHematoma de Muñón Uterino en Una PerraH Eddy L CoelloPas encore d'évaluation
- Practica de EnzimasDocument2 pagesPractica de EnzimasFabi RodríguezPas encore d'évaluation
- Parasitismo en PecesDocument26 pagesParasitismo en PecesRicardo Barboza MontealegrePas encore d'évaluation
- Dictyla MonotropidiaDocument6 pagesDictyla MonotropidiaMartha BaracaldoPas encore d'évaluation
- Practica 8. Herencia Ligada Al SexoDocument4 pagesPractica 8. Herencia Ligada Al Sexojhael rodrigo quispe chambillaPas encore d'évaluation
- Biología de 1ero ExamenDocument2 pagesBiología de 1ero ExamenKary SolisPas encore d'évaluation